5_HetBal(BW).ppt
- Количество слайдов: 16
 Элементы химической термодинамики Гетерогенные равновесия 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 1
Элементы химической термодинамики Гетерогенные равновесия 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 1
 1. Основные понятия • В термодинамике рассматриваются изолированные, закрытые и открытые системы. • Под изолированной системой понимается система, совершенно не взаимодействующая с окружающей средой. • Системы, обменивающиеся с окружающей средой только энергией (тепло, работа, излучение), называются закрытыми. • Системы, которые обмениваются с окружающей средой и веществом, и энергией, называются открытыми. • Стационарное состояние – такое состояние системы, в котором ее параметры не зависят от времени, но в общем случае могут зависеть от пространственных координат. • Равновесное состояние системы (равновесие) – это стационарное состояние, в котором отсутствуют потоки массы и энергии. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 2
1. Основные понятия • В термодинамике рассматриваются изолированные, закрытые и открытые системы. • Под изолированной системой понимается система, совершенно не взаимодействующая с окружающей средой. • Системы, обменивающиеся с окружающей средой только энергией (тепло, работа, излучение), называются закрытыми. • Системы, которые обмениваются с окружающей средой и веществом, и энергией, называются открытыми. • Стационарное состояние – такое состояние системы, в котором ее параметры не зависят от времени, но в общем случае могут зависеть от пространственных координат. • Равновесное состояние системы (равновесие) – это стационарное состояние, в котором отсутствуют потоки массы и энергии. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 2
 • Гомогенными называются системы, внутри которых свойства характеризуются непрерывной зависимостью от пространственных координат. • Гетерогенными называются системы, состоящие из гомогенных частей, на границе которых свойства характеризуются разрывами непрерывности. Гетерогенная система состоит из нескольких фаз. • Фаза – совокупность гомогенных, ограниченных поверхностями раздела, частей системы, термодинамические свойства которых одинаково определяются параметрами состояния (параметрами системы, не зависящими от пути перехода системы из одного состояния в другое). Фазы могут принадлежать к разным или одинаковым агрегатным состояниям вещества. • Компонент – такая пространственно распределенная составляющая системы, содержание которой не зависит от содержания других составляющих. Компонент в системе может существовать в различных формах: в виде атома или иона, входить в состав молекулы или радикала и др. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 3
• Гомогенными называются системы, внутри которых свойства характеризуются непрерывной зависимостью от пространственных координат. • Гетерогенными называются системы, состоящие из гомогенных частей, на границе которых свойства характеризуются разрывами непрерывности. Гетерогенная система состоит из нескольких фаз. • Фаза – совокупность гомогенных, ограниченных поверхностями раздела, частей системы, термодинамические свойства которых одинаково определяются параметрами состояния (параметрами системы, не зависящими от пути перехода системы из одного состояния в другое). Фазы могут принадлежать к разным или одинаковым агрегатным состояниям вещества. • Компонент – такая пространственно распределенная составляющая системы, содержание которой не зависит от содержания других составляющих. Компонент в системе может существовать в различных формах: в виде атома или иона, входить в состав молекулы или радикала и др. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 3
 2. Термодинамические потенциалы • Внутренняя энергия: d. U (S, V, ni) = Td. S – pd. V + idni (i = 1 … k). • Энтальпия: H(S, p, ni) = U + p. V; d. H = Td. S + Vdp + idni (i = 1 … k). • Энергия Гельмгольца: F(T, V, ni) = U – TS; d. F = – Sd. T – pd. V + idni (i = 1 … k). • Энергия Гиббса: G(T, p, ni) = U – TS + p. V = H – TS; d. G = – Sd. T + Vdp + idni (i = 1 … k). • Химический потенциал: i ( U / ni)S, V, nj i – определяет перераспределение числа молей компонента в системе. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 4
2. Термодинамические потенциалы • Внутренняя энергия: d. U (S, V, ni) = Td. S – pd. V + idni (i = 1 … k). • Энтальпия: H(S, p, ni) = U + p. V; d. H = Td. S + Vdp + idni (i = 1 … k). • Энергия Гельмгольца: F(T, V, ni) = U – TS; d. F = – Sd. T – pd. V + idni (i = 1 … k). • Энергия Гиббса: G(T, p, ni) = U – TS + p. V = H – TS; d. G = – Sd. T + Vdp + idni (i = 1 … k). • Химический потенциал: i ( U / ni)S, V, nj i – определяет перераспределение числа молей компонента в системе. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 4
 3. Принцип равновесия Гиббса • Изолированная система находится в состоянии равновесия, если ее энтропия при всех возможных изменениях, совместимых с условиями изоляции, остается постоянной или уменьшается: (δS)U, V, nj 0 или ( U)S, V, nj 0. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 5
3. Принцип равновесия Гиббса • Изолированная система находится в состоянии равновесия, если ее энтропия при всех возможных изменениях, совместимых с условиями изоляции, остается постоянной или уменьшается: (δS)U, V, nj 0 или ( U)S, V, nj 0. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 5
 4. Состояния равновесия • Стабильное (устойчивое) состояние равновесия. Состояние системы называется стабильным, если оно устойчиво относительно воздействий конечной величины: ( S)U, V, nj 0 или ( U)S, V, nj 0. • Метастабильное состояние равновесия. Состояние равновесия называется метастабильным, если оно устойчиво относительно воздействий бесконечно малой величины: (d. S)U, V, nj 0 или (d. U)S, V, nj 0. • Нейтральное состояние равновесия. Состояние равновесия называется нейтральным, если возможны изменения состояния, при которых энтропия и внутренняя энергия системы не изменяются с точностью до второго порядка малости: ( S)U, V, nj = 0 или ( U)S, V, nj = 0. • Лабильное (абсолютно неустойчивое) состояние равновесия. Состояние системы называется лабильным, если любые воздействия, в том числе бесконечно малой величины, приводят к возрастанию энтропии (уменьшению внутренней энергии): ( S)U, V, nj > 0 или 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 6 ( U)S, V, n > 0.
4. Состояния равновесия • Стабильное (устойчивое) состояние равновесия. Состояние системы называется стабильным, если оно устойчиво относительно воздействий конечной величины: ( S)U, V, nj 0 или ( U)S, V, nj 0. • Метастабильное состояние равновесия. Состояние равновесия называется метастабильным, если оно устойчиво относительно воздействий бесконечно малой величины: (d. S)U, V, nj 0 или (d. U)S, V, nj 0. • Нейтральное состояние равновесия. Состояние равновесия называется нейтральным, если возможны изменения состояния, при которых энтропия и внутренняя энергия системы не изменяются с точностью до второго порядка малости: ( S)U, V, nj = 0 или ( U)S, V, nj = 0. • Лабильное (абсолютно неустойчивое) состояние равновесия. Состояние системы называется лабильным, если любые воздействия, в том числе бесконечно малой величины, приводят к возрастанию энтропии (уменьшению внутренней энергии): ( S)U, V, nj > 0 или 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 6 ( U)S, V, n > 0.
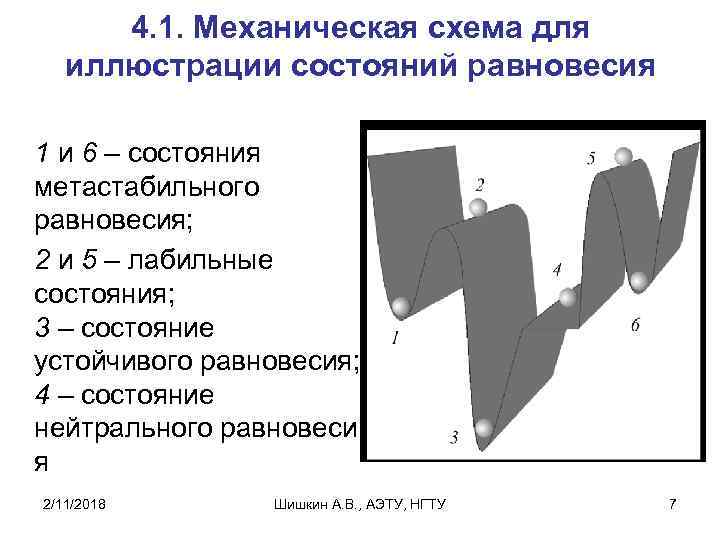 4. 1. Механическая схема для иллюстрации состояний равновесия 1 и 6 – состояния метастабильного равновесия; 2 и 5 – лабильные состояния; 3 – состояние устойчивого равновесия; 4 – состояние нейтрального равновеси я 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 7
4. 1. Механическая схема для иллюстрации состояний равновесия 1 и 6 – состояния метастабильного равновесия; 2 и 5 – лабильные состояния; 3 – состояние устойчивого равновесия; 4 – состояние нейтрального равновеси я 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 7
 5. Гетерогенные равновесия • Равновесие всегда устанавливается между чем-то. • Равновесие, устанавливающееся в системе в результате перераспределения компонентов и энергии между фазами, называется фазовым, т. е. в равновесии находятся фазы. • Равновесие, устанавливающееся в системе в результате протекания химических реакций, называется химическим, т. е. в равновесии находятся химические вещества. • Образование нового вещества в результате химической реакции может приводить к образованию новой фазы и необходимости установления фазового равновесия. • Объединение условий фазового и химического равновесий называется условиями гетерогенного равновесия. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 8
5. Гетерогенные равновесия • Равновесие всегда устанавливается между чем-то. • Равновесие, устанавливающееся в системе в результате перераспределения компонентов и энергии между фазами, называется фазовым, т. е. в равновесии находятся фазы. • Равновесие, устанавливающееся в системе в результате протекания химических реакций, называется химическим, т. е. в равновесии находятся химические вещества. • Образование нового вещества в результате химической реакции может приводить к образованию новой фазы и необходимости установления фазового равновесия. • Объединение условий фазового и химического равновесий называется условиями гетерогенного равновесия. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 8
 5. 1. Условия фазового равновесия • Для j-фазной k-компонентной системы нахождение условного минимума внутренней энергии приводит к выражениям: • термического равновесия T(i) = T(j), • механического равновесия p(i) = p(j), • диффузионного равновесия l(i) = l(j), (i, j = 1, …, ; l = 1, …, k). 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 9
5. 1. Условия фазового равновесия • Для j-фазной k-компонентной системы нахождение условного минимума внутренней энергии приводит к выражениям: • термического равновесия T(i) = T(j), • механического равновесия p(i) = p(j), • диффузионного равновесия l(i) = l(j), (i, j = 1, …, ; l = 1, …, k). 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 9
 6. Твердые растворы • Раствор – многокомпонентная гомогенная система, состав которой в определенных пределах может меняться без выделения новой фазы. • Кристаллические фазы принято делить на два основных вида: твердые растворы и промежуточные фазы. • Твердые растворы – многокомпонентные кристаллические фазы, при образовании которых сохраняется кристаллическая решетка одного из компонентов – растворителя. Твердые растворы – кристаллические фазы переменного состава. • Атомы растворенного элемента размещаются в узлах кристаллической решетки растворителя, образуя твердый раствор замещения, или занимают пустоты (поры) междоузельного пространства, образуя твердый раствор внедрения. Внедрение чужеродного атома в кристаллическую решетку чистого вещества приводит к ее искажению. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 10
6. Твердые растворы • Раствор – многокомпонентная гомогенная система, состав которой в определенных пределах может меняться без выделения новой фазы. • Кристаллические фазы принято делить на два основных вида: твердые растворы и промежуточные фазы. • Твердые растворы – многокомпонентные кристаллические фазы, при образовании которых сохраняется кристаллическая решетка одного из компонентов – растворителя. Твердые растворы – кристаллические фазы переменного состава. • Атомы растворенного элемента размещаются в узлах кристаллической решетки растворителя, образуя твердый раствор замещения, или занимают пустоты (поры) междоузельного пространства, образуя твердый раствор внедрения. Внедрение чужеродного атома в кристаллическую решетку чистого вещества приводит к ее искажению. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 10
 • Если растворимость в твердом состоянии ограничена и область твердого раствора прилегает к одному из чистых элементов, то такой твердый раствор называется первичным (или граничным) и имеет, соответственно, структуру этого чистого элемента. На основе химических соединений также образуются твердые растворы. • Твердые растворы внедрения возникают обычно при сплавлении переходных металлов с неметаллами, имеющими малый атомный радиус: H, N, C, B. Искажения кристаллической решетки при образовании раствора внедрения больше, чем при образовании раствора замещения. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 11
• Если растворимость в твердом состоянии ограничена и область твердого раствора прилегает к одному из чистых элементов, то такой твердый раствор называется первичным (или граничным) и имеет, соответственно, структуру этого чистого элемента. На основе химических соединений также образуются твердые растворы. • Твердые растворы внедрения возникают обычно при сплавлении переходных металлов с неметаллами, имеющими малый атомный радиус: H, N, C, B. Искажения кристаллической решетки при образовании раствора внедрения больше, чем при образовании раствора замещения. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 11
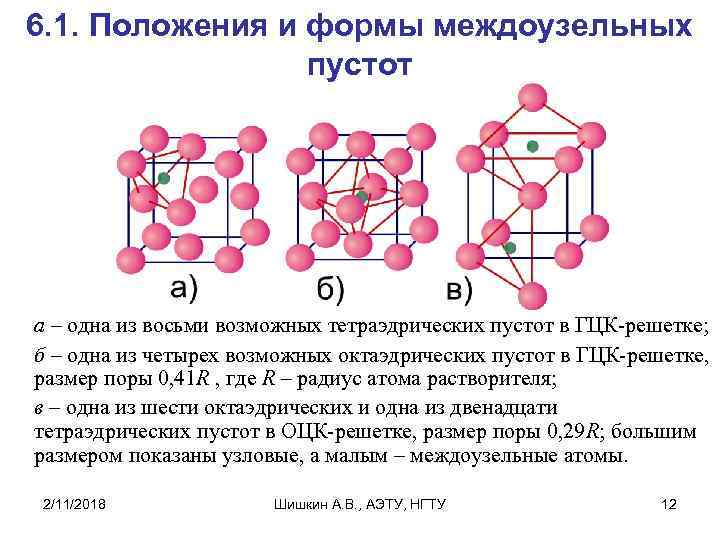 6. 1. Положения и формы междоузельных пустот а – одна из восьми возможных тетраэдрических пустот в ГЦК-решетке; б – одна из четырех возможных октаэдрических пустот в ГЦК-решетке, размер поры 0, 41 R , где R – радиус атома растворителя; в – одна из шести октаэдрических и одна из двенадцати тетраэдрических пустот в ОЦК-решетке, размер поры 0, 29 R; большим размером показаны узловые, а малым – междоузельные атомы. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 12
6. 1. Положения и формы междоузельных пустот а – одна из восьми возможных тетраэдрических пустот в ГЦК-решетке; б – одна из четырех возможных октаэдрических пустот в ГЦК-решетке, размер поры 0, 41 R , где R – радиус атома растворителя; в – одна из шести октаэдрических и одна из двенадцати тетраэдрических пустот в ОЦК-решетке, размер поры 0, 29 R; большим размером показаны узловые, а малым – междоузельные атомы. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 12
 6. 2. Размерный фактор • Атому с малым радиусом легче внедриться в кристаллическую решетку более крупных атомов, чем наоборот. Поэтому при образовании твердых растворов существенное значение имеют размеры (объемы, радиусы) атомов, межатомные расстояния в кристаллической решетке растворителя, виды и размеры пустот в ней. • В растворах замещения растворимость ограничивается, если атомные радиусы отличаются более чем на 14 15 %. Это условие называется размерным фактором. • Если отношение радиусов неметалла и металла Rнм / Rм < 0, 59 , то образуются фазы внедрения, когда атомы неметалла располагаются в порах кристаллической решетки, образуемой металлом. • Неограниченная растворимость при образовании твердых растворов замещения возможна при соблюдении размерного фактора и одинаковом типе кристаллических решеток элементов. Неограниченная растворимость наблюдается в сплавах Cu-Au, Cu-Ni, Si-Ge. В этих системах образуется непрерывный ряд твердых растворов. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 13
6. 2. Размерный фактор • Атому с малым радиусом легче внедриться в кристаллическую решетку более крупных атомов, чем наоборот. Поэтому при образовании твердых растворов существенное значение имеют размеры (объемы, радиусы) атомов, межатомные расстояния в кристаллической решетке растворителя, виды и размеры пустот в ней. • В растворах замещения растворимость ограничивается, если атомные радиусы отличаются более чем на 14 15 %. Это условие называется размерным фактором. • Если отношение радиусов неметалла и металла Rнм / Rм < 0, 59 , то образуются фазы внедрения, когда атомы неметалла располагаются в порах кристаллической решетки, образуемой металлом. • Неограниченная растворимость при образовании твердых растворов замещения возможна при соблюдении размерного фактора и одинаковом типе кристаллических решеток элементов. Неограниченная растворимость наблюдается в сплавах Cu-Au, Cu-Ni, Si-Ge. В этих системах образуется непрерывный ряд твердых растворов. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 13
 6. 3. Упорядочение в твердых растворах • Твердые растворы замещения могут быть упорядоченными или неупорядоченными. В упорядоченной фазе атомные позиции становятся неэквивалентными для заполнения атомами разного сорта: кристаллическая решетка неупорядоченной фазы распадается на несколько подрешеток. • Фазовый переход порядок – беспорядок происходит с повышением температуры. При более высокой температуре устойчива неупорядоченная фаза. • Упорядоченные области в кристалле называются антифазными доменами (АФД), а границы между ними – антифазными границами (АФГ). • Для упорядоченных растворов используется также термин сверхструктура. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 14
6. 3. Упорядочение в твердых растворах • Твердые растворы замещения могут быть упорядоченными или неупорядоченными. В упорядоченной фазе атомные позиции становятся неэквивалентными для заполнения атомами разного сорта: кристаллическая решетка неупорядоченной фазы распадается на несколько подрешеток. • Фазовый переход порядок – беспорядок происходит с повышением температуры. При более высокой температуре устойчива неупорядоченная фаза. • Упорядоченные области в кристалле называются антифазными доменами (АФД), а границы между ними – антифазными границами (АФГ). • Для упорядоченных растворов используется также термин сверхструктура. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 14
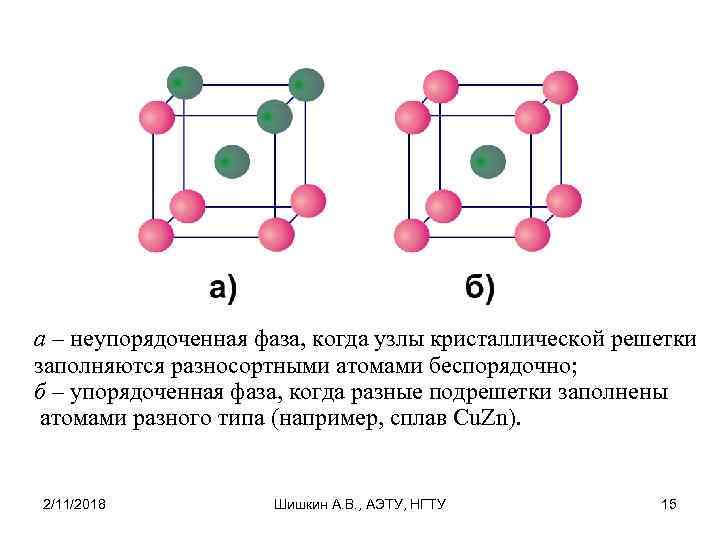 а – неупорядоченная фаза, когда узлы кристаллической решетки заполняются разносортными атомами беспорядочно; б – упорядоченная фаза, когда разные подрешетки заполнены атомами разного типа (например, сплав Cu. Zn). 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 15
а – неупорядоченная фаза, когда узлы кристаллической решетки заполняются разносортными атомами беспорядочно; б – упорядоченная фаза, когда разные подрешетки заполнены атомами разного типа (например, сплав Cu. Zn). 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 15
 7. Промежуточные фазы • Промежуточные фазы – многокомпонентные кристаллические фазы, при образовании которых возникает кристаллическая решетка, отличающаяся от кристаллических решеток исходных компонентов. • Такие фазы имеют место при образовании химических соединений, например, интерметаллических (интерметаллидов) – соединений разных металлов. • Большое число химических соединений, образующихся в металлических сплавах, не подчиняется законам валентности и не имеет постоянного стехиометрического состава. Они образуют различного рода промежуточные фазы. • На основе химического соединения могут возникать твердые растворы, обусловленные дефектами структуры. Появление стабильных промежуточных соединений приводит к сужению области первичных твердых растворов. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 16
7. Промежуточные фазы • Промежуточные фазы – многокомпонентные кристаллические фазы, при образовании которых возникает кристаллическая решетка, отличающаяся от кристаллических решеток исходных компонентов. • Такие фазы имеют место при образовании химических соединений, например, интерметаллических (интерметаллидов) – соединений разных металлов. • Большое число химических соединений, образующихся в металлических сплавах, не подчиняется законам валентности и не имеет постоянного стехиометрического состава. Они образуют различного рода промежуточные фазы. • На основе химического соединения могут возникать твердые растворы, обусловленные дефектами структуры. Появление стабильных промежуточных соединений приводит к сужению области первичных твердых растворов. 2/11/2018 Шишкин А. В. , АЭТУ, НГТУ 16


