Элементы VIIA группы.pptx
- Количество слайдов: 33
 Элементы VIIA группы. Галогены. 1 2 H Li 1713 VIIA = 14 F Cl B Na Mg Al Br K Ca d-элементы Ga I Rb Sr In At. Tl Cs Ba Fr Be C Si 15 16 17 ФТОР N ХЛОР O P S БРОМ Ge As Se ЙОД Sn Sb Te Pb АСТАТ Bi Po 18 (H) He Fluorine F Chlorine Ne Cl Ar Bromine Br Kr Iodine I Xe Astatine At Rn Ra 1
Элементы VIIA группы. Галогены. 1 2 H Li 1713 VIIA = 14 F Cl B Na Mg Al Br K Ca d-элементы Ga I Rb Sr In At. Tl Cs Ba Fr Be C Si 15 16 17 ФТОР N ХЛОР O P S БРОМ Ge As Se ЙОД Sn Sb Te Pb АСТАТ Bi Po 18 (H) He Fluorine F Chlorine Ne Cl Ar Bromine Br Kr Iodine I Xe Astatine At Rn Ra 1
![F Br I 9 Атомный номер, Z Cl 17 35 53 [He]2 s 22 F Br I 9 Атомный номер, Z Cl 17 35 53 [He]2 s 22](https://present5.com/presentation/10475851_133017584/image-2.jpg) F Br I 9 Атомный номер, Z Cl 17 35 53 [He]2 s 22 p Первый 5 потенциал ионизации 2 5 [Ne] 3 s 3 p Электронная 1800 конфигурация [Ar] 3 d 104 s 24 p 5 1700 [Kr] 4 d 105 s 25 p 5 1681 1251 1140 1008 Ae, к. Дж/моль 1400 χ 1300 (по Полингу) 1200 Ковалентный 1100 радиус, rcov, пм Ионный 1000 радиус, rion, 900 пм -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 181 196 220 I 1, к. Дж/моль 1600 I 1, к. Дж/моль 1500 Степени окисления 800 -1, F 0 -1, 0 , +1, +3, -1, 0, +1, +3, I -1, 0, +1, +3, Cl Br (+4), +5, (+6), (+4), +5, +72 +7
F Br I 9 Атомный номер, Z Cl 17 35 53 [He]2 s 22 p Первый 5 потенциал ионизации 2 5 [Ne] 3 s 3 p Электронная 1800 конфигурация [Ar] 3 d 104 s 24 p 5 1700 [Kr] 4 d 105 s 25 p 5 1681 1251 1140 1008 Ae, к. Дж/моль 1400 χ 1300 (по Полингу) 1200 Ковалентный 1100 радиус, rcov, пм Ионный 1000 радиус, rion, 900 пм -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 181 196 220 I 1, к. Дж/моль 1600 I 1, к. Дж/моль 1500 Степени окисления 800 -1, F 0 -1, 0 , +1, +3, -1, 0, +1, +3, I -1, 0, +1, +3, Cl Br (+4), +5, (+6), (+4), +5, +72 +7
 F Br I 9 Атомный номер, Z Cl 17 35 53 Сродство к электрону [He]2 s 22 p 5 [Ne] 3 s 23 p 5 Электронная -50 [Ar] 3 d 104 s 24 p 5 конфигурация -100 [Kr] 4 d 105 s 25 p 5 I 1, к. Дж/моль 1681 1251 1140 1008 Ae, к. Дж/моль -200 χ (по Полингу) -250 Ковалентный радиус, r-300 пм cov, Ионный радиус, r-350 пм ion, -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 181 196 220 Ae, к. Дж/моль -150 Степени -400 окисления F -1, 0 Cl -1, 0 , +1, +3, Br -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +7 +7 I -1, 0, +1, +3, +5, +73
F Br I 9 Атомный номер, Z Cl 17 35 53 Сродство к электрону [He]2 s 22 p 5 [Ne] 3 s 23 p 5 Электронная -50 [Ar] 3 d 104 s 24 p 5 конфигурация -100 [Kr] 4 d 105 s 25 p 5 I 1, к. Дж/моль 1681 1251 1140 1008 Ae, к. Дж/моль -200 χ (по Полингу) -250 Ковалентный радиус, r-300 пм cov, Ионный радиус, r-350 пм ion, -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 181 196 220 Ae, к. Дж/моль -150 Степени -400 окисления F -1, 0 Cl -1, 0 , +1, +3, Br -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +7 +7 I -1, 0, +1, +3, +5, +73
 F Электронная конфигурация 4 I 1, к. Дж/моль 3 Ae, к. Дж/моль χ (по Полингу) 2 Ковалентный радиус, rcov, пм Ионный 1 радиус, rion, пм Степени окисления Br I 9 Атомный номер, Z Cl 17 35 53 Электроотрицательность [He]2 s 22 p 5 (по Полингу) [Ne] 3 s 23 p 5 [Ar] 3 d 104 s 24 p 5 4. 00 1681 1251 -328 3. 20 -349 [Kr] 4 d 105 s 25 p 5 1140 3. 00 1008 -325 -295 4. 0 3. 2 3. 0 71 99 114 F 133 181 Cl 2. 70 -1, 0 Br 196 -1, 0 , +1, +3, -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +7 +7 2. 7 133 I 220 -1, 0, +1, +3, +5, +74
F Электронная конфигурация 4 I 1, к. Дж/моль 3 Ae, к. Дж/моль χ (по Полингу) 2 Ковалентный радиус, rcov, пм Ионный 1 радиус, rion, пм Степени окисления Br I 9 Атомный номер, Z Cl 17 35 53 Электроотрицательность [He]2 s 22 p 5 (по Полингу) [Ne] 3 s 23 p 5 [Ar] 3 d 104 s 24 p 5 4. 00 1681 1251 -328 3. 20 -349 [Kr] 4 d 105 s 25 p 5 1140 3. 00 1008 -325 -295 4. 0 3. 2 3. 0 71 99 114 F 133 181 Cl 2. 70 -1, 0 Br 196 -1, 0 , +1, +3, -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +7 +7 2. 7 133 I 220 -1, 0, +1, +3, +5, +74
 F Br I 9 Атомный номер, Z Cl 17 35 53 Ковалентный радиус 150 Электронная 140 конфигурация [He]2 s 22 p 5 [Ne] 3 s 23 p 5 [Ar] 3 d 104 s 24 p 5 130 rcov, пм 120 I 1, к. Дж/моль 110 Ae, к. Дж/моль 100 χ 90 (по Полингу) 80 Ковалентный радиус, rcov, 70 пм Ионный 60 радиус, rion, 50 пм Степени окисления [Kr] 4 d 105 s 25 p 5 1681 1251 1140 1008 -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 181 196 220 F -1, 0 I -1, 0 Cl+1, +3, Br , -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +75 +7
F Br I 9 Атомный номер, Z Cl 17 35 53 Ковалентный радиус 150 Электронная 140 конфигурация [He]2 s 22 p 5 [Ne] 3 s 23 p 5 [Ar] 3 d 104 s 24 p 5 130 rcov, пм 120 I 1, к. Дж/моль 110 Ae, к. Дж/моль 100 χ 90 (по Полингу) 80 Ковалентный радиус, rcov, 70 пм Ионный 60 радиус, rion, 50 пм Степени окисления [Kr] 4 d 105 s 25 p 5 1681 1251 1140 1008 -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 181 196 220 F -1, 0 I -1, 0 Cl+1, +3, Br , -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +75 +7
 F 250 Электронная конфигурация Br 9 Атомный номер, Z Cl 17 – 35 Х Ионный радиус [He]2 s 22 p 5 [Ne] 3 s 23 p 5 [Ar] 3 d 104 s 24 p 5 200 I 1, к. Дж/моль 150 rion, пм Ae, к. Дж/моль χ 100 (по Полингу) Ковалентный 50 радиус, rcov, пм Ионный радиус, rion, 0 пм Степени окисления I 53 [Kr] 4 d 105 s 25 p 5 1681 1251 1140 1008 -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 Для кристаллического состояния с КЧ(Х–) = 6 133 F -1, 0 181 196 Cl I -1, 0 , +1, +3, Br -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +7 +7 220 -1, 0, +1, +3, +5, +76
F 250 Электронная конфигурация Br 9 Атомный номер, Z Cl 17 – 35 Х Ионный радиус [He]2 s 22 p 5 [Ne] 3 s 23 p 5 [Ar] 3 d 104 s 24 p 5 200 I 1, к. Дж/моль 150 rion, пм Ae, к. Дж/моль χ 100 (по Полингу) Ковалентный 50 радиус, rcov, пм Ионный радиус, rion, 0 пм Степени окисления I 53 [Kr] 4 d 105 s 25 p 5 1681 1251 1140 1008 -328 -349 -325 -295 4. 0 3. 2 3. 0 2. 7 71 99 114 133 Для кристаллического состояния с КЧ(Х–) = 6 133 F -1, 0 181 196 Cl I -1, 0 , +1, +3, Br -1, 0, +1, +3, (+4), +5, (+6), (+4), +5, +7 +7 220 -1, 0, +1, +3, +5, +76
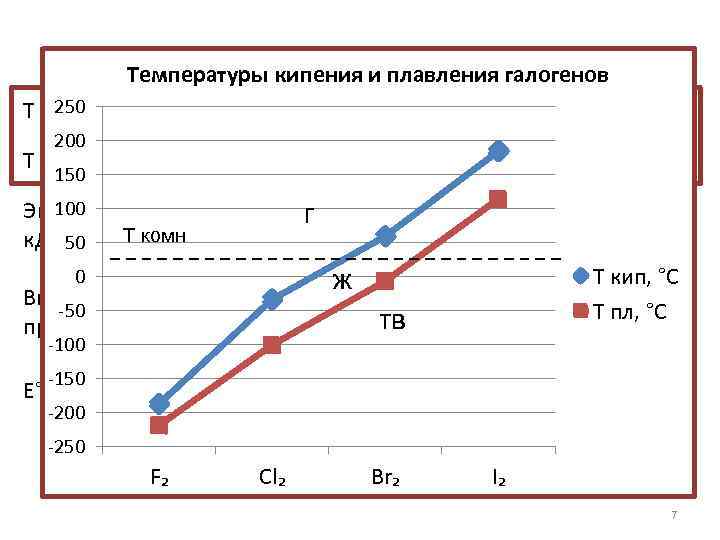 F₂ Cl₂ Br₂ Температуры кипения и плавления галогенов I₂ 250 Т кип, °С -188 -34 59 184, 5 200 Т пл, °С -219, 5 150 100 Энергия связи, к. Дж/моль. Т комн 50 0 Внешний вид -50 при н. у. -100 -150 E° (X₂/2 X⁻), В -200 159 бледножелтый газ 2, 87 -101 г 243 -7 114 193 151 Т кип, ж желтотемно-°С коричневая Т пл, °С зеленый тв жидкость фиолетовые газ кристаллы 1, 36 1, 09 0, 54 -250 F₂ Cl₂ Br₂ I₂ 7
F₂ Cl₂ Br₂ Температуры кипения и плавления галогенов I₂ 250 Т кип, °С -188 -34 59 184, 5 200 Т пл, °С -219, 5 150 100 Энергия связи, к. Дж/моль. Т комн 50 0 Внешний вид -50 при н. у. -100 -150 E° (X₂/2 X⁻), В -200 159 бледножелтый газ 2, 87 -101 г 243 -7 114 193 151 Т кип, ж желтотемно-°С коричневая Т пл, °С зеленый тв жидкость фиолетовые газ кристаллы 1, 36 1, 09 0, 54 -250 F₂ Cl₂ Br₂ I₂ 7
 F₂ Т кип, °С 260 Cl₂ Br₂ I₂ Энергия связи -34 к. Дж/моль Х–Х, -188 59 Т пл, °С 184, 5 -219, 5 240 Энергия связи, 220 к. Дж/моль 200 Внешний вид 180 при н. у. 160 E° 140 (X₂/2 X⁻), В -101 -7 114 159 243 193 151 бледножелтый газ желтотемнокоричневая зеленый фиолетовые жидкость газ кристаллы 2, 87 1, 36 1, 09 0, 54 120 F₂ Cl₂ Br₂ I₂ 8
F₂ Т кип, °С 260 Cl₂ Br₂ I₂ Энергия связи -34 к. Дж/моль Х–Х, -188 59 Т пл, °С 184, 5 -219, 5 240 Энергия связи, 220 к. Дж/моль 200 Внешний вид 180 при н. у. 160 E° 140 (X₂/2 X⁻), В -101 -7 114 159 243 193 151 бледножелтый газ желтотемнокоричневая зеленый фиолетовые жидкость газ кристаллы 2, 87 1, 36 1, 09 0, 54 120 F₂ Cl₂ Br₂ I₂ 8
 F₂ Cl₂ Br₂ I₂ -34 59 184, 5 E° (X₂/2 X⁻), В Т кип, 3. 5 °С -188 Т пл, °С 3 -219, 5 -101 -7 114 159 243 193 151 2. 5 Энергия связи, к. Дж/моль 2 1. 5 Внешний вид при н. у. 1 бледножелтый газ 0. 5 E° (X₂/2 X⁻), В желтотемнокоричневая зеленый фиолетовые жидкость газ кристаллы 2, 87 1, 36 1, 09 0, 54 0 F₂ Cl₂ Br₂ I₂ 9
F₂ Cl₂ Br₂ I₂ -34 59 184, 5 E° (X₂/2 X⁻), В Т кип, 3. 5 °С -188 Т пл, °С 3 -219, 5 -101 -7 114 159 243 193 151 2. 5 Энергия связи, к. Дж/моль 2 1. 5 Внешний вид при н. у. 1 бледножелтый газ 0. 5 E° (X₂/2 X⁻), В желтотемнокоричневая зеленый фиолетовые жидкость газ кристаллы 2, 87 1, 36 1, 09 0, 54 0 F₂ Cl₂ Br₂ I₂ 9
 Химические свойства галогенов. УВЕЛИЧЕНИЕ ОКИСЛИТЕЛЬНЫХ СВОЙСТВ 1. Фтор очень сильный окислитель. Si. O 2 (КВАРЦ) + 2 F 2 = Si. F 4 + O 2 Na 2 SO 4 + 2 F 2 = 2 Na. F + SO 2 F 2 + O 2 Xe + 2 F 2 = Xe. F 4 (КР. ) 2 H 2 O + 2 F 2 = 4 HF + O 2 (…+ O 3 + OF 2 + HFO…) 10
Химические свойства галогенов. УВЕЛИЧЕНИЕ ОКИСЛИТЕЛЬНЫХ СВОЙСТВ 1. Фтор очень сильный окислитель. Si. O 2 (КВАРЦ) + 2 F 2 = Si. F 4 + O 2 Na 2 SO 4 + 2 F 2 = 2 Na. F + SO 2 F 2 + O 2 Xe + 2 F 2 = Xe. F 4 (КР. ) 2 H 2 O + 2 F 2 = 4 HF + O 2 (…+ O 3 + OF 2 + HFO…) 10
 Химические свойства галогенов. 2. Окислительные свойства в ряду Cl 2 – Br 2 – I 2. 2 KBr + Cl 2 = Br 2 + 2 KCl 2 KI + Br 2 = I 2 + 2 KBr 2 KI + Cl 2 = I 2 + 2 KCl I 2 + 5 Cl 2 + 6 H 2 O = 2 HIO 3 + 10 HCl 3. Бром и хлор – сильные окислители: a) Почти все металлы и многие неметаллы реагируют с хлором и бромом с образованием высших галогенидов: 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 ; P 4 + 10 Br 2 = 4 PBr 5 (…+PBr 3) 2 Sb + 3 Cl 2 = 2 Sb. Cl 5 (…+Sb. Cl 3); Cu + Br 2 = Cu. Br 2 b) Ti. O 2 + 2 Cl 2 800ºC Ti. Cl 4 + 2 CO 3 Br 2 + S + 4 H 2 O = 6 HBr + H 2 SO 4 11
Химические свойства галогенов. 2. Окислительные свойства в ряду Cl 2 – Br 2 – I 2. 2 KBr + Cl 2 = Br 2 + 2 KCl 2 KI + Br 2 = I 2 + 2 KBr 2 KI + Cl 2 = I 2 + 2 KCl I 2 + 5 Cl 2 + 6 H 2 O = 2 HIO 3 + 10 HCl 3. Бром и хлор – сильные окислители: a) Почти все металлы и многие неметаллы реагируют с хлором и бромом с образованием высших галогенидов: 2 Fe + 3 Cl 2 = 2 Fe. Cl 3 ; P 4 + 10 Br 2 = 4 PBr 5 (…+PBr 3) 2 Sb + 3 Cl 2 = 2 Sb. Cl 5 (…+Sb. Cl 3); Cu + Br 2 = Cu. Br 2 b) Ti. O 2 + 2 Cl 2 800ºC Ti. Cl 4 + 2 CO 3 Br 2 + S + 4 H 2 O = 6 HBr + H 2 SO 4 11
 Химические свойства галогенов. 4. Йод является как окислителем, так и восстановителем: a) Окислительные свойства йода: 2 Al + 3 I 2 = 2 Al. I 3 ; H 2 S + I 2 = 2 HI + S 2 P(красн. ) + 3 I 2 + 6 H 2 O = 2 H 3 PO 3 + 6 HI b) Восстановительные свойства йода: 3 I 2(тв) + 10 HNO 3(100%) = 6 HIO 3 + 10 NO 2 + 2 H 2 O 5. Качественные реакции галогенов. a) Окрашивание слоя бензола в цвет паров(Cl 2, Br 2, I 2) b) m. I 2 + (C 6 H 10 O 5)n (крахмал) = (C 6 H 10 O 5)n·m. I 2 соединение включения сине-фиолетового окрашивания 12
Химические свойства галогенов. 4. Йод является как окислителем, так и восстановителем: a) Окислительные свойства йода: 2 Al + 3 I 2 = 2 Al. I 3 ; H 2 S + I 2 = 2 HI + S 2 P(красн. ) + 3 I 2 + 6 H 2 O = 2 H 3 PO 3 + 6 HI b) Восстановительные свойства йода: 3 I 2(тв) + 10 HNO 3(100%) = 6 HIO 3 + 10 NO 2 + 2 H 2 O 5. Качественные реакции галогенов. a) Окрашивание слоя бензола в цвет паров(Cl 2, Br 2, I 2) b) m. I 2 + (C 6 H 10 O 5)n (крахмал) = (C 6 H 10 O 5)n·m. I 2 соединение включения сине-фиолетового окрашивания 12
 Химические свойства галогенов. 6. Взаимодействие с водой. 2 F 2 + 2 H 2 O = (HF)2 + O 2 (…+ O 3 …+ H 2 O 2) (при 25 о. С) Хлор, бром и йод реагируют по схеме: X 2 + H 2 O HOX + H+ + X– (при 25 о. С) K = 3, 9· 10 -4 X = Cl K = 7, 2· 10 -9 X = Br K = 2, 0· 10 -13 X=I Тем не менее Cl 2 aq , Br 2 aq , I 2 aq Для повышения растворимости йода используют KI: 8 Cl 2· 46 H 2 O I– + I 2 = [I 3]– ([I 5]–, [I 7]–…) 13
Химические свойства галогенов. 6. Взаимодействие с водой. 2 F 2 + 2 H 2 O = (HF)2 + O 2 (…+ O 3 …+ H 2 O 2) (при 25 о. С) Хлор, бром и йод реагируют по схеме: X 2 + H 2 O HOX + H+ + X– (при 25 о. С) K = 3, 9· 10 -4 X = Cl K = 7, 2· 10 -9 X = Br K = 2, 0· 10 -13 X=I Тем не менее Cl 2 aq , Br 2 aq , I 2 aq Для повышения растворимости йода используют KI: 8 Cl 2· 46 H 2 O I– + I 2 = [I 3]– ([I 5]–, [I 7]–…) 13
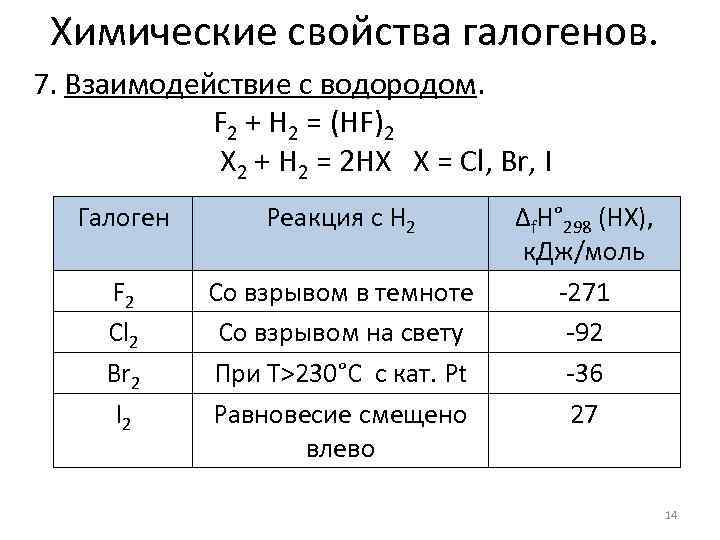 Химические свойства галогенов. 7. Взаимодействие с водородом. F 2 + H 2 = (HF)2 X 2 + H 2 = 2 HX X = Cl, Br, I Галоген Реакция с H 2 F 2 Cl 2 Br 2 I 2 Со взрывом в темноте Со взрывом на свету При Т>230°C c кат. Pt Равновесие смещено влево Δf. H° 298 (HX), к. Дж/моль -271 -92 -36 27 14
Химические свойства галогенов. 7. Взаимодействие с водородом. F 2 + H 2 = (HF)2 X 2 + H 2 = 2 HX X = Cl, Br, I Галоген Реакция с H 2 F 2 Cl 2 Br 2 I 2 Со взрывом в темноте Со взрывом на свету При Т>230°C c кат. Pt Равновесие смещено влево Δf. H° 298 (HX), к. Дж/моль -271 -92 -36 27 14
 HF HCl HBr HI Т кип, °С 19 -85 -67 -35 Т пл, °С HF -83 HCl -114 HBr -87 565 431 364 297 92 128 141 Т кип 161 Т пл 1, 86 1, 11 0, 79 0, 38 0, 00064 109 1011 1012 40 Энергия связи, 20 к. Дж/моль 0 -20 Длина связи, -40 пм -60 Дипольный момент, D -80 Константа-100 -120 диссоциации, KA -140 HI -51 15
HF HCl HBr HI Т кип, °С 19 -85 -67 -35 Т пл, °С HF -83 HCl -114 HBr -87 565 431 364 297 92 128 141 Т кип 161 Т пл 1, 86 1, 11 0, 79 0, 38 0, 00064 109 1011 1012 40 Энергия связи, 20 к. Дж/моль 0 -20 Длина связи, -40 пм -60 Дипольный момент, D -80 Константа-100 -120 диссоциации, KA -140 HI -51 15
 HF HCl Е св, к. Дж/моль 19 -85 Т кип, °С 565 -83431 Т пл, °С -67 -35 -87 -51 364 297 -114 565 431 92 128 1, 86 1, 11 mu, D Дипольный момент, D 92 Константа диссоциации, HF KA HI 364 Энергия связи, к. Дж/моль Длина связи, 1, 86 пм HBr 128 1, 11 0, 00064 HCl d 141 св, пм 161 141 0, 79 109 HBr 1011 0, 38 12 10 HI 16
HF HCl Е св, к. Дж/моль 19 -85 Т кип, °С 565 -83431 Т пл, °С -67 -35 -87 -51 364 297 -114 565 431 92 128 1, 86 1, 11 mu, D Дипольный момент, D 92 Константа диссоциации, HF KA HI 364 Энергия связи, к. Дж/моль Длина связи, 1, 86 пм HBr 128 1, 11 0, 00064 HCl d 141 св, пм 161 141 0, 79 109 HBr 1011 0, 38 12 10 HI 16
 Особенности фтороводорода В жидком HF образуются водородные связи между молекулами : Чаще всего встречаются частицы (HF)n , где n = 2 – 6. В водных растворах плавиковой кислоты образуются устойчивые частицы HF 2– : F – + HF = HF 2– Существуют устойчивые соли NH 4 HF 2 , KHF 2. Плавиковая кислота растворяет стекло: 4 HF + Si. O 2 = Si. F 4 + 2 H 2 O 6 HF(изб) + Si. O 2 = H 2[Si. F 6] + 2 H 2 O 17
Особенности фтороводорода В жидком HF образуются водородные связи между молекулами : Чаще всего встречаются частицы (HF)n , где n = 2 – 6. В водных растворах плавиковой кислоты образуются устойчивые частицы HF 2– : F – + HF = HF 2– Существуют устойчивые соли NH 4 HF 2 , KHF 2. Плавиковая кислота растворяет стекло: 4 HF + Si. O 2 = Si. F 4 + 2 H 2 O 6 HF(изб) + Si. O 2 = H 2[Si. F 6] + 2 H 2 O 17
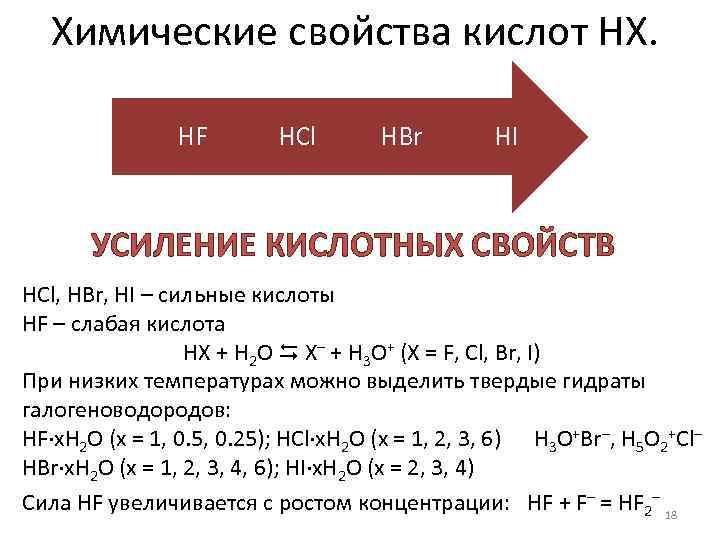 Химические свойства кислот НХ. HF HCl HBr HI УСИЛЕНИЕ КИСЛОТНЫХ СВОЙСТВ HCl, HBr, HI – сильные кислоты HF – слабая кислота HX + H 2 O X– + H 3 O+ (X = F, Cl, Br, I) При низких температурах можно выделить твердые гидраты галогеноводородов: HF·x. H 2 O (x = 1, 0. 5, 0. 25); HCl·x. H 2 O (x = 1, 2, 3, 6) H 3 O+Br–, H 5 O 2+Cl– HBr·x. H 2 O (x = 1, 2, 3, 4, 6); HI·x. H 2 O (x = 2, 3, 4) Сила HF увеличивается с ростом концентрации: HF + F– = HF 2– 18
Химические свойства кислот НХ. HF HCl HBr HI УСИЛЕНИЕ КИСЛОТНЫХ СВОЙСТВ HCl, HBr, HI – сильные кислоты HF – слабая кислота HX + H 2 O X– + H 3 O+ (X = F, Cl, Br, I) При низких температурах можно выделить твердые гидраты галогеноводородов: HF·x. H 2 O (x = 1, 0. 5, 0. 25); HCl·x. H 2 O (x = 1, 2, 3, 6) H 3 O+Br–, H 5 O 2+Cl– HBr·x. H 2 O (x = 1, 2, 3, 4, 6); HI·x. H 2 O (x = 2, 3, 4) Сила HF увеличивается с ростом концентрации: HF + F– = HF 2– 18
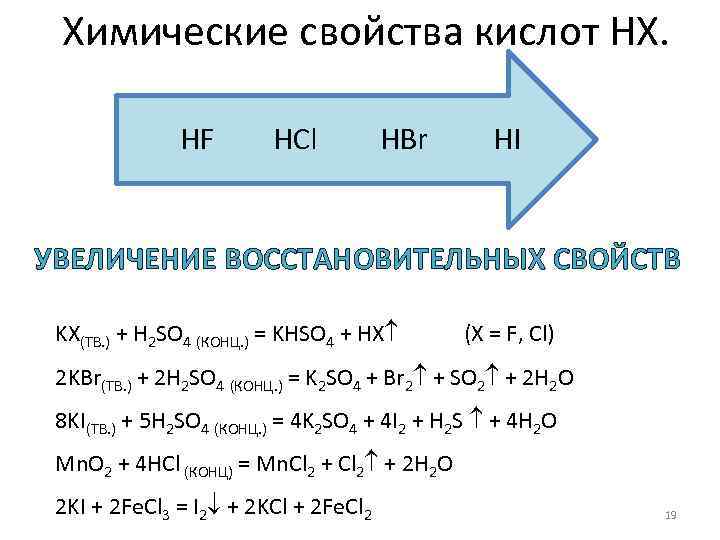 Химические свойства кислот НХ. HF HCl HBr HI УВЕЛИЧЕНИЕ ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ KX(ТВ. ) + H 2 SO 4 (КОНЦ. ) = KHSO 4 + HX (X = F, Cl) 2 KBr(ТВ. ) + 2 H 2 SO 4 (КОНЦ. ) = K 2 SO 4 + Br 2 + SO 2 + 2 H 2 O 8 KI(ТВ. ) + 5 H 2 SO 4 (КОНЦ. ) = 4 K 2 SO 4 + 4 I 2 + H 2 S + 4 H 2 O Mn. O 2 + 4 HCl (КОНЦ) = Mn. Cl 2 + 2 H 2 O 2 KI + 2 Fe. Cl 3 = I 2 + 2 KCl + 2 Fe. Cl 2 19
Химические свойства кислот НХ. HF HCl HBr HI УВЕЛИЧЕНИЕ ВОССТАНОВИТЕЛЬНЫХ СВОЙСТВ KX(ТВ. ) + H 2 SO 4 (КОНЦ. ) = KHSO 4 + HX (X = F, Cl) 2 KBr(ТВ. ) + 2 H 2 SO 4 (КОНЦ. ) = K 2 SO 4 + Br 2 + SO 2 + 2 H 2 O 8 KI(ТВ. ) + 5 H 2 SO 4 (КОНЦ. ) = 4 K 2 SO 4 + 4 I 2 + H 2 S + 4 H 2 O Mn. O 2 + 4 HCl (КОНЦ) = Mn. Cl 2 + 2 H 2 O 2 KI + 2 Fe. Cl 3 = I 2 + 2 KCl + 2 Fe. Cl 2 19
 Кислородные кислоты галогенов 1. Кислородных кислот фтора не существует. Есть очень неустойчивое соединение HOF, которое разлагается в присутствии воды: HOF + H 2 O = H 2 O 2 + HF 2. Для Cl, Br, I существует несколько кислородных кислот: СО Cl Br I +1 HCl. O HBr. O (HIO) +3 HCl. O 2 +5 HCl. O 3 HBr. O 3 HIO 3 +7 HCl. O 4 (HBr. O 4) H 5 IO 6 20
Кислородные кислоты галогенов 1. Кислородных кислот фтора не существует. Есть очень неустойчивое соединение HOF, которое разлагается в присутствии воды: HOF + H 2 O = H 2 O 2 + HF 2. Для Cl, Br, I существует несколько кислородных кислот: СО Cl Br I +1 HCl. O HBr. O (HIO) +3 HCl. O 2 +5 HCl. O 3 HBr. O 3 HIO 3 +7 HCl. O 4 (HBr. O 4) H 5 IO 6 20
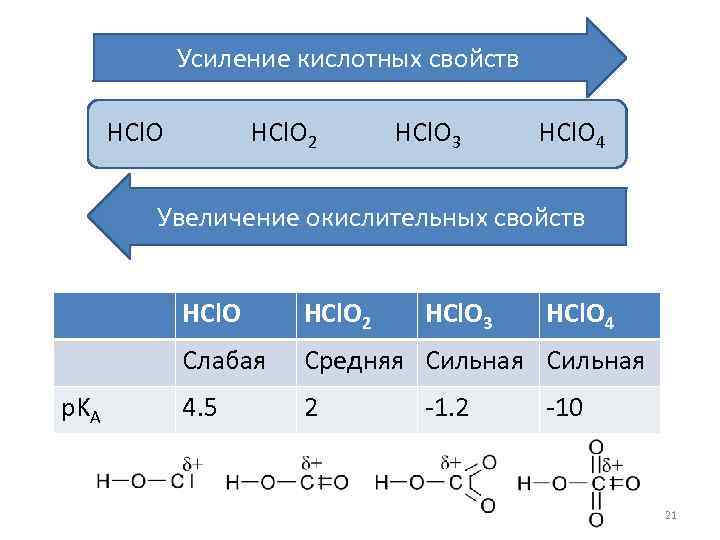 Усиление кислотных свойств HCl. O 2 HCl. O 3 HCl. O 4 Увеличение окислительных свойств HCl. O Слабая p. KA HCl. O 2 HCl. O 3 Средняя Сильная 4. 5 2 -1. 2 HCl. O 4 -10 21
Усиление кислотных свойств HCl. O 2 HCl. O 3 HCl. O 4 Увеличение окислительных свойств HCl. O Слабая p. KA HCl. O 2 HCl. O 3 Средняя Сильная 4. 5 2 -1. 2 HCl. O 4 -10 21
 HCl. O Br. O IO H H HCl. O 3 HB r. O 3 HIO 4 + 2 H 2 O = H 5 IO 6 3 Na. OH + H 5 IO 6 = Na 3 H 2 IO 6 HCl. O 4 Br. O 4 H HI 22
HCl. O Br. O IO H H HCl. O 3 HB r. O 3 HIO 4 + 2 H 2 O = H 5 IO 6 3 Na. OH + H 5 IO 6 = Na 3 H 2 IO 6 HCl. O 4 Br. O 4 H HI 22
 Химические свойства оксокислот галогенов и их солей. 2 Na. OH + Cl 2 0°C Na. Cl. O + Na. Cl + H 2 O 6 Na. OH + 3 Cl 2 60°C Na. Cl. O 3 + 5 Na. Cl + 3 H 2 O Диспропорционирование ионов XO– : 3 XO– = 2 X– + XO 3– Кравн растет в ряду IO– < Br. O– < Cl. O– Скорость реакции падает в ряду IO– > Br. O– > Cl. O– X = Br, I реакция идет очень быстро и IO– в любых растворах не обнаруживается. Ca(OH)2 + Cl 2 = Ca. OCl 2 + H 2 белильная известь Ca. OCl 2 = Ca. Cl 2 + 0, 5 O 2 хлорид гипохлорит кальция 23
Химические свойства оксокислот галогенов и их солей. 2 Na. OH + Cl 2 0°C Na. Cl. O + Na. Cl + H 2 O 6 Na. OH + 3 Cl 2 60°C Na. Cl. O 3 + 5 Na. Cl + 3 H 2 O Диспропорционирование ионов XO– : 3 XO– = 2 X– + XO 3– Кравн растет в ряду IO– < Br. O– < Cl. O– Скорость реакции падает в ряду IO– > Br. O– > Cl. O– X = Br, I реакция идет очень быстро и IO– в любых растворах не обнаруживается. Ca(OH)2 + Cl 2 = Ca. OCl 2 + H 2 белильная известь Ca. OCl 2 = Ca. Cl 2 + 0, 5 O 2 хлорид гипохлорит кальция 23
 Химические свойства оксокислот галогенов и их солей. HCl. O 2 – неустойчива: 4 HCl. O 2 = 2 Cl. O 2 + HCl. O 3 + HCl + H 2 O Ее соли хлориты используют для отбеливания, Ba(Cl. O 2)2 Растворы HBr. O 3 и HCl. O 3 >30% взрывоопасны. HIO 3 – кристаллическое вещество, хорошо растворимое в воде. При высоких концентрациях она димеризуется: IO 3– + HIO 3 [H(IO 3)2]– Окислительная способность анионов XO 3– изменяется в ряду: Br. O 3– Cl. O 3– > IO 3– (т/д фактор) HBr. O 3 + X 2 = 2 HXO 3 + Br 2 (X = Cl, I) Скорость реакций с XO 3– - окислителем изменяется в ряду: IO 3– > Br. O 3– > Cl. O 3– (кинетический фактор) KCl. O 3 – бертолетова соль – сильный окислитель: 4 KCl. O 3 + С 6 H 12 O 6 = 4 KCl + 6 CO 2 + 6 H 2 O 24
Химические свойства оксокислот галогенов и их солей. HCl. O 2 – неустойчива: 4 HCl. O 2 = 2 Cl. O 2 + HCl. O 3 + HCl + H 2 O Ее соли хлориты используют для отбеливания, Ba(Cl. O 2)2 Растворы HBr. O 3 и HCl. O 3 >30% взрывоопасны. HIO 3 – кристаллическое вещество, хорошо растворимое в воде. При высоких концентрациях она димеризуется: IO 3– + HIO 3 [H(IO 3)2]– Окислительная способность анионов XO 3– изменяется в ряду: Br. O 3– Cl. O 3– > IO 3– (т/д фактор) HBr. O 3 + X 2 = 2 HXO 3 + Br 2 (X = Cl, I) Скорость реакций с XO 3– - окислителем изменяется в ряду: IO 3– > Br. O 3– > Cl. O 3– (кинетический фактор) KCl. O 3 – бертолетова соль – сильный окислитель: 4 KCl. O 3 + С 6 H 12 O 6 = 4 KCl + 6 CO 2 + 6 H 2 O 24
 Химические свойства оксокислот галогенов и их солей. HCl. O 4 – бесцветная взрывоопасная жидкость. HBr. O 4 – существует только в растворах (до 50%). Йодных кислот существует несколько: HIO 4 – метайодная кислота, H 5 IO 6 – ортойодная кислота, (HIO 4· 2 H 2 O) – самая устойчивая. H 4 I 2 O 9 – димезойодная кислота, H 7 I 3 O 14 – трийодная кислота, H 3 IO 5 – мезойодная кислота (HIO 4·H 2 O) димезойодная кислота трийодная кислота 25
Химические свойства оксокислот галогенов и их солей. HCl. O 4 – бесцветная взрывоопасная жидкость. HBr. O 4 – существует только в растворах (до 50%). Йодных кислот существует несколько: HIO 4 – метайодная кислота, H 5 IO 6 – ортойодная кислота, (HIO 4· 2 H 2 O) – самая устойчивая. H 4 I 2 O 9 – димезойодная кислота, H 7 I 3 O 14 – трийодная кислота, H 3 IO 5 – мезойодная кислота (HIO 4·H 2 O) димезойодная кислота трийодная кислота 25
 Химические свойства оксокислот галогенов и их солей. Окислительные свойства XO 4– изменяются в ряду: Br. O 4– Cl. O 4– > IO 4– (аналогично XO 3– т/д фактор) Но в водных растворах реакции с участием Br. O 4– и Cl. O 4– идут крайне медленно: Mg + 2 HCl. O 4 = Mg(Cl. O 4)2 + H 2 HCl. O 4 не окисляет I– и NO 2– HBr. O 4 не окисляет HCl до Cl 2 , НО! H 5 IO 6 + 2 HCl = HIO 3 + Cl 2 + 3 H 2 O Т. е. скорость реакций меняется в ряду: IO 4– > Br. O 4– > Cl. O 4– (кинетический фактор) Na 5 IO 6 можно получить только в очень конц. Na. OH 2 Ag. NO 3 + Na 2 H 3 IO 6 = Ag 2 H 3 IO 6 (ЖЕЛТ) + 2 Na. NO 3 (при р. Н < 3) 5 Ag. NO 3 + Na 2 H 3 IO 6 = Ag 5 IO 6 (ЧЕРН) + 2 Na. NO 3 + 3 HNO 3 (при р. Н > 3) 26
Химические свойства оксокислот галогенов и их солей. Окислительные свойства XO 4– изменяются в ряду: Br. O 4– Cl. O 4– > IO 4– (аналогично XO 3– т/д фактор) Но в водных растворах реакции с участием Br. O 4– и Cl. O 4– идут крайне медленно: Mg + 2 HCl. O 4 = Mg(Cl. O 4)2 + H 2 HCl. O 4 не окисляет I– и NO 2– HBr. O 4 не окисляет HCl до Cl 2 , НО! H 5 IO 6 + 2 HCl = HIO 3 + Cl 2 + 3 H 2 O Т. е. скорость реакций меняется в ряду: IO 4– > Br. O 4– > Cl. O 4– (кинетический фактор) Na 5 IO 6 можно получить только в очень конц. Na. OH 2 Ag. NO 3 + Na 2 H 3 IO 6 = Ag 2 H 3 IO 6 (ЖЕЛТ) + 2 Na. NO 3 (при р. Н < 3) 5 Ag. NO 3 + Na 2 H 3 IO 6 = Ag 5 IO 6 (ЧЕРН) + 2 Na. NO 3 + 3 HNO 3 (при р. Н > 3) 26
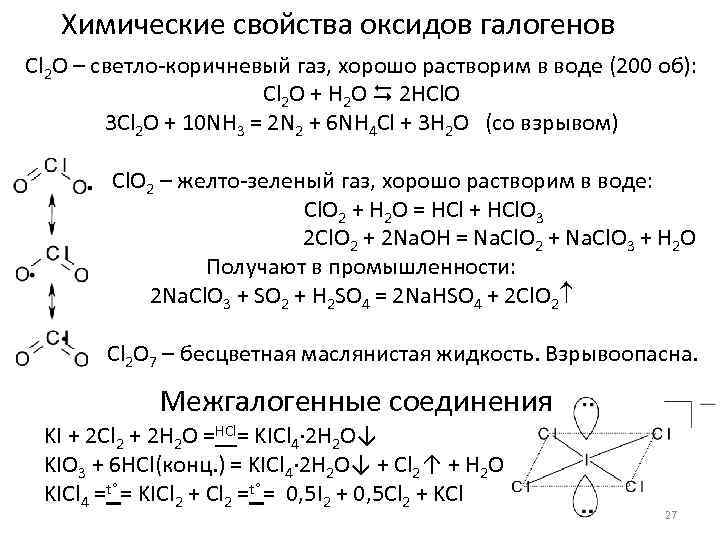 Химические свойства оксидов галогенов Cl 2 O – светло-коричневый газ, хорошо растворим в воде (200 об): Cl 2 O + H 2 O 2 HCl. O 3 Cl 2 O + 10 NH 3 = 2 N 2 + 6 NH 4 Cl + 3 H 2 O (со взрывом) Cl. O 2 – желто-зеленый газ, хорошо растворим в воде: Cl. O 2 + H 2 O = HCl + HCl. O 3 2 Cl. O 2 + 2 Na. OH = Na. Cl. O 2 + Na. Cl. O 3 + H 2 O Получают в промышленности: 2 Na. Cl. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2 Cl 2 O 7 – бесцветная маслянистая жидкость. Взрывоопасна. Межгалогенные соединения KI + 2 Cl 2 + 2 H 2 O =HCl= KICl 4· 2 H 2 O↓ KIO 3 + 6 HCl(конц. ) = KICl 4· 2 H 2 O↓ + Cl 2↑ + H 2 O KICl 4 =t° = KICl 2 + Cl 2 =t° = 0, 5 I 2 + 0, 5 Cl 2 + KCl 27
Химические свойства оксидов галогенов Cl 2 O – светло-коричневый газ, хорошо растворим в воде (200 об): Cl 2 O + H 2 O 2 HCl. O 3 Cl 2 O + 10 NH 3 = 2 N 2 + 6 NH 4 Cl + 3 H 2 O (со взрывом) Cl. O 2 – желто-зеленый газ, хорошо растворим в воде: Cl. O 2 + H 2 O = HCl + HCl. O 3 2 Cl. O 2 + 2 Na. OH = Na. Cl. O 2 + Na. Cl. O 3 + H 2 O Получают в промышленности: 2 Na. Cl. O 3 + SO 2 + H 2 SO 4 = 2 Na. HSO 4 + 2 Cl. O 2 Cl 2 O 7 – бесцветная маслянистая жидкость. Взрывоопасна. Межгалогенные соединения KI + 2 Cl 2 + 2 H 2 O =HCl= KICl 4· 2 H 2 O↓ KIO 3 + 6 HCl(конц. ) = KICl 4· 2 H 2 O↓ + Cl 2↑ + H 2 O KICl 4 =t° = KICl 2 + Cl 2 =t° = 0, 5 I 2 + 0, 5 Cl 2 + KCl 27
 Применения в медицине: 1. В зубных пастах Sn. F 2 + 2 Ca 5(PO 4)3(OH) Sn(OH)2 + 2 Ca 5(PO 4)3 F гидроксиапатит фторапатит 2. Фторуглероды – голубая кровь, высокая растворимость O 2 3. Иодинол – (крахмал + иод); Иодный раствор в спирте 4. Физиологический раствор 0, 9% раствор Na. Cl в воде. 5. Раствор KBr – успокаивающий препарат ( «бром» ). 6. Ca. OCl 2 – хлорная известь – санобработка. 7. Щитовидная железа содержит около 20 мг йода. Тироксин и другие гормоны ЩЖ регулируют температуру тела, умственную деятельность, физическое состояние. Ежедневная потребность около 0, 2 мг йода. тироксин 8. HCl – в желудочном соке. 9. Радиодиагностика опухолей 125 I и 131 I. 28
Применения в медицине: 1. В зубных пастах Sn. F 2 + 2 Ca 5(PO 4)3(OH) Sn(OH)2 + 2 Ca 5(PO 4)3 F гидроксиапатит фторапатит 2. Фторуглероды – голубая кровь, высокая растворимость O 2 3. Иодинол – (крахмал + иод); Иодный раствор в спирте 4. Физиологический раствор 0, 9% раствор Na. Cl в воде. 5. Раствор KBr – успокаивающий препарат ( «бром» ). 6. Ca. OCl 2 – хлорная известь – санобработка. 7. Щитовидная железа содержит около 20 мг йода. Тироксин и другие гормоны ЩЖ регулируют температуру тела, умственную деятельность, физическое состояние. Ежедневная потребность около 0, 2 мг йода. тироксин 8. HCl – в желудочном соке. 9. Радиодиагностика опухолей 125 I и 131 I. 28
 Гипервалентные связи в ионе I 3– 29
Гипервалентные связи в ионе I 3– 29
 30
30
 Энергетические характеристики гидратации иона Х– Энергия Гиббса, энатльпия, энтропия гидратации X– F⁻ Cl⁻ Br⁻ ΔShyd, Дж/(моль·К) -90 -70 I⁻ -50 -150 ΔGhyd, к. Дж/моль -334 -459 -361 -309 -270 -285 -330 ΔHhyd, к. Дж/моль -504 31
Энергетические характеристики гидратации иона Х– Энергия Гиббса, энатльпия, энтропия гидратации X– F⁻ Cl⁻ Br⁻ ΔShyd, Дж/(моль·К) -90 -70 I⁻ -50 -150 ΔGhyd, к. Дж/моль -334 -459 -361 -309 -270 -285 -330 ΔHhyd, к. Дж/моль -504 31
 32
32
 Е°, В Изменение окислительных свойств в ряду HCl. O – HCl. O 2 – HCl. O 3 – HCl. O 4 1. 8 1. 6 1. 4 1. 2 1 0. 8 0. 6 0. 4 0. 2 0 p. H 14 HCl. O₂ HCl. O₃ HCl. O₄ 33
Е°, В Изменение окислительных свойств в ряду HCl. O – HCl. O 2 – HCl. O 3 – HCl. O 4 1. 8 1. 6 1. 4 1. 2 1 0. 8 0. 6 0. 4 0. 2 0 p. H 14 HCl. O₂ HCl. O₃ HCl. O₄ 33


