Презентацияфосфор.ppt
- Количество слайдов: 66
 Элементы VА-группы 15 Фосфор P 30, 974 3 s 23 p 3 33 Мышьяк As 74, 921 3 d 104 s 24 p 3 51 Сурьма Sb 121, 76 4 d 105 s 25 p 3 83 Висмут Bi 208, 980 4 f 145 d 106 s 26 p 3
Элементы VА-группы 15 Фосфор P 30, 974 3 s 23 p 3 33 Мышьяк As 74, 921 3 d 104 s 24 p 3 51 Сурьма Sb 121, 76 4 d 105 s 25 p 3 83 Висмут Bi 208, 980 4 f 145 d 106 s 26 p 3
 Фосфор P, мышьяк As, сурьма Sb и висмут Bi составляют главную подгруппу VA группы периодической системы. Электронная конфигурация внешнего электронного уровня – ns²np³. Фосфор относят к типическим элементам, а мышьяк, сурьму и висмут объединяют в подгруппу мышьяка.
Фосфор P, мышьяк As, сурьма Sb и висмут Bi составляют главную подгруппу VA группы периодической системы. Электронная конфигурация внешнего электронного уровня – ns²np³. Фосфор относят к типическим элементам, а мышьяк, сурьму и висмут объединяют в подгруппу мышьяка.
 Атомы элементов VА-группы имеют на наружной оболочке по 5 электронов, 3 из которых - неспаренные. С. О. : -3 и +5. Низшую степень окисления проявляют фосфор и мышьяк в соединениях с водородом типа ЭН 3, а высшую - в соединениях с более электроотрицательными элементами, например, в оксидах типа Э 2 О 5.
Атомы элементов VА-группы имеют на наружной оболочке по 5 электронов, 3 из которых - неспаренные. С. О. : -3 и +5. Низшую степень окисления проявляют фосфор и мышьяк в соединениях с водородом типа ЭН 3, а высшую - в соединениях с более электроотрицательными элементами, например, в оксидах типа Э 2 О 5.
 Металлические свойства: при переходе от фосфора к висмуту возрастают. У сурьмы можно наблюдать практически в равной степени металлические и неметаллические свойства, а висмут обладает уже типичными металлическими свойствами. У элементов VА-группы неметаллические свойства выражены слабее, чем у соответствующих элементов VI А - и VII А групп.
Металлические свойства: при переходе от фосфора к висмуту возрастают. У сурьмы можно наблюдать практически в равной степени металлические и неметаллические свойства, а висмут обладает уже типичными металлическими свойствами. У элементов VА-группы неметаллические свойства выражены слабее, чем у соответствующих элементов VI А - и VII А групп.
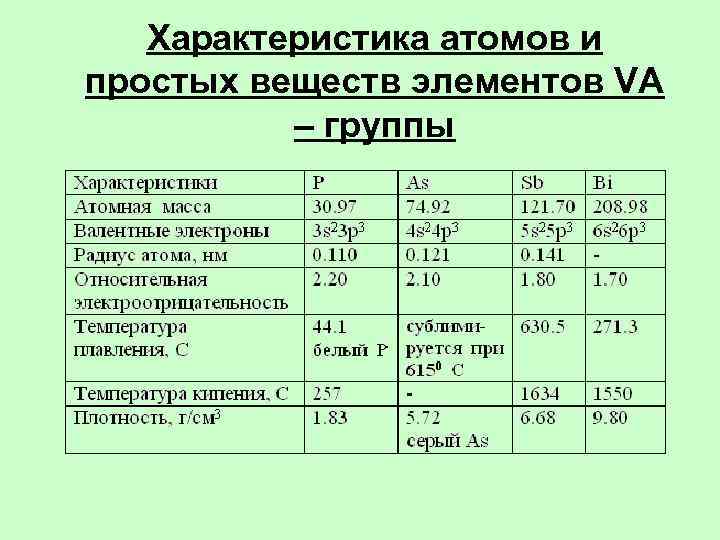 Характеристика атомов и простых веществ элементов VА – группы
Характеристика атомов и простых веществ элементов VА – группы
 Фосфор. Общая характеристика • Фосфор по аналогии с азотом (2 s² 2 p³) имеет пять валентных электронов (3 s² 3 p³). Валентными являются также 3 d-орбитали. Поэтому для данного элемента возможны 3 p³d²- , sp³d- и sp³- типы гибридизации валентных орбиталей • Фосфор может иметь следующие степени окисления: -3, +1, +3 и +5. Однако наиболее характерна +5. Максимальное координационное число фосфора равно 6
Фосфор. Общая характеристика • Фосфор по аналогии с азотом (2 s² 2 p³) имеет пять валентных электронов (3 s² 3 p³). Валентными являются также 3 d-орбитали. Поэтому для данного элемента возможны 3 p³d²- , sp³d- и sp³- типы гибридизации валентных орбиталей • Фосфор может иметь следующие степени окисления: -3, +1, +3 и +5. Однако наиболее характерна +5. Максимальное координационное число фосфора равно 6
 Впервые фосфор был получен Брандом, немецким купцом, алхимиком, в 1669 году нагреванием сухого остатка мочи без доступа воздуха. Позже Лавуазье доказал, что фосфор является самостоятельным химическим элементом.
Впервые фосфор был получен Брандом, немецким купцом, алхимиком, в 1669 году нагреванием сухого остатка мочи без доступа воздуха. Позже Лавуазье доказал, что фосфор является самостоятельным химическим элементом.
 Р - наиболее распространенный элемент VАгруппы (0, 09%). В свободном виде он в природе не встречается, так как обладает высокой химической активностью. Основные запасы фосфора сконцентрированы в виде апатитов (3 Ca 3(PO 4)2. Ca(Hal)2, где Hal - F, реже - Cl, OH) и фосфоритов (Ca 3(PO 4)2).
Р - наиболее распространенный элемент VАгруппы (0, 09%). В свободном виде он в природе не встречается, так как обладает высокой химической активностью. Основные запасы фосфора сконцентрированы в виде апатитов (3 Ca 3(PO 4)2. Ca(Hal)2, где Hal - F, реже - Cl, OH) и фосфоритов (Ca 3(PO 4)2).
 Промышленный способ получения фосфора из этих соединений основан на прокаливании в электропечах при 1500º С смеси, состоящей из фосфата кальция, угля и песка: 10 С + 6 Si. O 2 + 2 Ca 3(PO 4)2 → 10 CO + 6 Ca. Si. O 3 + 4 P
Промышленный способ получения фосфора из этих соединений основан на прокаливании в электропечах при 1500º С смеси, состоящей из фосфата кальция, угля и песка: 10 С + 6 Si. O 2 + 2 Ca 3(PO 4)2 → 10 CO + 6 Ca. Si. O 3 + 4 P
 Фосфор имеет три основные аллотропные модификации: белый, белый красный, черный фосфор и другие.
Фосфор имеет три основные аллотропные модификации: белый, белый красный, черный фосфор и другие.
 Белый фосфор наиболее химически активен среди остальных полиморфных модификаций. Белый фосфор - воскообразное вещество, нерастворимое в воде, но ХР в CS 2, PCl 3, CCl 4 и C 6 H 6, плавится при температуре 44º С. Получают его конденсацией паров фосфора. Очень ядовит!
Белый фосфор наиболее химически активен среди остальных полиморфных модификаций. Белый фосфор - воскообразное вещество, нерастворимое в воде, но ХР в CS 2, PCl 3, CCl 4 и C 6 H 6, плавится при температуре 44º С. Получают его конденсацией паров фосфора. Очень ядовит!
 Уже при обыч. температуре белый фосфор испаряется и окисляется сначала до P 4 O 6, а затем до P 4 O 10. В процессе окисления энергия выделяется в виде света. На воздухе белый фосфор самовоспламеняется. Хранят его под слоем воды в темном месте. При длительном слабом нагревании он переходит в красный фосфор.
Уже при обыч. температуре белый фосфор испаряется и окисляется сначала до P 4 O 6, а затем до P 4 O 10. В процессе окисления энергия выделяется в виде света. На воздухе белый фосфор самовоспламеняется. Хранят его под слоем воды в темном месте. При длительном слабом нагревании он переходит в красный фосфор.
 Красный фосфор - получают нагреванием белого фосфора до 300 -400 ºС без доступа воздуха. Он менее хим. активен, не летуч, ПН в воде и других растворителях. Температура плавления 585 до 610 ºС. В парообразном состоянии образуются молекулы Р 2, которые при конденсации переходят в молекулы белого фосфора Р 4.
Красный фосфор - получают нагреванием белого фосфора до 300 -400 ºС без доступа воздуха. Он менее хим. активен, не летуч, ПН в воде и других растворителях. Температура плавления 585 до 610 ºС. В парообразном состоянии образуются молекулы Р 2, которые при конденсации переходят в молекулы белого фосфора Р 4.
 Черный фосфор также получают из белого, Черный фосфор белого нагревая его до 200º С при высоком давлении (12000 МПа), или длительно нагревая его до 400º С в присутствии катализатора (Hg). Это наиболее устойчивая химическая модификация. Черный фосфор напоминает графит, жирен на ощупь, электро- и теплопроводен. Эта модификация имеет атомно-слоистую структуру. Фосфор легко окисляется : • 4 P + 5 O 2 → P 4 O 10 • 8 P + 10 NO 2 → 2 P 4 O 10 + 5 N 2 • 4 P + 10 CO 2 → P 4 O 10 + 10 CO • 2 P + 5 Cl 2 → 2 PCl 5
Черный фосфор также получают из белого, Черный фосфор белого нагревая его до 200º С при высоком давлении (12000 МПа), или длительно нагревая его до 400º С в присутствии катализатора (Hg). Это наиболее устойчивая химическая модификация. Черный фосфор напоминает графит, жирен на ощупь, электро- и теплопроводен. Эта модификация имеет атомно-слоистую структуру. Фосфор легко окисляется : • 4 P + 5 O 2 → P 4 O 10 • 8 P + 10 NO 2 → 2 P 4 O 10 + 5 N 2 • 4 P + 10 CO 2 → P 4 O 10 + 10 CO • 2 P + 5 Cl 2 → 2 PCl 5
 При действии конц. азотной и серной кислот фосфор окисляется до PO 43 - (c другими кислотами он не взаимодействует): P + 5 HNO 3 → H 3 PO 4 + 5 NO 2 + H 2 O 4 P+8 H 2 SO 4 → 4 H 3 PO 4 +7 SO 2+ S +2 H 2 O Фосфор способен проявлять окислительные свойства. 4 P + 6 Mg → 2 Mg 3 P 2
При действии конц. азотной и серной кислот фосфор окисляется до PO 43 - (c другими кислотами он не взаимодействует): P + 5 HNO 3 → H 3 PO 4 + 5 NO 2 + H 2 O 4 P+8 H 2 SO 4 → 4 H 3 PO 4 +7 SO 2+ S +2 H 2 O Фосфор способен проявлять окислительные свойства. 4 P + 6 Mg → 2 Mg 3 P 2
 Фосфиды s-элементов имеют ионную кристаллическую решетку. Они легко разлагаются водой. Фосфиды d-элементов образованы ковалентной связью. Большинство из них нерастворимы в воде и кислотах, имеют металлический блеск и электропроводны: Ba 3 P 2 + 6 H 2 O → 2 PH 3 + 3 Ba(OH)2
Фосфиды s-элементов имеют ионную кристаллическую решетку. Они легко разлагаются водой. Фосфиды d-элементов образованы ковалентной связью. Большинство из них нерастворимы в воде и кислотах, имеют металлический блеск и электропроводны: Ba 3 P 2 + 6 H 2 O → 2 PH 3 + 3 Ba(OH)2
 Растворяясь в щелочах, фосфор подвергается диспропорционированию: 4 P + 3 KOH + 3 H 2 O → PH 3 + 3 KH 2 PO 2 PH 3 - бесцветный газ с чесночным запахом, малорастворим в воде, хорошо растворим в дисульфиде углерода CS 2, бензоле C 6 H 6, этиловом эфире (С 2 H 5)2 O.
Растворяясь в щелочах, фосфор подвергается диспропорционированию: 4 P + 3 KOH + 3 H 2 O → PH 3 + 3 KH 2 PO 2 PH 3 - бесцветный газ с чесночным запахом, малорастворим в воде, хорошо растворим в дисульфиде углерода CS 2, бензоле C 6 H 6, этиловом эфире (С 2 H 5)2 O.
 PH 3 взаимодействует только с сильными кислотами, образуя соли с ионом фосфония: PH 3 + HI → PH 4 I PH 3 + HCIO 4 → PH 4(CIO 4) Восстановительные свойства у фосфина проявляются сильнее, чем у аммиака: PH 3 + 6 Ag. NO 3 + 3 H 2 O → 6 Ag + H 3 PO 3 + 6 HNO 3 На воздухе PH 3 самовоспламеняется при 150ºС: PH 3 +2 O 2 → H 3 PO 4
PH 3 взаимодействует только с сильными кислотами, образуя соли с ионом фосфония: PH 3 + HI → PH 4 I PH 3 + HCIO 4 → PH 4(CIO 4) Восстановительные свойства у фосфина проявляются сильнее, чем у аммиака: PH 3 + 6 Ag. NO 3 + 3 H 2 O → 6 Ag + H 3 PO 3 + 6 HNO 3 На воздухе PH 3 самовоспламеняется при 150ºС: PH 3 +2 O 2 → H 3 PO 4
 Физические и химические свойства галидов и их гидролиз: PCl 3+3 H 2 O→H 3 PO 3+3 HCl PBr 5 + 4 H 2 O → H 3 PO 4 + 5 HBr PF 5 в неводных растворах взаимодействует с основными фторидами, проявляя кислотные свойства, а с жидким HF гексафторофосфорную кислоту, по силе равную хлорной HCl. O 4: F + PF 5 → KPF 6 HF + PF 5 → HPF 6
Физические и химические свойства галидов и их гидролиз: PCl 3+3 H 2 O→H 3 PO 3+3 HCl PBr 5 + 4 H 2 O → H 3 PO 4 + 5 HBr PF 5 в неводных растворах взаимодействует с основными фторидами, проявляя кислотные свойства, а с жидким HF гексафторофосфорную кислоту, по силе равную хлорной HCl. O 4: F + PF 5 → KPF 6 HF + PF 5 → HPF 6
 Свойства оксидов, кислородных кислот фосфора и их солей Оксид фосфора (III) P 4 О 6 и оксид фосфора (V) P 4 O 10, кислоты: фосфорноватистая (гипофосфористая) H 3 PO 2), фосфористая H 3 PO 3 и ортофосфорная H 3 PO 4. Оксиды - бесцветные кристаллические вещества. В фосфорноватистой (гипофосфористой) кислоте H 3 PO 2 фосфор проявляет степень окисления +1.
Свойства оксидов, кислородных кислот фосфора и их солей Оксид фосфора (III) P 4 О 6 и оксид фосфора (V) P 4 O 10, кислоты: фосфорноватистая (гипофосфористая) H 3 PO 2), фосфористая H 3 PO 3 и ортофосфорная H 3 PO 4. Оксиды - бесцветные кристаллические вещества. В фосфорноватистой (гипофосфористой) кислоте H 3 PO 2 фосфор проявляет степень окисления +1.
 Фосфорноватистая кислота – (К(H 3 PO 2) = 8 х 10ˉ²) ионизирует, образуя гипофосфит-ион: H 3 PO 2 + H 2 O → H 3 O+ + H 2 PO 2 Соли фосфорноватистой кислот (гипофосфиты) ХР в воде. Получают: 8 P+3 Ca(OH)2+6 H 2 O→ 3 Ca(H 2 PO 2)2+ 2 PH 3 Фосфорноватистую кислоту получают: Ba(H 2 PO 2)2 + H 2 SO 4 → 2 H 3 PO 2 + Ba. SO 4
Фосфорноватистая кислота – (К(H 3 PO 2) = 8 х 10ˉ²) ионизирует, образуя гипофосфит-ион: H 3 PO 2 + H 2 O → H 3 O+ + H 2 PO 2 Соли фосфорноватистой кислот (гипофосфиты) ХР в воде. Получают: 8 P+3 Ca(OH)2+6 H 2 O→ 3 Ca(H 2 PO 2)2+ 2 PH 3 Фосфорноватистую кислоту получают: Ba(H 2 PO 2)2 + H 2 SO 4 → 2 H 3 PO 2 + Ba. SO 4
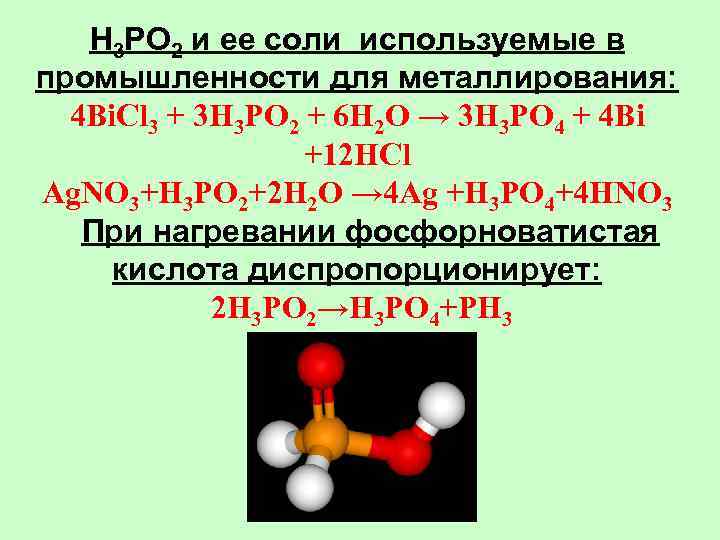 H 3 PO 2 и ее соли используемые в промышленности для металлирования: 4 Bi. Cl 3 + 3 H 3 PO 2 + 6 H 2 O → 3 H 3 PO 4 + 4 Bi +12 HCl Ag. NO 3+H 3 PO 2+2 H 2 O → 4 Ag +H 3 PO 4+4 HNO 3 При нагревании фосфорноватистая кислота диспропорционирует: 2 H 3 PO 2→H 3 PO 4+PH 3
H 3 PO 2 и ее соли используемые в промышленности для металлирования: 4 Bi. Cl 3 + 3 H 3 PO 2 + 6 H 2 O → 3 H 3 PO 4 + 4 Bi +12 HCl Ag. NO 3+H 3 PO 2+2 H 2 O → 4 Ag +H 3 PO 4+4 HNO 3 При нагревании фосфорноватистая кислота диспропорционирует: 2 H 3 PO 2→H 3 PO 4+PH 3
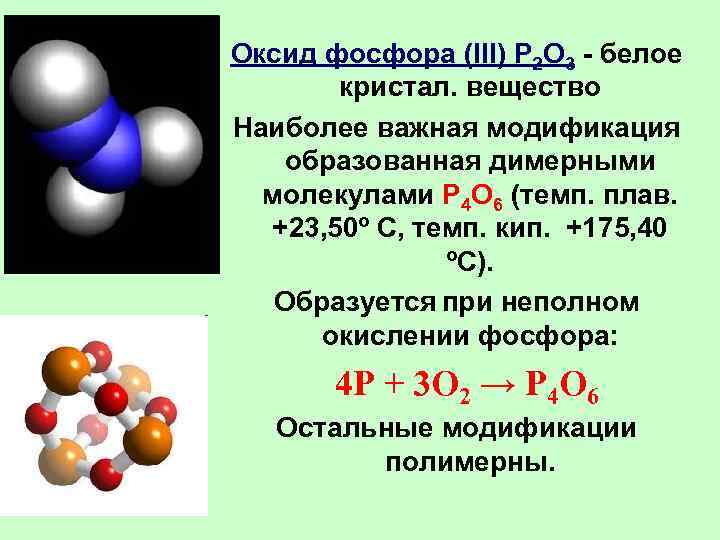 Оксид фосфора (III) P 2 O 3 - белое кристал. вещество Наиболее важная модификация образованная димерными молекулами P 4 O 6 (темп. плав. +23, 50º С, темп. кип. +175, 40 ºС). Образуется при неполном окислении фосфора: 4 P + 3 O 2 → P 4 O 6 Остальные модификации полимерны.
Оксид фосфора (III) P 2 O 3 - белое кристал. вещество Наиболее важная модификация образованная димерными молекулами P 4 O 6 (темп. плав. +23, 50º С, темп. кип. +175, 40 ºС). Образуется при неполном окислении фосфора: 4 P + 3 O 2 → P 4 O 6 Остальные модификации полимерны.
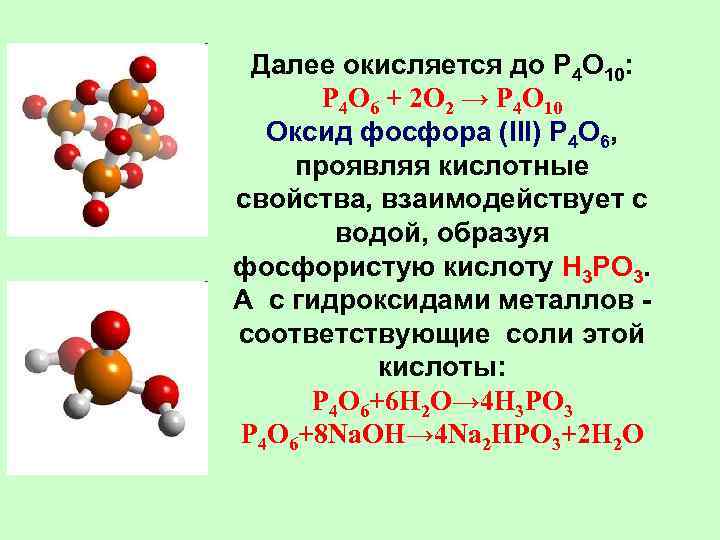 Далее окисляется до P 4 O 10: P 4 O 6 + 2 O 2 → P 4 O 10 Оксид фосфора (III) P 4 O 6, проявляя кислотные свойства, взаимодействует с водой, образуя фосфористую кислоту H 3 PO 3. А с гидроксидами металлов - соответствующие соли этой кислоты: P 4 O 6+6 H 2 O→ 4 H 3 PO 3 P 4 O 6+8 Na. OH→ 4 Na 2 HPO 3+2 H 2 O
Далее окисляется до P 4 O 10: P 4 O 6 + 2 O 2 → P 4 O 10 Оксид фосфора (III) P 4 O 6, проявляя кислотные свойства, взаимодействует с водой, образуя фосфористую кислоту H 3 PO 3. А с гидроксидами металлов - соответствующие соли этой кислоты: P 4 O 6+6 H 2 O→ 4 H 3 PO 3 P 4 O 6+8 Na. OH→ 4 Na 2 HPO 3+2 H 2 O
 Фосфористая кислота H 3 PO 3 – бесц. крис. вещество (тем. плав. +74º С), ХР в воде является двухосновной кислотой: H 2(HPO 3) + H 2 O → H 3 O+ + H(HPO 3)-, (HPO 3)ˉ + H 2 O → H 3 O+ + (HPO 3)²ˉ, H 3 PO 3 обладает окислительновосстановительными свойствами: Cl 2 + H 3 PO 3 + H 2 O → H 3 PO 4 + Hg + 2 HCl H 2 SO 4 + H 3 PO 3 → H 3 PO 4 + SO 2 + H 2 O 3 Zn + H 3 PO 3 + 3 H 2 SO 4 → 3 Zn. SO 4+PH 3+3 H 2 O
Фосфористая кислота H 3 PO 3 – бесц. крис. вещество (тем. плав. +74º С), ХР в воде является двухосновной кислотой: H 2(HPO 3) + H 2 O → H 3 O+ + H(HPO 3)-, (HPO 3)ˉ + H 2 O → H 3 O+ + (HPO 3)²ˉ, H 3 PO 3 обладает окислительновосстановительными свойствами: Cl 2 + H 3 PO 3 + H 2 O → H 3 PO 4 + Hg + 2 HCl H 2 SO 4 + H 3 PO 3 → H 3 PO 4 + SO 2 + H 2 O 3 Zn + H 3 PO 3 + 3 H 2 SO 4 → 3 Zn. SO 4+PH 3+3 H 2 O
 Фосфористая кислота диспропорционирует: 4 H 3 PO 3 → 3 H 3 PO 4 + PH 3 Оксид фосфора (V) P 2 O 5 - белый кристаллический порошок (тем. Плавл. +23, 50º С), при нагревании возгоняется, гигроскопичен. Его молекула в парообразном состоянии имеет состав P 4 O 10 энергично взаимодействует : 4 HNO 3 + P 4 O 10 → 2 N 2 O 5 + 4 HPO 3 4 HCl. O 4 + P 4 O 10 → 2 Cl 2 O 7 + 4 HPO 3 Поэтому P 2 O 5 используют в качестве дегидратирующего средства в хим. анализе и синтезе.
Фосфористая кислота диспропорционирует: 4 H 3 PO 3 → 3 H 3 PO 4 + PH 3 Оксид фосфора (V) P 2 O 5 - белый кристаллический порошок (тем. Плавл. +23, 50º С), при нагревании возгоняется, гигроскопичен. Его молекула в парообразном состоянии имеет состав P 4 O 10 энергично взаимодействует : 4 HNO 3 + P 4 O 10 → 2 N 2 O 5 + 4 HPO 3 4 HCl. O 4 + P 4 O 10 → 2 Cl 2 O 7 + 4 HPO 3 Поэтому P 2 O 5 используют в качестве дегидратирующего средства в хим. анализе и синтезе.
 Ортофосфорная (фосфорная) кислота H 3 PO 4 - белое тв. гигроскопичное вещество (тем. плав. +42º С). Экстракционным способом получают, обрабатывая измельченный фторапатит Ca 3(PO 4)2. Ca. F 2 серной кислотой: Ca 3(PO 4)2 + 3 H 2 SO 4 → 2 H 3 PO 4 + 3 Ca. SO 4 В лаборатории H 3 PO 4 получат окислением фосфора 30% азотной кислотой: 3 P + 5 HNO 3 +2 H 2 O → 3 H 3 PO 4 + 5 NO
Ортофосфорная (фосфорная) кислота H 3 PO 4 - белое тв. гигроскопичное вещество (тем. плав. +42º С). Экстракционным способом получают, обрабатывая измельченный фторапатит Ca 3(PO 4)2. Ca. F 2 серной кислотой: Ca 3(PO 4)2 + 3 H 2 SO 4 → 2 H 3 PO 4 + 3 Ca. SO 4 В лаборатории H 3 PO 4 получат окислением фосфора 30% азотной кислотой: 3 P + 5 HNO 3 +2 H 2 O → 3 H 3 PO 4 + 5 NO
 H 3 PO 4 - устойчивое соединение, не проявляет окислительных свойств , трехосновная кислота средней силы. Ступенчато диссоциирует: H 3 PO 4 + H 2 O → H 3 O+ + H 2 PO 4 -; K(H 3 PO 4)1 = 7, 2 х10ˉ³ H 2 PO 4ˉ + H 2 O → H 3 O+ + HPO 4²ˉ, K(H 3 PO 4)2 = 6, 2 х 10 -8 HPO 4²ˉ + H 2 O→ H 3 O+ + PO 4³ˉ, K(H 3 PO 4)3 = 4, 6 х 10ˉ¹³
H 3 PO 4 - устойчивое соединение, не проявляет окислительных свойств , трехосновная кислота средней силы. Ступенчато диссоциирует: H 3 PO 4 + H 2 O → H 3 O+ + H 2 PO 4 -; K(H 3 PO 4)1 = 7, 2 х10ˉ³ H 2 PO 4ˉ + H 2 O → H 3 O+ + HPO 4²ˉ, K(H 3 PO 4)2 = 6, 2 х 10 -8 HPO 4²ˉ + H 2 O→ H 3 O+ + PO 4³ˉ, K(H 3 PO 4)3 = 4, 6 х 10ˉ¹³
 Фосфорная кислота образует три типа солей: однозамещенные - дигидрофосфаты Na. H 2 PO 4 двухзамещенные – гидрофосфаты Na 2 HPO 4 трехзамещенные - фосфаты Na 3 PO 4 Хорошо растворимы в воде лишь фосфаты щелочных металлов и аммония
Фосфорная кислота образует три типа солей: однозамещенные - дигидрофосфаты Na. H 2 PO 4 двухзамещенные – гидрофосфаты Na 2 HPO 4 трехзамещенные - фосфаты Na 3 PO 4 Хорошо растворимы в воде лишь фосфаты щелочных металлов и аммония
 Получение и свойства мета- и полифосфорных кислот Анионы фосфорной кислоты могут соединятся между собой через кислород, образуя полимерные соединения, имеющие циклическое строение (метафосфорные кислоты) или линейное строение (полифосфорные кислоты). Метафосфорные кислоты имеют общую формулу (HPO 3)n, где n может принимать значения 3, 4, 6. Эти кислоты представляют собой стекловидные массы, хорошо растворимые в воде. Они относятся к сильным кислотам. P 4 O 10 + 2 H 2 O → (HPO 3)4
Получение и свойства мета- и полифосфорных кислот Анионы фосфорной кислоты могут соединятся между собой через кислород, образуя полимерные соединения, имеющие циклическое строение (метафосфорные кислоты) или линейное строение (полифосфорные кислоты). Метафосфорные кислоты имеют общую формулу (HPO 3)n, где n может принимать значения 3, 4, 6. Эти кислоты представляют собой стекловидные массы, хорошо растворимые в воде. Они относятся к сильным кислотам. P 4 O 10 + 2 H 2 O → (HPO 3)4
 Из полифосфорных кислот наибольшее значение имеет дифосфорная кислота H 4 P 2 O 7. Его можно получить дегидратацией ортофосфорной кислоты: 2 H 3 PO 4 → H 4 P 2 O 7 + H 2 O H 4 P 2 O 7 в растворе постепенно снова превращается в H 3 PO 4. Дифосфорная кислота хорошо растворима в воде и является более сильной кислотой, чем ортофосфорная: H 4 P 2 O 7 + H 2 O → H 3 P 2 O 7ˉ + H 3 O+; K 1 = 1, 4 х 10ˉ¹ H 3 P 2 O 7ˉ + H 2 O →H 2 P 2 O 7²ˉ + H 3 O+; К 2 = 3 х10ˉ²
Из полифосфорных кислот наибольшее значение имеет дифосфорная кислота H 4 P 2 O 7. Его можно получить дегидратацией ортофосфорной кислоты: 2 H 3 PO 4 → H 4 P 2 O 7 + H 2 O H 4 P 2 O 7 в растворе постепенно снова превращается в H 3 PO 4. Дифосфорная кислота хорошо растворима в воде и является более сильной кислотой, чем ортофосфорная: H 4 P 2 O 7 + H 2 O → H 3 P 2 O 7ˉ + H 3 O+; K 1 = 1, 4 х 10ˉ¹ H 3 P 2 O 7ˉ + H 2 O →H 2 P 2 O 7²ˉ + H 3 O+; К 2 = 3 х10ˉ²
 Элементы подгруппы мышьяка. Общие свойства мышьяка, сурьмы и висмута В соединениях элементы подгруппы мышьяка проявляют степени окисления -3, +3 и +5. Для Sb и As наиболее характерна степень окисления +5, для висмута +3. Мышьяк (мышиный яд) от греческого arsen, что значит мужественный, сильный.
Элементы подгруппы мышьяка. Общие свойства мышьяка, сурьмы и висмута В соединениях элементы подгруппы мышьяка проявляют степени окисления -3, +3 и +5. Для Sb и As наиболее характерна степень окисления +5, для висмута +3. Мышьяк (мышиный яд) от греческого arsen, что значит мужественный, сильный.
 Сурьма и висмут были известны и применялись еще в древние времена. Римляне умели получать металлическую сурьму. Висмут долгое время путали со свинцом и оловом. Впервые выделил металлический висмут Хелло в 1737 году. А Потт в 1739 году опубликовал результаты исследований о взаимодействии некоторых реактивов с металлическим висмутом.
Сурьма и висмут были известны и применялись еще в древние времена. Римляне умели получать металлическую сурьму. Висмут долгое время путали со свинцом и оловом. Впервые выделил металлический висмут Хелло в 1737 году. А Потт в 1739 году опубликовал результаты исследований о взаимодействии некоторых реактивов с металлическим висмутом.
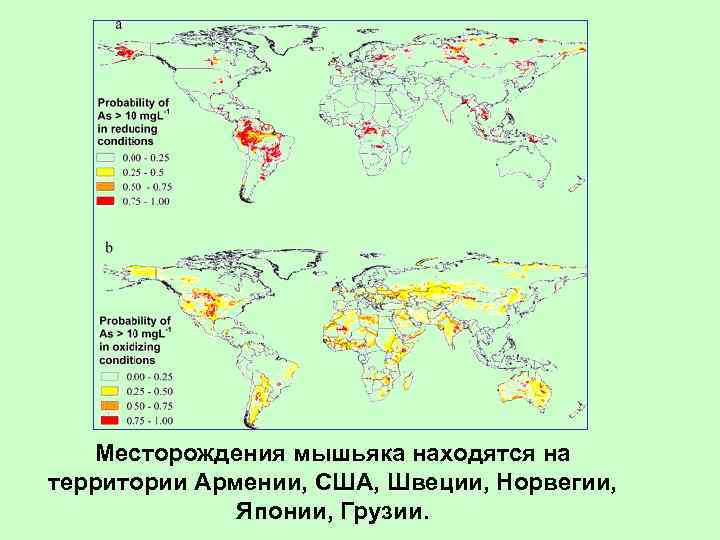 Месторождения мышьяка находятся на территории Армении, США, Швеции, Норвегии, Японии, Грузии.
Месторождения мышьяка находятся на территории Армении, США, Швеции, Норвегии, Японии, Грузии.
 Получение Мышьяка и его хим. свойства прибор для отгонки и поглощения Мышьяка Альберт Великий, живший в XIII в.
Получение Мышьяка и его хим. свойства прибор для отгонки и поглощения Мышьяка Альберт Великий, живший в XIII в.
 Метод Лавуазье Именно А. Л. Лавуазье присвоил элементу имя Арсеникум
Метод Лавуазье Именно А. Л. Лавуазье присвоил элементу имя Арсеникум
 As, Sb u Bi входят в состав таких минералов, как реальгар As 4 S 4, аурипигмент As 2 S 3, мышьяковый цвет As 2 O 3, сурьмяная охра (сенармонтин) Sb 2 O 3, стибнит Sb 2 O 3. Sb 2 O 5. 2 H 2 O, кернезид 2 Sb 2 S 3. Sb 2 O 3, висмутин (висмутовый блеск) Bi 2 S 3, бисмит (висмутовая охра) Bi 2 O 3.
As, Sb u Bi входят в состав таких минералов, как реальгар As 4 S 4, аурипигмент As 2 S 3, мышьяковый цвет As 2 O 3, сурьмяная охра (сенармонтин) Sb 2 O 3, стибнит Sb 2 O 3. Sb 2 O 5. 2 H 2 O, кернезид 2 Sb 2 S 3. Sb 2 O 3, висмутин (висмутовый блеск) Bi 2 S 3, бисмит (висмутовая охра) Bi 2 O 3.
 2 Fe. As + 3 O 2 → As 2 O 3 + Fe 2 O 3 As 2 O 3 + 3 C → 2 As + 3 CO Sb 2 S 3 + 9 O 2 → 2 Sb 2 O 3 + 6 SO 2 Sb 2 O 3 + 3 C → 2 Sb + 3 CO 2 Bi 2 S 3 + 9 O 2 → 2 Bi 2 O 3 +6 SO 2 Известно несколько аллотропических форм мышьяка, висмута и сурьмы. Устойчивыми при обычных условиях являются металлическая модификация (серого цвета). Неметаллическая (желтая) модификация менее устойчива. При слабом нагревании она превращается в металлическую модификацию.
2 Fe. As + 3 O 2 → As 2 O 3 + Fe 2 O 3 As 2 O 3 + 3 C → 2 As + 3 CO Sb 2 S 3 + 9 O 2 → 2 Sb 2 O 3 + 6 SO 2 Sb 2 O 3 + 3 C → 2 Sb + 3 CO 2 Bi 2 S 3 + 9 O 2 → 2 Bi 2 O 3 +6 SO 2 Известно несколько аллотропических форм мышьяка, висмута и сурьмы. Устойчивыми при обычных условиях являются металлическая модификация (серого цвета). Неметаллическая (желтая) модификация менее устойчива. При слабом нагревании она превращается в металлическую модификацию.
 При нагревании на воздухе мышьяк, сурьма и висмут становятся матовыми, так как покрываются тонкой пленкой оксидов: 4 As + 3 O 2 → 2 As 2 O 3 4 Sb + 3 O 2 → 2 Sb 2 O 3 4 Bi + 3 O 2 → 2 Bi 2 O 3
При нагревании на воздухе мышьяк, сурьма и висмут становятся матовыми, так как покрываются тонкой пленкой оксидов: 4 As + 3 O 2 → 2 As 2 O 3 4 Sb + 3 O 2 → 2 Sb 2 O 3 4 Bi + 3 O 2 → 2 Bi 2 O 3
 As и Sb вступают в реакцию с концентрированной кислотой, образуя мышьяковую кислоту и сурьмяную кислоту. А висмут в конц. азотной кислоте пассивируется, а в разб. HNO 3 проявляет металлические свойства: 3 As + 5 HNO 3(к) + 2 H 2 O → 3 H 3 As. O 4 + 5 NO 3 Sb + 5 HNO 3(к) → 3 HSb. O 3 +5 NO+H 2 O Bi + 4 HNO 3(р) → Bi(NO 3)3 + NO+ 2 H 2 O
As и Sb вступают в реакцию с концентрированной кислотой, образуя мышьяковую кислоту и сурьмяную кислоту. А висмут в конц. азотной кислоте пассивируется, а в разб. HNO 3 проявляет металлические свойства: 3 As + 5 HNO 3(к) + 2 H 2 O → 3 H 3 As. O 4 + 5 NO 3 Sb + 5 HNO 3(к) → 3 HSb. O 3 +5 NO+H 2 O Bi + 4 HNO 3(р) → Bi(NO 3)3 + NO+ 2 H 2 O
 С разбавленной хлороводородной кислотой: 4 As + 12 HCl + 3 O 2 → 4 As. Cl 3 + 6 H 2 O
С разбавленной хлороводородной кислотой: 4 As + 12 HCl + 3 O 2 → 4 As. Cl 3 + 6 H 2 O
 Сурьма, как и висмут взаимодействуют только с конц. кислотами (кроме HNO 3), а Bi растворяется в царской водке: 2 Bi+6 H 2 SO 4(к) →Bi 2(SO 4)3 + 3 SO 2 +6 H 2 O Bi + 3 HCl + HNO 3 → Bi. Cl 3 + NO+ 2 H 2 O Конц. серная кислота окисляет As и Sb до степени окисления +3: 2 As + 3 H 2 SO 4(к) → 2 H 3 As. O 4 + 3 SO 2 2 Sb + 3 H 2 SO 4(к) → 2 H 3 Sb. O 3 + 3 SO 2
Сурьма, как и висмут взаимодействуют только с конц. кислотами (кроме HNO 3), а Bi растворяется в царской водке: 2 Bi+6 H 2 SO 4(к) →Bi 2(SO 4)3 + 3 SO 2 +6 H 2 O Bi + 3 HCl + HNO 3 → Bi. Cl 3 + NO+ 2 H 2 O Конц. серная кислота окисляет As и Sb до степени окисления +3: 2 As + 3 H 2 SO 4(к) → 2 H 3 As. O 4 + 3 SO 2 2 Sb + 3 H 2 SO 4(к) → 2 H 3 Sb. O 3 + 3 SO 2
 Свойства соединений с отрицательными степенями окисления Мышьяк, сурьма и висмут образуют соединения с водородом ЭH 3 (гидриды) и с s-элементами I и II групп Ме 3 Э или Ме 3 Э 2 (арсениды, стибиды или антимониды, висмутиды), в которых проявляют степень окисления -3. Гидриды мышьяка As. H 3 (арсин), сурьмы Sb. H 3 (стибин) и висмута Bi. H 3 (висмутин) представляют собой очень токсичные, бесцветные, с неприятным запахом газы.
Свойства соединений с отрицательными степенями окисления Мышьяк, сурьма и висмут образуют соединения с водородом ЭH 3 (гидриды) и с s-элементами I и II групп Ме 3 Э или Ме 3 Э 2 (арсениды, стибиды или антимониды, висмутиды), в которых проявляют степень окисления -3. Гидриды мышьяка As. H 3 (арсин), сурьмы Sb. H 3 (стибин) и висмута Bi. H 3 (висмутин) представляют собой очень токсичные, бесцветные, с неприятным запахом газы.
 Эти соединения неустойчивы, разлагаются при обычной температуре (при нагревании быстрее) на водород и металлические As, Sb u Bi, которые осаждаются в виде зеркала на стенках сосуда, напимер: 2 Sb. H 3→ 2 Sb+3 H 2 Гидриды являются сильными восстановителями. При пропускании арсина через раствор Ag. NO 3 образуется металлическое серебро: As. H 3+6 Ag. NO 3+3 H 2 O→H 3 As. O 3+6 Ag+6 HNO 3
Эти соединения неустойчивы, разлагаются при обычной температуре (при нагревании быстрее) на водород и металлические As, Sb u Bi, которые осаждаются в виде зеркала на стенках сосуда, напимер: 2 Sb. H 3→ 2 Sb+3 H 2 Гидриды являются сильными восстановителями. При пропускании арсина через раствор Ag. NO 3 образуется металлическое серебро: As. H 3+6 Ag. NO 3+3 H 2 O→H 3 As. O 3+6 Ag+6 HNO 3
 Гидриды элементов подгруппы мышьяка восстанавливают сероводород и оксид азота (II): 2 Sb. H 3 + 3 H 2 S → Sb 2 S 3 + 6 H 2 5 As. H 3 + 3 NO → 5 As + 3 NH 3 + 3 H 2 O Арсин и стибин получают, воздействуя кислотой и цинком на их соединения : 2 Sb. Cl 3+6 Zn+3 H 2 SO 4→ 2 Sb. H 3+3 Zn. SO 4+3 Zn. Cl 2 As 2 O 3 + 6 Zn + 12 HCl → 2 As. H 3 + 6 Zn. Cl 2 + 3 H 2 O А висмутин растворением сплавов Bi c Mg и Zn в разбавленной хлороводородной кислоте: Mg 3 Bi 2 + 6 HCl → 2 Bi. H 3 + 3 Mg. Cl 2
Гидриды элементов подгруппы мышьяка восстанавливают сероводород и оксид азота (II): 2 Sb. H 3 + 3 H 2 S → Sb 2 S 3 + 6 H 2 5 As. H 3 + 3 NO → 5 As + 3 NH 3 + 3 H 2 O Арсин и стибин получают, воздействуя кислотой и цинком на их соединения : 2 Sb. Cl 3+6 Zn+3 H 2 SO 4→ 2 Sb. H 3+3 Zn. SO 4+3 Zn. Cl 2 As 2 O 3 + 6 Zn + 12 HCl → 2 As. H 3 + 6 Zn. Cl 2 + 3 H 2 O А висмутин растворением сплавов Bi c Mg и Zn в разбавленной хлороводородной кислоте: Mg 3 Bi 2 + 6 HCl → 2 Bi. H 3 + 3 Mg. Cl 2
 Арсениды, стибиды (антимониды) и висмутиды образуются при взаимодействии с элементами IА и IIА групп, легко разлагаются кислотами, образуя соответствующие гидриды: 3 Mg + 2 As → Mg 3 As 2 Ca 3 Э 2 + 6 HCl → 3 Ca. Cl 2 + 2 ЭH 3
Арсениды, стибиды (антимониды) и висмутиды образуются при взаимодействии с элементами IА и IIА групп, легко разлагаются кислотами, образуя соответствующие гидриды: 3 Mg + 2 As → Mg 3 As 2 Ca 3 Э 2 + 6 HCl → 3 Ca. Cl 2 + 2 ЭH 3
 Свойства соединений с положительными степенями окисления Мышьяк и его аналоги в кислородных соединениях, галогенидах и сульфидах проявляют степень окисления +3 и +5. Устойчивость степени окисления +3 в соединениях элементов VА-группы повышается с увеличением порядкового номера элемента, а основные свойства этих соединений усиливаются. Напротив, с увеличением заряда ядра в ряду As-Sb - Bi устойчивость соединений с высшей степенью окисления +5 уменьшается, при этом усиливаются их кислотные свойства.
Свойства соединений с положительными степенями окисления Мышьяк и его аналоги в кислородных соединениях, галогенидах и сульфидах проявляют степень окисления +3 и +5. Устойчивость степени окисления +3 в соединениях элементов VА-группы повышается с увеличением порядкового номера элемента, а основные свойства этих соединений усиливаются. Напротив, с увеличением заряда ядра в ряду As-Sb - Bi устойчивость соединений с высшей степенью окисления +5 уменьшается, при этом усиливаются их кислотные свойства.
 Sb 2 O 3 образуется в результате окисления сурьмы разбавленной азотной кислотой, а Bi 2 O 3 - термическим разложением Bi(NO 3)3 или прокаливанием Bi 2 S 3: 2 Sb + 6 HNO 3 → Sb 2 O 3 + 6 NO 2 + 3 H 2 O 4 Bi(NO 3)3 → 2 Bi 2 O 3 + 12 NO 2+ 3 O 2 2 Bi 2 S 3 +9 O 2 → 2 Bi 2 O 3 + 6 SO 2
Sb 2 O 3 образуется в результате окисления сурьмы разбавленной азотной кислотой, а Bi 2 O 3 - термическим разложением Bi(NO 3)3 или прокаливанием Bi 2 S 3: 2 Sb + 6 HNO 3 → Sb 2 O 3 + 6 NO 2 + 3 H 2 O 4 Bi(NO 3)3 → 2 Bi 2 O 3 + 12 NO 2+ 3 O 2 2 Bi 2 S 3 +9 O 2 → 2 Bi 2 O 3 + 6 SO 2
 As 2 O 3 (белый мышьяк) - оксид, обладающий преимущественно кислотными свойствами. Оксид мышьяка (III) взаимодействует со щелочами и с кислотами. В отличие от P 2 O 3 он вступает в реакцию даже с галогеноводородными кислотами: As 2 O 3 + 2 KOH + 3 H 2 O → 2 K[As(OH)4] As 2 O 3 + 8 HCl → 2 HAs. Cl 4 + 3 H 2 O Белый мышьяк, растворяясь в воде, образует гидроксид мышьяка (III) As(OH)3 или ортомышьяковистую (мышьяковистую) кислоту H 3 As. O 3: As 2 O 3 + 3 H 2 O → 2 H 3 As. O 3
As 2 O 3 (белый мышьяк) - оксид, обладающий преимущественно кислотными свойствами. Оксид мышьяка (III) взаимодействует со щелочами и с кислотами. В отличие от P 2 O 3 он вступает в реакцию даже с галогеноводородными кислотами: As 2 O 3 + 2 KOH + 3 H 2 O → 2 K[As(OH)4] As 2 O 3 + 8 HCl → 2 HAs. Cl 4 + 3 H 2 O Белый мышьяк, растворяясь в воде, образует гидроксид мышьяка (III) As(OH)3 или ортомышьяковистую (мышьяковистую) кислоту H 3 As. O 3: As 2 O 3 + 3 H 2 O → 2 H 3 As. O 3
 Мышьяковистая кислота H 3 As. O 3 обладает амфотерным характером. Это слабая кислота (К(H 3 As. O 3) = 6 х10ˉ¹. Соли этой кислоты - арсениты - получают сплавлением: As 2 O 3 + 6 Na. OH → 2 Na 3 As. O 3 + 3 H 2 O
Мышьяковистая кислота H 3 As. O 3 обладает амфотерным характером. Это слабая кислота (К(H 3 As. O 3) = 6 х10ˉ¹. Соли этой кислоты - арсениты - получают сплавлением: As 2 O 3 + 6 Na. OH → 2 Na 3 As. O 3 + 3 H 2 O
 Оксид сурьмы (III) Sb 2 O 3 - амфотерный оксид с преобладанием основных свойств. Он легко растворяется в кислотах с образованием соответствующих солей: Sb 2 O 3 + 6 HCl (к) → 2 Sb. Cl 3 + 3 H 2 O Sb 2 O 3 + 6 HNO 3(p) → 2 Sb(NO 3)3 + 3 H 2 O
Оксид сурьмы (III) Sb 2 O 3 - амфотерный оксид с преобладанием основных свойств. Он легко растворяется в кислотах с образованием соответствующих солей: Sb 2 O 3 + 6 HCl (к) → 2 Sb. Cl 3 + 3 H 2 O Sb 2 O 3 + 6 HNO 3(p) → 2 Sb(NO 3)3 + 3 H 2 O
 Sb 2 O 3 трудно растворяется в воде. В результате его взаимодействия с водой в образуется гидроксид сурьмы (III) Sb(OH)3 или сурьмянистая кислота H 3 Sb. O 3: Sb 2 O 3 + 3 H 2 O → 2 Sb(OH)3
Sb 2 O 3 трудно растворяется в воде. В результате его взаимодействия с водой в образуется гидроксид сурьмы (III) Sb(OH)3 или сурьмянистая кислота H 3 Sb. O 3: Sb 2 O 3 + 3 H 2 O → 2 Sb(OH)3
 Sb 2 O 3 и As 2 O 3 вступают в реакцию с растворами щелочей, образуя тетрагидроксоантимониты и тетрагидроксоарсениты: Э 2 O 3 + 2 Na. OH + 3 H 2 O → 2 Na[Э(OH)4] Оксид висмута (III) Bi 2 O 3 в воде практически не растворяется, со щелочами в реакцию не вступает, но взаимодействует с кислотами, образуя соли: Bi 2 O 3 + 6 HNO 3 → 2 Bi(NO 3)3 + 3 H 2 O
Sb 2 O 3 и As 2 O 3 вступают в реакцию с растворами щелочей, образуя тетрагидроксоантимониты и тетрагидроксоарсениты: Э 2 O 3 + 2 Na. OH + 3 H 2 O → 2 Na[Э(OH)4] Оксид висмута (III) Bi 2 O 3 в воде практически не растворяется, со щелочами в реакцию не вступает, но взаимодействует с кислотами, образуя соли: Bi 2 O 3 + 6 HNO 3 → 2 Bi(NO 3)3 + 3 H 2 O
 Гидроксид висмута (III) Bi(OH)3, как и Sb(OH)3, практически не растворяется в воде. Получают их, воздействуя растворами щелочей на соли Sb(III) и Bi(III): Sb. Cl 3 + 3 Na. OH → Sb(OH)3+ 3 Na. Cl Bi(NO 3)3 + 3 Na. OH → Bi(OH)3 + 3 Na. NO 3 Соединения мышьяка (III) проявляют сильные восстановительные свойства. K 3 As. O 3 + I 2 + 2 KOH → K 3 As. O 4 + 2 KI + H 2 O
Гидроксид висмута (III) Bi(OH)3, как и Sb(OH)3, практически не растворяется в воде. Получают их, воздействуя растворами щелочей на соли Sb(III) и Bi(III): Sb. Cl 3 + 3 Na. OH → Sb(OH)3+ 3 Na. Cl Bi(NO 3)3 + 3 Na. OH → Bi(OH)3 + 3 Na. NO 3 Соединения мышьяка (III) проявляют сильные восстановительные свойства. K 3 As. O 3 + I 2 + 2 KOH → K 3 As. O 4 + 2 KI + H 2 O
 В кислой среде, напротив, мышьяковая кислота легко взаимодействует с восстановителями, переходя в мышьяковистую кислоту или в арсениты: K 3 As. O 4+2 KI+H 2 SO 4→K 3 As. O 3 +I 2+K 2 SO 4+ H 2 O
В кислой среде, напротив, мышьяковая кислота легко взаимодействует с восстановителями, переходя в мышьяковистую кислоту или в арсениты: K 3 As. O 4+2 KI+H 2 SO 4→K 3 As. O 3 +I 2+K 2 SO 4+ H 2 O
 Производные сурьмы (III) обладают менее выраженными восстановительными свойствами, чем аналогичные соединения мышьяка. А восстановление соединений Bi(III) до Bi(V) возможно лишь при воздействии энергичным окислителем в сильно щелочной среде: Bi. Cl 3 + Cl 2 + 6 KOH → KBi. O 3 + 5 KCl + 3 H 2 O
Производные сурьмы (III) обладают менее выраженными восстановительными свойствами, чем аналогичные соединения мышьяка. А восстановление соединений Bi(III) до Bi(V) возможно лишь при воздействии энергичным окислителем в сильно щелочной среде: Bi. Cl 3 + Cl 2 + 6 KOH → KBi. O 3 + 5 KCl + 3 H 2 O
 Оксид мышьяка (V) по структкре и свойствам подобен P 2 O 5. При растворении в воде он образует слабую мышьяковую кислоту H 3 As. O 4 (К(H 3 As. O 4) = 6 х10ˉ4) : As 2 O 5 + 3 H 2 O → 2 H 3 As. O 4 Оксид сурьмы (V) Sb 2 O 5 - твердое вещество желтого цвета, трудно растворимое в воде. Но в присутствии влаги Sb 2 O 5 образует гексагидроксосурьмяную кислоту, так как у него сильно выражен кислотный характер: 66). Sb 2 O 5 + 7 H 2 O → 2 H[Sb(OH)6] Эта кислота существует в водных растворах. При попытке ее выделения образуется осадок неопределенного состава Sb 2 O 5 х n. H 2 O. Sb 2 O 5 растворяется в щелочах с образованием гексагидроксостибатов и в концентрированной хлроводородной кислоте: 67). Sb 2 O 5 + 2 KOH + 5 H 2 O → 2 K[Sb(OH)6] 68). Sb 2 O 5 + 12 HCl → 2 H[Sb. Cl 6] + 5 H 2 O
Оксид мышьяка (V) по структкре и свойствам подобен P 2 O 5. При растворении в воде он образует слабую мышьяковую кислоту H 3 As. O 4 (К(H 3 As. O 4) = 6 х10ˉ4) : As 2 O 5 + 3 H 2 O → 2 H 3 As. O 4 Оксид сурьмы (V) Sb 2 O 5 - твердое вещество желтого цвета, трудно растворимое в воде. Но в присутствии влаги Sb 2 O 5 образует гексагидроксосурьмяную кислоту, так как у него сильно выражен кислотный характер: 66). Sb 2 O 5 + 7 H 2 O → 2 H[Sb(OH)6] Эта кислота существует в водных растворах. При попытке ее выделения образуется осадок неопределенного состава Sb 2 O 5 х n. H 2 O. Sb 2 O 5 растворяется в щелочах с образованием гексагидроксостибатов и в концентрированной хлроводородной кислоте: 67). Sb 2 O 5 + 2 KOH + 5 H 2 O → 2 K[Sb(OH)6] 68). Sb 2 O 5 + 12 HCl → 2 H[Sb. Cl 6] + 5 H 2 O
 As 3 O 5 и Sb 2 O 5 при сплавлении со щелочами и с оксидами металлов образуют оксоарсенаты (V) и оксостибаты (V) (например, KAs. O 3, Al. Sb. O 4 и Mg 2 As 2 O 7), большинство из которых являются полимерными соединениями. Соединения Bi(V) - малорастворимы в воде. Они являются сильными окислителями и в кислой, и в щелочной среде. Производные As(V) и Sb(V) проявляют окислительные свойства лишь в кислой среде.
As 3 O 5 и Sb 2 O 5 при сплавлении со щелочами и с оксидами металлов образуют оксоарсенаты (V) и оксостибаты (V) (например, KAs. O 3, Al. Sb. O 4 и Mg 2 As 2 O 7), большинство из которых являются полимерными соединениями. Соединения Bi(V) - малорастворимы в воде. Они являются сильными окислителями и в кислой, и в щелочной среде. Производные As(V) и Sb(V) проявляют окислительные свойства лишь в кислой среде.
 Окислительная активность в ряду As(V) - Sb(V) - Bi(V) усиливается. Соединения Bi(V) - висмутаты способны окислять хлороводородную кислоту до хлора, мышьяковистую кислоту - до мышьяковой, соли двухвалентного марганца - до перманганата: 10 KBi. O 3 + 4 Mn. SO 4 + 14 H 2 SO 4 → 5 Bi 2(SO 4)3 + 4 KMn. O 4 + 3 K 2 SO 4 + 14 H 2 O
Окислительная активность в ряду As(V) - Sb(V) - Bi(V) усиливается. Соединения Bi(V) - висмутаты способны окислять хлороводородную кислоту до хлора, мышьяковистую кислоту - до мышьяковой, соли двухвалентного марганца - до перманганата: 10 KBi. O 3 + 4 Mn. SO 4 + 14 H 2 SO 4 → 5 Bi 2(SO 4)3 + 4 KMn. O 4 + 3 K 2 SO 4 + 14 H 2 O
 Получают соединения Bi(V), воздействуя на Bi(OH)3 такими сильными окислителями, как O 3, KMn. O 4, KCl. O 3, Na 2 O 2 и т. д. в концентрированных растворах щелочей. Оксид висмута (V) Bi 2 O 5 - темно-коричневый порошок, плавящийся при температуре 1500º С. Он трудно растворяется в воде, но легко – в кислотах и щелочах. Bi 2 O 5 при нагревании разлагается до Bi 2 O 3 и восcтанавливается водородом и оксидом углерода (IV), образуя промежуточные продукты: Bi. O 2, Bi 2 O 3, Bi. O, а затем металлический висмут. Висмутовые кислоты не выделены в свободном состоянии.
Получают соединения Bi(V), воздействуя на Bi(OH)3 такими сильными окислителями, как O 3, KMn. O 4, KCl. O 3, Na 2 O 2 и т. д. в концентрированных растворах щелочей. Оксид висмута (V) Bi 2 O 5 - темно-коричневый порошок, плавящийся при температуре 1500º С. Он трудно растворяется в воде, но легко – в кислотах и щелочах. Bi 2 O 5 при нагревании разлагается до Bi 2 O 3 и восcтанавливается водородом и оксидом углерода (IV), образуя промежуточные продукты: Bi. O 2, Bi 2 O 3, Bi. O, а затем металлический висмут. Висмутовые кислоты не выделены в свободном состоянии.
 Висмутаты можно получить воздействием сильного окислителя (например, хлором, перекисью натрия) на суспензию Bi(OH)3 в кипящем концентрированном растворе щелочи: Bi(OH)3 + 3 Na. OH + Cl 2→Na. Bi. O 3 +2 Na. Cl + 3 H 2 O
Висмутаты можно получить воздействием сильного окислителя (например, хлором, перекисью натрия) на суспензию Bi(OH)3 в кипящем концентрированном растворе щелочи: Bi(OH)3 + 3 Na. OH + Cl 2→Na. Bi. O 3 +2 Na. Cl + 3 H 2 O
 Состав висмутатов близок к Mе. Bi. O 3. Они окрашены в различные цвета: Na. Bi. O 3 и KBi. O - в желтый, Ca(Bi. O 3)2 х 4 H 2 O - в оранжевый, Ag. Bi. O 3 – в черный. Сульфиды элементов подгруппы мышьяка Э 2 S 3 и Э 2 S 5 получают из простых веществ или пропусканием H 2 S через раствор производнх As(V), Sb(V) или Bi(V) в кислой среде: 71). 2 Na 3 As. O 4 +5 H 2 S +6 HCl →As 2 S 5 +6 Na. Cl +8 H 2 O Эти соединения имеют кислотный характер. Они (кроме Bi 2 S 3) способны реагировать с основными сульфидами в присутствии щелочей: 72). As 2 S 3 + 3(NH 4)2 S → 2(NH 4)3 As. S 3 73). Sb 2 S 5 + 3 Na 2 S → 2 Na 3 Sb. S 4
Состав висмутатов близок к Mе. Bi. O 3. Они окрашены в различные цвета: Na. Bi. O 3 и KBi. O - в желтый, Ca(Bi. O 3)2 х 4 H 2 O - в оранжевый, Ag. Bi. O 3 – в черный. Сульфиды элементов подгруппы мышьяка Э 2 S 3 и Э 2 S 5 получают из простых веществ или пропусканием H 2 S через раствор производнх As(V), Sb(V) или Bi(V) в кислой среде: 71). 2 Na 3 As. O 4 +5 H 2 S +6 HCl →As 2 S 5 +6 Na. Cl +8 H 2 O Эти соединения имеют кислотный характер. Они (кроме Bi 2 S 3) способны реагировать с основными сульфидами в присутствии щелочей: 72). As 2 S 3 + 3(NH 4)2 S → 2(NH 4)3 As. S 3 73). Sb 2 S 5 + 3 Na 2 S → 2 Na 3 Sb. S 4
 Сульфид As(III) легко окисляется персульфидом аммония до сульфида As(V): As 2 S 3 + 2(NH 4)2 S 2 → As 2 S 5 + 2(NH 4)2 S Галиды типа ЭHal 3 подвергаются обратимому гидролизу: As. Cl 3 + 4 H 2 O → H[As(OH)4] + 3 HCl Sb. Cl 3 + H 2 O →Sb. OCl + 2 HCl Bi. Cl 3 + H 2 O → Bi. OCl + 3 HCl
Сульфид As(III) легко окисляется персульфидом аммония до сульфида As(V): As 2 S 3 + 2(NH 4)2 S 2 → As 2 S 5 + 2(NH 4)2 S Галиды типа ЭHal 3 подвергаются обратимому гидролизу: As. Cl 3 + 4 H 2 O → H[As(OH)4] + 3 HCl Sb. Cl 3 + H 2 O →Sb. OCl + 2 HCl Bi. Cl 3 + H 2 O → Bi. OCl + 3 HCl
 Галогеноарсенаты (III) и галогеностибаты (III) - белые кристаллические вещества, трудно растворимые в воде, но растворимые в хлороводородной кислоте. Пентагалиды мышьяка, сурьмы и висмута вступают в реакцию с галидами основного характера, проявляя кислотные свойства): As. F 5 + KF → K[As. F 6] Sb. Cl 5 + KCl → K[Sb. Cl 6] Bi. F 5 + 3 KF → K 3[Bi. F 8]
Галогеноарсенаты (III) и галогеностибаты (III) - белые кристаллические вещества, трудно растворимые в воде, но растворимые в хлороводородной кислоте. Пентагалиды мышьяка, сурьмы и висмута вступают в реакцию с галидами основного характера, проявляя кислотные свойства): As. F 5 + KF → K[As. F 6] Sb. Cl 5 + KCl → K[Sb. Cl 6] Bi. F 5 + 3 KF → K 3[Bi. F 8]
 Биологическая роль Сходство симптомов отравления мышьяком с симптомами холеры длительное время позволяло успешно использовать мышьяк - триоксид мышьяка As 2 O 3 - в качестве смертельного яда. Во Франции порошок триоксида мышьяка за высокую «эффективность» получил обиходное название «наследственный порошок» . В 1832 появилась надёжная качественная реакция на мышьяк — проба Марша, значительно повысившая эффективность раскрытия отравлений.
Биологическая роль Сходство симптомов отравления мышьяком с симптомами холеры длительное время позволяло успешно использовать мышьяк - триоксид мышьяка As 2 O 3 - в качестве смертельного яда. Во Франции порошок триоксида мышьяка за высокую «эффективность» получил обиходное название «наследственный порошок» . В 1832 появилась надёжная качественная реакция на мышьяк — проба Марша, значительно повысившая эффективность раскрытия отравлений.
 Унитиол Аппарат для регистрации мышьяка
Унитиол Аппарат для регистрации мышьяка


