5 гр азот.ppt
- Количество слайдов: 31
 ЭЛЕМЕНТЫ V А ПОДГРУППЫ Пниктогены (греч. «удушливый» )
ЭЛЕМЕНТЫ V А ПОДГРУППЫ Пниктогены (греч. «удушливый» )
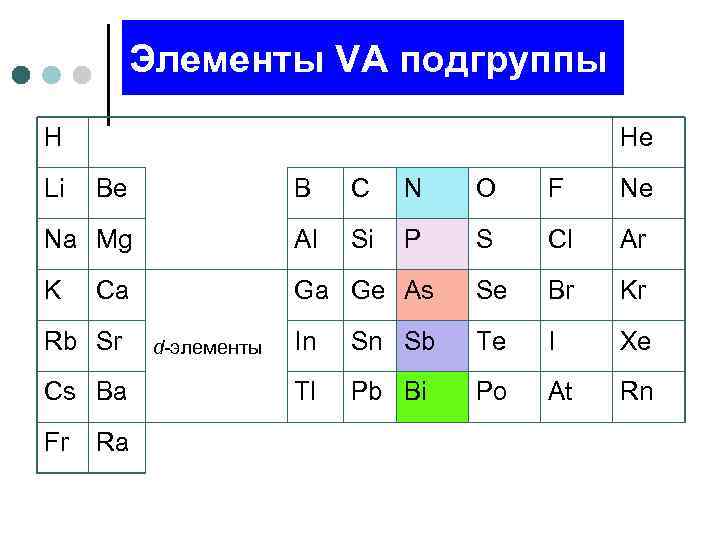 Элементы VА подгруппы H Li He Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ga Ge As Se Br Kr In Sn Sb Te I Xe Tl Pb Bi Po At Rn Ca Rb Sr Cs Ba Fr Ra d-элементы
Элементы VА подгруппы H Li He Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ga Ge As Se Br Kr In Sn Sb Te I Xe Tl Pb Bi Po At Rn Ca Rb Sr Cs Ba Fr Ra d-элементы
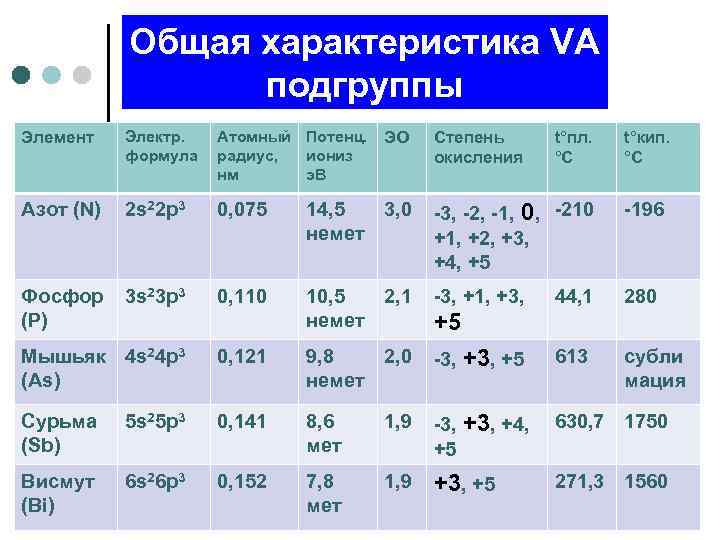 Общая характеристика VA подгруппы Элемент Электр. формула Атомный Потенц. ЭО радиус, иониз нм э. В Степень окисления Азот (N) 2 s 22 p 3 0, 075 14, 5 3, 0 немет -3, -2, -1, 0, -210 +1, +2, +3, +4, +5 -196 Фосфор 3 s 23 p 3 (P) 0, 110 10, 5 2, 1 немет -3, +1, +3, 44, 1 280 Мышьяк 4 s 24 p 3 (As) 0, 121 9, 8 2, 0 немет -3, +5 613 субли мация Сурьма (Sb) 5 s 25 p 3 0, 141 8, 6 мет 1, 9 -3, +4, 630, 7 1750 +5 Висмут (Bi) 6 s 26 p 3 0, 152 7, 8 мет 1, 9 +3, +5 t°пл. °С t°кип. °С +5 271, 3 1560
Общая характеристика VA подгруппы Элемент Электр. формула Атомный Потенц. ЭО радиус, иониз нм э. В Степень окисления Азот (N) 2 s 22 p 3 0, 075 14, 5 3, 0 немет -3, -2, -1, 0, -210 +1, +2, +3, +4, +5 -196 Фосфор 3 s 23 p 3 (P) 0, 110 10, 5 2, 1 немет -3, +1, +3, 44, 1 280 Мышьяк 4 s 24 p 3 (As) 0, 121 9, 8 2, 0 немет -3, +5 613 субли мация Сурьма (Sb) 5 s 25 p 3 0, 141 8, 6 мет 1, 9 -3, +4, 630, 7 1750 +5 Висмут (Bi) 6 s 26 p 3 0, 152 7, 8 мет 1, 9 +3, +5 t°пл. °С t°кип. °С +5 271, 3 1560
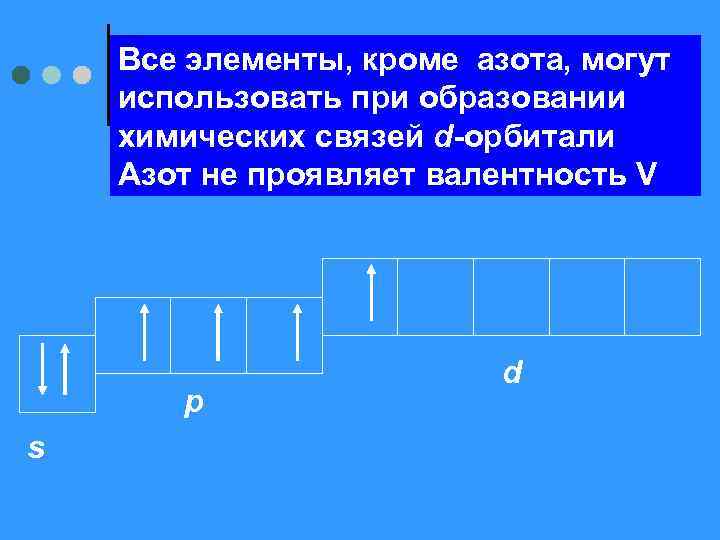 Все элементы, кроме азота, могут использовать при образовании химических связей d-орбитали Азот не проявляет валентность V s p d
Все элементы, кроме азота, могут использовать при образовании химических связей d-орбитали Азот не проявляет валентность V s p d
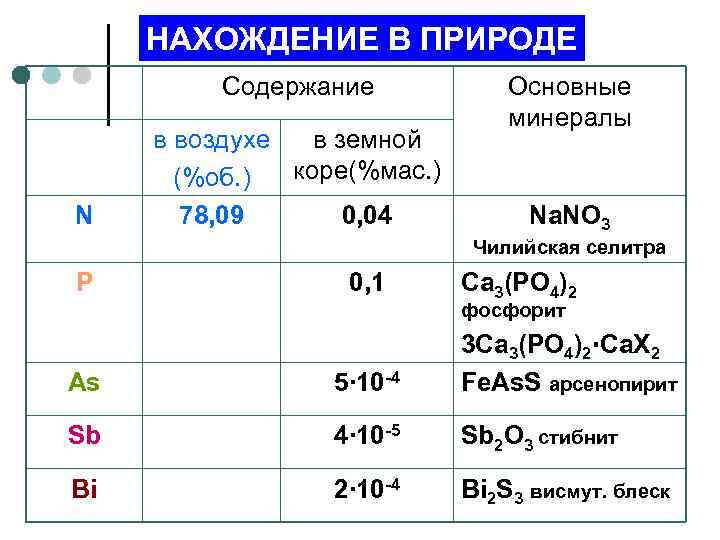 НАХОЖДЕНИЕ В ПРИРОДЕ Содержание N в воздухе в земной коре(%мас. ) (%об. ) 78, 09 0, 04 Основные минералы Na. NO 3 Чилийская селитра P 0, 1 Ca 3(PO 4)2 фосфорит As 5∙ 10 -4 3 Ca 3(PO 4)2∙Ca. Х 2 Fe. As. S арсенопирит Sb 4∙ 10 -5 Sb 2 O 3 стибнит Bi 2∙ 10 -4 Bi 2 S 3 висмут. блеск
НАХОЖДЕНИЕ В ПРИРОДЕ Содержание N в воздухе в земной коре(%мас. ) (%об. ) 78, 09 0, 04 Основные минералы Na. NO 3 Чилийская селитра P 0, 1 Ca 3(PO 4)2 фосфорит As 5∙ 10 -4 3 Ca 3(PO 4)2∙Ca. Х 2 Fe. As. S арсенопирит Sb 4∙ 10 -5 Sb 2 O 3 стибнит Bi 2∙ 10 -4 Bi 2 S 3 висмут. блеск
 ПРОСТЫЕ ВЕЩЕСТВА N 2 Sb P Bi As
ПРОСТЫЕ ВЕЩЕСТВА N 2 Sb P Bi As
 ОСНОВНЫЕ МИНЕРАЛЫ фосфорит стибнит апатит стибнит арсенопирит висмут. блеск
ОСНОВНЫЕ МИНЕРАЛЫ фосфорит стибнит апатит стибнит арсенопирит висмут. блеск
 Азот – простое вещество Молекула азота (: N Ξ N: ) N 2 ¢ В молекуле имеются одна σ- и две π- связи. ¢ Молекула очень устойчива, поэтому обладает низкой реакционной способностью. ¢ Открыт Д. Резерфордом в 1772 г. ¢ Основной компонент воздуха (78% по объему, 75, 6% по массе). ¢ Газ, без цвета, запаха и вкуса; плохо растворим в воде, не поддерживает дыхание и горение ¢
Азот – простое вещество Молекула азота (: N Ξ N: ) N 2 ¢ В молекуле имеются одна σ- и две π- связи. ¢ Молекула очень устойчива, поэтому обладает низкой реакционной способностью. ¢ Открыт Д. Резерфордом в 1772 г. ¢ Основной компонент воздуха (78% по объему, 75, 6% по массе). ¢ Газ, без цвета, запаха и вкуса; плохо растворим в воде, не поддерживает дыхание и горение ¢
 АЗОТ – «безжизненный» ПОЛУЧЕНИЕ - в промышленности сжижение и фракционная перегонка воздуха tкип. (N 2) = - 196 o. C tкип. (О 2) = - 183 о. С - в лаборатории t NH 4 NO 2 = N 2 + H 2 O (NH 4)2 Сr 2 O 7 = N 2 + 4 H 2 O + Сr 2 O 3
АЗОТ – «безжизненный» ПОЛУЧЕНИЕ - в промышленности сжижение и фракционная перегонка воздуха tкип. (N 2) = - 196 o. C tкип. (О 2) = - 183 о. С - в лаборатории t NH 4 NO 2 = N 2 + H 2 O (NH 4)2 Сr 2 O 7 = N 2 + 4 H 2 O + Сr 2 O 3
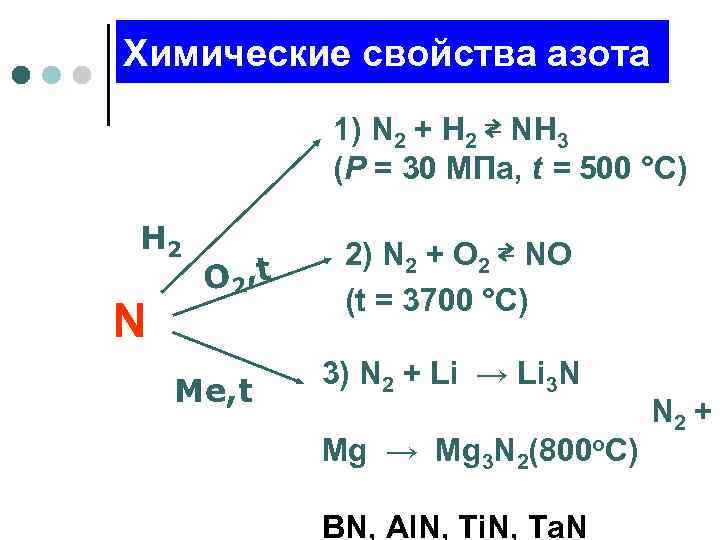 Химические свойства азота 1) N 2 + H 2 ⇄ NH 3 (P = 30 MПа, t = 500 °С) H 2 O 2, t N Me, t 2) N 2 + O 2 ⇄ NO (t = 3700 °С) 3) N 2 + Li → Li 3 N N 2 + Mg → Mg 3 N 2(800 o. C) BN, Al. N, Ti. N, Ta. N
Химические свойства азота 1) N 2 + H 2 ⇄ NH 3 (P = 30 MПа, t = 500 °С) H 2 O 2, t N Me, t 2) N 2 + O 2 ⇄ NO (t = 3700 °С) 3) N 2 + Li → Li 3 N N 2 + Mg → Mg 3 N 2(800 o. C) BN, Al. N, Ti. N, Ta. N
 ВОДОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА Аммиак NH 3 и его производные Молекула полярная, атом азота находится в sp 3 - гибридном состоянии, угол HNH = 107, 3°.
ВОДОРОДНЫЕ СОЕДИНЕНИЯ АЗОТА Аммиак NH 3 и его производные Молекула полярная, атом азота находится в sp 3 - гибридном состоянии, угол HNH = 107, 3°.
 ФИЗИЧЕСКИЕ СВОЙСТВА NH 3 - бесцветный газ, с резким запахом, ядовит. t° кип. = -33, 4°C; t°пл. = -78°C. Молекулы аммиака связаны водородными связями.
ФИЗИЧЕСКИЕ СВОЙСТВА NH 3 - бесцветный газ, с резким запахом, ядовит. t° кип. = -33, 4°C; t°пл. = -78°C. Молекулы аммиака связаны водородными связями.
 Аммиак очень хорошо растворим в NH 4 OH воде: при 20°С в 1 л. воды можно растворить до 800 л. NH 3, а при 0°С – около 1200 л. H 3 N: + H – O → NH 3 ∙ H 2 O H NH 3 ∙ H 2 O ⇄ NH 4+ + OH– Kд = 1, 8∙ 10– 5
Аммиак очень хорошо растворим в NH 4 OH воде: при 20°С в 1 л. воды можно растворить до 800 л. NH 3, а при 0°С – около 1200 л. H 3 N: + H – O → NH 3 ∙ H 2 O H NH 3 ∙ H 2 O ⇄ NH 4+ + OH– Kд = 1, 8∙ 10– 5
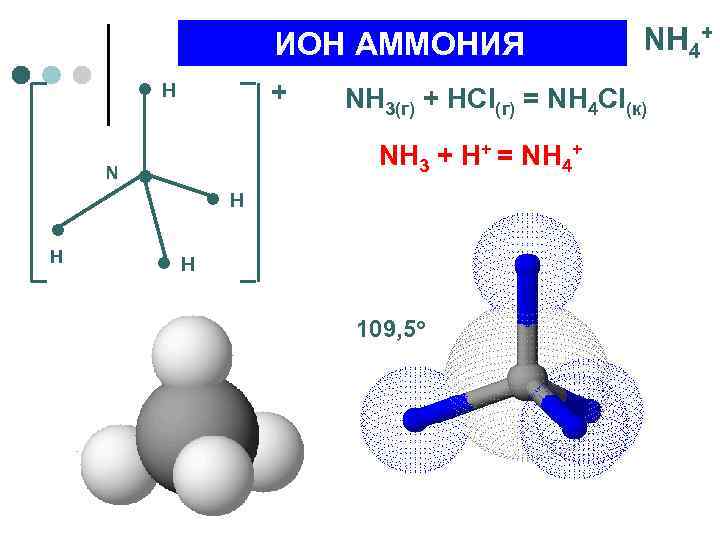 ИОН АММОНИЯ – – + ● H N ● H NH 4+ NH 3(г) + HCl(г) = NH 4 Cl(к) NH 3 + H+ = NH 4+ ● H – – 109, 5 o
ИОН АММОНИЯ – – + ● H N ● H NH 4+ NH 3(г) + HCl(г) = NH 4 Cl(к) NH 3 + H+ = NH 4+ ● H – – 109, 5 o
 ПОЛУЧЕНИЕ NH 3 n Промышленный способ: N 2 + 3 H 2 = 2 NH 3 (p=1000 атм; t°= 500°C; kat – Fe, Ni) n Лабораторный способ: Нагревание солей аммония со щелочами. 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3 + 2 Н 2 O (NH 4)2 SO 4 + 2 KOH = K 2 SO 4 + 2 NH 3 +
ПОЛУЧЕНИЕ NH 3 n Промышленный способ: N 2 + 3 H 2 = 2 NH 3 (p=1000 атм; t°= 500°C; kat – Fe, Ni) n Лабораторный способ: Нагревание солей аммония со щелочами. 2 NH 4 Cl + Ca(OH)2 = Ca. Cl 2 + 2 NH 3 + 2 Н 2 O (NH 4)2 SO 4 + 2 KOH = K 2 SO 4 + 2 NH 3 +
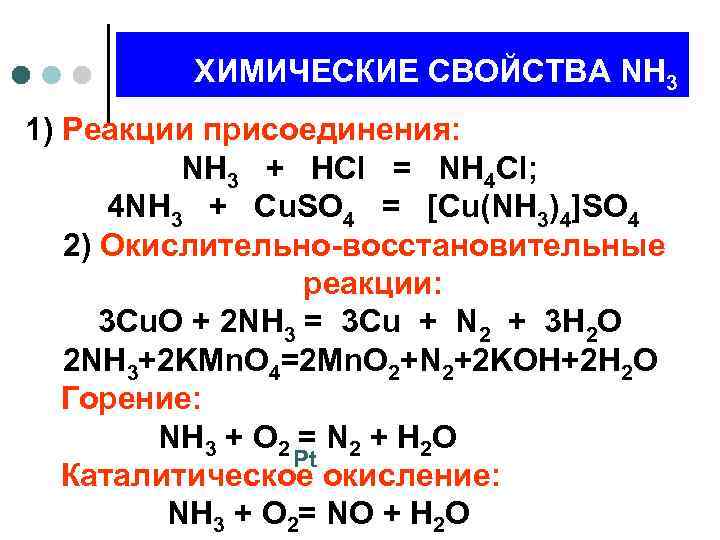 ХИМИЧЕСКИЕ СВОЙСТВА NH 3 1) Реакции присоединения: NH 3 + HCl = NH 4 Cl; 4 NH 3 + Cu. SO 4 = [Cu(NH 3)4]SO 4 2) Окислительно-восстановительные реакции: 3 Cu. O + 2 NH 3 = 3 Cu + N 2 + 3 H 2 O 2 NH 3+2 KMn. O 4=2 Mn. O 2+N 2+2 KOH+2 H 2 O Горение: NH 3 + O 2 = N 2 + H 2 O Pt Каталитическое окисление: NH 3 + O 2= NO + H 2 O
ХИМИЧЕСКИЕ СВОЙСТВА NH 3 1) Реакции присоединения: NH 3 + HCl = NH 4 Cl; 4 NH 3 + Cu. SO 4 = [Cu(NH 3)4]SO 4 2) Окислительно-восстановительные реакции: 3 Cu. O + 2 NH 3 = 3 Cu + N 2 + 3 H 2 O 2 NH 3+2 KMn. O 4=2 Mn. O 2+N 2+2 KOH+2 H 2 O Горение: NH 3 + O 2 = N 2 + H 2 O Pt Каталитическое окисление: NH 3 + O 2= NO + H 2 O
 ХИМИЧЕСКИЕ СВОЙСТВА NH 3 3) Реакции замещения: 2 NH 3 + 2 Na = 2 Na. NH 2 + H 2 амид натрия NH 3 + 2 Na = Na 2 NH + H 2 имид натрия 2 NH 3 + 6 Na = 2 Na 3 N + 3 H 2 нитрид натрия 4) Окисление аммиака до гидразина (N 2 H 4) 2 NH 3 + Na. OCl = N 2 H 4 + Na. Cl + H 2 O перхлорат натрия
ХИМИЧЕСКИЕ СВОЙСТВА NH 3 3) Реакции замещения: 2 NH 3 + 2 Na = 2 Na. NH 2 + H 2 амид натрия NH 3 + 2 Na = Na 2 NH + H 2 имид натрия 2 NH 3 + 6 Na = 2 Na 3 N + 3 H 2 нитрид натрия 4) Окисление аммиака до гидразина (N 2 H 4) 2 NH 3 + Na. OCl = N 2 H 4 + Na. Cl + H 2 O перхлорат натрия
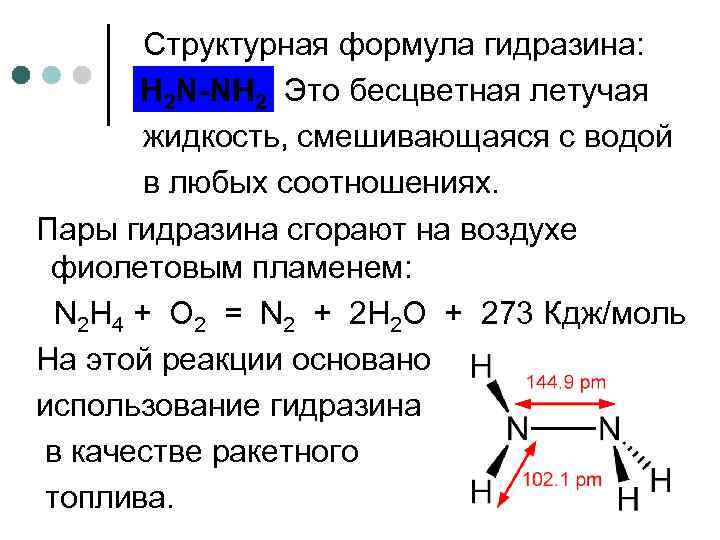 Cтруктурная формула гидразина: H 2 N-NH 2 . Это бесцветная летучая жидкость, смешивающаяся с водой в любых соотношениях. Пары гидразина сгорают на воздухе фиолетовым пламенем: N 2 H 4 + O 2 = N 2 + 2 H 2 O + 273 Кдж/моль На этой реакции основано использование гидразина в качестве ракетного топлива.
Cтруктурная формула гидразина: H 2 N-NH 2 . Это бесцветная летучая жидкость, смешивающаяся с водой в любых соотношениях. Пары гидразина сгорают на воздухе фиолетовым пламенем: N 2 H 4 + O 2 = N 2 + 2 H 2 O + 273 Кдж/моль На этой реакции основано использование гидразина в качестве ракетного топлива.
 СОЛИ АММОНИЯ Разложение при нагревании: NH 4 Cl = NH 3 + HCl NH 4 HCO 3 = NH 3 + Н 2 O + CO 2 NH 4 NO 3 = N 2 O + 2 Н 2 O NH 4 NO 2 = N 2 + 2 Н 2 O Качественная реакция на NH 4+ При нагревании со щелочами выделяется аммиак NH 4 Cl + Na. OH = Na. Cl + NH 3+ Н 2 O По запаху аммиака можно судить о наличии соли аммония.
СОЛИ АММОНИЯ Разложение при нагревании: NH 4 Cl = NH 3 + HCl NH 4 HCO 3 = NH 3 + Н 2 O + CO 2 NH 4 NO 3 = N 2 O + 2 Н 2 O NH 4 NO 2 = N 2 + 2 Н 2 O Качественная реакция на NH 4+ При нагревании со щелочами выделяется аммиак NH 4 Cl + Na. OH = Na. Cl + NH 3+ Н 2 O По запаху аммиака можно судить о наличии соли аммония.
 Оксиды азота I II IV V N 2 O, NO, N 2 O 3, NO 2(N 2 O 4), N 2 O 5 Кислотные св-ва усиливаются несолеобразующие газ жидк газ тв. вещ. N 2 O – «веселящий» газ (наркоз) (получают разложением NH 4 NO 3) NO – малорастворим в воде (получают действием на медь разб азотной кислоты). Ядовит. Окисляется на воздухе до NO 2.
Оксиды азота I II IV V N 2 O, NO, N 2 O 3, NO 2(N 2 O 4), N 2 O 5 Кислотные св-ва усиливаются несолеобразующие газ жидк газ тв. вещ. N 2 O – «веселящий» газ (наркоз) (получают разложением NH 4 NO 3) NO – малорастворим в воде (получают действием на медь разб азотной кислоты). Ядовит. Окисляется на воздухе до NO 2.
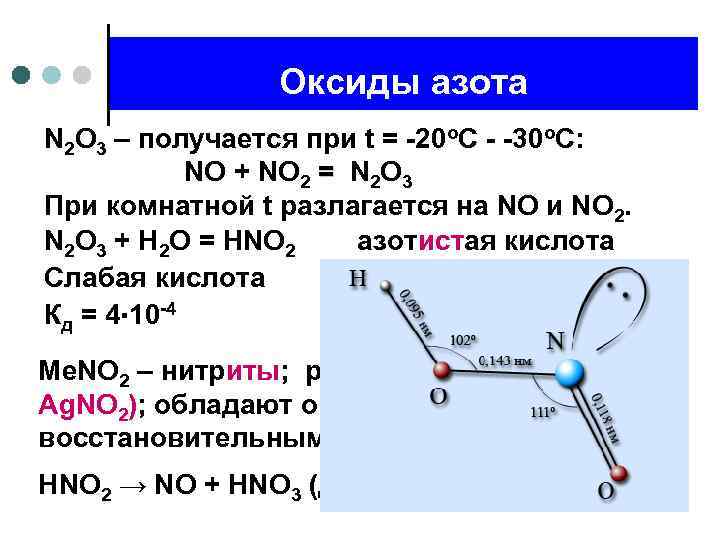 Оксиды азота N 2 O 3 – получается при t = -20 о. С - -30 о. С: NO + NO 2 = N 2 O 3 = При комнатной t разлагается на NO и NO 2. N 2 O 3 + H 2 O = HNO 2 азотистая кислота Слабая кислота Кд = 4∙ 10 -4 Me. NO 2 – нитриты; растворимы в воде (кроме Ag. NO 2); обладают окислительновосстановительными свойствами. HNO 2 → NO + HNO 3 (диспропорционирование)
Оксиды азота N 2 O 3 – получается при t = -20 о. С - -30 о. С: NO + NO 2 = N 2 O 3 = При комнатной t разлагается на NO и NO 2. N 2 O 3 + H 2 O = HNO 2 азотистая кислота Слабая кислота Кд = 4∙ 10 -4 Me. NO 2 – нитриты; растворимы в воде (кроме Ag. NO 2); обладают окислительновосстановительными свойствами. HNO 2 → NO + HNO 3 (диспропорционирование)
 Оксиды азота NO 2 в лаборатории получают действием на медь конц. азотной кислоты. 2 NO 2(г) ⇄ N 2 O 4 (ж) , H = -57 к. Дж; 22 о. С P↑, T↓ → вправо Р↓, Т ↑ ← влево Химические свойства NO 2 1) 2 NO 2 + H 2 O → HNO 2 + HNO 3 4 NO 2 + 2 H 2 O + О 2 → 4 HNO 3 2) 2 NO 2 + KOH KNO 2 + KNO 3 Ядовит! 2 NO + KOH + O KNO + H O 2 2 3 2
Оксиды азота NO 2 в лаборатории получают действием на медь конц. азотной кислоты. 2 NO 2(г) ⇄ N 2 O 4 (ж) , H = -57 к. Дж; 22 о. С P↑, T↓ → вправо Р↓, Т ↑ ← влево Химические свойства NO 2 1) 2 NO 2 + H 2 O → HNO 2 + HNO 3 4 NO 2 + 2 H 2 O + О 2 → 4 HNO 3 2) 2 NO 2 + KOH KNO 2 + KNO 3 Ядовит! 2 NO + KOH + O KNO + H O 2 2 3 2
 Оксиды азота N 2 O 5 получают обезвоживанием HNO 3 оксидом фосфора 2 HNO 3 + P 2 O 5 = 2 HPO 3 + N 2 O 5 + H 2 O = 2 HNO 3 - азотная кислота N 2 O 5 обладает всеми свойствами кислотных оксидов. Сильный окислитель.
Оксиды азота N 2 O 5 получают обезвоживанием HNO 3 оксидом фосфора 2 HNO 3 + P 2 O 5 = 2 HPO 3 + N 2 O 5 + H 2 O = 2 HNO 3 - азотная кислота N 2 O 5 обладает всеми свойствами кислотных оксидов. Сильный окислитель.
 Азотная кислота
Азотная кислота
 Азотная кислота. Получение. В промышленности азотную кислоту получают в три этапа: NH 3 + О 2 → NO + … NO + О 2 → NO 2 + H 2 O + О 2 → HNO 3
Азотная кислота. Получение. В промышленности азотную кислоту получают в три этапа: NH 3 + О 2 → NO + … NO + О 2 → NO 2 + H 2 O + О 2 → HNO 3
 Азотная кислота. Свойства. Очень сильная кислота: HNO 3 → H+ + NO 3 - Азотная кислота и ее соли – сильные окислители. HNO 3 в никогда не взаимодействует с металлами с выделением молекулярного водорода H 2. Чем более активен металл и чем меньшую концентрацию имеет HNO 3, тем глубже идет восстановление (до NН 3)
Азотная кислота. Свойства. Очень сильная кислота: HNO 3 → H+ + NO 3 - Азотная кислота и ее соли – сильные окислители. HNO 3 в никогда не взаимодействует с металлами с выделением молекулярного водорода H 2. Чем более активен металл и чем меньшую концентрацию имеет HNO 3, тем глубже идет восстановление (до NН 3)
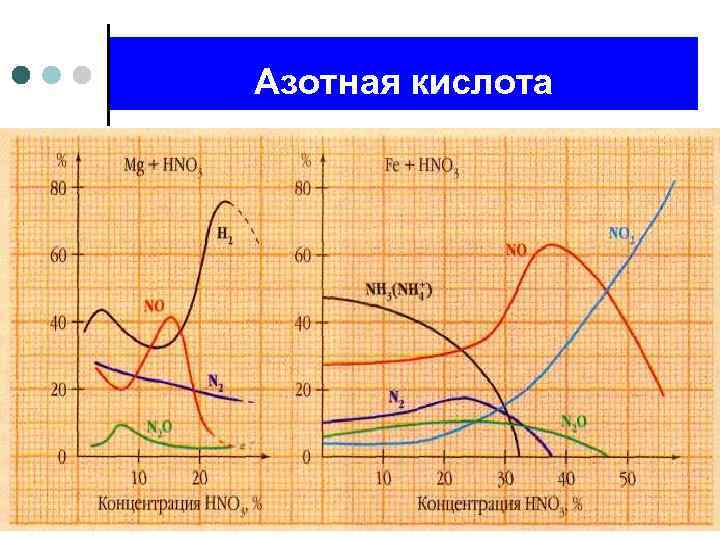
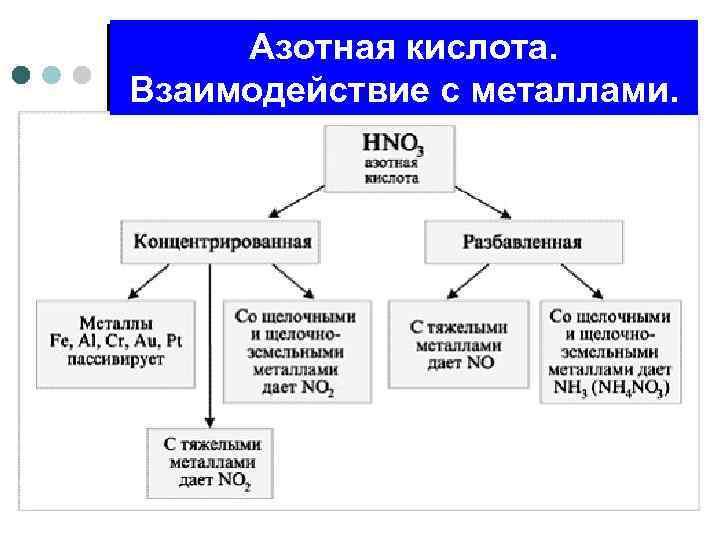 Азотная кислота. Взаимодействие с металлами.
Азотная кислота. Взаимодействие с металлами.
 Азотная кислота
Азотная кислота
 «Царская водка» Смесь концентрированных HNO 3 и HCl называется “царская водка”. Царская водка обладает сильными окислительными свойствами за счет наличия в ней хлористого нитрозила (NOCl) и атомарного хлора. HNO 3 : HCl = 1: 3 HNO 3 + HCl NOCl + H 2 O Au + HNO 3 + HCl H[Au. Cl 4] + NO + H 2 O Pt + HNO 3 + HCl H 2[Pt. Cl 6 ] + NO + H 2 O
«Царская водка» Смесь концентрированных HNO 3 и HCl называется “царская водка”. Царская водка обладает сильными окислительными свойствами за счет наличия в ней хлористого нитрозила (NOCl) и атомарного хлора. HNO 3 : HCl = 1: 3 HNO 3 + HCl NOCl + H 2 O Au + HNO 3 + HCl H[Au. Cl 4] + NO + H 2 O Pt + HNO 3 + HCl H 2[Pt. Cl 6 ] + NO + H 2 O
 Cоли азотной кислоты NH 4 NO 3 Na. NO 3 Cr(NO 3)3 Co(NO 3)2
Cоли азотной кислоты NH 4 NO 3 Na. NO 3 Cr(NO 3)3 Co(NO 3)2
 Соли азотной кислоты Нитраты всех металлов растворимы Нитраты - сильные окислители t Fe 2 O 3 + KNO 3 + KOH → K 2 Fe. O 4 + KNO 2 + H 2 O Нитраты при T > 200 – 300 °С разлагаются NH 4 NO 3 → N 2 O↑ + H 2 O↑ Na. NO 3 → Na. NO 2 + O 2↑ (до Mg) Pb(NO 3)2 → Pb. O + NO 2↑ + O 2↑ ( от Mg до Cu) Ag. NO 3 → Ag + NO 2↑ + O 2↑ (после Cu)
Соли азотной кислоты Нитраты всех металлов растворимы Нитраты - сильные окислители t Fe 2 O 3 + KNO 3 + KOH → K 2 Fe. O 4 + KNO 2 + H 2 O Нитраты при T > 200 – 300 °С разлагаются NH 4 NO 3 → N 2 O↑ + H 2 O↑ Na. NO 3 → Na. NO 2 + O 2↑ (до Mg) Pb(NO 3)2 → Pb. O + NO 2↑ + O 2↑ ( от Mg до Cu) Ag. NO 3 → Ag + NO 2↑ + O 2↑ (после Cu)


