Элементы подгруппы ванадия.ppt
- Количество слайдов: 17

Элементы подгруппы ванадия V Nb Ta

Открытие • Ванадий назван в честь богини красоты древних скандинавов — легендарной Фреи Ванадис. Это имя элементу дал в 1831 г. Гавриил Сефстрем, профессор Горного института в Стокгольме. Он выделил элемент из шлака, получающегося при плавке руды в доменных печах. Работу Г. Сефстрем осуществил вместе со своим учеником Иоганном Якобом Берцелиусом. • Элементы, образующие в семействе V группы свою «ветвь» , похожи друг на друга не только по своим свойствам, но и «родственники» по названиям: ванадии, ниобий, тантал. Во-первых, наименования всех трех относятся к области мифологии. Во-вторых, в названиях указана прямая родственная связь: в древнегреческой мифологии Ниобея является дочерью Тантала. Имя «ниобий» дал элементу немецкий химик Генрих Розе. Тем самым подчеркивалось сходство нового (как был уверен Г. Розе) элемента с уже известным к 1844 г. танталом.

Нахождение в природе • Всего известно более 65 минералов, включающих ванадий. Интересной особенностью распространения этого элемента является его содержание в ископаемых растительного происхождения: углях, нефти, горючих сланцах и др. Вода морей содержит 0, 3 г ванадия на 1000 т, и некоторые обитатели морей (морские ежи, голотурии) включают его в состав своего организма. Содержание V в земной коре 1, 9· 102 % по массе (в почве -1, 0*10 -2 %), в воде океанов -3*10 -7 %, золе растений - 6, 1*10 -3 %. Ванадий относится к рассеянным элементам. • Важнейшие минералы ванадия: патронит V 2 S 5, ванадинит Pb 5(VO 4)3 Cl, деклуазит Pb(Zn, Cu)(VO 4)(OH), моттрамит 5(Cu, Pb)O*V 2 O 5*2 H 2 O, тюямунит Ca(UO 2)2(VO 4)2*8 H 2 O, карнотит K 2(UO 2)2(VO 4)2*3 H 2 O, роскоэлит KV 2[Al. Si 3 O 10](OH)2. • Важнейшие минералы Nb и Ta: колумбит (Fe, Mn)(Nb. O 3)2, танталит (Fe, Mn)(Ta. O 3)2, лопарит (Na, Ce)(Nb, Ti)O 3

Богатые ниобием кристаллы колумбита имеют таблитчатый или призматический облик, богатые танталом -столбчатый, с выраженной штриховкой граней Колумбит танталит
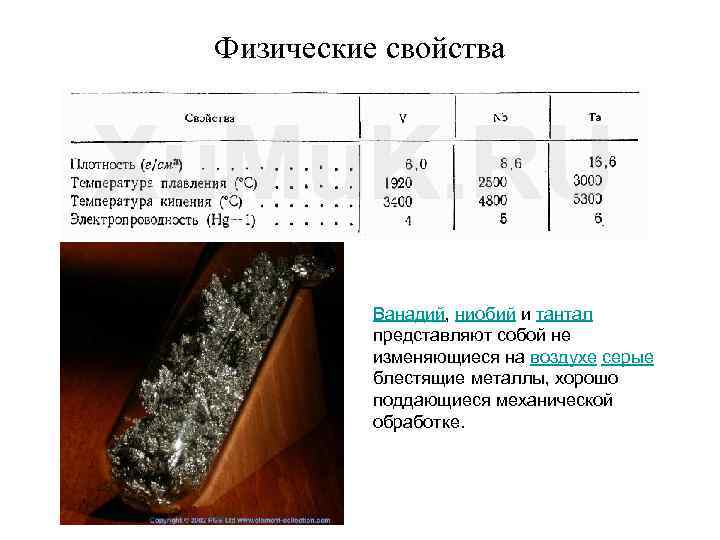
Физические свойства Ванадий, ниобий и тантал представляют собой не изменяющиеся на воздухе серые блестящие металлы, хорошо поддающиеся механической обработке.

Получение V • Металлы подгруппы V получают путем металлотермического восстановления соответствующих пентаокисей или галогенидов. При использовании кремний- и алюмотермии получают соответственно феррованадий, феррониобий и ферротантал. • При сплавлении карнотита с содой и хлоридом натрия и последующем подкислении плава выпадает осадок ванадиевой кислоты, при прокаливании которой образуется пятиокись V 2 O 5 K 2(UO 2)2(VO 4)2 + Na. Cl + Na 2 CO 3 → Na 3 VO 4 + Na 2 UO 4 + KCl + CO 2 Na 3 VO 4 + HCl = H 3 VO 4 + Na. Cl H 3 VO 4 → V 2 O 5 + H 2 O • Также ванадий получают: а) термической диссоциацией VI 2 в вакууме; б) восстановлением окислов VO, V 2 O 3, VO 2, V 2 O 5 металлическими Ca, Al, H 2, C; в) восстановлением VCl 2, VCl 3, VCl 4 водородом; г) катодным восстановлением расплавов, содержащих V 2 O 5.

Получение Nb и Ta • При сплавлении танталито-колумбита с едким натром и подкислении образующейся смеси танталата и ниобата натрия осаждаются гидратированные пятиокиси Ta и Nb, которые затем переводят в комплексные фториды • (Fe, Mn)(Nb, Ta. O 3)2 →→ Na 3 Nb. O 4, Na 3 Ta. O 4 →→ Nb 2 O 5·n. H 2 O↓, Ta 2 O 5·n. H 2 O↓ →→ K 2[Nb. OF 5], K 2[Ta. F 7]


Химические свойства • • • Ванадий – поливалентный элемент; он встречается в 2 х-, 3 х-, 4 х- и 5 валентном состоянии. Водные растворы солей V(II) окрашены в фиолетовый V(III) – зеленый V(IV) – синий цвета V(V) – бесцветны или окрашены в цвета от желто-оранжевого до красного. При комнатной tº металлический V не окисляется ни во влажном, ни в сухом воздухе. При повышенной tº V взаимодействует с O 2, Hal 2, S, N 2, Si, C, B: V + O 2, Hal 2, S, N 2, Si, C, B → V 2 O 5, VF 5, VCl 4, VBr 3, VI 3, V 2 S 3, VN, V 2 Si, VC, VSi 2 При комнатной tº V + HF, конц. = VF 3 +H 2 V + HNO 3, конц. = VO 2 NO 3 (HVO 3) + NO 2 V + HCl. O 4, конц. = VO 2 Cl. O 4+ HCl V + HNO 3 + HCl = VCl 4 + NO + H 2 O При нагревании V растворяется в HCl, конц. H 2 SO 4, разб. HNO 3 V + HCl. = VCl 2 + H 2 V + H 2 SO 4, конц. = VOSO 4+ SO 2 + H 2 O При действии щелочных окислительных плавов образуются ванадаты щелочных металлов V + KNO 3 + KOH = KVO 3 + KNO 2 + H 2 O

Химические свойства • На металлические Nb и Ta не действуют разб. и конц. кислоты HCl, HNO 3, H 2 SO 4 и царская водка. Они растворяются только в смеси крепких HF и HNO 3, в конц. HF (в контакте с Pt), а также щелочных окислительных расплавах M + KNO 3(KCl. O 3) + KOH = K 3 MO 4 + KNO 2(KCl) + H 2 O M + HF + HNO 3 = H[MF 6] + NO + H 2 O В последнем случае в кислых фторидных растворах присутствуют анионные комплексы состава Ta. F 6 -, Ta. F 72 -, Ta. F 83 -, Ta. OF 4 -, Ta. OF 63 -, Nb. F 6 -, Nb. F 72 -, Nb. OF 52 -. • Металлический V вытесняет Pt, Ir, Rh, Au из растворов их солей и восстанавливает ионы Hg 2+, Cu 2+, Fe 3+ до Hg 22+, Cu+, Fe 2+, превращаясь в соединения V(IV): Pt. Cl 4 + V + H 2 O = VOCl 2 + Pt + HCl Hg. Cl 2 + V + H 2 O = VOCl 2 + Hg 2 Cl 2 + HCl Fe. Cl 3 + V + H 2 O = VOCl 2 + Fe. Cl 2 + HCl

Соединения V(II, IV). • Восстановлением соединений V(V) различными восстановителями получают соединения V(II), V(IV), которые неустойчивы и под действием кислорода воздуха снова превращаются в соединения V(V, IV): • VO 3 - →→→→VO 2+ →→→→→→→V 3+→→→→→→→V 2+ • б/ц синий зеленый фиолетовый V 2 O 5 + Zn + HCl = VOCl 2 (VCl 3) + Zn. Cl 2 + H 2 O • В отличие от соединений V(II, IV) соединения V(V) обладают ярко выраженными кислотными свойствами и склонностью к комплексообразованию и конденсации. V 2 O 5 ведет себя как амфотерное вво с преобладанием кислотных свойств, легко растворяется в щелочах и конц. кислотах. При растворении V 2 O 5 в избытке холодной щелочи получаются орто- и пированадаты, а при нагревании – триметаванадаты V 2 O 5 + 6 Na. OH = Na 3 VO 4 + 3 H 2 O V 2 O 5 + 4 Na. OH = Na 4 V 2 O 7 + 2 H 2 O 3 V 2 O 5 + 6 Na. OH = 2 Na 3 V 3 O 9 + 3 H 2 O • VO 43 - - ион в конц. растворах легко превращается на холоду в пированадат -ион V 2 O 74 - , который при нагревании переходит в полимерный метаванадат-ион (VO 3 -)n. • Нагревание V 2 O 5 с сухим HCl дает VOCl 3, а при нагревании V 2 O 5 с конц. HCl выделяется хлор: V 2 O 5 + HCl, конц. = VOCl 2 + H 2 O
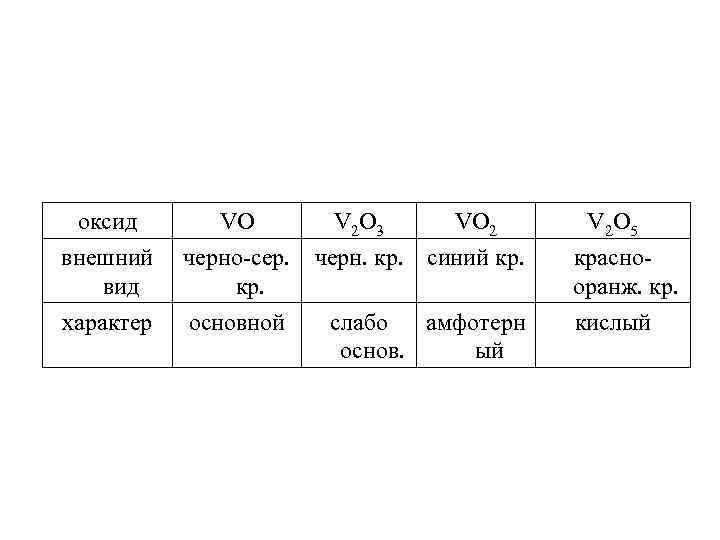
оксид внешний вид характер VO черно-сер. кр. основной V 2 O 3 VO 2 черн. кр. синий кр. слабо амфотерн основ. ый V 2 O 5 краснооранж. кр. кислый

Нанотубулены оксида ванадия

Изумруд — разновидность минерала берилла. Химическая формула: Be 3 Al 2(Si. O 3)6. Зеленый цвет изумруда обусловлен наличием в нем примеси хрома Cr. Типичные изумруды содержат 0, 14% хрома Cr, 0, 12% железа Fe и 0, 05% ванадия V. Считается, что аквамарин способен укрощать бушующее море. Это талисман верной любви, оберегающий дружбу и сохраняющий справедливость. Когда-то считалось, что он укрепляет сердце, помогает при заболеваниях легких, кожи и нервной системы.

Применение V • Благодаря высокой tºплав, малой ρ и хорошей коррозионной стойкости металлический V и его сплавы используют в качестве конструкционных материалов. • -феррованадий служит добавкой для получения конструкционных и быстрорежущих сталей; конструкционные стали, легированные Cr, Mo, V обладают высокой усталостной прочностью; • - соединения V находят применение в химической промышленности в качестве катализаторов при производстве H 2 SO 4, при окислении нафталина или оксилола до фталевого ангидрида, антрацена в антрахинон, ацетилена до уксусной кислоты и др. • - V 2 O 5 служит красителем для стекла и керамики


Применение Nb, Ta • Благодаря высоким tºплав. и способности к эмиссии e металлический Nb применяется в вакуумной технике, радиолокационной и рентгеновской аппаратуре. - для получения жаропрочных, тугоплавких, кислотоупорных и магнитных сплавов; - сплавы Nb-Ta используют в сверхзвуковых самолетах, в ракетной и космической технике; - карбиды Nb, W, Mo, Ti служат основой наиболее жаропрочных и сверхтвердых сплавов • Благодаря высокой коррозионной стойкости Ta используют в химической аппаратуре и для изготовления химической посуды (тиглей, капсул, разновесов) - в электронной промышленности производстве конденсаторов с рабочим диапазоном tº от – 60 до +120ºС; - в хирургии при изготовлении нитей для сшивания кровеносных сосудов и нервов; • Металлический Ta успешно заменяет Pt, Au , Ag.
Элементы подгруппы ванадия.ppt