Элементы механики газа.ppt
- Количество слайдов: 19
 Элементы механики газа
Элементы механики газа
 Влияние на плотность газа температуры и давления Газы, в отличие от капельных жидкостей, характеризуются значительной сжимаемостью и высокими значениями коэффициента температурного расширения. Зависимость плотности газа от давления и температуры устанавливается уравнением состояния. Наиболее простыми свойствами обладает газ, разреженный настолько, что взаимодействие между его молекулами может не учитываться. Это идеальный (совершенный) газ, для которого справедливо уравнение Менделеева-Клапейрона:
Влияние на плотность газа температуры и давления Газы, в отличие от капельных жидкостей, характеризуются значительной сжимаемостью и высокими значениями коэффициента температурного расширения. Зависимость плотности газа от давления и температуры устанавливается уравнением состояния. Наиболее простыми свойствами обладает газ, разреженный настолько, что взаимодействие между его молекулами может не учитываться. Это идеальный (совершенный) газ, для которого справедливо уравнение Менделеева-Клапейрона:
 Влияние на плотность газа температуры и давления р - абсолютное давление; R - удельная газовая постоянная, различная для разных газов, но не зависящая от температуры и давления (для воздуха R =287 Дж/ (кг·К); Т - абсолютная температура. Поведение реальных газов в условиях, далеких от сжижения, лишь незначительно отличается от поведения совершенных газов, и для них в широких пределах можно пользоваться уравнениями состояния совершенных газов.
Влияние на плотность газа температуры и давления р - абсолютное давление; R - удельная газовая постоянная, различная для разных газов, но не зависящая от температуры и давления (для воздуха R =287 Дж/ (кг·К); Т - абсолютная температура. Поведение реальных газов в условиях, далеких от сжижения, лишь незначительно отличается от поведения совершенных газов, и для них в широких пределах можно пользоваться уравнениями состояния совершенных газов.
 Влияние на плотность газа температуры и давления В технических расчетах плотность газа обычно приводят к нормальным физическим условиям: T=20°C; р = 101325 Па. Для воздуха в данных условиях ρ=1, 2 кг/м 3. Плотность воздуха при других условиях определяется по формуле:
Влияние на плотность газа температуры и давления В технических расчетах плотность газа обычно приводят к нормальным физическим условиям: T=20°C; р = 101325 Па. Для воздуха в данных условиях ρ=1, 2 кг/м 3. Плотность воздуха при других условиях определяется по формуле:
 Влияние на плотность газа температуры и давления По данной формуле для изотермического процесса (Т = сonst): Адиабатический процесс – это процесс, протекающий без внешнего теплообмена. Для адиабатического процесса k=ср /сv адиабатическая постоянная газа; ср - теплоемкость, газа при постоянном давлении; сv - то же, при постоянном объеме.
Влияние на плотность газа температуры и давления По данной формуле для изотермического процесса (Т = сonst): Адиабатический процесс – это процесс, протекающий без внешнего теплообмена. Для адиабатического процесса k=ср /сv адиабатическая постоянная газа; ср - теплоемкость, газа при постоянном давлении; сv - то же, при постоянном объеме.
 Влияние на плотность газа температуры и давления Важной характеристикой, определяющей зависимость изменения плотности при изменении давления в движущемся потоке, является скорость распространения звука а. В однородной среде скорость распространения звука определяется из выражения: Для воздуха а= 330 м/с; для углекислого газа 261 м/с.
Влияние на плотность газа температуры и давления Важной характеристикой, определяющей зависимость изменения плотности при изменении давления в движущемся потоке, является скорость распространения звука а. В однородной среде скорость распространения звука определяется из выражения: Для воздуха а= 330 м/с; для углекислого газа 261 м/с.
 Влияние на плотность газа температуры и давления Так как объем газа в большой мере зависит от температуры и давления, выводы, полученные при изучении капельных жидкостей, можно распространять на газы лишь в том случае, если в пределах рассматриваемого явления изменения давления и температуры незначительны. 3 начительные разности давлений, вызывающие существенное изменение плотности газов, могут возникнуть при их движении с большими скоростями. Соотношение между скоростью движения и скоростью звука в ней позволяет судить о необходимости учета сжимаемости в каждом конкретном случае.
Влияние на плотность газа температуры и давления Так как объем газа в большой мере зависит от температуры и давления, выводы, полученные при изучении капельных жидкостей, можно распространять на газы лишь в том случае, если в пределах рассматриваемого явления изменения давления и температуры незначительны. 3 начительные разности давлений, вызывающие существенное изменение плотности газов, могут возникнуть при их движении с большими скоростями. Соотношение между скоростью движения и скоростью звука в ней позволяет судить о необходимости учета сжимаемости в каждом конкретном случае.
 Влияние на плотность газа температуры и давления Если жидкость или газ движется, то для оценки сжимаемости пользуются не абсолютным значением скорости звука, а числом Маха, равным отношению скорости потока к скорости звука. М = ν/а Если число Маха значительно меньше единицы, то капельную жидкость или газ можно считать практически несжимаемым
Влияние на плотность газа температуры и давления Если жидкость или газ движется, то для оценки сжимаемости пользуются не абсолютным значением скорости звука, а числом Маха, равным отношению скорости потока к скорости звука. М = ν/а Если число Маха значительно меньше единицы, то капельную жидкость или газ можно считать практически несжимаемым
 Равновесие газа При малой высоте столба газа его плотность можно считать одинаковой по высоте столба: тогда давление, создаваемое этим столбом, определяют по основному уравнению гидростатики. При большой высоте столба воздуха плотность его в различных точках уже не одинаковая, поэтому уравнение гидростатики в этом случае не применяется.
Равновесие газа При малой высоте столба газа его плотность можно считать одинаковой по высоте столба: тогда давление, создаваемое этим столбом, определяют по основному уравнению гидростатики. При большой высоте столба воздуха плотность его в различных точках уже не одинаковая, поэтому уравнение гидростатики в этом случае не применяется.
 Равновесие газа Рассматривая дифференциальное уравнение давления для случая абсолютного покоя и подставляя в него значение плотности, имеем Для того, чтобы проинтегрировать это уравнение, необходимо знать закон изменения температуры воздуха по высоте столба воздуха. Выразить изменение температуры простой функцией высоты или давления нe представляется возможным, поэтому решение уравнения может быть только приближенным.
Равновесие газа Рассматривая дифференциальное уравнение давления для случая абсолютного покоя и подставляя в него значение плотности, имеем Для того, чтобы проинтегрировать это уравнение, необходимо знать закон изменения температуры воздуха по высоте столба воздуха. Выразить изменение температуры простой функцией высоты или давления нe представляется возможным, поэтому решение уравнения может быть только приближенным.
 Равновесие газа Для отдельных слоев атмосферы с достаточной точностью можно принять, что изменение температуры в зависимости от высоты (а для шахты - от глубины) происходит по линейному закону: Т = Т 0 +αz, где Т и Т 0 - абсолютная температура воздуха соответственно на высоте (глубине) z и на поверхности земли α- температурный градиент, характеризующий изменение температуры воздуха при увеличении высоты(-α) или глубины (+α) на 1 м, К/м.
Равновесие газа Для отдельных слоев атмосферы с достаточной точностью можно принять, что изменение температуры в зависимости от высоты (а для шахты - от глубины) происходит по линейному закону: Т = Т 0 +αz, где Т и Т 0 - абсолютная температура воздуха соответственно на высоте (глубине) z и на поверхности земли α- температурный градиент, характеризующий изменение температуры воздуха при увеличении высоты(-α) или глубины (+α) на 1 м, К/м.
 Равновесие газа Значения коэффициента α на разных участках по высоте в атмосфере или по глубине в шахте различные. Кроме того, они зависят также от метеорологических условий, времени года, и других факторов. При определении температуры в пределах тропосферы (т. е. до 11000 м) обычно принимают α = 0, 0065 K/м, для глубоких шахт среднее значение α принимают, равным 0, 004÷ 0, 006 K/м для сухих стволов, для мокрых - 0, 01.
Равновесие газа Значения коэффициента α на разных участках по высоте в атмосфере или по глубине в шахте различные. Кроме того, они зависят также от метеорологических условий, времени года, и других факторов. При определении температуры в пределах тропосферы (т. е. до 11000 м) обычно принимают α = 0, 0065 K/м, для глубоких шахт среднее значение α принимают, равным 0, 004÷ 0, 006 K/м для сухих стволов, для мокрых - 0, 01.
 Равновесие газа Подставляя в дифференциальное уравнение давления формулу изменения температуры, и интегрируя его, получаем Уравнение решается относительно Н, заменяя натуральные логарифмы десятичными, α - его значением из уравнения через температуру, R - значением для воздуха, равным 287 Дж/ (кг·К); и подставляем g = 9, 81 м/с2.
Равновесие газа Подставляя в дифференциальное уравнение давления формулу изменения температуры, и интегрируя его, получаем Уравнение решается относительно Н, заменяя натуральные логарифмы десятичными, α - его значением из уравнения через температуру, R - значением для воздуха, равным 287 Дж/ (кг·К); и подставляем g = 9, 81 м/с2.
 Равновесие газа В результате этих действий получается барометрическая формула Н = 29, 3(Т-Т 0)(lg p/p 0)/(lg. T 0/T), а также формула для определения давления где n определяется по формуле
Равновесие газа В результате этих действий получается барометрическая формула Н = 29, 3(Т-Т 0)(lg p/p 0)/(lg. T 0/T), а также формула для определения давления где n определяется по формуле
 УСТАНОВИВШЕЕСЯ ДВИЖЕНИЕ ГАЗОВ В ТРУБАХ Закон сохранения энергии в механической форме для элемента длины dx круглой трубы диаметром d при условии, что изменение геодезической высоты мало по сравнению с изменением пьезометрического напора, имеет вид Здесь потери удельной энергии на трение взяты по формуле Дарси-Вейсбаха Для политропического процесса с постоянным показателем политропы n = const и в предположении, что λ= const после интегрирования получается закон распределения давления вдоль газопровода
УСТАНОВИВШЕЕСЯ ДВИЖЕНИЕ ГАЗОВ В ТРУБАХ Закон сохранения энергии в механической форме для элемента длины dx круглой трубы диаметром d при условии, что изменение геодезической высоты мало по сравнению с изменением пьезометрического напора, имеет вид Здесь потери удельной энергии на трение взяты по формуле Дарси-Вейсбаха Для политропического процесса с постоянным показателем политропы n = const и в предположении, что λ= const после интегрирования получается закон распределения давления вдоль газопровода
 УСТАНОВИВШЕЕСЯ ДВИЖЕНИЕ ГАЗОВ В ТРУБАХ Для магистральных газопроводов поэтому для массового расхода можно записать формулу
УСТАНОВИВШЕЕСЯ ДВИЖЕНИЕ ГАЗОВ В ТРУБАХ Для магистральных газопроводов поэтому для массового расхода можно записать формулу
 УСТАНОВИВШЕЕСЯ ДВИЖЕНИЕ ГАЗОВ В ТРУБАХ М ω При n = 1 формулы справедливы для установившегося изотермического течения газа. Коэффициент гидравлического сопротивления λ для газа в зависимости от числа Рейнольдса можно вычислить по формулам, используемым при течении жидкости.
УСТАНОВИВШЕЕСЯ ДВИЖЕНИЕ ГАЗОВ В ТРУБАХ М ω При n = 1 формулы справедливы для установившегося изотермического течения газа. Коэффициент гидравлического сопротивления λ для газа в зависимости от числа Рейнольдса можно вычислить по формулам, используемым при течении жидкости.
 При движении реальных углеводородных газов для изотермического процесса используется уравнение состояния где коэффициент сжимаемости z природных углеводородных газов определяется по экспериментальным кривым или аналитически - по приближенным уравнениям состояния.
При движении реальных углеводородных газов для изотермического процесса используется уравнение состояния где коэффициент сжимаемости z природных углеводородных газов определяется по экспериментальным кривым или аналитически - по приближенным уравнениям состояния.
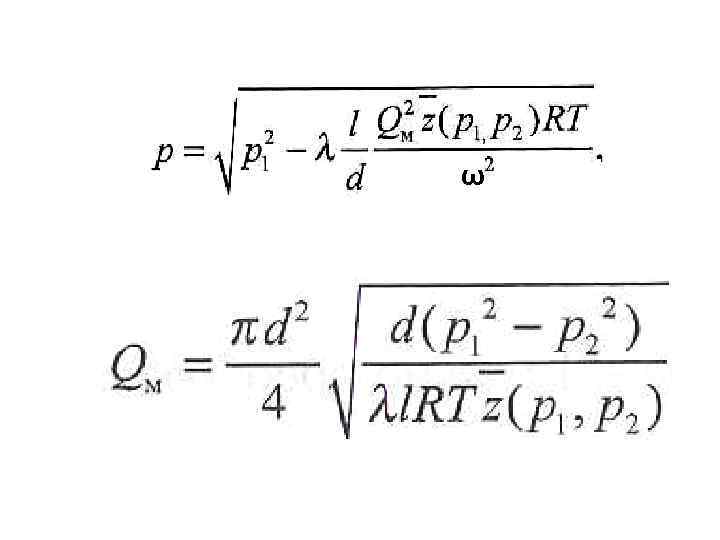 ω
ω


