Элементы IV группы периодической системы.ppt
- Количество слайдов: 24
Элементы IV группы периодической системы

Общая характеристика элементов главной подгруппы IV группы • Общая электронная формула. . . ns 2 p 2. Элементы имеют четыре валентных электрона. В своих соединениях могут проявлять степени окисления от +4 до -4. В подгруппе наблюдается резкое изменение свойств элементов: углерод и кремний типичные неметаллы, германий - полуметалл, олово и свинец – металлы. С возрастанием радиуса атома от углерода к свинцу металлические свойства усиливаются, и более характерной становится низшая степень окисления. • Для C, Si, Ge характерной является степень окисления +4. Для Sn и Pb +2. Устойчивые водородные соединения имеет только углерод, для свинца водородные соединения неизвестны.

Углерод Природные соединения Входит в состав многих минералов, органических соединений и встречается в свободном состоянии (алмаз, графит, уголь). • Известны четыре аллотропные модификации углерода: алмаз, графит, карбин, фуллерен C 60. Его следующим • устойчивым гомологом является C 70, за которым следуют C 76, C 78 , C 82, C 84, C 90, C 94, C 96 и т. д C 540. В основе строения их молекул лежит одно из следствий теоремы Эйлера, которое говорит о том, что для выстилания сферической поверхности необходимо n шестиугольников и 12 пятиугольников, за исключением n = 1. • Графит – черный, мягкий • Алмаз – бесцветный, прозрачный, очень твердый. • Алмаз имеет тетраэдрическую кристаллическую решетку, кристаллическая решетка графита – многоплоскостная структура. • Мелкодисперсный графит (сажа) носит название аморфный углерод. Из графита так же можно получить алмаз путем нагревания графита до 1500 – 2000 С под давлением до 500 тыс. атм.


Химические свойства • 1. Углерод достаточно инертен. При нагревании до 800 – 900 С вступает в реакции с неметаллами и металлами: • 2 C + N 2 = C 2 N 2 (циан или дициан) • C + Si = Si. C (карборунд); • C + O 2 = CO 2 • 3 C + 4 Al = Al 4 C 3 (карбид алюминия) • C + 2 S = CS 2 (сероуглерод) • 2. С кислородом углерод образует два оксида (CO и CO 2). СО - оксид двухвалентного углерода (угарный газ): без цвета и запаха, ядовит, получается при неполном сгорании угля. В лабораторных условиях можно получить обезвоживанием муравьиной кислоты серной кислотой.

• СО – хороший восстановитель и используется для получения металлов из оксидов: • Cu. O + CO = Cu + CO 2 • СО легко вступает в реакции присоединения: • CO + Cl 2 = COCl 2 (фосген) • CO + S = COS (тиооксид углерода) • Молекулы СО – могут выступать в роли лигандов в карбонильных комплексах: • Ni + 4 CO = [Ni(CO)4] • Карбонильные комплексы - ядовитые жидкости; широко используются для получения чистых металлов.

• При температуре 1000 С с аммиаком образует карбамид (мочевина): • СO 2 + 2 NH 3 = CO(NH 2)2 + H 2 O + СО 2 • СO 2 является кислотным оксидом угольной кислоты: • CO 2 + H 2 O = H 2 CO 3 кислота очень слабая и нестойкая. • Кислые соли (гидрокарбонаты) можно получить по реакции: • Ca. CO 3 + CO 2 + H 2 O = Ca(HCO 3)2 • Соли (кроме солей щелочных металлов) угольной кислоты термически нестойки: • Zn. CO 3 = Zn. O + CO 2

• 3. При пропускании через раскаленный уголь паров серы образуется маслянистая жидкость сероуглерод CS 2 • CS 2 - является ангидридом тиоугольной кислоты, которая получается косвенным путем: • CS 2 + Na 2 S = Na 2 CS 3 • Na 2 CS 3 + 2 HCl = H 2 CS 3 + 2 Na. Cl • Эта кислота является исходным веществом для получения монотиоугольной кислоты H 2 CO 2 S и дитиоугольной кислоты H 2 CO 2 S 2, которые используются для получения искусственного шелка. • 4. С азотом углерод образует дициан, газ с запахом миндаля, хорошо растворимый в воде: • 2 C + N 2 = (CN)2; • (CN)2 + 4 H 2 O = (NH 4)2 C 2 O 4 • При взаимодействии дициана со щелочами образуются два ряда солей цианиды и цианаты: • (CN)2 + 2 KOH = KCN + KNCO + H 2 O • KCN – соль цианистоводородной кислоты (цианид калия), KNCO – соль циановой кислоты (цианат калия).
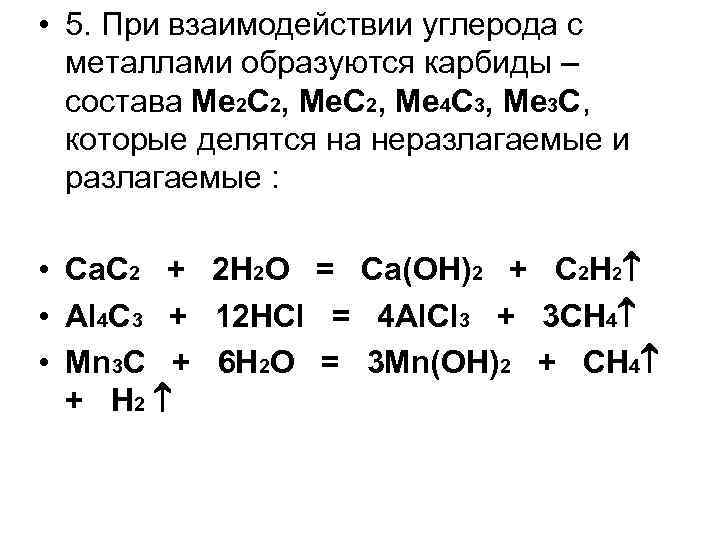
• 5. При взаимодействии углерода с металлами образуются карбиды – состава Me 2 C 2, Me 4 C 3, Me 3 C, которые делятся на неразлагаемые и разлагаемые : • Ca. C 2 + 2 H 2 O = Ca(OH)2 + C 2 H 2 • Al 4 C 3 + 12 HCl = 4 Al. Cl 3 + 3 CH 4 • Mn 3 C + 6 H 2 O = 3 Mn(OH)2 + CH 4 + H 2

ПРИМЕНЕНИЕ • Смешанные галогениды CCl 2 F 2, CCl 3 F, CBr 3 F называются фреонами и используются в качестве хладагентов в холодильной технике. • Применение СО 2: как инертная атмосфера при сварке металлов; в пищевой промышленности. Na. HCO 3, NH 4 HCO 3 – в хлебопекарном производстве. Na 2 CO 3, Ca. CO 3 - в производстве моющих средств, стекла.

Кремний • Кремний в природе содержится во многих минералах в виде оксида Si. O 2, из которого элементарный кремний можно получить восстановлением магнием или углеродом. В чистом виде кремний тверд, хрупок, имеет алмазоподобную структуру. Различают аморфный и кристаллический кремний.

Химические свойства • 1. Кремний очень инертен. При высоких температурах взаимодействует с фтором, углеродом, некоторыми металлами: • Si + 2 F 2 = Si. F 4; • Si + C = Si. C (карборунд); • Si + 2 Mg = Mg 2 Si (силицид). • 2. Хорошо растворяется в щелочах и плавиковой кислоте: • Si + 4 Na. OH = Na 4 Si. O 4 + 2 H 2 • Si + 4 HF = Si. F 4 + 2 H 2 • Si. F 4 + 2 HF = H 2[Si. F 6] • 3. Оксид кремния полимер, Si. O 2 образует многочисленные поликремниевые кислоты. • Растворяется в плавиковой кислоте и щелочах: • Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O

• 4. Непосредственно с водородом кремний не взаимодействует, поэтому водородные соединения (силаны) получают из силицидов: • Mg 2 Si + 4 HCl = 2 Mg. Cl 2 + Si. H 4 (моносилан) • Силаны могут быть различного состава Si 2 H 6, Si 3 H 8, Si 6 H 14 , . . . Это сильные восстановители, химически очень активны, на воздухе самовоспламеняются: • Si. H 4 + 2 O 2 = Si. O 2 + 2 H 2 O

Применение • Si. O 2 - твердое вещество с температурой плавления 1715 С. Идет на изготовление химической посуды, кварцевых ламп и т. п. • Na 2 Si. O 3 – силикат натрия (жидкое стекло, конторский клей) • Кристаллический кремний - подложка, основа полупроводниковых приборов. • При прокаливании кремневой кислоты образуется Si. O 2 в виде аморфного соединения, носит название “силикагель” и используется в качестве поглотителя влаги.

Германий, олово, свинец. Природные соединения • Sn. O 2 – кассеперит, • Pb. S – свинцовый блеск. • Германий собственных руд не имеет, встречается с рудами цинка, олова, свинца. • Олово и свинец получают пирометаллургическим способом: олово - восстановлением углеродом из оксида, • свинец - обжигом сульфида в кислороде, и восстановлением оксидом углерода (II) до металла. • Германий получают более сложным способом: вначале получают четыреххлористый германий Ge. Cl 4 • Ge. Cl 4 + H 2 O = Ge. O 2 + 4 HCl • Ge. O 2 + 2 H 2 = Ge + 2 H 2 O

• Германий и олово – белые блестящие металлы на воздухе окисляются слабо. Свинец – серого цвета за счет пленки оксида. Олово полиморфно. • При температуре > +13 С устойчива βмодификация. С понижением температуры βолово переходит в α- модификацию. • Этот переход начинается при +13 С и очень быстро протекает при -33 С, в результате олово превращается в порошок. Это явление носит название “оловянная чума”.

Химические свойства • • • 1. При нагревании реагируют с неметаллами. 2 Pb + O 2 = 2 Pb. O; Ge + 2 S = Ge. S 2; Sn + 2 Cl 2 = Sn. Cl 4 3. Германий и олово с водой не взаимодействуют. Свинец медленно растворяется в воде: 2 Pb + O 2 + 2 H 2 O = 2 Pb(OH)2 4. В ряду активности Ge стоит между Cu и Ag, т. е. после водорода, а Sn и Pb до водорода. Олово слабо вытесняет водород: Sn + H 2 SO 4 (pазб) = Sn. SO 4 + H 2 Аналогичные реакции со свинцом практически не идут, т. к. Pb. Cl 2 и Pb. SO 4 плохо растворимы. • •

• Свинец и олово взаимодействуют аналогично (в концентрированной cвинец пассивируется): • 3 Pb + 8 HNO 3 (разб) = 3 Pb(NO 3)2 + 2 NO + 4 H 2 O • Олово и германий взаимодействуют с концентрированной азотной кислотой: • Sn + 4 HNO 3 = H 2 Sn. O 3 + 4 NO 2 + H 2 O • 5. Все три элемента взаимодействуют со щелочами (германий в присутствии окислителя): • Sn + 2 Na. OH + 2 H 2 O = Na 2[Sn(OH)4] + H 2 • Ge + 2 Na. OH + 2 H 2 O 2 = Na 2[Ge(OH)6]

Применение • Ge – как полупроводниковый материал, • Sn и Pb в основном в виде сплавов (бронзы, баббиты), • Sn – в качестве защитного покрытия от коррозии, • Pb 3 O 4 – как краситель, • Pb(C 2 H 5)4 (тетраэтилсвинец) – добавка в бензин (антидетонатор).

Элементы побочной подгруппы IV группы • -. В природе встречаются в виде минералов: • Fe. Ti. O 3 – ильменит, Ti. O 2 – рутил, Zr. Si. O 4 – циркон. Hf своих руд не имеет, встречается в рудах циркония, железа, марганца. • Ti получают пирометаллургическим способом из Ti. Cl 4 или Ti. O 2: • Ti. O 2 + 2 Mg = Ti + 2 Mg. O • Очистка титана от примесей обычно проводится газотранспортным методом: • Ti + 2 J 2 → Ti. J 4 → Ti + 2 J 2 • Цирконий и гафний получают электролизом расплавов их солей.

• Чистые металлы вязкие, • ударопрочные, • с высокими температурами плавления (Ti – 1700 С, Zr – 1900 С, Hf – 2200 С). • Ti относится к легким металлам, плотность его 4, 5 г/см 3. • Химически наиболее активен титан. Цирконий и гафний менее активны.

Химические свойства • 1. Характерные степени окисления в соединениях для Ti +4, +3; для Zr и Hf +4. При нагревании все три элемента активно взаимодействуют с различными неметаллами: • Zr + C = Zr. C; • Hf + 2 S = Hf. S 2; • 2 Ti + N 2 = 2 Ti. N; • Ti + 2 Cl 2 = Ti. Cl 4 • 2. С кислотами Ti, Zr и Hf взаимодействуют плохо. Лишь титан растворяется в азотной кислоте: • Ti + 4 HNO 3 = H 2 Ti. O 3 + 4 NO 2 + H 2 O

• Цирконий и гафний взаимодействуют только с “царской водкой”: • 3 Hf + 18 HCl + 4 HNO 3 = 3 H 2[Hf. Cl 6] + 4 NO + 8 H 2 O • 3. Оксиды Ti. O 2 – амфотерный, Zr. O 2 – слабоамфотерный, Hf. O 2 – основный. • 4. При взаимодействии с серной кислотой оксиды образуют соответствующие сульфаты, которые быстро гидролизуются до сульфата титанила, цирконила, гафнила: • Ti. O 2 + 2 H 2 SO 4 = Ti(SO 4)2 + 2 H 2 O • Ti(SO 4)2 + H 2 O = Ti. OSO 4 + H 2 SO 4 • У амфотерного Ti. O 2 более выражена кислотная функция. Соответствующая ему метатитановая кислота H 2 Ti. O 3 существует в двух модификациях α и β. Общая формула титановых кислот x. Ti. O 2 · y. H 2 O.

Применение • Титан – третий по значимости (после железа и алюминия) конструкционный материал. Титан применяется в виде сплавов в корабле, ракето-, машиностроении. Цирконий и гафний применяются в ядерном реакторостроении (цирконий для оболочек тепловыделяющих элементов, гафний – регулирующие стержни для поглощения нейтронов при работе реактора).
Элементы IV группы периодической системы.ppt