 Элементы IV А группы
Элементы IV А группы
 C – углерод Si – кремний Ge – германий Sn – олово Pb - свинец
C – углерод Si – кремний Ge – германий Sn – олово Pb - свинец
 Нахождение в природе
Нахождение в природе
 Углерод (карбогениум) C Кларк 0, 15 % В виде простого вещества – алмаз, графит В виде сложных веществ • Уголь, нефть, природный газ • Известняк и мрамор Сa. CO 3 • Магнезит Mg. CO 3
Углерод (карбогениум) C Кларк 0, 15 % В виде простого вещества – алмаз, графит В виде сложных веществ • Уголь, нефть, природный газ • Известняк и мрамор Сa. CO 3 • Магнезит Mg. CO 3
 Кремний (силициум) Si от лат. silex — кремень, твердый. «кремний» греч. κρημνός — «утес, гора» .
Кремний (силициум) Si от лат. silex — кремень, твердый. «кремний» греч. κρημνός — «утес, гора» .
 Кларк 20% молек. или 27% масс. Только в связанном виде. (Si. O 2)n - кремнезем, кварц, горный хрусталь
Кларк 20% молек. или 27% масс. Только в связанном виде. (Si. O 2)n - кремнезем, кварц, горный хрусталь

 • аметист, агат, яшма, топаз – разновидности кварца с примесями
• аметист, агат, яшма, топаз – разновидности кварца с примесями
 Полевые шпаты – M(Al. Si 3 O 8) Слюды - MЭ(Al. Si 3 O 8) M–Ca, Na, Li Э–Al, Fe
Полевые шпаты – M(Al. Si 3 O 8) Слюды - MЭ(Al. Si 3 O 8) M–Ca, Na, Li Э–Al, Fe
 Глины Al 2 O 3. 2 Si. O 2. 2 H 2 O КАОЛИН
Глины Al 2 O 3. 2 Si. O 2. 2 H 2 O КАОЛИН
 В живых существах кремний накапливается в морских звездах (радиоляриях) и губках
В живых существах кремний накапливается в морских звездах (радиоляриях) и губках
 Германий Кларк 2. 10 -3 Рассеянный. Аргиродит 4 Ag 2 S. Ge. S 2 Германит 3 Cu 2 S. Fe. S. 2 Ge. S 2
Германий Кларк 2. 10 -3 Рассеянный. Аргиродит 4 Ag 2 S. Ge. S 2 Германит 3 Cu 2 S. Fe. S. 2 Ge. S 2
 Олово (Станум) Кларк 7. 10 -3 Sn Касситерит (оловянный камень) Sn. O 2 Станнин (оловянный колчедан) Cu 2 S. Fe. S. Sn. S 2
Олово (Станум) Кларк 7. 10 -3 Sn Касситерит (оловянный камень) Sn. O 2 Станнин (оловянный колчедан) Cu 2 S. Fe. S. Sn. S 2
 Свинец (Плюмбум) Кларк 1, 6. 10 -3 Галенит (свинцовый блеск) Pb. S Англезит Pb. SO 4 Церуссит Pb. CO 3
Свинец (Плюмбум) Кларк 1, 6. 10 -3 Галенит (свинцовый блеск) Pb. S Англезит Pb. SO 4 Церуссит Pb. CO 3
 Физические свойства простых веществ
Физические свойства простых веществ
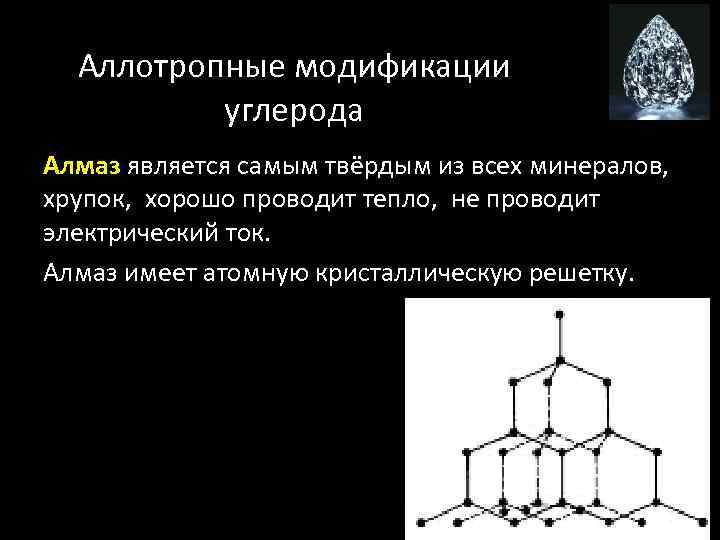 Аллотропные модификации углерода Алмаз является самым твёрдым из всех минералов, хрупок, хорошо проводит тепло, не проводит электрический ток. Алмаз имеет атомную кристаллическую решетку.
Аллотропные модификации углерода Алмаз является самым твёрдым из всех минералов, хрупок, хорошо проводит тепло, не проводит электрический ток. Алмаз имеет атомную кристаллическую решетку.
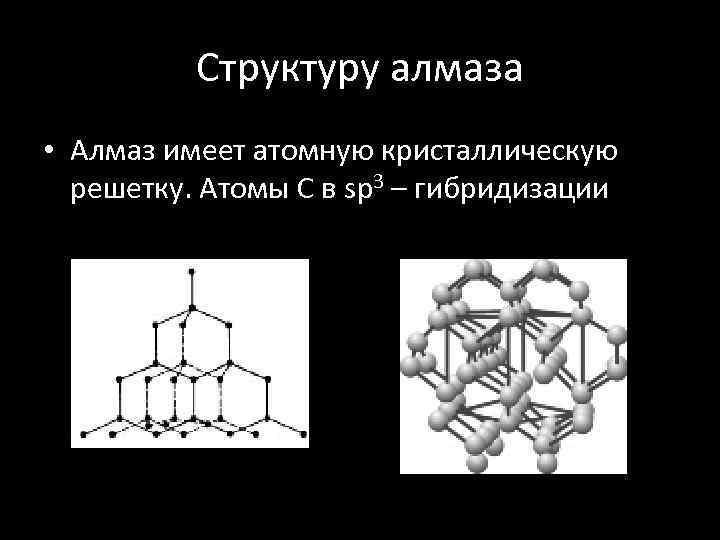 Структуру алмаза • Алмаз имеет атомную кристаллическую решетку. Атомы С в sp 3 – гибридизации
Структуру алмаза • Алмаз имеет атомную кристаллическую решетку. Атомы С в sp 3 – гибридизации
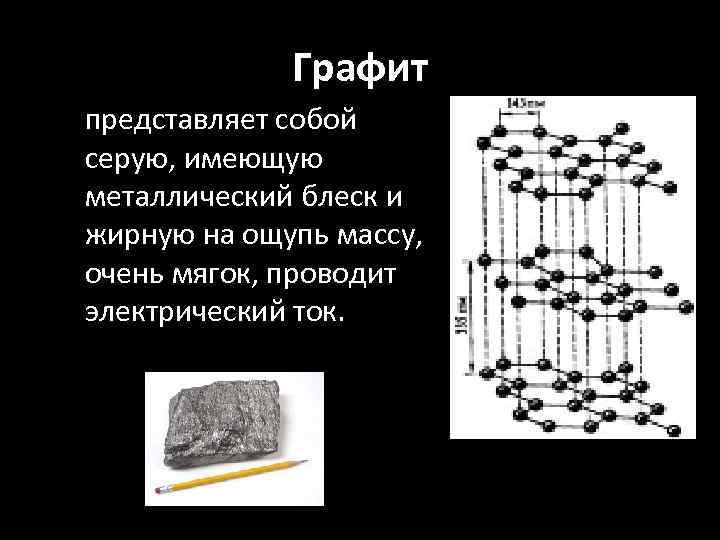 Графит представляет собой серую, имеющую металлический блеск и жирную на ощупь массу, очень мягок, проводит электрический ток.
Графит представляет собой серую, имеющую металлический блеск и жирную на ощупь массу, очень мягок, проводит электрический ток.
 Аморфный углерод • По свойствам довольно близок к графиту. Плотность 1, 8 -2, 1 г/см 3. • Строго не аморфен, а мелкокристаллический. • У некоторых разновидностей “аморфного” углерода очень сильно выражена способность к адсорбции • Основные разновидности - древесный уголь, животный уголь и сажа
Аморфный углерод • По свойствам довольно близок к графиту. Плотность 1, 8 -2, 1 г/см 3. • Строго не аморфен, а мелкокристаллический. • У некоторых разновидностей “аморфного” углерода очень сильно выражена способность к адсорбции • Основные разновидности - древесный уголь, животный уголь и сажа
 карбин • Карбин линейная форма полимеров типа ( С С )n — полиинов и ( С С )n — кумуленов.
карбин • Карбин линейная форма полимеров типа ( С С )n — полиинов и ( С С )n — кумуленов.
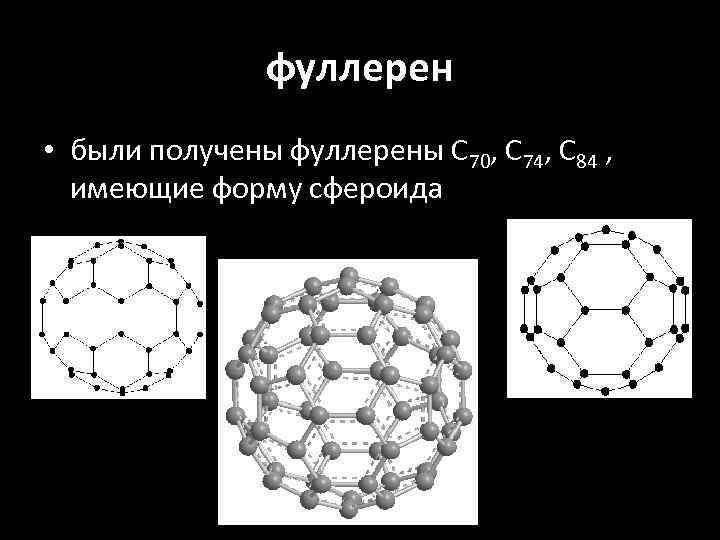 фуллерен • были получены фуллерены С 70, С 74, С 84 , имеющие форму сфероида
фуллерен • были получены фуллерены С 70, С 74, С 84 , имеющие форму сфероида
 Аморфный углерод По свойствам довольно близок к графиту. Строго не аморфен, а мелкокристаллический. У некоторых разновидностей “аморфного” углерода очень сильно выражена способность к адсорбции Основные разновидности - древесный уголь, животный уголь и сажа
Аморфный углерод По свойствам довольно близок к графиту. Строго не аморфен, а мелкокристаллический. У некоторых разновидностей “аморфного” углерода очень сильно выражена способность к адсорбции Основные разновидности - древесный уголь, животный уголь и сажа
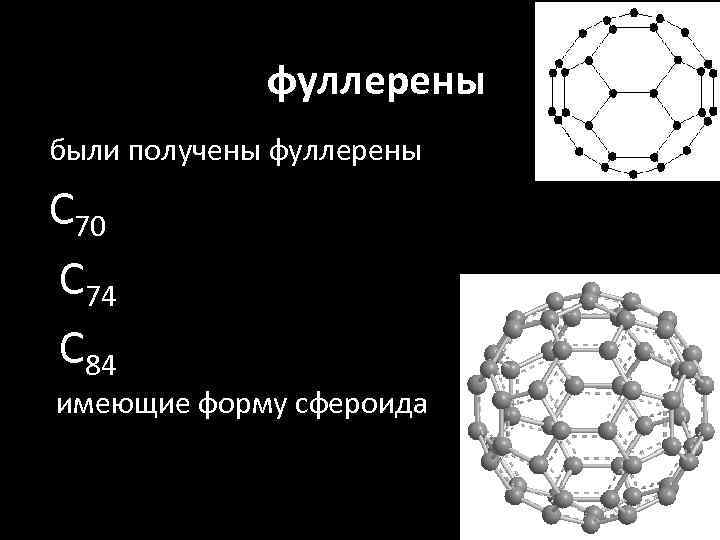 фуллерены были получены фуллерены С 70 С 74 С 84 имеющие форму сфероида
фуллерены были получены фуллерены С 70 С 74 С 84 имеющие форму сфероида
 Si При н. у. устойчива кристаллическая модификация серо-стального цвета. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Прозрачен к инфракрасному излучению. Полупроводник Аморфный Si – порошок серого цвета
Si При н. у. устойчива кристаллическая модификация серо-стального цвета. Кремний хрупок, только при нагревании выше 800 °C он становится пластичным веществом. Прозрачен к инфракрасному излучению. Полупроводник Аморфный Si – порошок серого цвета
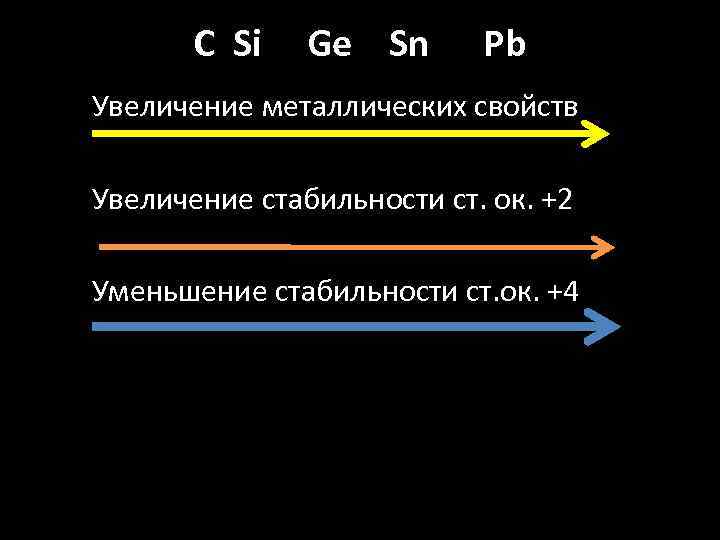 С Si Ge Sn Pb Увеличение металлических свойств Увеличение стабильности ст. ок. +2 Уменьшение стабильности ст. ок. +4
С Si Ge Sn Pb Увеличение металлических свойств Увеличение стабильности ст. ок. +2 Уменьшение стабильности ст. ок. +4
 Химические свойства
Химические свойства
 Углерод В обычных условиях инертен. При комнатной температуре вступает во взаимодействие лишь со фтором. С + 2 F 2 =CF 4 При высоких температурах реагирует с металлами и неметаллами.
Углерод В обычных условиях инертен. При комнатной температуре вступает во взаимодействие лишь со фтором. С + 2 F 2 =CF 4 При высоких температурах реагирует с металлами и неметаллами.
 •
•
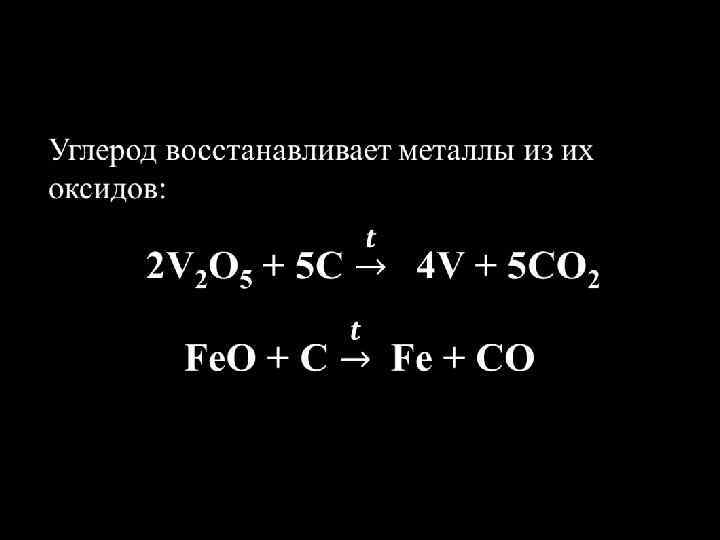 •
•
 СОЕДИНЕНИЯ УГЛЕРОДА
СОЕДИНЕНИЯ УГЛЕРОДА
 Соединения углерода с металлами - карбиды • С металлами углерод вступает во взаимодействие лишь при высоких температурах, образуя карбиды. • По отношению к воде и разбавленным кислотам карбиды распадаются на две большие группы: разлагаемые этими веществами и не разлагаемые ими.
Соединения углерода с металлами - карбиды • С металлами углерод вступает во взаимодействие лишь при высоких температурах, образуя карбиды. • По отношению к воде и разбавленным кислотам карбиды распадаются на две большие группы: разлагаемые этими веществами и не разлагаемые ими.
 Карбиды первой группы в зависимости от химической природы летучих продуктов их разложения можно в свою очередь подразделить на: а) ацетилениды; б) метаниды в) дающие смесь различных продуктов.
Карбиды первой группы в зависимости от химической природы летучих продуктов их разложения можно в свою очередь подразделить на: а) ацетилениды; б) метаниды в) дающие смесь различных продуктов.
 ацетилениды • Их образуют главным образом наиболее активные металлы. • Общая формула карбидов этой подгруппы имеет вид М 2 С 2 для одновалентного металла, • МС 2 — для двухвалентного и • М 2 С 6 — для трёхвалентного. При взаимодействии их с водой, образуется ацетилен Ca. C 2+2 H 2 O = Ca(OH)2 + C 2 H 2
ацетилениды • Их образуют главным образом наиболее активные металлы. • Общая формула карбидов этой подгруппы имеет вид М 2 С 2 для одновалентного металла, • МС 2 — для двухвалентного и • М 2 С 6 — для трёхвалентного. При взаимодействии их с водой, образуется ацетилен Ca. C 2+2 H 2 O = Ca(OH)2 + C 2 H 2
 метаниды • Известны они только для бериллия и алюминия, причём в обоих случаях простейшие формулы (Ве 2 С и Аl 4 C 3) отвечают обычным валентностям элементов. • При действии горячей воды или разбавленных кислот оба карбида разлагаются с выделением чистого метана: Al 4 C 3 + 12 H 2 O = 4 Al(OH)3 + 3 CH 4.
метаниды • Известны они только для бериллия и алюминия, причём в обоих случаях простейшие формулы (Ве 2 С и Аl 4 C 3) отвечают обычным валентностям элементов. • При действии горячей воды или разбавленных кислот оба карбида разлагаются с выделением чистого метана: Al 4 C 3 + 12 H 2 O = 4 Al(OH)3 + 3 CH 4.
 • Карбиды третьего типа, дающие при разложении смесь различных продуктов, образуют d-металлы. • Они реагирует с водой преимущественно по уравнению: Mn 3 C + 6 H 2 O = 3 Mn(OH)2 + CH 4 + H 2 Одновременно образуются также и другие газообразные углеводороды.
• Карбиды третьего типа, дающие при разложении смесь различных продуктов, образуют d-металлы. • Они реагирует с водой преимущественно по уравнению: Mn 3 C + 6 H 2 O = 3 Mn(OH)2 + CH 4 + H 2 Одновременно образуются также и другие газообразные углеводороды.
 • Многие соединения этого типа принадлежат к наиболее тугоплавким из всех известных веществ. • Например, WC (т. пл. 2600 С с разл. ), W 2 C (2700), VC (2800), Nb. C (3500), Ta. C (3900 С). • Сплавы на основе карбида хрома весьма стойки к коррозии и износу. • Сцементированный никелем карбид тантала под названием “рамет” находит применение в качестве сверхтвёрдого сплава, а карбиды Nb и Ta — в ракетной технике.
• Многие соединения этого типа принадлежат к наиболее тугоплавким из всех известных веществ. • Например, WC (т. пл. 2600 С с разл. ), W 2 C (2700), VC (2800), Nb. C (3500), Ta. C (3900 С). • Сплавы на основе карбида хрома весьма стойки к коррозии и износу. • Сцементированный никелем карбид тантала под названием “рамет” находит применение в качестве сверхтвёрдого сплава, а карбиды Nb и Ta — в ракетной технике.
 Разлагаемые карбиды Карбиды первой группы в зависимости от химической природы летучих продуктов их разложения можно в свою очередь подразделить на: а) ацетилениды; б) метаниды в) дающие смесь различных продуктов.
Разлагаемые карбиды Карбиды первой группы в зависимости от химической природы летучих продуктов их разложения можно в свою очередь подразделить на: а) ацетилениды; б) метаниды в) дающие смесь различных продуктов.
 Некоторые карбиды d-элементов - металлиды. Проводят электрический ток, тугоплавкие, твердые Они являются соединениями переменного состава, . Например: W 2 C (Tпл= 2700 o. C ), VC (Tпл= 2800 o. C), Nb. C (Tпл= 3500 o. C), Ta. C (Tпл= 3900 С).
Некоторые карбиды d-элементов - металлиды. Проводят электрический ток, тугоплавкие, твердые Они являются соединениями переменного состава, . Например: W 2 C (Tпл= 2700 o. C ), VC (Tпл= 2800 o. C), Nb. C (Tпл= 3500 o. C), Ta. C (Tпл= 3900 С).
 Оксиды углерода Углерод с кислородом образует три оксида СO CO 2 C 3 O 2
Оксиды углерода Углерод с кислородом образует три оксида СO CO 2 C 3 O 2
 Оксид углерода (II) – угарный газ СO бесцветный, не имеющий запаха газ, малорастворимый в воде и химически с ней не взаимодействующий. Не реагирует со щелочами и кислотами. Несолеобразующий. Чрезвычайно ядовит.
Оксид углерода (II) – угарный газ СO бесцветный, не имеющий запаха газ, малорастворимый в воде и химически с ней не взаимодействующий. Не реагирует со щелочами и кислотами. Несолеобразующий. Чрезвычайно ядовит.
 Обнаружить угарный газ можно при помощи реакции: Pd. Cl 2 + H 2 O + CO = CO 2 + 2 HCl + Pd .
Обнаружить угарный газ можно при помощи реакции: Pd. Cl 2 + H 2 O + CO = CO 2 + 2 HCl + Pd .
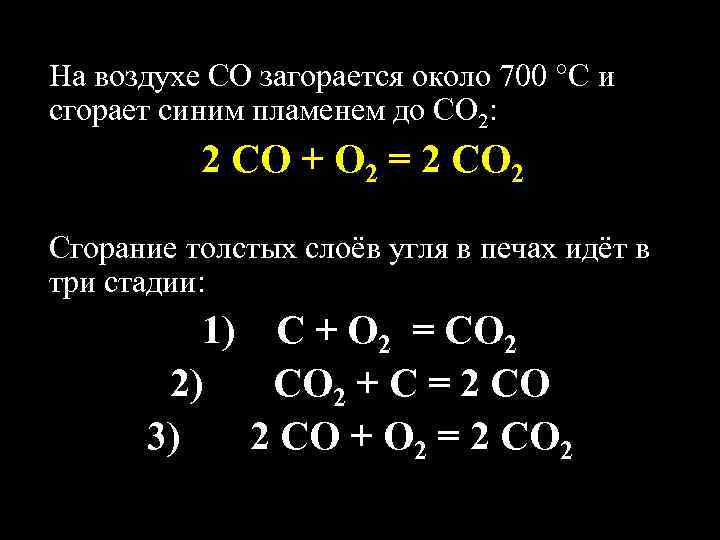 На воздухе СО загорается около 700 С и сгорает синим пламенем до СО 2: 2 СО + О 2 = 2 СО 2 Сгорание толстых слоёв угля в печах идёт в три стадии: 1) С + О 2 = СО 2 2) СО 2 + С = 2 СО 3) 2 СО + О 2 = 2 СО 2
На воздухе СО загорается около 700 С и сгорает синим пламенем до СО 2: 2 СО + О 2 = 2 СО 2 Сгорание толстых слоёв угля в печах идёт в три стадии: 1) С + О 2 = СО 2 2) СО 2 + С = 2 СО 3) 2 СО + О 2 = 2 СО 2
 оксид углерода (III) С 3 О 2 • Это бесцветный газ с резким запахом Строение его молекулы отвечает линейной структуре О=С=С=С=О • При нагревании С 3 О 2 легко полимеризуется с образованием красного полимера и почти так же легко разлагается С 3 О 2 = СО 2 + С 2 (с дальнейшим переходом молекул углерода в графит). На воздухе он горит синим пламенем с выделением копоти, а при взаимодействии с водой даёт малоновую кислоту. С 3 О 2+H 2 O= CH 2(СOOH)2
оксид углерода (III) С 3 О 2 • Это бесцветный газ с резким запахом Строение его молекулы отвечает линейной структуре О=С=С=С=О • При нагревании С 3 О 2 легко полимеризуется с образованием красного полимера и почти так же легко разлагается С 3 О 2 = СО 2 + С 2 (с дальнейшим переходом молекул углерода в графит). На воздухе он горит синим пламенем с выделением копоти, а при взаимодействии с водой даёт малоновую кислоту. С 3 О 2+H 2 O= CH 2(СOOH)2
 Оксид углерода (IV) – CO 2 углекислый газ • б|ц, со слегка кисловатым запахом и вкусом. • Под давлением около 60 атм сжижается уже при обычных температурах в бесцветную жидкость. • При сильном охлаждении он застывает в белую снегообразную массу “сухой лёд” • Атмосфера Земли содержит в среднем 0, 03% СО 2 по объёму.
Оксид углерода (IV) – CO 2 углекислый газ • б|ц, со слегка кисловатым запахом и вкусом. • Под давлением около 60 атм сжижается уже при обычных температурах в бесцветную жидкость. • При сильном охлаждении он застывает в белую снегообразную массу “сухой лёд” • Атмосфера Земли содержит в среднем 0, 03% СО 2 по объёму.
 • Углекислый газ не поддерживает горения обычных видов топлива. • Однако, вещества, сродство которых к кислороду значительно больше, чем у углерода, горят в углекислом газе. СО 2 + 2 Mg = 2 Mg. O + C
• Углекислый газ не поддерживает горения обычных видов топлива. • Однако, вещества, сродство которых к кислороду значительно больше, чем у углерода, горят в углекислом газе. СО 2 + 2 Mg = 2 Mg. O + C
 Термически устойчив. Только при Т более 2000 0 С начинает разлагаться 2 СO 2 = 2 СO + O 2
Термически устойчив. Только при Т более 2000 0 С начинает разлагаться 2 СO 2 = 2 СO + O 2
 • В воде СО 2 растворим хорошо • При растворении углекислого газа происходит его частичное взаимодействие с водой, ведущее к образованию угольной кислоты: Н 2 О + СО 2 Н 2 СО 3
• В воде СО 2 растворим хорошо • При растворении углекислого газа происходит его частичное взаимодействие с водой, ведущее к образованию угольной кислоты: Н 2 О + СО 2 Н 2 СО 3
 Угольная кислота Н 2 СО 3 слабая кислота Н 2 СО 3 Н+ + НСО 3 - Ка. I = 4, 5. 10 -7 НСО 3 - Н+ + СО 32 - Ка. II = 4, 8. 10 -11 Неустойчивая, существует только в растворах, легко разлагается: H 2 CO 3 = CO 2 + H 2 O
Угольная кислота Н 2 СО 3 слабая кислота Н 2 СО 3 Н+ + НСО 3 - Ка. I = 4, 5. 10 -7 НСО 3 - Н+ + СО 32 - Ка. II = 4, 8. 10 -11 Неустойчивая, существует только в растворах, легко разлагается: H 2 CO 3 = CO 2 + H 2 O
 • Производными угольной кислоты являются пероксоугольные кислоты пероксомоноугольная (надугольная) НООС О О Н. • Пероксодиугольная (динадугольная) НООС О О СООН).
• Производными угольной кислоты являются пероксоугольные кислоты пероксомоноугольная (надугольная) НООС О О Н. • Пероксодиугольная (динадугольная) НООС О О СООН).
 Карбаминовая кислота • В свободном состоянии не существует, очень неустойчива • Соль – карбаминад аммония – образуется: 2 NH 3 + CO 2 = NH 2 COONH 4 при нагревании разлагается NH 2 COONH 4 = H 2 O + H 2 N-CO-NH 2 Карбамид - мочевина
Карбаминовая кислота • В свободном состоянии не существует, очень неустойчива • Соль – карбаминад аммония – образуется: 2 NH 3 + CO 2 = NH 2 COONH 4 при нагревании разлагается NH 2 COONH 4 = H 2 O + H 2 N-CO-NH 2 Карбамид - мочевина
 (CN)2 циан Газ, токсичен. По химическим свойствам похож на галогены. С металлами образует цианиды 2 Ag. CN → 2 Ag + (CN)2 2 С+N 2+H 2 = 2 HCN циановодород (CN)2 +H 2 O =HCN + HCNO циановодородная кислота циановая кислота
(CN)2 циан Газ, токсичен. По химическим свойствам похож на галогены. С металлами образует цианиды 2 Ag. CN → 2 Ag + (CN)2 2 С+N 2+H 2 = 2 HCN циановодород (CN)2 +H 2 O =HCN + HCNO циановодородная кислота циановая кислота
 HCN Бесцветная летучая жидкость, Ткип= 26, 5 0 С, запах горького миндаля. Водный раствор –циановодородная или синильная кислота. Слабая, слабее угольной, водой разлагается: HCN + +H 2 O → H-C-OOH + NH 3
HCN Бесцветная летучая жидкость, Ткип= 26, 5 0 С, запах горького миндаля. Водный раствор –циановодородная или синильная кислота. Слабая, слабее угольной, водой разлагается: HCN + +H 2 O → H-C-OOH + NH 3
 HCNO циановая кислота Летучая жидкость, сильная кислота. Существует в трех формах: H-O-C ≡N H-N=C=O H-O-N≡C циановая изоциановая гремучая Соли гремучей кислоты – фульмиаты – взрывчатые вещества: Hg(ONC)2→Hg +2 CO +N 2 «гремучая ртуть»
HCNO циановая кислота Летучая жидкость, сильная кислота. Существует в трех формах: H-O-C ≡N H-N=C=O H-O-N≡C циановая изоциановая гремучая Соли гремучей кислоты – фульмиаты – взрывчатые вещества: Hg(ONC)2→Hg +2 CO +N 2 «гремучая ртуть»
 KCN +S = KCNS тиоцианат (роданид) H-S-C≡N H-N=C=S Тиоциановая изотиоциановая Сильная кислота 2 KCNS + I 2 = 2 KI + (CNS)2 Родан, безцветный газ.
KCN +S = KCNS тиоцианат (роданид) H-S-C≡N H-N=C=S Тиоциановая изотиоциановая Сильная кислота 2 KCNS + I 2 = 2 KI + (CNS)2 Родан, безцветный газ.
 КРЕМНИЙ
КРЕМНИЙ
 ХИМИЧЕСКИЕ СВОЙСТВА При н. у. Si малоактивен и реагирует только с газообразным фтором: Si +2 F 2 = Si. F 4↑ Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода воздуха или воды (водяных паров). Аморфный Si более реакционноспособен, расплавленный очень активен.
ХИМИЧЕСКИЕ СВОЙСТВА При н. у. Si малоактивен и реагирует только с газообразным фтором: Si +2 F 2 = Si. F 4↑ Такая «неактивность» кремния связана с пассивацией поверхности наноразмерным слоем диоксида кремния, немедленно образующегося в присутствии кислорода воздуха или воды (водяных паров). Аморфный Si более реакционноспособен, расплавленный очень активен.
 При нагревании до температуры 400— 500 °C кремний реагирует с O 2, Cl 2, Br 2 , S: Si + O 2 = Si. O 2 Si + 2 Cl 2 = Si. Cl 4 С азотом кремний при температуре около 1000 °C образует нитрид Si 3 N 4, с бором — термически и химически стойкие бориды Si. B 3, Si. B 6 и Si. B 12. , c углеродом карбид кремния Si. C (карборунд). При нагревании кремния с металлами могут образовываться силициды.
При нагревании до температуры 400— 500 °C кремний реагирует с O 2, Cl 2, Br 2 , S: Si + O 2 = Si. O 2 Si + 2 Cl 2 = Si. Cl 4 С азотом кремний при температуре около 1000 °C образует нитрид Si 3 N 4, с бором — термически и химически стойкие бориды Si. B 3, Si. B 6 и Si. B 12. , c углеродом карбид кремния Si. C (карборунд). При нагревании кремния с металлами могут образовываться силициды.
 С кислотами Si не реагирует. Лишь смесь азотной и плавиковой кислот окисляет его до растворимой в воде гексафторкремниевой кислоты 3 Si+8 HNO 3+18 HF=3 H 2[Si. F 6]+4 NO+8 H 2 O В растворах щелочей энергично растворяется на холоду (неметаллические свойства) Si + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 2 H 2 При высоких t взаимодействует с водой Si + 3 H 2 O = H 2 Si. O 3 + 2 H 2
С кислотами Si не реагирует. Лишь смесь азотной и плавиковой кислот окисляет его до растворимой в воде гексафторкремниевой кислоты 3 Si+8 HNO 3+18 HF=3 H 2[Si. F 6]+4 NO+8 H 2 O В растворах щелочей энергично растворяется на холоду (неметаллические свойства) Si + 2 Na. OH + H 2 O = Na 2 Si. O 3 + 2 H 2 При высоких t взаимодействует с водой Si + 3 H 2 O = H 2 Si. O 3 + 2 H 2
 С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой Sin. H 2 n+2 получают косвенным путем. Моносилан Si. H 4 Ca 2 Si + 4 HCl → 2 Ca. Cl 2 + Si. H 4↑ примесь других силанов, дисилана Si 2 H 6 и трисилана Si 3 H 8.
С водородом кремний непосредственно не реагирует, соединения кремния с водородом — силаны с общей формулой Sin. H 2 n+2 получают косвенным путем. Моносилан Si. H 4 Ca 2 Si + 4 HCl → 2 Ca. Cl 2 + Si. H 4↑ примесь других силанов, дисилана Si 2 H 6 и трисилана Si 3 H 8.
 Полисиланы Токсичны, имеют неприятный запах, менее термически стойки, по сравнению с Сn. H 2 n+2 Восстановители Si. H 4 + O 2 = Si. O 2 + 2 H 2 O В воде гидролизуются Si. H 4 + 2 H 2 O = Si. O 2 + 4 H 2
Полисиланы Токсичны, имеют неприятный запах, менее термически стойки, по сравнению с Сn. H 2 n+2 Восстановители Si. H 4 + O 2 = Si. O 2 + 2 H 2 O В воде гидролизуются Si. H 4 + 2 H 2 O = Si. O 2 + 4 H 2
 СИЛИЦИДЫ I. Ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния Ca 2 Si, Mg 2 Si ) Разлагаются под действием кислот Ca 2 Si + 2 H 2 SO 4 = 2 Ca. SO 4 +Si. H 4 II. Металлоподобные (силициды переходных металлов). Химически стойки и под действием кислот не разлагаются, устойчивы к действию кислорода даже при высоких температурах. Имеют высокие Tпл (до 2000 °C). Наиболее часто Me. Si, Me 3 Si 2, Me 2 Si 3, Me 5 Si 3 и Me. Si 2.
СИЛИЦИДЫ I. Ионно-ковалентные (силициды щелочных, щелочноземельных металлов и магния Ca 2 Si, Mg 2 Si ) Разлагаются под действием кислот Ca 2 Si + 2 H 2 SO 4 = 2 Ca. SO 4 +Si. H 4 II. Металлоподобные (силициды переходных металлов). Химически стойки и под действием кислот не разлагаются, устойчивы к действию кислорода даже при высоких температурах. Имеют высокие Tпл (до 2000 °C). Наиболее часто Me. Si, Me 3 Si 2, Me 2 Si 3, Me 5 Si 3 и Me. Si 2.
 Соединения кремния (+2) •
Соединения кремния (+2) •
 Соединения Si (+4) • Оксид кремния Si. O 2 самый распространенный оксид в земной коре. • Твердый, Тпл более 1700 °С • Тетраэдры [Si. O 4], соединенные вершинами
Соединения Si (+4) • Оксид кремния Si. O 2 самый распространенный оксид в земной коре. • Твердый, Тпл более 1700 °С • Тетраэдры [Si. O 4], соединенные вершинами
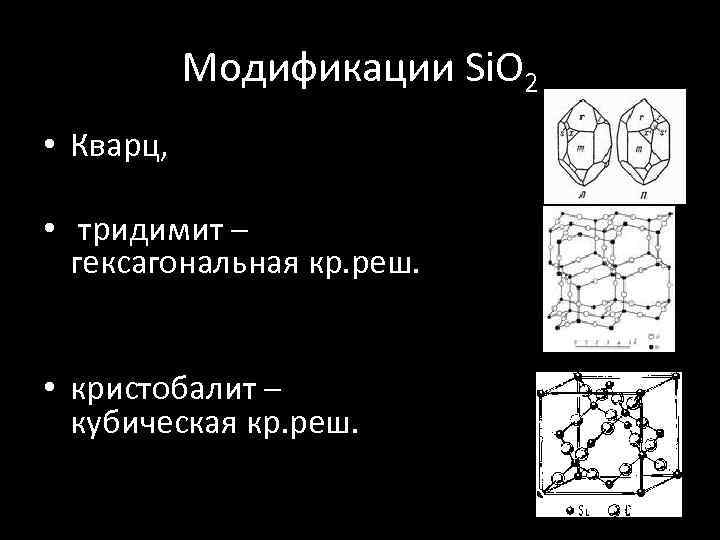 Модификации Si. O 2 • Кварц, • тридимит – гексагональная кр. реш. • кристобалит – кубическая кр. реш.
Модификации Si. O 2 • Кварц, • тридимит – гексагональная кр. реш. • кристобалит – кубическая кр. реш.
 Легко с F 2 и HF Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O Si. O 2 + F 2 = Si. F 4 + O 2 В воде не растворим В растворах щелочей легко Si. O 2 + 2 Na. OH =Na 2 Si. O 3 + H 2 O Спекается с солями Si. O 2 + Na 2 CO 3 = Na 2 Si. O 3 + CO 2 Si. O 2 + Pb. O = Pb. Si. O 3
Легко с F 2 и HF Si. O 2 + 4 HF = Si. F 4 + 2 H 2 O Si. O 2 + F 2 = Si. F 4 + O 2 В воде не растворим В растворах щелочей легко Si. O 2 + 2 Na. OH =Na 2 Si. O 3 + H 2 O Спекается с солями Si. O 2 + Na 2 CO 3 = Na 2 Si. O 3 + CO 2 Si. O 2 + Pb. O = Pb. Si. O 3
 Si. O 2 соответствует кремниевая кислота • Na 2 Si. O 3 + HCl = H 2 Si. O 3 + Na. Cl • H 2 Si. O 3 - метакремниевая, или кремниевая кислота • H 4 Si. O 4 - ортокремниевая кислота существуют только в растворе и необратимо превращаются в Si. O 2, если выпарить воду.
Si. O 2 соответствует кремниевая кислота • Na 2 Si. O 3 + HCl = H 2 Si. O 3 + Na. Cl • H 2 Si. O 3 - метакремниевая, или кремниевая кислота • H 4 Si. O 4 - ортокремниевая кислота существуют только в растворе и необратимо превращаются в Si. O 2, если выпарить воду.
 Si. O 2 соответствует кремниевая кислота • Na 2 Si. O 3 + HCl = H 2 Si. O 3 + Na. Cl • H 2 Si. O 3 - метакремниевая, или кремниевая кислота • H 4 Si. O 4 - ортокремниевая кислота существуют только в растворе и необратимо превращаются в Si. O 2, если выпарить воду.
Si. O 2 соответствует кремниевая кислота • Na 2 Si. O 3 + HCl = H 2 Si. O 3 + Na. Cl • H 2 Si. O 3 - метакремниевая, или кремниевая кислота • H 4 Si. O 4 - ортокремниевая кислота существуют только в растворе и необратимо превращаются в Si. O 2, если выпарить воду.
 • Другие кремниевые кислоты общего состава x. Si. O 2. y. H 2 O получаются за счет различного количества воды в их составе: H 6 Si 2 O 7 (пирокремниевая кислота из двух молекул ортокремниевой кислоты), H 2 Si 2 O 5 и H 4 Si 3 O 8 (ди- и трикремниевая кислоты из двух и соответственно трех молекул метакремниевой кислоты). • Все кислоты кремния слабые. • Частично обезвоженное соединение • x. Si. O 2. y. H 2 O (x
• Другие кремниевые кислоты общего состава x. Si. O 2. y. H 2 O получаются за счет различного количества воды в их составе: H 6 Si 2 O 7 (пирокремниевая кислота из двух молекул ортокремниевой кислоты), H 2 Si 2 O 5 и H 4 Si 3 O 8 (ди- и трикремниевая кислоты из двух и соответственно трех молекул метакремниевой кислоты). • Все кислоты кремния слабые. • Частично обезвоженное соединение • x. Si. O 2. y. H 2 O (x
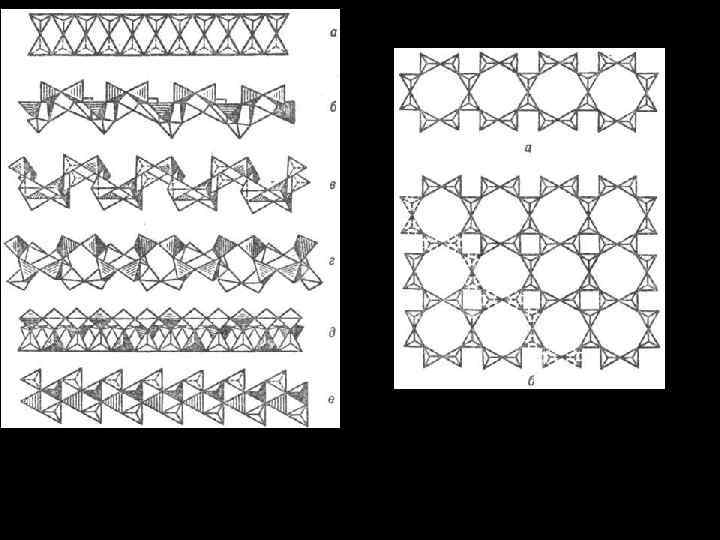
 Соли кремниевых кислот - силикаты • В основе структурного строения всех силикатов лежит тесная связь кремния и кислорода; эта связь исходит из кристаллохимического принципа, а именно из отношения радиусов ионов Si (0. 39Å) и O (1. 32Å). • Каждый атом кремния окружён тетраэдрически расположенными вокруг него атомами кислорода. [Si. O 4]3 • В зависимости от того, как сочетаются между собой кремнекислородные тетраэдры, различают следующие структурные типы силикатов.
Соли кремниевых кислот - силикаты • В основе структурного строения всех силикатов лежит тесная связь кремния и кислорода; эта связь исходит из кристаллохимического принципа, а именно из отношения радиусов ионов Si (0. 39Å) и O (1. 32Å). • Каждый атом кремния окружён тетраэдрически расположенными вокруг него атомами кислорода. [Si. O 4]3 • В зависимости от того, как сочетаются между собой кремнекислородные тетраэдры, различают следующие структурные типы силикатов.
![• 1. Островные силикаты, то есть силикаты с изолированными тетраэдрами [Si. O 4]4− • 1. Островные силикаты, то есть силикаты с изолированными тетраэдрами [Si. O 4]4−](https://present5.com/presentation/3/-33157459_83418938.pdf-img/-33157459_83418938.pdf-70.jpg) • 1. Островные силикаты, то есть силикаты с изолированными тетраэдрами [Si. O 4]4− и изолированными группами тетраэдров: а) силикаты с изолированными кремнекислородными тетраэдрами • Островные силикаты с добавочными анионами О 2−, ОН 1−, F 1− и др. • в) Силикаты со сдвоенными тетраэдрами. Отличаются обособленными парами кремнекислородных тетраэдров [Si 2 O 7]6−. Один из атомов кислорода у них общий , остальные связаны с катионами.
• 1. Островные силикаты, то есть силикаты с изолированными тетраэдрами [Si. O 4]4− и изолированными группами тетраэдров: а) силикаты с изолированными кремнекислородными тетраэдрами • Островные силикаты с добавочными анионами О 2−, ОН 1−, F 1− и др. • в) Силикаты со сдвоенными тетраэдрами. Отличаются обособленными парами кремнекислородных тетраэдров [Si 2 O 7]6−. Один из атомов кислорода у них общий , остальные связаны с катионами.
 Стекло В зависимости от основного используемого стеклообразующего вещества, стекла бывают оксидными (силикатные, кварцевое, германатные, фосфатные, боратные), фторидными, сульфидными и т. д. Силикатное стекло получают сплавляя смесь кварцевого песка (Si. O 2), соды (Na 2 CO 3) и извести (Ca. O). В результате получается химический комплекс с составом Na 2 O. Ca. O. 6 Si. O 2.
Стекло В зависимости от основного используемого стеклообразующего вещества, стекла бывают оксидными (силикатные, кварцевое, германатные, фосфатные, боратные), фторидными, сульфидными и т. д. Силикатное стекло получают сплавляя смесь кварцевого песка (Si. O 2), соды (Na 2 CO 3) и извести (Ca. O). В результате получается химический комплекс с составом Na 2 O. Ca. O. 6 Si. O 2.


