Элементы II А-группы Электронное строение


















- Размер: 713 Кб
- Количество слайдов: 25
Описание презентации Элементы II А-группы Электронное строение по слайдам
 Элементы II А-группы Электронное строение Ca, Sr, Ba, Ra. Ra – щелочноземельные металлы Общая электронная формула: [[ ЭЭ ]ns]ns 22 npnp 00 Э – благородный газ, завершающий ( n-1 ) период Электронные конфигурации изолированных атомов IIA -группа Название элемента № элемента Период Электронная конфигурация Be. Be Бериллий 4 2 [He]2 s 2 Mg. Mg Магний 12 3 [Ne]3 s 2 Ca. Ca Кальций 20 4 [Ar]4 s 2 Sr. Sr Стронций 38 5 [Kr]5 s 2 Ba. Ba Барий 56 6 [Xe]6 s 2 Ra. Ra Радий 88 7 [Rn]7 s
Элементы II А-группы Электронное строение Ca, Sr, Ba, Ra. Ra – щелочноземельные металлы Общая электронная формула: [[ ЭЭ ]ns]ns 22 npnp 00 Э – благородный газ, завершающий ( n-1 ) период Электронные конфигурации изолированных атомов IIA -группа Название элемента № элемента Период Электронная конфигурация Be. Be Бериллий 4 2 [He]2 s 2 Mg. Mg Магний 12 3 [Ne]3 s 2 Ca. Ca Кальций 20 4 [Ar]4 s 2 Sr. Sr Стронций 38 5 [Kr]5 s 2 Ba. Ba Барий 56 6 [Xe]6 s 2 Ra. Ra Радий 88 7 [Rn]7 s
 Характеристика атомов элементов IIA- группы Увеличение числа электронов в атоме и размеров орбиталей, занимаемых последними электронами Потеря единственного валентного электрона => r ион <r мет
Характеристика атомов элементов IIA- группы Увеличение числа электронов в атоме и размеров орбиталей, занимаемых последними электронами Потеря единственного валентного электрона => r ион <r мет
 От l -А группы ко ll -А уменьшаются орбитальные атомные радиусы и увеличивается прочность связи внешних электронов с ядром. Имеется значительная разница между l 1 и l 2 , поэтому элементы ll -А группы проявляют степень окисления +
От l -А группы ко ll -А уменьшаются орбитальные атомные радиусы и увеличивается прочность связи внешних электронов с ядром. Имеется значительная разница между l 1 и l 2 , поэтому элементы ll -А группы проявляют степень окисления +
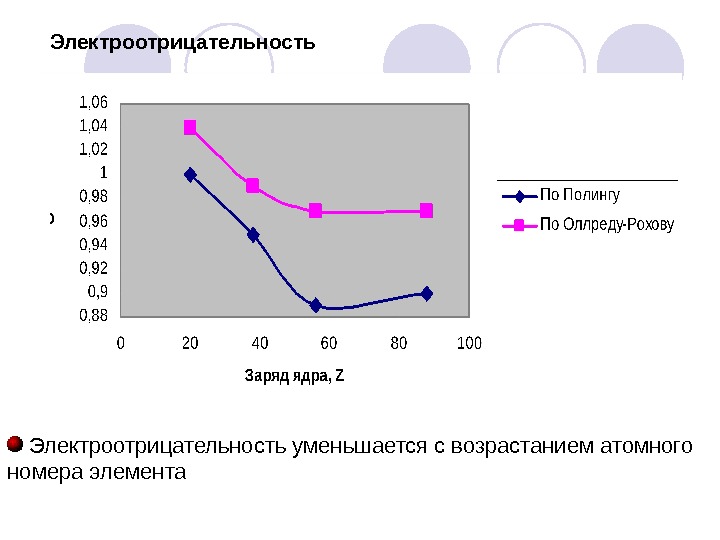
 Электроотрицательность уменьшается с возрастанием атомного номера элемента
Электроотрицательность уменьшается с возрастанием атомного номера элемента
 Особенности химии бериллия Ион Be 2+ устойчив лишь в газовой фазе при высокой температуре Химическая связь в бинарных соединениях Be с наиболее электроотрицательными элементами обладает высокой долей ковалентности ( Be. O, Be. F 2 ) Химия водных растворов Be имеет свою специфику: в первой координационной сфере Be могут находиться 4 лиганда [Be(H 2 O)4 ]2+ , [Be(H 2 O)4 ]2 —
Особенности химии бериллия Ион Be 2+ устойчив лишь в газовой фазе при высокой температуре Химическая связь в бинарных соединениях Be с наиболее электроотрицательными элементами обладает высокой долей ковалентности ( Be. O, Be. F 2 ) Химия водных растворов Be имеет свою специфику: в первой координационной сфере Be могут находиться 4 лиганда [Be(H 2 O)4 ]2+ , [Be(H 2 O)4 ]2 —
 В чистом виде Be , Mg и щелочноземельные металлы имеют серебристо-белый цвет. Все металлы, кроме Be , очень легкие. Физические свойства Кальций Бериллий
В чистом виде Be , Mg и щелочноземельные металлы имеют серебристо-белый цвет. Все металлы, кроме Be , очень легкие. Физические свойства Кальций Бериллий
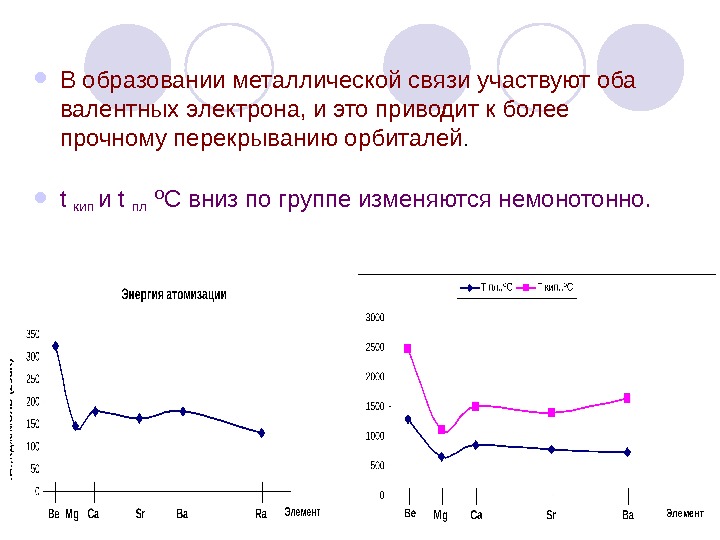
 В образовании металлической связи участвуют оба валентных электрона, и это приводит к более прочному перекрыванию орбиталей. t кип и t пл ºC вниз по группе изменяются немонотонно.
В образовании металлической связи участвуют оба валентных электрона, и это приводит к более прочному перекрыванию орбиталей. t кип и t пл ºC вниз по группе изменяются немонотонно.
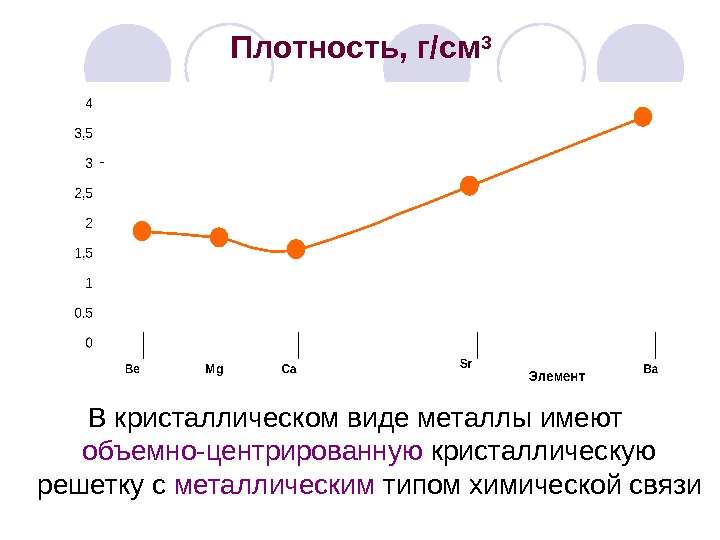
 Плотность, г/см 3 В кристаллическом виде металлы имеют объемно-центрированную кристаллическую решетку с металлическим типом химической связи
Плотность, г/см 3 В кристаллическом виде металлы имеют объемно-центрированную кристаллическую решетку с металлическим типом химической связи
 Распространенность в природе Be. Be Mg. Mg Ca. Ca Sr. Sr Ba. Ba Ra. Ra Содержание (кларк %) 6 , 0 *10 -4 2, 00 3, 4 1, 4*1 0 -2 2 , 6 *10 -2 10 -10 Место по распростране нности 48 8 5 23 19 84 Ca и Mg – наиболее широко распространены в природе. Из-за высокой химической активности, элементы II -А группы в свободном виде не встречаются (только в минералах).
Распространенность в природе Be. Be Mg. Mg Ca. Ca Sr. Sr Ba. Ba Ra. Ra Содержание (кларк %) 6 , 0 *10 -4 2, 00 3, 4 1, 4*1 0 -2 2 , 6 *10 -2 10 -10 Место по распростране нности 48 8 5 23 19 84 Ca и Mg – наиболее широко распространены в природе. Из-за высокой химической активности, элементы II -А группы в свободном виде не встречаются (только в минералах).
 Минералы 2 Mg. O*Si. O 2 ( оливин) 3 Mg. O *4 Si. O 2 *4 H 2 O ( тальк)
Минералы 2 Mg. O*Si. O 2 ( оливин) 3 Mg. O *4 Si. O 2 *4 H 2 O ( тальк)
 Ca. CO 3 кальцит (известняк, мрамор, мел) Sr. SO 4 ( целестин)
Ca. CO 3 кальцит (известняк, мрамор, мел) Sr. SO 4 ( целестин)
 Ba. SO 4 ( барит)
Ba. SO 4 ( барит)
 Получение Расплав Mg. Cl 2 , KCl , Na. Cl Cl 2 ( г. ) Электролит Железный катод (круговой) Графитовый анод Железная сетка (круговая) Mg. Mg : электролиз расплава Mg. Cl 2. катод: Mg. Mg 2+ 2+ + 2 e — — =Mg=Mg анод: 22 Cl. Cl — 2 e 2 e — — =Cl=Cl 22 Be. F 22 + Mg → Mg. F 2 2 + Be Ca, Sr, Ba получают восстановлением их оксидов при температуре выше 1200 ºCºC : : 1. 4 Sr. O + 2 Al → 3 Sr + Sr. O*Al 22 OO 33 22. 2. 2 Mg. O + Si + 2 Са O → Ca 22 Si. O 44 + Mg 3. Mg. O + C → CO↑+ Mg
Получение Расплав Mg. Cl 2 , KCl , Na. Cl Cl 2 ( г. ) Электролит Железный катод (круговой) Графитовый анод Железная сетка (круговая) Mg. Mg : электролиз расплава Mg. Cl 2. катод: Mg. Mg 2+ 2+ + 2 e — — =Mg=Mg анод: 22 Cl. Cl — 2 e 2 e — — =Cl=Cl 22 Be. F 22 + Mg → Mg. F 2 2 + Be Ca, Sr, Ba получают восстановлением их оксидов при температуре выше 1200 ºCºC : : 1. 4 Sr. O + 2 Al → 3 Sr + Sr. O*Al 22 OO 33 22. 2. 2 Mg. O + Si + 2 Са O → Ca 22 Si. O 44 + Mg 3. Mg. O + C → CO↑+ Mg
 Применение Be и его сплавы применяются в самолето- и ракетостроении, ядерной энергетике. Mg и его сплавы с алюминием ( Al) – применяют для изготовления деталей в самолето- и автомобилестроении. Порошок магния используется в сигнальных ракетах, а другие соединения: жженая магнезия Mg. O или горькая соль Mg. SO 4 *7 H 2 O – применяются в медицине. Ca служит восстановителем в металлотермии, раскислителем при выплавке стали ; Ca. O и С a(OH) 2 используется в строительстве, металлургии, при производстве стекла, сахара, бумаги. Sr при добавлении улучшает механические свойства чугуна и титановых сплавов. Ba используется в качестве геттера (газопоглотитель) в вакуумных трубках.
Применение Be и его сплавы применяются в самолето- и ракетостроении, ядерной энергетике. Mg и его сплавы с алюминием ( Al) – применяют для изготовления деталей в самолето- и автомобилестроении. Порошок магния используется в сигнальных ракетах, а другие соединения: жженая магнезия Mg. O или горькая соль Mg. SO 4 *7 H 2 O – применяются в медицине. Ca служит восстановителем в металлотермии, раскислителем при выплавке стали ; Ca. O и С a(OH) 2 используется в строительстве, металлургии, при производстве стекла, сахара, бумаги. Sr при добавлении улучшает механические свойства чугуна и титановых сплавов. Ba используется в качестве геттера (газопоглотитель) в вакуумных трубках.
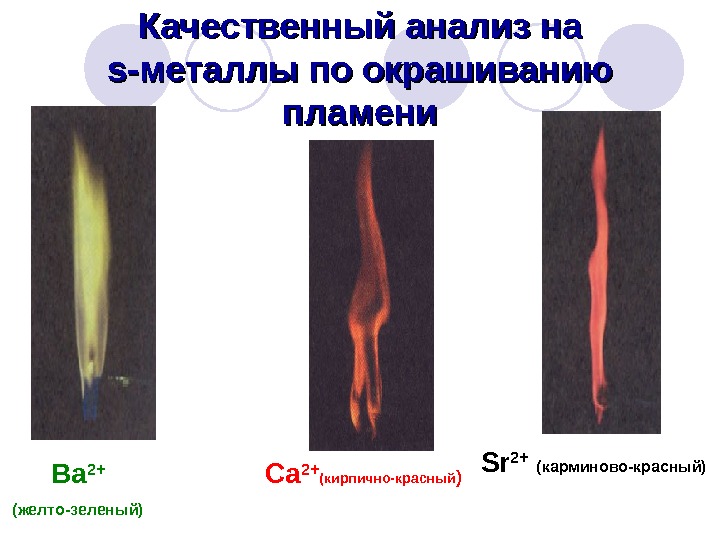
 Качественный анализ на s-s- металлы по окрашиванию пламени Ba 2+ ( желто-зеленый) Ca 2+ (кирпично-красный ) Sr 2+ ( карминово-красный)
Качественный анализ на s-s- металлы по окрашиванию пламени Ba 2+ ( желто-зеленый) Ca 2+ (кирпично-красный ) Sr 2+ ( карминово-красный)
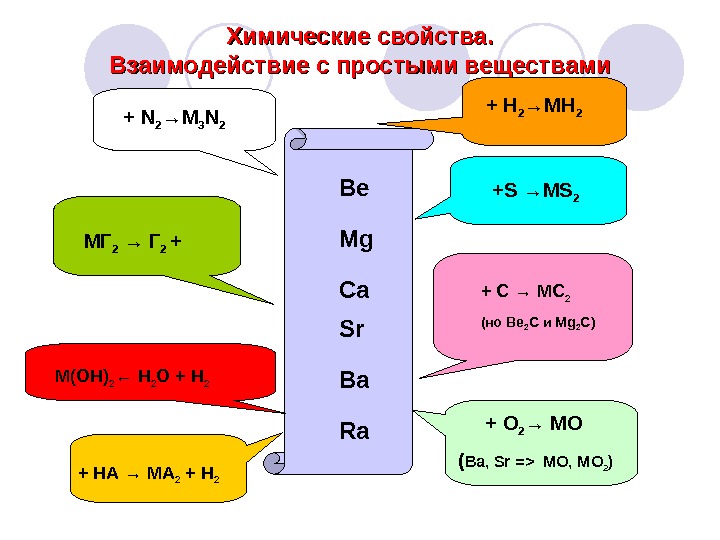
 Химические свойства. Взаимодействие с простыми веществами Be Mg Ca Sr Ba Ra + H 2 →MH 2 +S →MS 2 + C → MC 2 ( но Be 2 C и Mg 2 C) + O 2 → MO ( Ba, Sr => MO, MO 2 ) + HA → MA 2 + H 2 M(OH) 2 ← H 2 O + H 2 M Г 2 → Г 2 ++ N 2 →M 3 N
Химические свойства. Взаимодействие с простыми веществами Be Mg Ca Sr Ba Ra + H 2 →MH 2 +S →MS 2 + C → MC 2 ( но Be 2 C и Mg 2 C) + O 2 → MO ( Ba, Sr => MO, MO 2 ) + HA → MA 2 + H 2 M(OH) 2 ← H 2 O + H 2 M Г 2 → Г 2 ++ N 2 →M 3 N
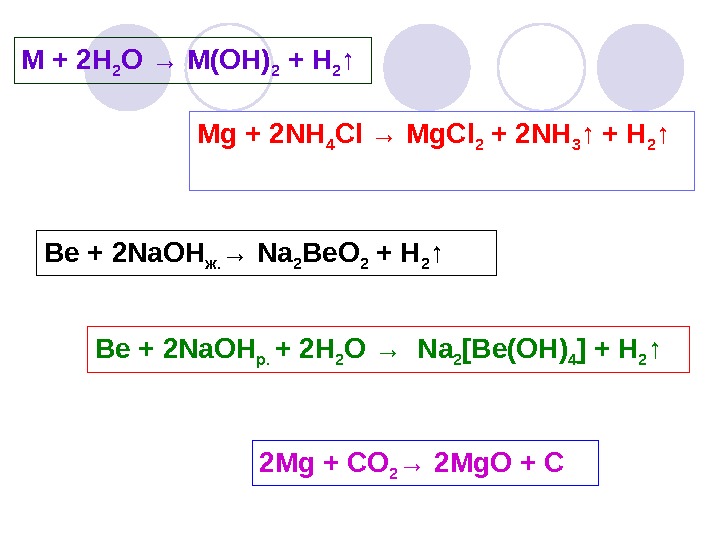
 M + 2 H 2 O → M(OH) 2 + H 2 ↑ Mg + 2 NH 4 Cl → Mg. Cl 2 + 2 NH 3 ↑ + H 2 ↑ Be + 2 Na. OH ж. → Na 2 Be. O 2 + H 2 ↑ Be + 2 Na. OH р. + 2 H 2 O → Na 2 [Be(OH) 4 ] + H 2 ↑ 2 Mg + CO 2 → 2 Mg. O +
M + 2 H 2 O → M(OH) 2 + H 2 ↑ Mg + 2 NH 4 Cl → Mg. Cl 2 + 2 NH 3 ↑ + H 2 ↑ Be + 2 Na. OH ж. → Na 2 Be. O 2 + H 2 ↑ Be + 2 Na. OH р. + 2 H 2 O → Na 2 [Be(OH) 4 ] + H 2 ↑ 2 Mg + CO 2 → 2 Mg. O +
 Соединения с неметаллами MH 2 M(OH) 2 ← O 2 + +H 2 O → M(OH) 2 + 2 H 2 Ba. SO 4 + 4 C → Ba. S + 4 CO Ca. C 2 + 2 H 2 O → Ca(OH)
Соединения с неметаллами MH 2 M(OH) 2 ← O 2 + +H 2 O → M(OH) 2 + 2 H 2 Ba. SO 4 + 4 C → Ba. S + 4 CO Ca. C 2 + 2 H 2 O → Ca(OH)
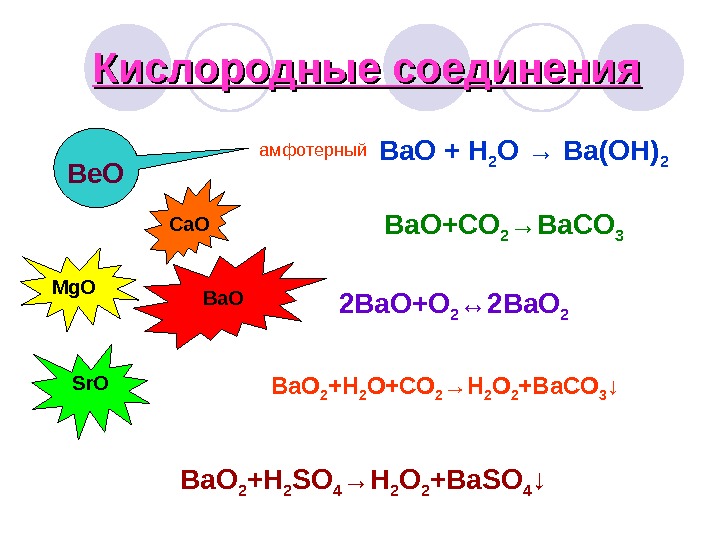
 Кислородные соединения Be. O амфотерный Mg. O Ca. O Sr. O Ba. O + H 2 O → Ba(OH) 2 Ba. O+CO 2 →Ba. CO 3 2 Ba. O+O 2 ↔ 2 Ba. O 2 +H 2 O+CO 2 →H 2 O 2 +Ba. CO 3 ↓ Ba. O 2 +H 2 SO 4 →H 2 O 2 +Ba. SO 4 ↓
Кислородные соединения Be. O амфотерный Mg. O Ca. O Sr. O Ba. O + H 2 O → Ba(OH) 2 Ba. O+CO 2 →Ba. CO 3 2 Ba. O+O 2 ↔ 2 Ba. O 2 +H 2 O+CO 2 →H 2 O 2 +Ba. CO 3 ↓ Ba. O 2 +H 2 SO 4 →H 2 O 2 +Ba. SO 4 ↓
 Гидроксиды. Mg(OH)2 Ca(OH)2 Sr(OH) 2 Ba(OH)2 Be(OH) 2 + 2 H 3 O + → Be 2+ + 2 H 2 O Be(OH) 2 + 2 OH — → [Be(OH) 4 ] 2 — Mg(OH) 2 ↔ Mg 2+ + 2 OH — Sr. Cl 2 + 2 KOH → Sr(OH) 2 ↓ + 2 KCl Mg(OH) 2 + 2 NH 4 Cl → Mg. Cl 2 + 2 NH 3 *H 2 O M(OH) 2 →MO + H 2 O
Гидроксиды. Mg(OH)2 Ca(OH)2 Sr(OH) 2 Ba(OH)2 Be(OH) 2 + 2 H 3 O + → Be 2+ + 2 H 2 O Be(OH) 2 + 2 OH — → [Be(OH) 4 ] 2 — Mg(OH) 2 ↔ Mg 2+ + 2 OH — Sr. Cl 2 + 2 KOH → Sr(OH) 2 ↓ + 2 KCl Mg(OH) 2 + 2 NH 4 Cl → Mg. Cl 2 + 2 NH 3 *H 2 O M(OH) 2 →MO + H 2 O
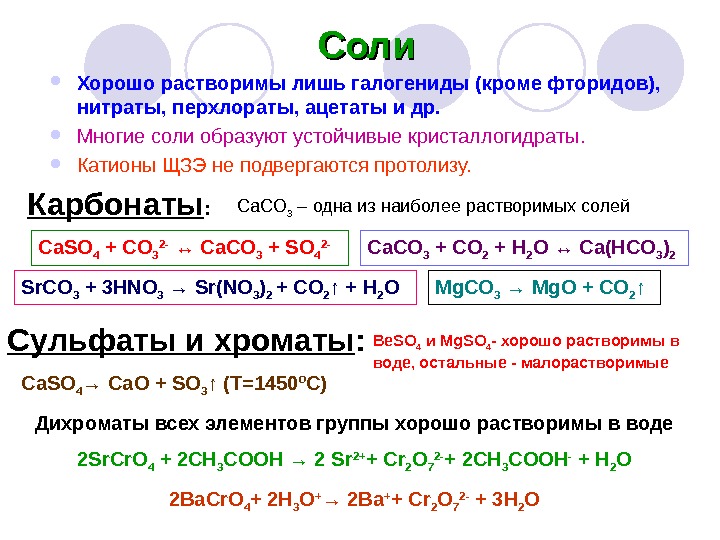
 Хорошо растворимы лишь галогениды (кроме фторидов), нитраты, перхлораты, ацетаты и др. Многие соли образуют устойчивые кристаллогидраты. Катионы ЩЗЭ не подвергаются протолизу. Соли Карбонаты : Ca. CO 3 – одна из наиболее растворимых солей Ca. CO 3 + CO 2 + H 2 O ↔ Ca(HCO 3 ) 2 Ca. SO 4 + CO 3 2 — ↔ Ca. CO 3 + SO 4 2 — Sr. CO 3 + 3 HNO 3 → Sr(NO 3 ) 2 + CO 2 ↑ + H 2 O Mg. CO 3 → Mg. O + CO 2 ↑ Сульфаты и хроматы : Be. SO 4 и Mg. SO 4 — хорошо растворимы в воде, остальные — малорастворимые Ca. SO 4 → Ca. O + SO 3 ↑ (T=1450ºC) Дихроматы всех элементов группы хорошо растворимы в воде 2 Sr. Cr. O 4 + 2 CH 3 COOH → 2 Sr 2+ + Cr 2 O 7 2 — + 2 CH 3 COOH — + H 2 O 2 Ba. Cr. O 4 + 2 H 3 O + → 2 Ba + + Cr 2 O 7 2 — + 3 H 2 O
Хорошо растворимы лишь галогениды (кроме фторидов), нитраты, перхлораты, ацетаты и др. Многие соли образуют устойчивые кристаллогидраты. Катионы ЩЗЭ не подвергаются протолизу. Соли Карбонаты : Ca. CO 3 – одна из наиболее растворимых солей Ca. CO 3 + CO 2 + H 2 O ↔ Ca(HCO 3 ) 2 Ca. SO 4 + CO 3 2 — ↔ Ca. CO 3 + SO 4 2 — Sr. CO 3 + 3 HNO 3 → Sr(NO 3 ) 2 + CO 2 ↑ + H 2 O Mg. CO 3 → Mg. O + CO 2 ↑ Сульфаты и хроматы : Be. SO 4 и Mg. SO 4 — хорошо растворимы в воде, остальные — малорастворимые Ca. SO 4 → Ca. O + SO 3 ↑ (T=1450ºC) Дихроматы всех элементов группы хорошо растворимы в воде 2 Sr. Cr. O 4 + 2 CH 3 COOH → 2 Sr 2+ + Cr 2 O 7 2 — + 2 CH 3 COOH — + H 2 O 2 Ba. Cr. O 4 + 2 H 3 O + → 2 Ba + + Cr 2 O 7 2 — + 3 H 2 O
 Нитраты Ba(NO 3 )2 кристаллизуется в безводном состоянии Остальные соли образуют кристаллогидраты 2 Mg(NO 3 ) 2 → 2 Mg. O + 4 NO 2 + O 2 ( при нагревании) Ba(NO 3 ) 2 → Ba(NO 2 ) 2 + O 2 ↑( при нагревании)
Нитраты Ba(NO 3 )2 кристаллизуется в безводном состоянии Остальные соли образуют кристаллогидраты 2 Mg(NO 3 ) 2 → 2 Mg. O + 4 NO 2 + O 2 ( при нагревании) Ba(NO 3 ) 2 → Ba(NO 2 ) 2 + O 2 ↑( при нагревании)
 Образование комплексных соединений более характерно, чем для щелочных металлов. В водном растворе Be входит в состав аквакатиона [Be(H 2 O) 4 ] 2+ в кислотной среде или в состав гидроксоаниона [Be(H 2 O)] 2 — в щелочной среде. Be 2+ способен удерживать большое число электронных пар, образуя различные комплексные ионы с К. Ч. =4; наиболее стабильны гидроксид ион, альдегид, эфиры и др. Комплексы Mg и ЩЗЭ с монодентатными лигандами малоустойчивы. Ионы Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ образуют устойчивые комплексы с краун-эфирами, широко применяются в органическом синтезе ( RMg. X- реактивы Гриньяра). Комплексные соединения
Образование комплексных соединений более характерно, чем для щелочных металлов. В водном растворе Be входит в состав аквакатиона [Be(H 2 O) 4 ] 2+ в кислотной среде или в состав гидроксоаниона [Be(H 2 O)] 2 — в щелочной среде. Be 2+ способен удерживать большое число электронных пар, образуя различные комплексные ионы с К. Ч. =4; наиболее стабильны гидроксид ион, альдегид, эфиры и др. Комплексы Mg и ЩЗЭ с монодентатными лигандами малоустойчивы. Ионы Mg 2+ , Ca 2+ , Sr 2+ , Ba 2+ образуют устойчивые комплексы с краун-эфирами, широко применяются в органическом синтезе ( RMg. X- реактивы Гриньяра). Комплексные соединения
 Элементы II -А группы содержат на внешнем энергетическом уровне два электрона. Вниз по группе радиус атомов растет, энергия ионизации и Э. О. уменьшается. Be по своим физико-химическим свойствам выделяется среди элементов II -А группы ( Be пассивирует с холодными концентрированными H 2 SO 4 и HNO 3 ). Из-за наиболее высокого значения энергии ионизации, Be образует преимущественно ковалентные связи. Способность образовывать комплексные соединения. Выводы
Элементы II -А группы содержат на внешнем энергетическом уровне два электрона. Вниз по группе радиус атомов растет, энергия ионизации и Э. О. уменьшается. Be по своим физико-химическим свойствам выделяется среди элементов II -А группы ( Be пассивирует с холодными концентрированными H 2 SO 4 и HNO 3 ). Из-за наиболее высокого значения энергии ионизации, Be образует преимущественно ковалентные связи. Способность образовывать комплексные соединения. Выводы
 Список литературы Неорганическая химия: В 3 т. / Под ред. Ю. Д. Третьякова. Т. 2: Химия непереходных элементов: Учебник для студ. высш. учеб. заведений / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов. – М. : Издательский центр «Академия» , 2004. – 368 с. Савинкина Е. В. , Давыдова М. Н. , Рукк Н. С. Химия s -элементов. Учебно-методическое пособие. М. : МИТХТ, 2003, 56 с. Интернет-сайт www. chemist. ru , www. wikipedia. org
Список литературы Неорганическая химия: В 3 т. / Под ред. Ю. Д. Третьякова. Т. 2: Химия непереходных элементов: Учебник для студ. высш. учеб. заведений / А. А. Дроздов, В. П. Зломанов, Г. Н. Мазо, Ф. М. Спиридонов. – М. : Издательский центр «Академия» , 2004. – 368 с. Савинкина Е. В. , Давыдова М. Н. , Рукк Н. С. Химия s -элементов. Учебно-методическое пособие. М. : МИТХТ, 2003, 56 с. Интернет-сайт www. chemist. ru , www. wikipedia. org

