Лекция 2 Кислород.ppt
- Количество слайдов: 68

Элементы группы 6 -А Кислород

Общая характеристика элементов группы 6 -А • К ним относятся: О, S, Se, Te, Po • Халькоген происходит от греч. “халкос” - медь и “ген”- образование, рождение, т. е. “рожденные медью”. Медные руды состоят из соединений, содержащих кислород, серу и т. д.

Электронная конфигурация и структура атомов ns 2 np 4 - 6 е- на внешней оболочке Халькогены менее электроотрицательны, чем галогены.

• Кислород и сера О, S – типичные неметаллы • Селен Se – неметаллические свойства выражены менее ярко • Теллур Te – металлоид • Полоний Po – металл Различия между халькогенами выражены гораздо сильнее, чем между галогенами.
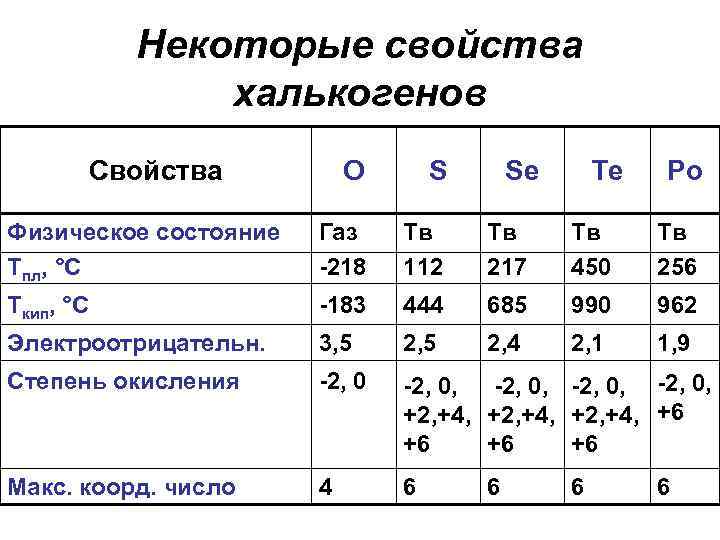
Некоторые свойства халькогенов Свойства О S Se Физическое состояние Тпл, °С Газ -218 Тв 112 Тв 217 Тв 450 Тв 256 Ткип, °С -183 444 685 990 962 Электроотрицательн. 3, 5 2, 4 2, 1 1, 9 Степень окисления -2, 0, -2, 0, +2, +4, +6 +6 Макс. коорд. число 4 6 6 Te 6 Po 6

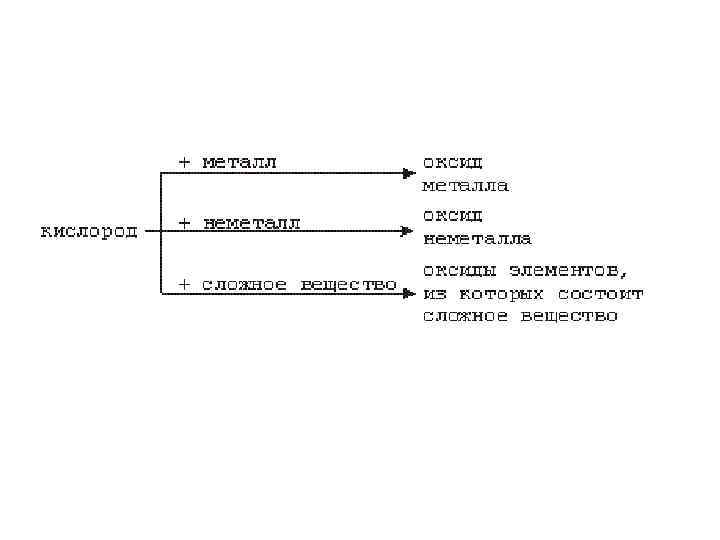
Кислород • Кислород – самый распространенный элемент земной коры. • Взаимодействует со всеми простыми веществами (исключая благородные газы, галогены и благородные металлы). • Оксиды, гидроксиды, пероксиды, надоксиды, озониды, соли, оксосоли, гидраты и т. д. – большинство известных неорганических соединений содержат кислород.

Применение кислорода • В металлургии чистый кислород расходуется главным образом на получение стали из чугуна и металлолома. • Чистый кислород или воздух, обогащенный кислородом, используется при получении многих металлов (меди, никеля, свинца и др. ).

• Кислород используют при резке и сварке металлов. При этом применяют «баллонный» кислород. В баллоне кислород может находиться под давлением до 15 МПа. Баллоны с кислородом окрашены в голубой цвет.

• Жидкий кислород — мощный окислитель, его используют как компонент ракетного топлива. • Пропитанные жидким кислородом такие легко окисляющиеся материалы, как древесные опилки, вата, угольный порошок и др. (эти смеси называют оксиликвитами ), используют как взрывчатые вещества, применяемые, например, при прокладке дорог в горах.

Кислород молекулярный О 2 • Бесцветный газ, не имеющий запаха. Плохо растворяется в воде. • Лавуазье назвал поддерживающий горение газ oxygene — «образующий кислоты» (от греч. oxys — кислый и gennao — рождаю; отсюда и русское название «кислород» ), так как он тогда считал, что все кислоты содержат кислород.

Структура молекулы О 2. . . . • Формулы Льюиса: : О=О: (а), : О-О: (б). . . Молекула О 2 парамагнитна, в каждой молекуле имеется по 2 неспаренных электрона, и имеет кратную связь => формулы (а) и (б) не годятся.

• Молекулярные орбитали: Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону: (σsсв)2(σsраз)2(σzсв)2(πx, yсв)4(πxраз)1(πyраз)1 (σzсв)0

Получение кислорода Промышленное : Выделение из воздуха низкотемпературной фракционной перегонкой. Хранят кислород в сосуде Дьюара.

Сосуд Дьюара • Колба с двойными посеребренными изнутри стенками, из пространства между которыми выкачан воздух. Теплопроводность разреженного газа между стенками столь мала, что температура веществ, помещаемых в сосуд Дьюара, сохраняется постоянной долгое время. Предложен Дж. Дьюаром (1898). Небольшие сосуды Дьюара (в т. ч. бытовые термосы) изготовляют из стекла, больших объемов — из металла.

Получение кислорода Лабораторное: 1. H 2 O 2 = О 2 + H 2 О 2. Термическое разложение богатых кислородом соединений 2 KCl. O 3 = 2 KCl + 3 O 2 2 Pb 3 O 4 = 6 Pb. O + O 2 4 Cr. O 3 = 2 Cr 2 O 3 + 3 О 2 2 Pb. O 2 = 2 Pb. O + О 2 3 Mn. O 2 = Mn 3 O 4 + О 2

3. 2 Na 2 O 2 + 2 H 2 О = О 2 + 4 Na. OH 4. Электролиз водных растворов кислот и щелочей 4 OH- = О 2 + 2 H 2 О + 4 e 5. 2 KMn. O 4 = K 2 Mn. O 4 + Mn. O 2+ О 2

Источником кислорода в космических кораблях, подводных лодках и т. п. замкнутых помещениях служит смесь пероксида натрия Na 2 O 2 и супероксида калия KO 2. При взаимодействии этих соединений с углекислым газом освобождается кислород: 2 Na 2 O 2 + 2 CO 2 = 2 Na 2 CO 3 + O 2, 4 КО 2 + 2 СО 2 = 2 К 2 СО 3 + 3 О 2.

• Убыль кислорода в атмосфере от процессов окисления при горении, гниении и дыхании компенсируется выделением кислорода растениями при фотосинтезе.

Свойства кислорода • Плохо растворяется в воде, охотно растворяется в полярных жидкостях. • Молекулярный кислород очень активен, со многими веществами реагирует уже при нормальных условиях. • В природе он медленно вступает в превращения при процессах гниения.
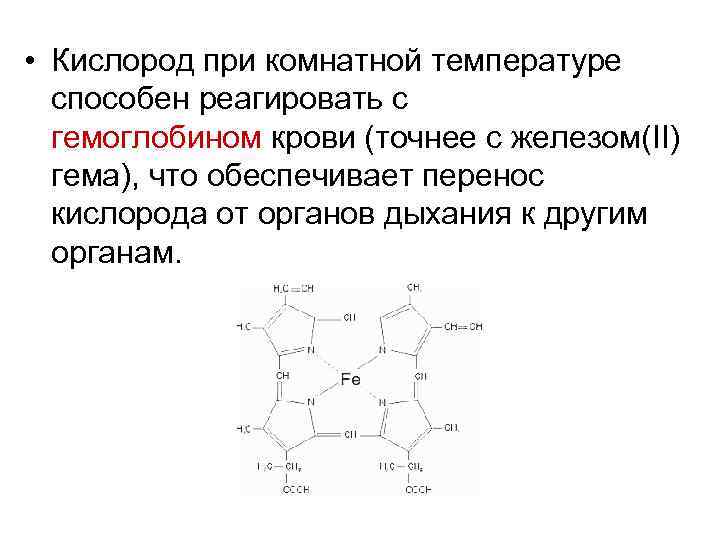
• Кислород при комнатной температуре способен реагировать с гемоглобином крови (точнее с железом(II) гема), что обеспечивает перенос кислорода от органов дыхания к другим органам.

• Взаимодействует с большинством простых и сложных веществ (за исключением галогенов, благородных газов, платины и золота) Mg + O 2 = Mg. O, 4 P + 5 O 2 = 2 P 2 O 5, 4 NH 3 + 3 O 2 = 2 N 2 + 6 H 2 O.

• Под действием кислорода растворы гидроксидов некоторых переходных металлов переходят в нерастворимые соединения, выпадают в осадок: O 2 + 4 Cr(OH)2 + 2 H 2 O = 4 Cr(OH)3.
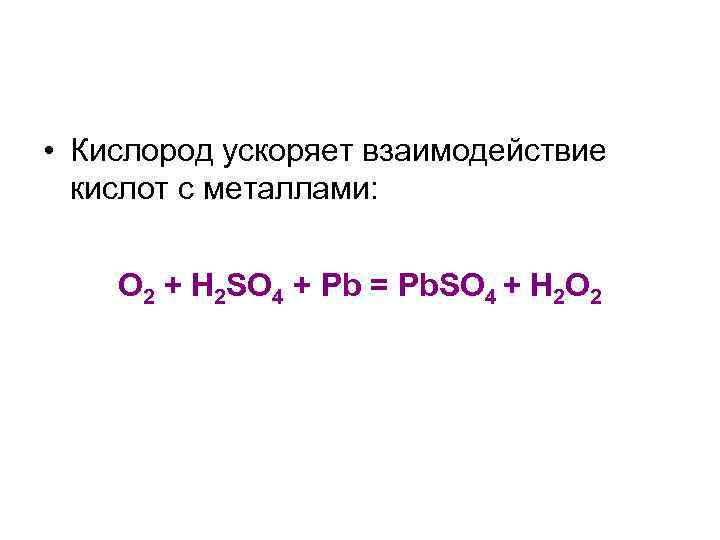
• Кислород ускоряет взаимодействие кислот с металлами: O 2 + H 2 SO 4 + Pb = Pb. SO 4 + H 2 O 2

• Под действием кислорода растворы некоторых веществ в кислотах и щелочах образуют комплексы: O 2 + 4 H 2 O + 2 Ti. Cl 3 + 2 HCl = H 2 O 2 + 2 H 2[Ti. Cl 4(OH)2], O 2 + 2 Co(NO 3)2 + 10(NH 3 • H 2 O) = [Co 2(NH 3)10(NO 3)4] + 10 H 2 O.

• При пропускании электрических разрядов молекулярный кислород переходит в более активный атомарный: O 2 = 2 O. • Атомарный кислород способен соединятся в аллотропную модификацию кислорода озон: 3 O 2 = 2 O 3.

Горение и окисление Окисление – процесс присоединения кислорода к веществу. Горение - процесс присоединения кислорода к веществу, сопровождающийся выделением теплоты и света. Более широко: окислительный процесс с выделением теплоты и света.
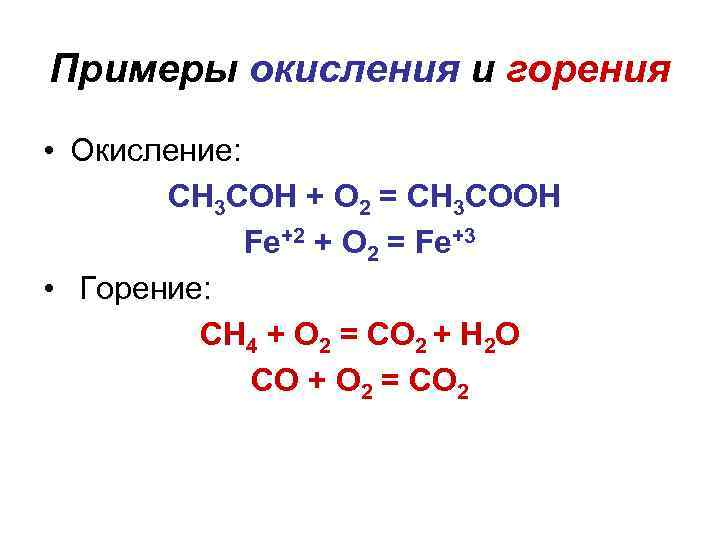
Примеры окисления и горения • Окисление: СН 3 СОН + O 2 = СН 3 СООН Fe+2 + O 2 = Fe+3 • Горение: СН 4 + O 2 = СО 2 + Н 2 О СО + O 2 = СО 2

Механизм окисления • Радикальный RH + O 2 = ROO • + HO • • Оксигенальный (образование оксигенальных комплексов) A + O 2 = AO 2 Фермент AO 2 + P = A + PO 2 субстрат продукт

Соединения кислорода • • Оксиды Пероксиды Смешанные оксиды Гидроксиды и т. д.

Оксиды ОКСИДЫ - бинарные соединения химических элементов с кислородом.

• Классификация по составу Нормальные оксиды: Mg. O, Si. O 2 Пероксиды: H 2 O 2, Na 2 O 2 Смешанные оксиды: Fe 3 O 4, Pb 3 O 4

H 2 O 2, Na 2 O 2 - горение 2 Na + O 2 → Na 2 O 2 Ba. O 2 + H 2 SO 4 → Ba. SO 4 + H 2 O 2 В пероксидах кислород O 2 -2 имеет степень окисления -1 Если горение Na проводить под давлением кислорода, то могут получаться надпероксиды: Na + O 2 → Na. O 2 , где O 2 -1 Пероксиды и надпероксиды - сильные окислители Смешанные оксиды Эти соединения можно рассматривать как смесь двух оксидов Pb 3 O 4 ≡ Pb. O (2) + Pb. O 2 (1) Fe 3 O 4 ≡ Fe. O + Fe 2 O 3

• Классификация по кислотно-основным свойствам Основные оксиды: K 2 O Кислотные оксиды: SO 3 Амфотерные оксиды: Zn. O Нейтральные оксиды: NO, CO, N 2 O

Основные оксиды Mg. O + 2 HCl → Mg. Cl 2 + H 2 O
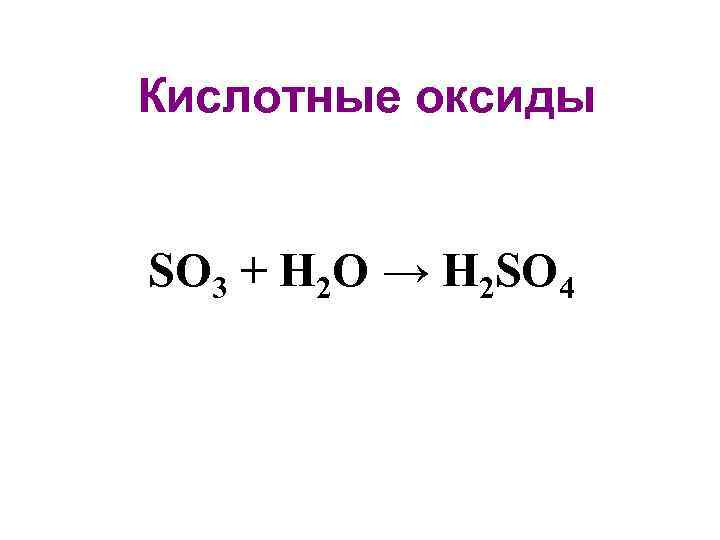
Кислотные оксиды SO 3 + H 2 O → H 2 SO 4
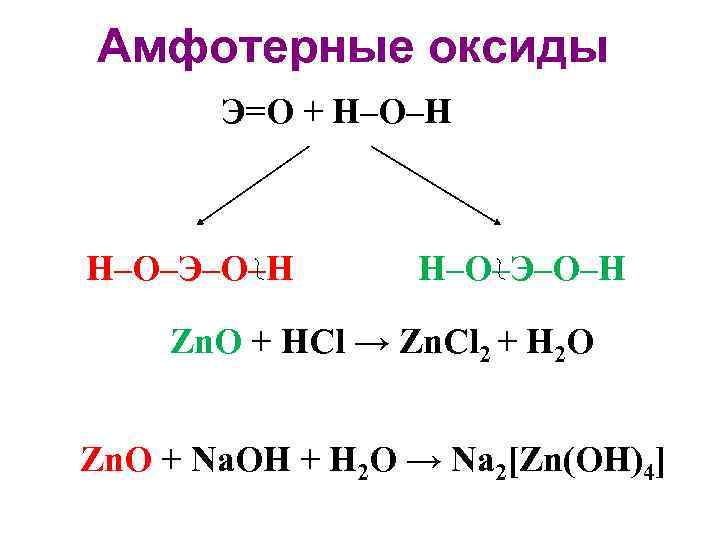
Амфотерные оксиды Э=O + H–O–H H–O–Э–O–H Zn. O + HCl → Zn. Cl 2 + H 2 O Zn. O + Na. OH + H 2 O → Na 2[Zn(OH)4]

Нейтральные оксиды 2 C + O 2 → 2 CO

Вода • ВОДА, Н 2 О, жидкость без запаха, вкуса, цвета (в толстых слоях голубоватая) - самое распространённое в природе химическое соединение.

• Запасы воды на Земле: в морях и океанах - 1, 4 млрд. км 3 в ледниках - 30 млн. км 3 в реках и озёрах - 2 млн. км 3 в атмосфере - 14 тыс. км 3 в живых организмах - 65% • В настоящее время основным источником пресной воды являются воды рек, озер, артезианских скважин и опреснение морской воды.

Круговорот воды в природе • Ежегодно вода испаряется с поверхности суши и океана и потом выпадает в виде осадков. • Вода в атмосфере в течение года обновляется 45 раз.
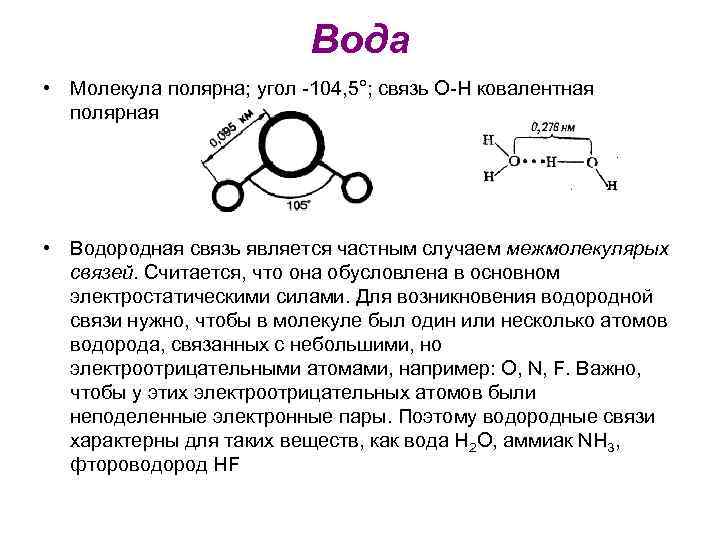
Вода • Молекула полярна; угол -104, 5°; связь O-H ковалентная полярная • Водородная связь является частным случаем межмолекулярых связей. Считается, что она обусловлена в основном электростатическими силами. Для возникновения водородной связи нужно, чтобы в молекуле был один или несколько атомов водорода, связанных с небольшими, но электроотрицательными атомами, например: O, N, F. Важно, чтобы у этих электроотрицательных атомов были неподеленные электронные пары. Поэтому водородные связи характерны для таких веществ, как вода H 2 O, аммиак NH 3, фтороводород HF
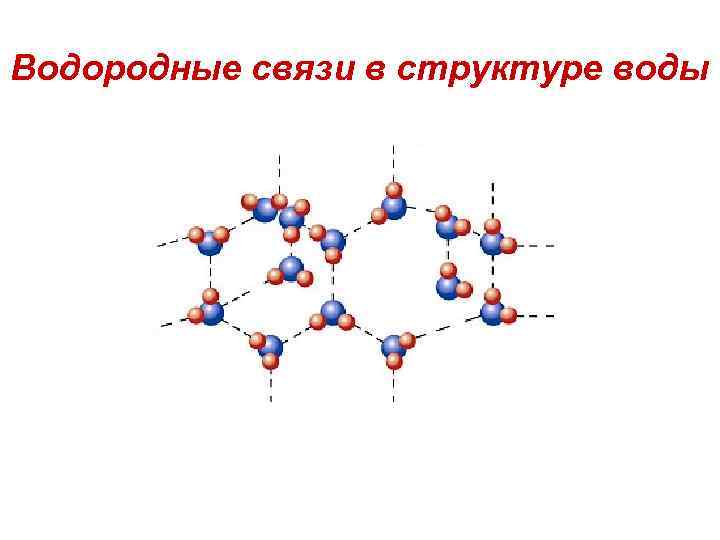
Водородные связи в структуре воды

Физические свойства D 2 O H 2 O Молекулярная масса 20 18 Плотность при 20°C(г/см 3) 1, 1050 0, 9982 t° кристаллизации (°C) 3, 8 0 t° кипения (°C) 101, 4 100 Химические реакции с тяжёлой водой протекают медленнее, чем с обычной водой.
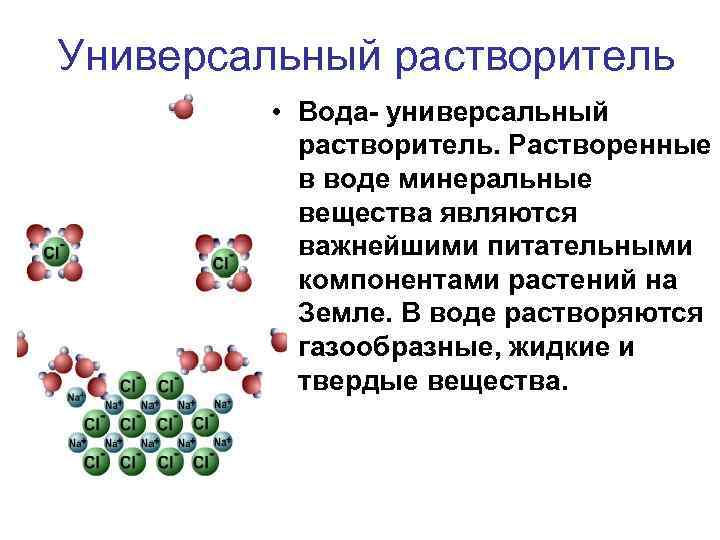
Универсальный растворитель • Вода- универсальный растворитель. Растворенные в воде минеральные вещества являются важнейшими питательными компонентами растений на Земле. В воде растворяются газообразные, жидкие и твердые вещества.

Качество воды • • • • Прозрачность Наличие растворенных неорг. веществ (нитраты) Окраска (хлориды железа) Температура Наличие растворенных орг. веществ (фенол) Вкус Наличие микроорганизмов Запах Наличие флоры и фауны р. Н Электропроводность Жесткость ХПК БПК

Загрязнение воды • • • Сточные воды Твердые отходы Эвторификация Токсичные неорганические отходы Микробиологическая загрязненность Пестициды Утечка нефти Кислотные дожди Радиоактивное и тепловое загрязнение
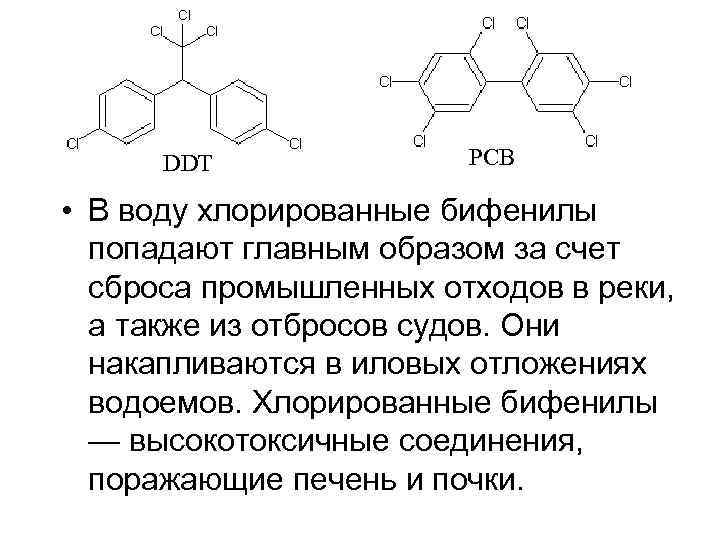
DDT PCB • В воду хлорированные бифенилы попадают главным образом за счет сброса промышленных отходов в реки, а также из отбросов судов. Они накапливаются в иловых отложениях водоемов. Хлорированные бифенилы — высокотоксичные соединения, поражающие печень и почки.

Химические реакции с участием воды • Кислотно-основные реакции Вода - амфотерное вещество. 2 H 2 O = H 3 О+ + OH-

• Окисление и восстановление С металлами : 2 Na + 2 H 2 O = 2 Na. OH + H 2 Ca + 2 H 2 O = Ca(OH)2 + H 2 3 Fe + 4 H 2 O =t°= Fe 3 O 4 + 4 H 2 С галогенами (продукты различны): 4 F 2 + 3 H 2 O = OF 2+ 6 HF + O 2 Cl 2 + H 2 O = HCl. O + HCl

• Гидратация Молекулы воды с некоторыми солями дают кристаллогидраты: Cu. SO 4(белый) + 5 H 2 O = Cu. SO 4· 5 H 2 O(синий)

• Гидролиз РCl 3 + 3 H 2 O = P (OH)3 + 3 HCl Гидролиз некоторых солей приводит к их полному разложению: Al 2 S 3 + 6 H 2 O = 2 Al(OH)3 + 3 H 2 S Al 2(CO 3)3 + 6 H 2 O = 2 Al(OH)3 + 3 H 2 O + 3 CO 2

Озон О 3 Озон - один из аллотропов кислорода. Голубой газ, плохо растворимый в воде. При концентрациях больше 100 р. р. m. – становится токсичным. Имя “озон” было присвоено газу изза характерного запаха и происходит от греческого слова “озиен”, что значит “пахнуть”.

Получение озона В верхних слоях атмосферы образуется из кислорода под действием УФ-лучей: 3 О 2 = 2 О 3, ΔНº = 284 к. Дж/моль
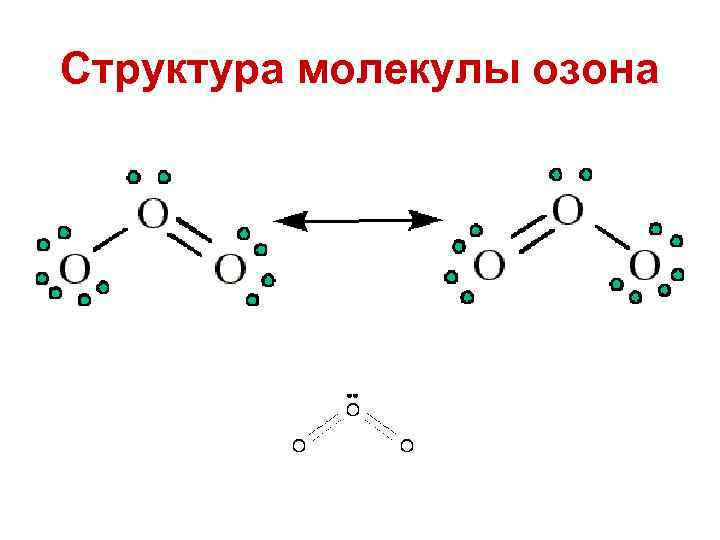
Структура молекулы озона

Получение озона. 1. Основным способом получения озона является пропускание тихого электрического разряда через кислород. 2. При медленном разложении фторида кислорода водой выделяется озон, кислород и фтороводород: 4 OF 2 + 4 H 2 O = 2 O 3 + O 2 + 8 HF.
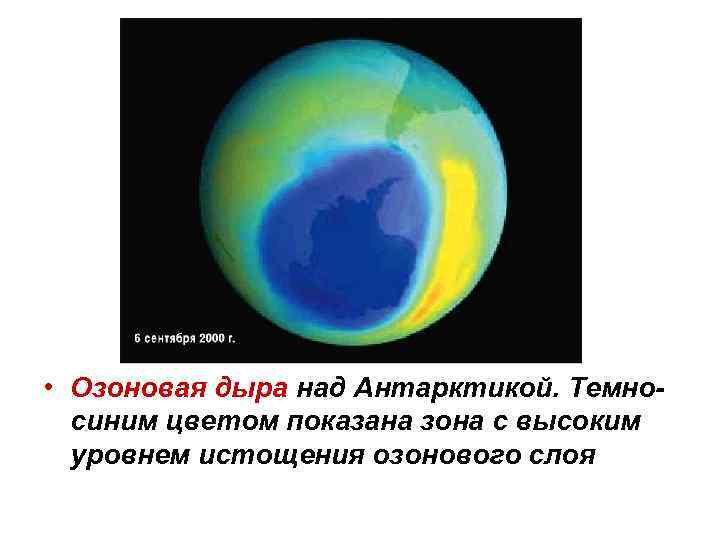
• Озоновая дыра над Антарктикой. Темносиним цветом показана зона с высоким уровнем истощения озонового слоя
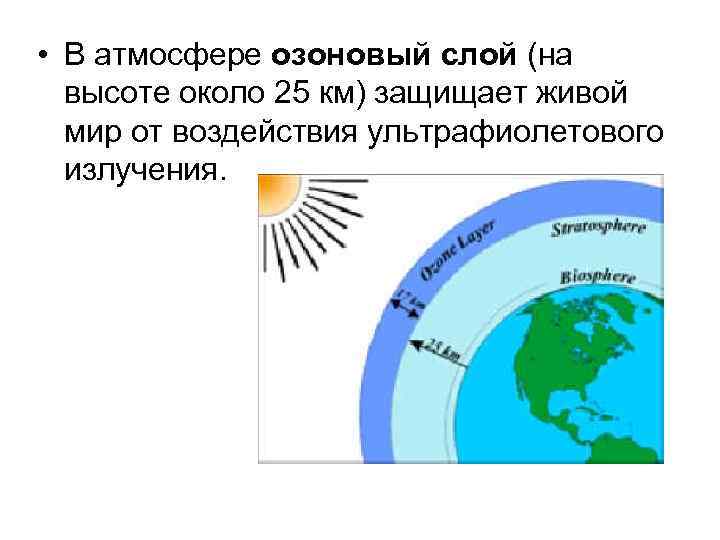
• В атмосфере озоновый слой (на высоте около 25 км) защищает живой мир от воздействия ультрафиолетового излучения.
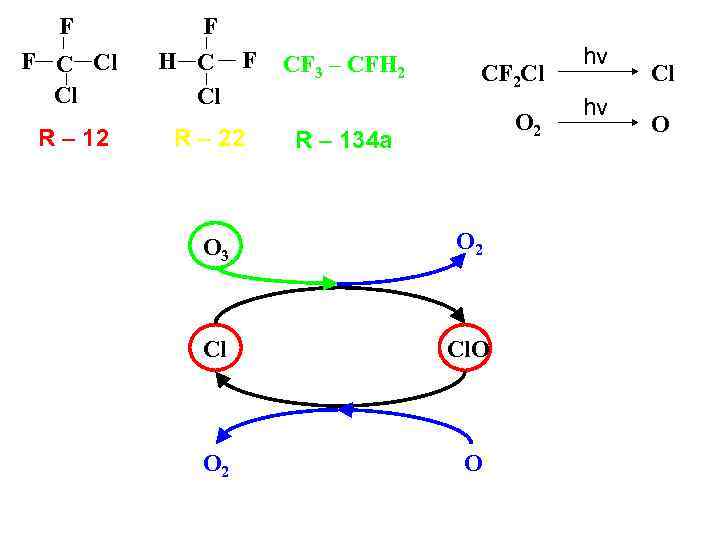
F F C Cl Cl R – 12 F H C F Cl CF 3 – CFH 2 R – 22 R – 134 a CF 2 Cl O 2 O 3 O 2 Cl Cl. O O 2 O hv hv Cl O

Свойства озона • Более сильный окислитель, чем кислород O 3 + H 2 O + 2 KI → I 2↓ + O 2↑ + 2 KOH (качественная реакция на озон) O 2 + H 2 O + 2 KI → • Озон окисляет все металлы за исключением золота и группы платины, доокисляет оксиды серы и азота, окисляет аммиак 2 Cu 2+ + 2 H 3 O+ + O 3 → 2 Cu 3+ + 3 H 2 O + O 2 3 SO 2 + 3 H 2 O + O 3 → 3 H 2 SO 4 NO 2 + O 3 → NO 3 + O 2 2 NH 3 + 4 O 3 → NH 4 NO 3 + 4 O 2 + H 2 O

• Озон является сильнейшим окислителем, окисляет даже золото и платину, и уступает только фтору и фториду кислорода. Действующее начало озона - атомарный кислород: 2 KI + O 3 + H 2 O = I 2 + 2 KOH + O 2 4 O 3 + 3 Pb. S = 3 Pb. SO 4 O 3 + H 2 S = SO 2 + H 2 O 3 O 3 + Cr = Cr. O 3 + 3 O 2

• Взаимодействует с металлами или их гидроксидами в особых условиях, образуя озониды состава K+O 3–, которые обычно окрашены в красный цвет: 4 KOH + 4 O 3 = 4 KO 3 + O 2 + 2 H 2 O.
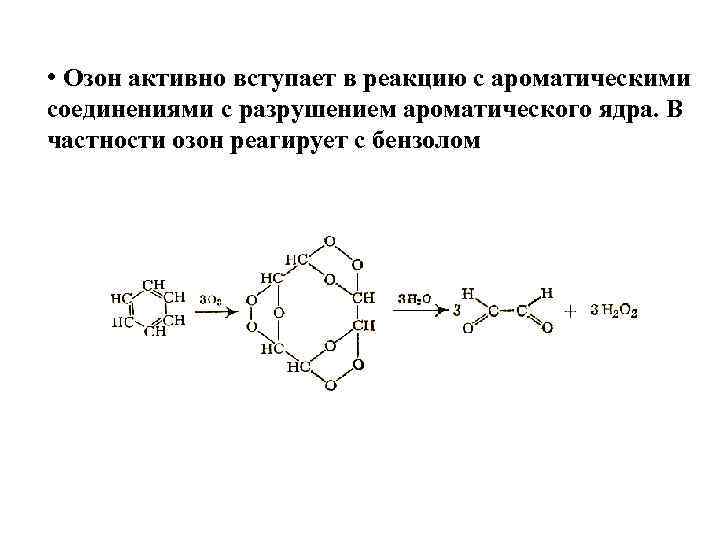
• Озон активно вступает в реакцию с ароматическими соединениями с разрушением ароматического ядра. В частности озон реагирует с бензолом
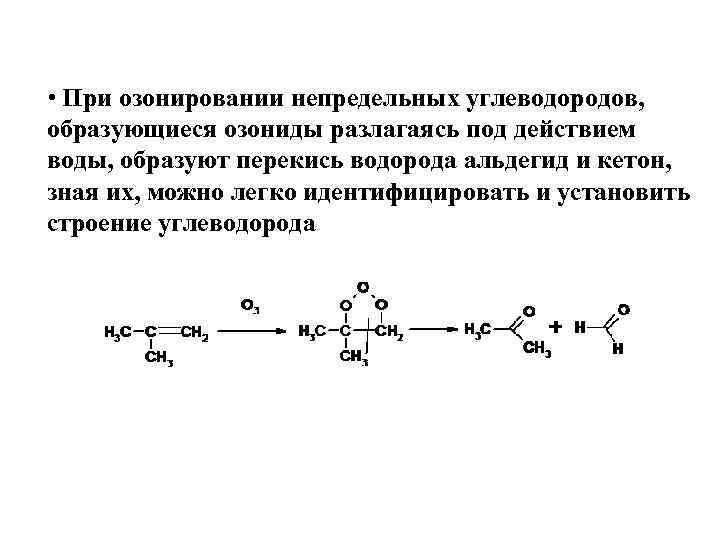
• При озонировании непредельных углеводородов, образующиеся озониды разлагаясь под действием воды, образуют перекись водорода альдегид и кетон, зная их, можно легко идентифицировать и установить строение углеводорода

• Взаимодействие озона с органическими соединениями находит широкое применение в химической промышленности и в смежных отраслях. Реакции озона с ароматическими соединениями легли в основу технологий дезодорации различных сред, помещений и сточных вод.

• Качественная реакция: O 3 + H 2 O + 2 KI = I 2↓ + O 2↑ + 2 KOH (кислород O 2 в реакцию не вступает).

• При озонировании непредельных углеводородов, образуюшиеся озониды разлагаясь под действием воды, образуют перекись водорода альдегид и кетон, зная их, можно легко идентифицировать и установить строение углеводорода.

Применение озона • Озон применяют для дезинфекции воды. • В медицине. • Для отбеливания тканей и очистки некоторых соединений. • Для идентификации соединений.
Лекция 2 Кислород.ppt