Элементы 1 -В группы Zn

























 Элементы 1 -В группы Zn Cd Hg Cn
Элементы 1 -В группы Zn Cd Hg Cn
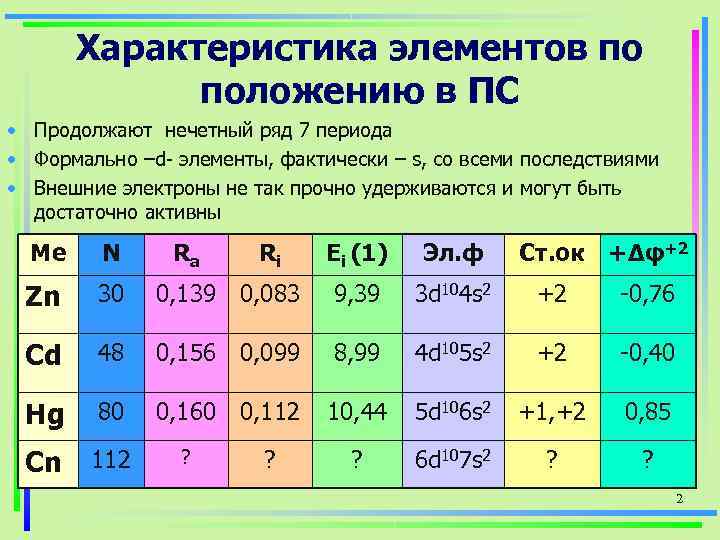
 Характеристика элементов по положению в ПС • Продолжают нечетный ряд 7 периода • Формально –d- элементы, фактически – s, со всеми последствиями • Внешние электроны не так прочно удерживаются и могут быть достаточно активны Ме N Ra Ri Ei (1) Эл. ф Ст. ок +Δφ+2 Zn 30 0, 139 0, 083 9, 39 3 d 104 s 2 +2 -0, 76 Cd 48 0, 156 0, 099 8, 99 4 d 105 s 2 +2 -0, 40 Hg 80 0, 160 0, 112 10, 44 5 d 106 s 2 +1, +2 0, 85 Cn 112 ? ? ? 6 d 107 s 2 ? 2
Характеристика элементов по положению в ПС • Продолжают нечетный ряд 7 периода • Формально –d- элементы, фактически – s, со всеми последствиями • Внешние электроны не так прочно удерживаются и могут быть достаточно активны Ме N Ra Ri Ei (1) Эл. ф Ст. ок +Δφ+2 Zn 30 0, 139 0, 083 9, 39 3 d 104 s 2 +2 -0, 76 Cd 48 0, 156 0, 099 8, 99 4 d 105 s 2 +2 -0, 40 Hg 80 0, 160 0, 112 10, 44 5 d 106 s 2 +1, +2 0, 85 Cn 112 ? ? ? 6 d 107 s 2 ? 2
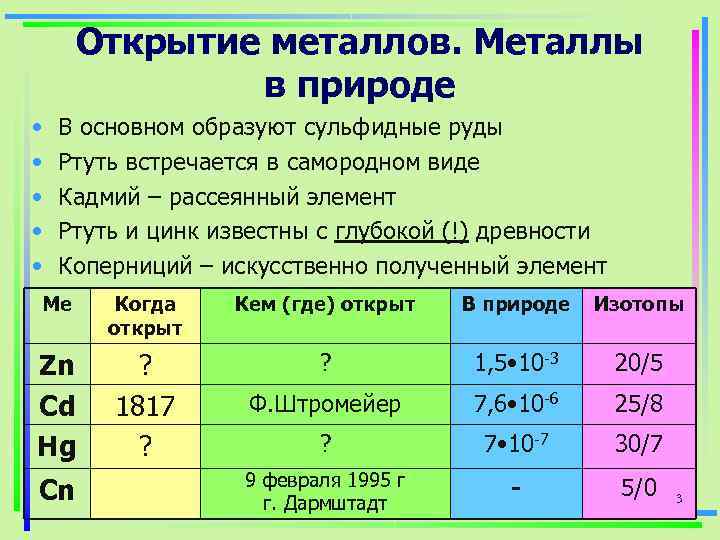
 Открытие металлов. Металлы в природе • В основном образуют сульфидные руды • Ртуть встречается в самородном виде • Кадмий – рассеянный элемент • Ртуть и цинк известны с глубокой (!) древности • Коперниций – искусственно полученный элемент Ме Когда Кем (где) открыт В природе Изотопы открыт Zn ? 1, 5 • 10 -3 20/5 Cd 1817 Ф. Штромейер 7, 6 • 10 -6 25/8 Hg ? 7 • 10 -7 30/7 9 февраля 1995 г Cn г. Дармштадт - 5/0 3
Открытие металлов. Металлы в природе • В основном образуют сульфидные руды • Ртуть встречается в самородном виде • Кадмий – рассеянный элемент • Ртуть и цинк известны с глубокой (!) древности • Коперниций – искусственно полученный элемент Ме Когда Кем (где) открыт В природе Изотопы открыт Zn ? 1, 5 • 10 -3 20/5 Cd 1817 Ф. Штромейер 7, 6 • 10 -6 25/8 Hg ? 7 • 10 -7 30/7 9 февраля 1995 г Cn г. Дармштадт - 5/0 3
 Получение металлов • Цинк – обжигом сульфидной руды с последующим восстановлением углем или оксидом углерода или переводом оксида в сульфат с последующим электролизом • Кадмий – из остатков переработки меди, цинка, свинца путем перевода в сульфат, очистки раствора и выделения электролизом или цинком • Ртуть – разложение сульфида при 8000 С • Коперниций впервые получен по реакции: 4
Получение металлов • Цинк – обжигом сульфидной руды с последующим восстановлением углем или оксидом углерода или переводом оксида в сульфат с последующим электролизом • Кадмий – из остатков переработки меди, цинка, свинца путем перевода в сульфат, очистки раствора и выделения электролизом или цинком • Ртуть – разложение сульфида при 8000 С • Коперниций впервые получен по реакции: 4
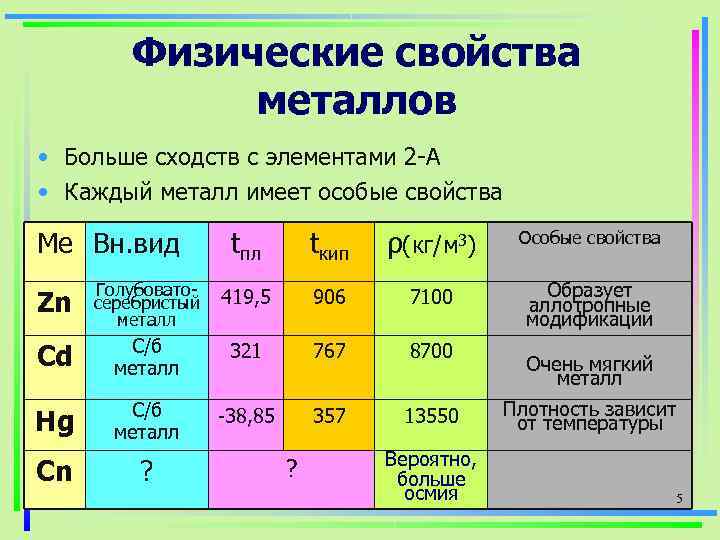
 Физические свойства металлов • Больше сходств с элементами 2 -А • Каждый металл имеет особые свойства Ме Вн. вид tпл tкип ρ(кг/м 3) Особые свойства Голубовато- Образует Zn серебристый металл 419, 5 906 7100 аллотропные модификации С/б Cd металл 321 767 8700 Очень мягкий металл С/б Плотность зависит Hg металл -38, 85 357 13550 от температуры Вероятно, Cn ? больше осмия 5
Физические свойства металлов • Больше сходств с элементами 2 -А • Каждый металл имеет особые свойства Ме Вн. вид tпл tкип ρ(кг/м 3) Особые свойства Голубовато- Образует Zn серебристый металл 419, 5 906 7100 аллотропные модификации С/б Cd металл 321 767 8700 Очень мягкий металл С/б Плотность зависит Hg металл -38, 85 357 13550 от температуры Вероятно, Cn ? больше осмия 5
 Свойства простых веществ и соединений Соединения цинка Соединения кадмия Соединения ртути Применение металлов
Свойства простых веществ и соединений Соединения цинка Соединения кадмия Соединения ртути Применение металлов
 Простые вещества металлы • Типичные металлы с достаточной химической активностью • Цинк – наиболее типичен, взаимодействует с кислотами, растворами щелочей, окисляется кислородом, взаимодействует с другими неметаллами: 2 Zn +O 2 = 2 Zn. O Zn +2 HCl = Zn. Cl 2+H 2 Zn +2 Na. OH = Na 2 Zn. O 2+H 2 Zn+S = Zn. S 7
Простые вещества металлы • Типичные металлы с достаточной химической активностью • Цинк – наиболее типичен, взаимодействует с кислотами, растворами щелочей, окисляется кислородом, взаимодействует с другими неметаллами: 2 Zn +O 2 = 2 Zn. O Zn +2 HCl = Zn. Cl 2+H 2 Zn +2 Na. OH = Na 2 Zn. O 2+H 2 Zn+S = Zn. S 7
 Простые вещества металлы • Кадмий при нагревании реагирует с неметаллами, растворяется в разбавленных кислотах, в порошкообразном виде реагирует с водой • Ртуть обладает большей химической инертностью: - с азотной и серной кислотами взаимодействует с образованием оксидов серы и азота, аналогично меди - с кислородом образует оксид при 3000 С -с серой реагирует при растирании -с галогенами взаимодействует при обычных условиях 8
Простые вещества металлы • Кадмий при нагревании реагирует с неметаллами, растворяется в разбавленных кислотах, в порошкообразном виде реагирует с водой • Ртуть обладает большей химической инертностью: - с азотной и серной кислотами взаимодействует с образованием оксидов серы и азота, аналогично меди - с кислородом образует оксид при 3000 С -с серой реагирует при растирании -с галогенами взаимодействует при обычных условиях 8
 Соединения цинка Оксид Гидроксид Соли Комплексные соединения
Соединения цинка Оксид Гидроксид Соли Комплексные соединения
 Оксид цинка • Zn. O – твердое вещество белого цвета • Обладает амфотерными свойствами, растворяется в кислотах и щелочах: Zn. O+2 HCl = Zn. Cl 2 + H 2 O ([Zn(H 2 O)4]Cl 2) Zn. O + 2 Na. OH = Na 2 Zn. O 2 +H 2 O (Na 2[Zn(OH)4]) • В воде оксид цинка растворяется плохо, но при длительном контакте с водой переходит в гидроксид: Zn. O + H 2 O = Zn(OН)2 • Оксид цинка не токсичен, входит в состав красок как белый пигмент 10
Оксид цинка • Zn. O – твердое вещество белого цвета • Обладает амфотерными свойствами, растворяется в кислотах и щелочах: Zn. O+2 HCl = Zn. Cl 2 + H 2 O ([Zn(H 2 O)4]Cl 2) Zn. O + 2 Na. OH = Na 2 Zn. O 2 +H 2 O (Na 2[Zn(OH)4]) • В воде оксид цинка растворяется плохо, но при длительном контакте с водой переходит в гидроксид: Zn. O + H 2 O = Zn(OН)2 • Оксид цинка не токсичен, входит в состав красок как белый пигмент 10
 Гидроксид цинка • Zn(OН)2 – белый студенистый осадок, при стоянии переходит в кристаллическую форму • Мало растворим в воде, выпадает в осадок в результате реакций обмена: Zn. Cl 2 + 2 Na. OH = Zn(OН)2 + 2 Na. Cl • Обладает ярко выраженными амфотерными свойствами: Zn(OН)2 +2 HCl = Zn. Cl 2 + 2 H 2 O ([Zn(H 2 O)4]Cl 2) Zn(OН)2 + 2 Na. OH = Na 2 Zn. O 2 +2 H 2 O (Na 2[Zn(OH)4]) • Растворяется в водном растворе аммиака: Zn(OН)2 + 4 NH 3 = [Zn(NH 3)4](OH)2 11
Гидроксид цинка • Zn(OН)2 – белый студенистый осадок, при стоянии переходит в кристаллическую форму • Мало растворим в воде, выпадает в осадок в результате реакций обмена: Zn. Cl 2 + 2 Na. OH = Zn(OН)2 + 2 Na. Cl • Обладает ярко выраженными амфотерными свойствами: Zn(OН)2 +2 HCl = Zn. Cl 2 + 2 H 2 O ([Zn(H 2 O)4]Cl 2) Zn(OН)2 + 2 Na. OH = Na 2 Zn. O 2 +2 H 2 O (Na 2[Zn(OH)4]) • Растворяется в водном растворе аммиака: Zn(OН)2 + 4 NH 3 = [Zn(NH 3)4](OH)2 11
 Соли цинка Zn 2+ • Большинство хорошо растворяются в воде • Подвергаются гидролизу по катиону (р. Н<6) • Важнейшее значение имеют: -хлорид – для очистки поверхностей металлов при их пайке и сварке -сульфид – обладает способностью к люминесценции -сульфат - антисептик -нитрат цинка – в лабораторной практике 12
Соли цинка Zn 2+ • Большинство хорошо растворяются в воде • Подвергаются гидролизу по катиону (р. Н<6) • Важнейшее значение имеют: -хлорид – для очистки поверхностей металлов при их пайке и сварке -сульфид – обладает способностью к люминесценции -сульфат - антисептик -нитрат цинка – в лабораторной практике 12
 Комплексные соединения цинка • Координационное число – 4, реже – 6 • Примеры комплексов: Ме 2[Zn(OH)4] [Zn(H 2 O)4]SO 4 [Zn(NH 3)4]Cl 2 Ba 2[Zn(OH)6] Zn. NO 3· 6 H 2 O Zn. SO 4 · 7 H 2 O Zn(Br. O 3)2 · 6 H 2 O 13
Комплексные соединения цинка • Координационное число – 4, реже – 6 • Примеры комплексов: Ме 2[Zn(OH)4] [Zn(H 2 O)4]SO 4 [Zn(NH 3)4]Cl 2 Ba 2[Zn(OH)6] Zn. NO 3· 6 H 2 O Zn. SO 4 · 7 H 2 O Zn(Br. O 3)2 · 6 H 2 O 13
 Соединения кадмия Оксид Гидроксид Соли Комплексные соединения
Соединения кадмия Оксид Гидроксид Соли Комплексные соединения
 Оксид кадмия • Сd. O – твердое вещество цвет -? • Цвет зависит от размера частиц Способ получения Цвет Разложение гидроксида при 350 -3700 С Зеленовато-желтый Разложение гидроксида при 8000 С Темно-синий Прокаливание карбоната Коричневый Разложение нитрата Черный • Основный оксид со слабо выраженными амфотерными свойствами • Практически нерастворим в воде • При нагревании до 7000 С возгоняется • Легко восстанавливается водородом и углем до чистого металла 15
Оксид кадмия • Сd. O – твердое вещество цвет -? • Цвет зависит от размера частиц Способ получения Цвет Разложение гидроксида при 350 -3700 С Зеленовато-желтый Разложение гидроксида при 8000 С Темно-синий Прокаливание карбоната Коричневый Разложение нитрата Черный • Основный оксид со слабо выраженными амфотерными свойствами • Практически нерастворим в воде • При нагревании до 7000 С возгоняется • Легко восстанавливается водородом и углем до чистого металла 15
 Гидроксид кадмия • Сd(OН)2 –осадок белого цвета, образуется в реакциях обмена: Сd(NO 3)2+ 2 Na. OH = Сd(ОН)2 + 2 Na. NO 3 • Практически нерастворим в щелочах, но растворяется в кислотах, цианидах, растворе аммиака: Сd(ОН)2 + 2 НNO 3 = Сd(NO 3)2+ 2 Н 2 О Сd(ОН)2 + 4 КСN = К 2[Cd(CN)4] + 2 KOH Сd(ОН)2 + 4 NH 3 = [Cd(NH 3)4](OH)2 • При длительном кипячении в щелочах протекает реакция: Сd(ОН)2 + 4 Na. OH = Na 4[Cd(ОН)6] 16
Гидроксид кадмия • Сd(OН)2 –осадок белого цвета, образуется в реакциях обмена: Сd(NO 3)2+ 2 Na. OH = Сd(ОН)2 + 2 Na. NO 3 • Практически нерастворим в щелочах, но растворяется в кислотах, цианидах, растворе аммиака: Сd(ОН)2 + 2 НNO 3 = Сd(NO 3)2+ 2 Н 2 О Сd(ОН)2 + 4 КСN = К 2[Cd(CN)4] + 2 KOH Сd(ОН)2 + 4 NH 3 = [Cd(NH 3)4](OH)2 • При длительном кипячении в щелочах протекает реакция: Сd(ОН)2 + 4 Na. OH = Na 4[Cd(ОН)6] 16
 Соли кадмия • Галогениды – легко образуются прямым взаимодействием металла с галогенами или его соединений с соответствующими кислотами, растворимы, бесцветны, не имеют практического значения • Сульфид – входит в состав природных минералов, используется для изготовления желтой краски и цветных стекол, в пиротехнике – синий цвет • Селенид – окраска стекла, рубиновое стекло для Кремлевских звезд • Сульфат – промежуточный продукт получения кадмия 17
Соли кадмия • Галогениды – легко образуются прямым взаимодействием металла с галогенами или его соединений с соответствующими кислотами, растворимы, бесцветны, не имеют практического значения • Сульфид – входит в состав природных минералов, используется для изготовления желтой краски и цветных стекол, в пиротехнике – синий цвет • Селенид – окраска стекла, рубиновое стекло для Кремлевских звезд • Сульфат – промежуточный продукт получения кадмия 17
 Комплексные соединения кадмия • Координационное число – 4, 6 • Аммиачные комплексы легко образуются при добавлении раствора аммиака к гидроксиду или любой соли кадмия • Примеры комплексов: [Cd(NH 3)6](NO 3)2 [Cd(NH 3)4 Cl 2] K 4[Cd(OH)6] K 2[Cd(Cl)4] 18
Комплексные соединения кадмия • Координационное число – 4, 6 • Аммиачные комплексы легко образуются при добавлении раствора аммиака к гидроксиду или любой соли кадмия • Примеры комплексов: [Cd(NH 3)6](NO 3)2 [Cd(NH 3)4 Cl 2] K 4[Cd(OH)6] K 2[Cd(Cl)4] 18
 Соединения ртути Оксиды Гидроксиды Соли Комплексные соединения
Соединения ртути Оксиды Гидроксиды Соли Комплексные соединения
 Оксиды ртути Hg 2 O – вещество черного цвета, неустойчиво, поэтому сведения скудные Оксиды ртути Hg. O желтый красный Кристаллы мельче, плотность 11, 14 Кристаллы крупнее, плотность 11, 14 При нагревании краснеет При нагревании чернеет При достаточно сильном нагревании разлагаются с выделением кислорода: 2 Hg. O = 2 Hg + О 2 Растворяются в кислотах, проявляя основные свойства: Hg. O + 2 НNO 3 = Hg(NO 3)2 + 2 Н 2 О Получается по реакции: Получается по реакции: 2 Hg(NO 3)2 = 2 Hg. O + 4 NO 2 + О 2 Hg. Cl 2 + 2 Na. OH = Hg. O+2 Na. Cl+H 220 O
Оксиды ртути Hg 2 O – вещество черного цвета, неустойчиво, поэтому сведения скудные Оксиды ртути Hg. O желтый красный Кристаллы мельче, плотность 11, 14 Кристаллы крупнее, плотность 11, 14 При нагревании краснеет При нагревании чернеет При достаточно сильном нагревании разлагаются с выделением кислорода: 2 Hg. O = 2 Hg + О 2 Растворяются в кислотах, проявляя основные свойства: Hg. O + 2 НNO 3 = Hg(NO 3)2 + 2 Н 2 О Получается по реакции: Получается по реакции: 2 Hg(NO 3)2 = 2 Hg. O + 4 NO 2 + О 2 Hg. Cl 2 + 2 Na. OH = Hg. O+2 Na. Cl+H 220 O
 Гидроксиды ртути Hg. OН – неустойчив, разлагается в момент образования, особого интереса не представляет Hg(OН)2 – неустойчив, разлагается в момент образования на оксид и воду, вероятно, основание, теоретически должен взаимодействовать с кислотами : Hg (OH)2 + 2 НNО 3 = Hg(NО 3)2 + 2 H 2 O 21
Гидроксиды ртути Hg. OН – неустойчив, разлагается в момент образования, особого интереса не представляет Hg(OН)2 – неустойчив, разлагается в момент образования на оксид и воду, вероятно, основание, теоретически должен взаимодействовать с кислотами : Hg (OH)2 + 2 НNО 3 = Hg(NО 3)2 + 2 H 2 O 21
 Соли ртути Hg 22+: -Hg-Hg- Проявляют свойства окислителей и восстановителей: Hg 2 Cl 2 + Cl 2 = 2 Hg. Cl 2 Hg 2 Cl 2 + Sn. Cl 2 = 2 Hg + Sn. Cl 4 Наиболее известны: Hg 2 Cl 2 – каломель Hg 2 (NО 3)2· 2 H 2 O, получается при действии на ртуть холодной НNО 3 Hg 2+ Hg. Cl 2 – сулема, сильный яд Hg (NО 3)2 – наиболее часто используется в лаборатории Hg. S – имеет три модификации: черная и две красных – α и β – киноварь ( можно получить до 28 оттенков) 22
Соли ртути Hg 22+: -Hg-Hg- Проявляют свойства окислителей и восстановителей: Hg 2 Cl 2 + Cl 2 = 2 Hg. Cl 2 Hg 2 Cl 2 + Sn. Cl 2 = 2 Hg + Sn. Cl 4 Наиболее известны: Hg 2 Cl 2 – каломель Hg 2 (NО 3)2· 2 H 2 O, получается при действии на ртуть холодной НNО 3 Hg 2+ Hg. Cl 2 – сулема, сильный яд Hg (NО 3)2 – наиболее часто используется в лаборатории Hg. S – имеет три модификации: черная и две красных – α и β – киноварь ( можно получить до 28 оттенков) 22
 Комплексные соединения ртути • Координационное число – 2, 4, 6 • В целом, по составу аналогичны соединениям цинка и кадмия 23
Комплексные соединения ртути • Координационное число – 2, 4, 6 • В целом, по составу аналогичны соединениям цинка и кадмия 23
 Применение металлов • Цинк – цветной металл, электротехника, сплавы • Кадмий – редкий металл, легкоплавкие сплавы, электротехника, атомная энергетика • Ртуть – амальгамы, лампы дневного света, катод, катализатор химических процессов 24
Применение металлов • Цинк – цветной металл, электротехника, сплавы • Кадмий – редкий металл, легкоплавкие сплавы, электротехника, атомная энергетика • Ртуть – амальгамы, лампы дневного света, катод, катализатор химических процессов 24
 Биологическое значение • Цинк – микроэлемент, входит в состав инсулина, дыхательных ферментов • Кадмий – нетоксичен, но соединения очень ядовиты: угнетают действие ферментных систем, провоцируют сердечно-сосудистые заболевания • Ртуть – обладает ядовитыми свойствами, приводит к угнетению нервной системы; может накапливаться в живых тканях Все соединения цинка, кадмия, ртути ядовиты! 25
Биологическое значение • Цинк – микроэлемент, входит в состав инсулина, дыхательных ферментов • Кадмий – нетоксичен, но соединения очень ядовиты: угнетают действие ферментных систем, провоцируют сердечно-сосудистые заболевания • Ртуть – обладает ядовитыми свойствами, приводит к угнетению нервной системы; может накапливаться в живых тканях Все соединения цинка, кадмия, ртути ядовиты! 25
 Коперниций Наиболее стабильное ядро - , 285 Cn, 112 протонов, 173 нейтрона, период полураспада около 34 секунд В настоящее время известны трансурановые элементы с номерами 113— 118, полученные в в Дубне, при этом независимыми исследованиями подтверждено только открытие элемента под номером 114 Открытие 112 -го элемента было признано в мае 2009 г Международным союзом теоретической и прикладной химии Учёные GSI (Gesellschaft für Schwerionenforschung ) предложили для 112 элемента название Copernicium (Cn) в честь Николая Коперника, 19 февраля 2010 г, в день рождения Коперника, ИЮПАК официально утвердил название элемента 26
Коперниций Наиболее стабильное ядро - , 285 Cn, 112 протонов, 173 нейтрона, период полураспада около 34 секунд В настоящее время известны трансурановые элементы с номерами 113— 118, полученные в в Дубне, при этом независимыми исследованиями подтверждено только открытие элемента под номером 114 Открытие 112 -го элемента было признано в мае 2009 г Международным союзом теоретической и прикладной химии Учёные GSI (Gesellschaft für Schwerionenforschung ) предложили для 112 элемента название Copernicium (Cn) в честь Николая Коперника, 19 февраля 2010 г, в день рождения Коперника, ИЮПАК официально утвердил название элемента 26
 Спасибо за внимание и плодотворную работу! 27
Спасибо за внимание и плодотворную работу! 27

