Элементы 1 -В группы Cu



















![Комплексные соединения золота • Галогеноаураты: H[Au. Cl 4] • Комплексные соединения золота • Галогеноаураты: H[Au. Cl 4] •](https://present5.com/presentation/3/37650700_174317567.pdf-img/37650700_174317567.pdf-23.jpg)




 Элементы 1 -В группы Cu Ag Au Rg
Элементы 1 -В группы Cu Ag Au Rg
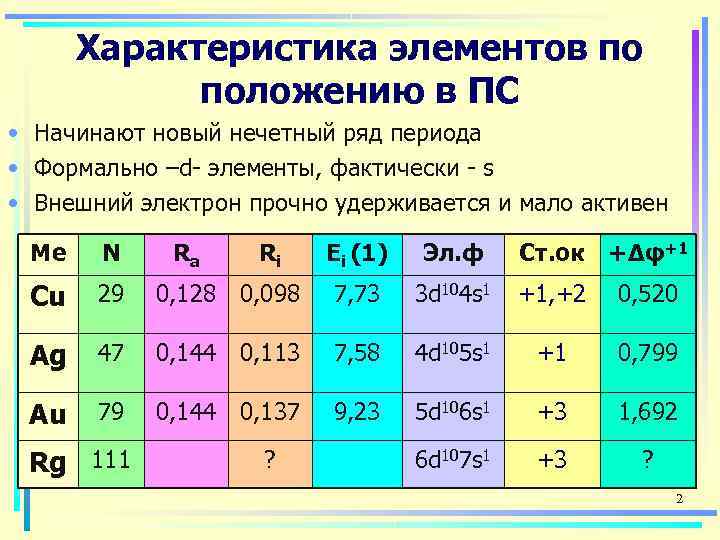
 Характеристика элементов по положению в ПС • Начинают новый нечетный ряд периода • Формально –d- элементы, фактически - s • Внешний электрон прочно удерживается и мало активен Ме N Ra Ri Ei (1) Эл. ф Ст. ок +Δφ+1 Cu 29 0, 128 0, 098 7, 73 3 d 104 s 1 +1, +2 0, 520 Ag 47 0, 144 0, 113 7, 58 4 d 105 s 1 +1 0, 799 Au 79 0, 144 0, 137 9, 23 5 d 106 s 1 +3 1, 692 Rg 111 ? 6 d 107 s 1 +3 ? 2
Характеристика элементов по положению в ПС • Начинают новый нечетный ряд периода • Формально –d- элементы, фактически - s • Внешний электрон прочно удерживается и мало активен Ме N Ra Ri Ei (1) Эл. ф Ст. ок +Δφ+1 Cu 29 0, 128 0, 098 7, 73 3 d 104 s 1 +1, +2 0, 520 Ag 47 0, 144 0, 113 7, 58 4 d 105 s 1 +1 0, 799 Au 79 0, 144 0, 137 9, 23 5 d 106 s 1 +3 1, 692 Rg 111 ? 6 d 107 s 1 +3 ? 2
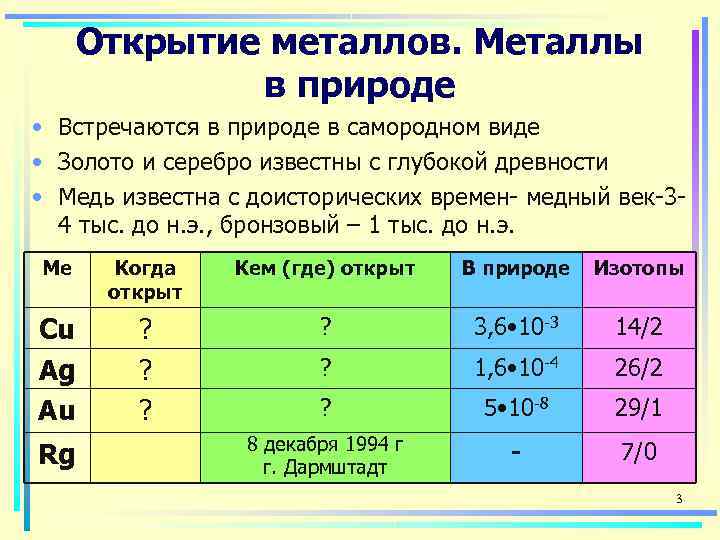
 Открытие металлов. Металлы в природе • Встречаются в природе в самородном виде • Золото и серебро известны с глубокой древности • Медь известна с доисторических времен- медный век-3 - 4 тыс. до н. э. , бронзовый – 1 тыс. до н. э. Ме Когда Кем (где) открыт В природе Изотопы открыт Cu ? 3, 6 • 10 -3 14/2 Ag ? 1, 6 • 10 -4 26/2 Au ? 5 • 10 -8 29/1 8 декабря 1994 г Rg г. Дармштадт - 7/0 3
Открытие металлов. Металлы в природе • Встречаются в природе в самородном виде • Золото и серебро известны с глубокой древности • Медь известна с доисторических времен- медный век-3 - 4 тыс. до н. э. , бронзовый – 1 тыс. до н. э. Ме Когда Кем (где) открыт В природе Изотопы открыт Cu ? 3, 6 • 10 -3 14/2 Ag ? 1, 6 • 10 -4 26/2 Au ? 5 • 10 -8 29/1 8 декабря 1994 г Rg г. Дармштадт - 7/0 3
 Получение металлов • Медь – обжигом сульфидной руды с последующим восстановлением • Серебро – электрометаллургия • Золото – промывка руд водой • Рентгений впервые получен по реакции: 4
Получение металлов • Медь – обжигом сульфидной руды с последующим восстановлением • Серебро – электрометаллургия • Золото – промывка руд водой • Рентгений впервые получен по реакции: 4
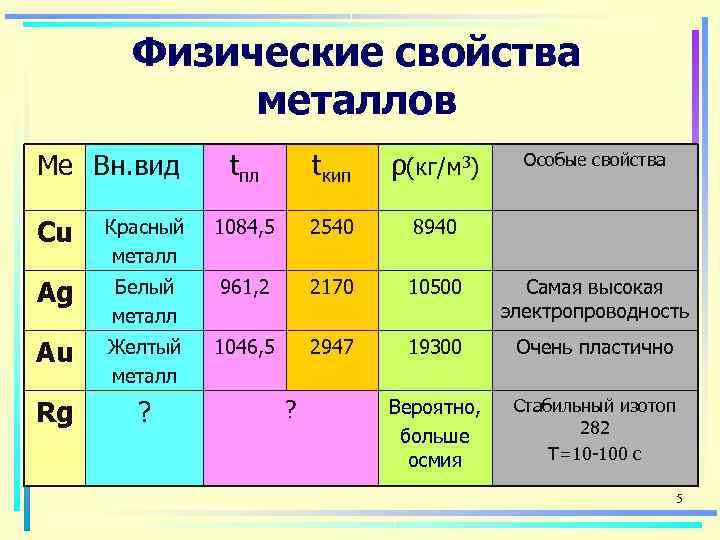
 Физические свойства металлов Ме Вн. вид tпл tкип ρ(кг/м 3) Особые свойства Cu Красный 1084, 5 2540 8940 металл Ag Белый 961, 2 2170 10500 Самая высокая металл электропроводность Au Желтый 1046, 5 2947 19300 Очень пластично металл Rg ? Вероятно, Стабильный изотоп 282 больше осмия Т=10 -100 с 5
Физические свойства металлов Ме Вн. вид tпл tкип ρ(кг/м 3) Особые свойства Cu Красный 1084, 5 2540 8940 металл Ag Белый 961, 2 2170 10500 Самая высокая металл электропроводность Au Желтый 1046, 5 2947 19300 Очень пластично металл Rg ? Вероятно, Стабильный изотоп 282 больше осмия Т=10 -100 с 5
 Свойства простых веществ и соединений Соединения меди Соединения серебра Соединения золота Применение металлов
Свойства простых веществ и соединений Соединения меди Соединения серебра Соединения золота Применение металлов
 Простые вещества металлы • Типичные металлы • Имеют высокую электропроводность • Все очень пластичны • Все химически малоактивны и вступают в реакции только с активными окислителями при нагревании: 2 Cu+O 2 = 2 Cu. O – 400 -5000 C (Cu 2 O- 10000 C) Cu+S =Cu. S – 4000 C (Cu 2 S - > 4000 C) Cu+Cl 2 = Cu. Cl 2 (2 Cu+I 2 = 2 Cu. I) 2 Ag+S=Ag 2 S 2 Au+3 Cl 2 +2 HCl= 2 H[Au. Cl 4] 7
Простые вещества металлы • Типичные металлы • Имеют высокую электропроводность • Все очень пластичны • Все химически малоактивны и вступают в реакции только с активными окислителями при нагревании: 2 Cu+O 2 = 2 Cu. O – 400 -5000 C (Cu 2 O- 10000 C) Cu+S =Cu. S – 4000 C (Cu 2 S - > 4000 C) Cu+Cl 2 = Cu. Cl 2 (2 Cu+I 2 = 2 Cu. I) 2 Ag+S=Ag 2 S 2 Au+3 Cl 2 +2 HCl= 2 H[Au. Cl 4] 7
 Простые вещества металлы • Медь и серебро реагируют с азотной кислотой с образованием солей и NO 2 и серной концентрированной с образованием солей и SO 2: Cu +4 HNO 3 = Cu(NO 3)2 + 2 NO 2 +H 2 O Cu+2 H 2 SO 4 = Cu. SO 4 +SO 2+2 H 2 O • Золото растворяется в царской водке: Au+HNO 3 + 4 HCl = H[Au. Cl 4] + NO+2 H 2 O • Все металлы переходят в раствор при контакте с окислителями и возможными лигандами; 4 Au + 8 KCN +O 2 + 2 H 2 O = 4 K[Au(CN)2] + 4 KOH 2 Cu+O 2 + 8 NH 3 +2 H 2) = 2[Cu(NH 3)4](OH)2 8
Простые вещества металлы • Медь и серебро реагируют с азотной кислотой с образованием солей и NO 2 и серной концентрированной с образованием солей и SO 2: Cu +4 HNO 3 = Cu(NO 3)2 + 2 NO 2 +H 2 O Cu+2 H 2 SO 4 = Cu. SO 4 +SO 2+2 H 2 O • Золото растворяется в царской водке: Au+HNO 3 + 4 HCl = H[Au. Cl 4] + NO+2 H 2 O • Все металлы переходят в раствор при контакте с окислителями и возможными лигандами; 4 Au + 8 KCN +O 2 + 2 H 2 O = 4 K[Au(CN)2] + 4 KOH 2 Cu+O 2 + 8 NH 3 +2 H 2) = 2[Cu(NH 3)4](OH)2 8
 Соединения меди Оксиды Гидроксиды Соли Комплексные соединения
Соединения меди Оксиды Гидроксиды Соли Комплексные соединения
 Оксиды меди Cu 2 O- твердое вещество красного цвета, восстановитель, имеет слабые амфотерные свойства с преобладанием основных: Cu 2 O + 4 HCl = 2 Н[Сu. Cl 2] +Н 2 О Cu 2 O + H 2 SO 4 = Cu. SO 4 + Cu + Н 2 О Cu 2 O + 2 КОН + Н 2 О = 2 К[Сu(ОН)2] - дигидроксокупрат(I) калия С раствором аммиака образует комплексное соединение: Cu 2 O + 4 NH 4 ОН = 2[Cu(NH 3)2](OH) +3 Н 2 О Cu. O –порошок черного цвета, обладает амфотерными свойствами, при нагревании взаимодействует с кислотами и щелочами: Cu. O + H 2 SO 4 = Cu. SO 4 + Н 2 О Cu. O + 2 КОН = К 2 Cu. O 2 + Н 2 О Растворяется в водном растворе аммиака: Cu 2 O + 4 NH 4 ОН = [Cu(NH 3)4](OH)2 +3 Н 2 О Обладает окислительными свойствами: Cu. O + H 2 = Cu + Н 2 О, Cu. O+ С 2 Н 5 ОН С 2 Н 4 О + Cu + Н 2 О 10
Оксиды меди Cu 2 O- твердое вещество красного цвета, восстановитель, имеет слабые амфотерные свойства с преобладанием основных: Cu 2 O + 4 HCl = 2 Н[Сu. Cl 2] +Н 2 О Cu 2 O + H 2 SO 4 = Cu. SO 4 + Cu + Н 2 О Cu 2 O + 2 КОН + Н 2 О = 2 К[Сu(ОН)2] - дигидроксокупрат(I) калия С раствором аммиака образует комплексное соединение: Cu 2 O + 4 NH 4 ОН = 2[Cu(NH 3)2](OH) +3 Н 2 О Cu. O –порошок черного цвета, обладает амфотерными свойствами, при нагревании взаимодействует с кислотами и щелочами: Cu. O + H 2 SO 4 = Cu. SO 4 + Н 2 О Cu. O + 2 КОН = К 2 Cu. O 2 + Н 2 О Растворяется в водном растворе аммиака: Cu 2 O + 4 NH 4 ОН = [Cu(NH 3)4](OH)2 +3 Н 2 О Обладает окислительными свойствами: Cu. O + H 2 = Cu + Н 2 О, Cu. O+ С 2 Н 5 ОН С 2 Н 4 О + Cu + Н 2 О 10
 Гидроксиды меди Cu ОН – вероятно, образуется в ходе некоторых реакций, но неустойчив, выделить не удается, легко разлагается: 2 Cu ОН = Cu 2 О + Н 2 О Обладает слабовыраженными амфотерными свойствами: 2 Cu. OН + 4 HCl = 2 Н[Сu. Cl 2] +2 Н 2 О 2 Cu. OН + 2 КОН = 2 К[Сu(ОН)2] Cu (ОН)2 – выделяется из растворов в виде осадка ярко-голубого цвета При нагревании легко разлагается: Cu (ОН)2 = Cu. О + Н 2 О Обладает амфотерными свойствами: [Cu(H 2 O)4]Cl 2 Cu(OН)2 + 2 HCl = Сu. Cl 2 + 2 Н 2 О Cu(OН)2 + 2 Na. OH = Na 2[Cu(OН)4] Является реактивом на кислородсодержащие органические вещества, в растворах образуются комплексные соединения ярко –синего цвета С раствором глюкозы образуется ярко-синий раствор, при нагревании цвет изменяется до красного (Cu 2 O) 11
Гидроксиды меди Cu ОН – вероятно, образуется в ходе некоторых реакций, но неустойчив, выделить не удается, легко разлагается: 2 Cu ОН = Cu 2 О + Н 2 О Обладает слабовыраженными амфотерными свойствами: 2 Cu. OН + 4 HCl = 2 Н[Сu. Cl 2] +2 Н 2 О 2 Cu. OН + 2 КОН = 2 К[Сu(ОН)2] Cu (ОН)2 – выделяется из растворов в виде осадка ярко-голубого цвета При нагревании легко разлагается: Cu (ОН)2 = Cu. О + Н 2 О Обладает амфотерными свойствами: [Cu(H 2 O)4]Cl 2 Cu(OН)2 + 2 HCl = Сu. Cl 2 + 2 Н 2 О Cu(OН)2 + 2 Na. OH = Na 2[Cu(OН)4] Является реактивом на кислородсодержащие органические вещества, в растворах образуются комплексные соединения ярко –синего цвета С раствором глюкозы образуется ярко-синий раствор, при нагревании цвет изменяется до красного (Cu 2 O) 11
 Соли меди Cu 2+ • Большинство хорошо растворяются в воде • Подвергаются гидролизу по катиону (р. Н<6) Растворимы Нерастворимы Нет достоверных сведений Cu. Gal 2 Cu. SO 3 Cu. SO 4 Cu 3(PO 4) Cu(NO 2)2 Cu(NO 3)2 Cu. CO 3 Cu. Si. O 3 (CH 3 COO)2 Cu • Важнейшее значение имеют Cu. Сl 2, Cu(NO 3)2, Cu. SO 4 , (Cu ОН)2 CO 3 12
Соли меди Cu 2+ • Большинство хорошо растворяются в воде • Подвергаются гидролизу по катиону (р. Н<6) Растворимы Нерастворимы Нет достоверных сведений Cu. Gal 2 Cu. SO 3 Cu. SO 4 Cu 3(PO 4) Cu(NO 2)2 Cu(NO 3)2 Cu. CO 3 Cu. Si. O 3 (CH 3 COO)2 Cu • Важнейшее значение имеют Cu. Сl 2, Cu(NO 3)2, Cu. SO 4 , (Cu ОН)2 CO 3 12
 Комплексные соединения меди Cu+ Cu 2+ Cu. SO 4· 5 H 2 O: [Cu(H 2 O)2]+ [Cu(H 2 O)4]2+ [Cu(H 2 O)4]SO 4·H 2 O [Cu(NH 3)2]+ [Cu(NH 3)4]2+ [Cu(CN)2]- [Cu(CN)4]2 - [Cu(OH)2]- [Cu(OH)4]2 - Cu 3+ K 7[Cu(IO 6)] · 7 H 2 O , Na 9[Cu(Te. O 6)2] Аналитические реакции Cu 2+: Cu 2+ + [Fe(CN)6]4 - = Cu 2 [Fe(CN)6] Cu 2+ + 4 NH 4 OH = [Cu(NH 3)4]2+ + 4 H 2 O Cu 2+ + [Hg(CNS)4]2 - = Cu [Hg(CNS)4] 13
Комплексные соединения меди Cu+ Cu 2+ Cu. SO 4· 5 H 2 O: [Cu(H 2 O)2]+ [Cu(H 2 O)4]2+ [Cu(H 2 O)4]SO 4·H 2 O [Cu(NH 3)2]+ [Cu(NH 3)4]2+ [Cu(CN)2]- [Cu(CN)4]2 - [Cu(OH)2]- [Cu(OH)4]2 - Cu 3+ K 7[Cu(IO 6)] · 7 H 2 O , Na 9[Cu(Te. O 6)2] Аналитические реакции Cu 2+: Cu 2+ + [Fe(CN)6]4 - = Cu 2 [Fe(CN)6] Cu 2+ + 4 NH 4 OH = [Cu(NH 3)4]2+ + 4 H 2 O Cu 2+ + [Hg(CNS)4]2 - = Cu [Hg(CNS)4] 13
 Соединения серебра Оксиды Гидроксиды Соли Комплексные соединения
Соединения серебра Оксиды Гидроксиды Соли Комплексные соединения
 Оксиды серебра Ag 2 O – темно-коричневый порошок, обладает основными свойствами, получается в результате реакций обмена: 2 Ag. NO 3 + 2 Na. OH = Ag 2 O + 2 Na. NO 3 + H 2 O Ag 2 O + H 2 SO 4 = Ag 2 SO 4 + H 2 O Ag 2 O + H 2 O = 2 Ag+ + 2 OH- Ag 2 O + 4 NH 4 OH = 2[Ag(NH 3)2](OH) + 3 H 2 O Обладает окислительными свойствами, окисляет органические вещества: С 6 Н 12 О 6 + Ag 2 O = С 6 Н 12 О 7 + 2 Ag Эта реакция используется для серебрения зеркал Известны оксиды Ag. O Ag 2 O 3 , сведения отсутствуют, оксиды неустойчивы 15
Оксиды серебра Ag 2 O – темно-коричневый порошок, обладает основными свойствами, получается в результате реакций обмена: 2 Ag. NO 3 + 2 Na. OH = Ag 2 O + 2 Na. NO 3 + H 2 O Ag 2 O + H 2 SO 4 = Ag 2 SO 4 + H 2 O Ag 2 O + H 2 O = 2 Ag+ + 2 OH- Ag 2 O + 4 NH 4 OH = 2[Ag(NH 3)2](OH) + 3 H 2 O Обладает окислительными свойствами, окисляет органические вещества: С 6 Н 12 О 6 + Ag 2 O = С 6 Н 12 О 7 + 2 Ag Эта реакция используется для серебрения зеркал Известны оксиды Ag. O Ag 2 O 3 , сведения отсутствуют, оксиды неустойчивы 15
 Гидроксиды серебра • Ag. OН – единственный изученный гидроксид • Осадок белого цвета, образуется в реакциях обмена: Ag. NO 3 + Na. OH = Ag. OН + Na. NO 3 • В следующий момент разлагается: 2 Ag. OН = Ag 2 O + H 2 O • Сильное основание, соли серебра не подвергаются гидролизу, способен осаждать гидроксиды некоторых металлов из раствора 16
Гидроксиды серебра • Ag. OН – единственный изученный гидроксид • Осадок белого цвета, образуется в реакциях обмена: Ag. NO 3 + Na. OH = Ag. OН + Na. NO 3 • В следующий момент разлагается: 2 Ag. OН = Ag 2 O + H 2 O • Сильное основание, соли серебра не подвергаются гидролизу, способен осаждать гидроксиды некоторых металлов из раствора 16
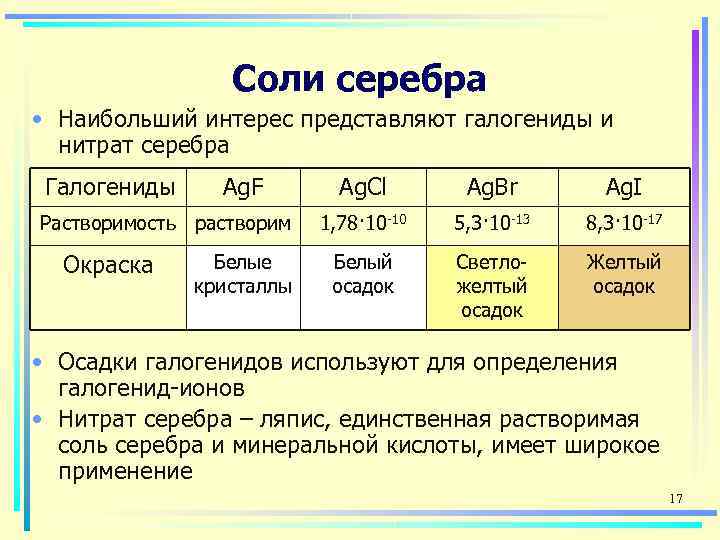
 Соли серебра • Наибольший интерес представляют галогениды и нитрат серебра Галогениды Ag. F Ag. Cl Ag. Br Ag. I Растворимость растворим 1, 78· 10 -10 5, 3· 10 -13 8, 3· 10 -17 Окраска Белые Белый Светло- Желтый кристаллы осадок желтый осадок • Осадки галогенидов используют для определения галогенид-ионов • Нитрат серебра – ляпис, единственная растворимая соль серебра и минеральной кислоты, имеет широкое применение 17
Соли серебра • Наибольший интерес представляют галогениды и нитрат серебра Галогениды Ag. F Ag. Cl Ag. Br Ag. I Растворимость растворим 1, 78· 10 -10 5, 3· 10 -13 8, 3· 10 -17 Окраска Белые Белый Светло- Желтый кристаллы осадок желтый осадок • Осадки галогенидов используют для определения галогенид-ионов • Нитрат серебра – ляпис, единственная растворимая соль серебра и минеральной кислоты, имеет широкое применение 17
 Комплексные соединения серебра • Координационное число – 2 • Комплексы имеют линейное строение • Аммиачные комплексы серебра легко образуются при добавлении раствора аммиака к оксиду или хлориду серебра • Комплексы восстанавливаются в растворах с образованием чистого серебра • Цианистые соединения серебра – [Ag(CN)2]- легко разлагаются электрическим током с образованием мелкокристаллического серебра 18
Комплексные соединения серебра • Координационное число – 2 • Комплексы имеют линейное строение • Аммиачные комплексы серебра легко образуются при добавлении раствора аммиака к оксиду или хлориду серебра • Комплексы восстанавливаются в растворах с образованием чистого серебра • Цианистые соединения серебра – [Ag(CN)2]- легко разлагаются электрическим током с образованием мелкокристаллического серебра 18
 Соединения золота Оксиды Гидроксиды Соли Комплексные соединения
Соединения золота Оксиды Гидроксиды Соли Комплексные соединения
 Оксиды золота Au 2 O – твердое вещество фиолетового цвета Основный оксид, образует с кислотами соли золота Au 2 O 3 – твердое вещество бурого цвета, обладает амфотерными свойствами, устойчив, как все соединения Au(III), образуется при разложении соответствующего гидроксида, особого интереса не представляет, поэтому сведения скудные 20
Оксиды золота Au 2 O – твердое вещество фиолетового цвета Основный оксид, образует с кислотами соли золота Au 2 O 3 – твердое вещество бурого цвета, обладает амфотерными свойствами, устойчив, как все соединения Au(III), образуется при разложении соответствующего гидроксида, особого интереса не представляет, поэтому сведения скудные 20
 Гидроксиды золота Au. OН – неустойчив, выпадает при действии щелочей на соли Au(I), но быстро переходит в оксид, обладает основными свойствами, особого интереса не представляет Au(OН)3 – золотая кислота, амфотерное соединение с преобладанием кислотных свойств, выпадает в виде бурого осадка в результате реакций обмена: H[Au. Cl 4] + 4 Na. OH = Au(OH)3 + 4 Na. Cl +H 2 O Взаимодействует с кислотами и щелочами: Au(OH)3 + Na. OH = Na [Au(ОН)4] Au(OH)3 + 4 НNО 3 = H[Au(NО 3)4] + 3 H 2 O 21
Гидроксиды золота Au. OН – неустойчив, выпадает при действии щелочей на соли Au(I), но быстро переходит в оксид, обладает основными свойствами, особого интереса не представляет Au(OН)3 – золотая кислота, амфотерное соединение с преобладанием кислотных свойств, выпадает в виде бурого осадка в результате реакций обмена: H[Au. Cl 4] + 4 Na. OH = Au(OH)3 + 4 Na. Cl +H 2 O Взаимодействует с кислотами и щелочами: Au(OH)3 + Na. OH = Na [Au(ОН)4] Au(OH)3 + 4 НNО 3 = H[Au(NО 3)4] + 3 H 2 O 21
 Соли золота • Au. Cl - неустойчивое соединение, получается при нагревании Au. Cl 3 с углекислым газом Твердое вещество белого цвета, мало растворимо в воде • Au. Cl 3 – красновато – коричневые кристаллы, устойчивы, в воде растворяется, подвергается гидролизу: Au. Cl 3 + H 2 O = H[Au(OH)Cl 3] Au. Cl 3 + H 2 O = H 2[Au. OCl 3] • Au. F 5 – красно-коричневые кристаллы, проявляет кислотные свойства: Au. F 5 + Na. F = Na[Au. F 6] Очень сильный окислитель: Au. F 5 + Хе. F 2 = Au. F 3 + Хе. F 4 22
Соли золота • Au. Cl - неустойчивое соединение, получается при нагревании Au. Cl 3 с углекислым газом Твердое вещество белого цвета, мало растворимо в воде • Au. Cl 3 – красновато – коричневые кристаллы, устойчивы, в воде растворяется, подвергается гидролизу: Au. Cl 3 + H 2 O = H[Au(OH)Cl 3] Au. Cl 3 + H 2 O = H 2[Au. OCl 3] • Au. F 5 – красно-коричневые кристаллы, проявляет кислотные свойства: Au. F 5 + Na. F = Na[Au. F 6] Очень сильный окислитель: Au. F 5 + Хе. F 2 = Au. F 3 + Хе. F 4 22
![> Комплексные соединения золота • Галогеноаураты: H[Au. Cl 4] • > Комплексные соединения золота • Галогеноаураты: H[Au. Cl 4] •](https://present5.com/presentation/3/37650700_174317567.pdf-img/37650700_174317567.pdf-23.jpg) Комплексные соединения золота • Галогеноаураты: H[Au. Cl 4] • Сульфатоаураты: Ме [Au(SO 4)2] • Нитратоаураты: Ме [Au(NO 3)4] • Гидроксоаураты: Ме [Au(ОН)4] • Цианоаураты: Ме [Au(СN)4] • Сульфидоаураты: Ме [Au(S)2] • Коллоидные растворы золота имеют фиолетовую окраску 23
Комплексные соединения золота • Галогеноаураты: H[Au. Cl 4] • Сульфатоаураты: Ме [Au(SO 4)2] • Нитратоаураты: Ме [Au(NO 3)4] • Гидроксоаураты: Ме [Au(ОН)4] • Цианоаураты: Ме [Au(СN)4] • Сульфидоаураты: Ме [Au(S)2] • Коллоидные растворы золота имеют фиолетовую окраску 23
 Применение металлов • Медь – цветной металл, электротехника, сплавы • Серебро – драгоценный металл, электротехника, медицина • Золото – ценный металл, международный эквивалент стоимости, электротехника, медицина, атомная энергетика, изготовление цветного стекла 24
Применение металлов • Медь – цветной металл, электротехника, сплавы • Серебро – драгоценный металл, электротехника, медицина • Золото – ценный металл, международный эквивалент стоимости, электротехника, медицина, атомная энергетика, изготовление цветного стекла 24
 Биологическое значение • Медь – дыхательные пигменты холоднокровных, дыхательная цепь митохондрий • Серебро – обладает бактерицидными свойствами, обеззараживающие препараты (ляпис) • Золото – обладает бактерицидными свойствами, входит в состав сильнодействуюших препаратов Все растворимые соединения меди, серебра, золота ядовиты! 25
Биологическое значение • Медь – дыхательные пигменты холоднокровных, дыхательная цепь митохондрий • Серебро – обладает бактерицидными свойствами, обеззараживающие препараты (ляпис) • Золото – обладает бактерицидными свойствами, входит в состав сильнодействуюших препаратов Все растворимые соединения меди, серебра, золота ядовиты! 25
 Рентгений Наиболее долгоживущий – 281, ≈20 секунд Предполагается, что рентгений — переходный металл, аналог золота, относится к группе благородных металлов, и предполагается, что он является химически малоактивным металлом, ещё менее активен, чем золото, и является самым химически инертным металлом, цвет неизвестен Наиболее вероятная степень окисления рентгения +3, подобно золоту (к примеру, в трифториде Rg. F 3) Плотность может быть чрезвычайно высокой, существенно тяжелее, чем осмий 26
Рентгений Наиболее долгоживущий – 281, ≈20 секунд Предполагается, что рентгений — переходный металл, аналог золота, относится к группе благородных металлов, и предполагается, что он является химически малоактивным металлом, ещё менее активен, чем золото, и является самым химически инертным металлом, цвет неизвестен Наиболее вероятная степень окисления рентгения +3, подобно золоту (к примеру, в трифториде Rg. F 3) Плотность может быть чрезвычайно высокой, существенно тяжелее, чем осмий 26
 Спасибо за внимание и плодотворную работу! 27
Спасибо за внимание и плодотворную работу! 27

