
ЕЛЕМЕНТИ V ГРУПИ
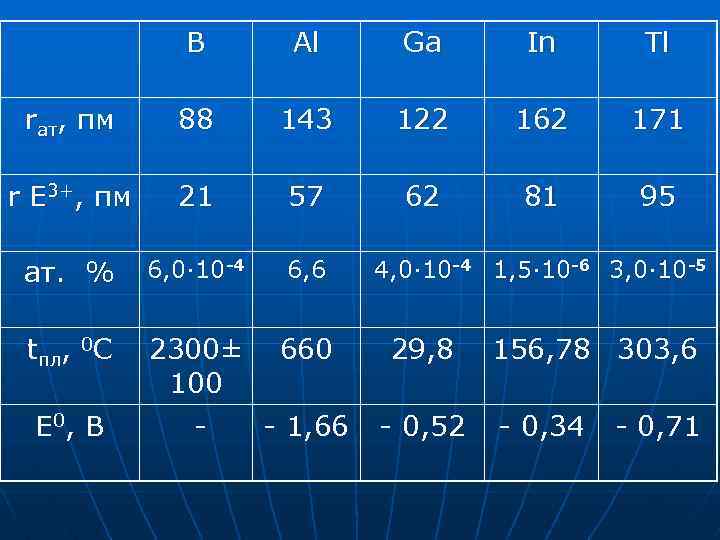
B Al Ga In Tl rат, пм 88 143 122 162 171 r E 3+, пм 21 57 62 81 95 ат. % 6, 0· 10 -4 6, 6 tпл, 0 C 2300± 660 100 - 1, 66 E 0 , B 4, 0· 10 -4 1, 5· 10 -6 3, 0· 10 -5 29, 8 - 0, 52 156, 78 303, 6 - 0, 34 - 0, 71

Бор

В – рідкісний елемент, зустрічається виключно у зв'язаному вигляді Na 2 B 4 O 7 · 10 H 20 - бура Na 2 B 4 O 7 · 4 H 2 O - керніт H 3 BO 3 - сассолін (термальні джерела вулканічного походження) Ca 2 B 6 O 11 - колеманіт Mg 3 B 8 O 15 – борацит

Добування 2 Ca 2 B 6 O 11 + Na 2 CO 3 + H 2 O → 3 Na 2 B 4 O 7 + + 4 Ca. CO 3 + 2 Na. OH Na 2 B 4 O 7 → H 3 BO 3 → B 2 O 3 B 2 O 3 + C B 2 O 3 + 3 Mg → 3 Mg. O + 2 B

чистий B добувають t B 2 H 6 → 2 B + 3 H 2 12000 C 2 BCl 3 + 3 H 2 → B + 6 HCl t 2 BI 3 → 2 B + 3 I 2

Аморфний В (темно – бурий порошок ρ = 1, 74 г/см 3) Кристалічний В (сіро – чорний порошок ρ = 2, 34 г/см 3)

2 s 2 2 p 1 В вал = 1 (майже ніколи не реалізується) B* sp 2 -гібридизація

Властивості В нагадують властивості Si (діагональна подібність) Si і В є електронодефіцитними елементами В* зв'язки Si* В—Н і В—В нестійкі В—О В—F – стійкі

Характерні ступені окиснення -3 Mg 3 B 2 0 B +3 B 2 O 3, H 3 BO 3, Na 2 B 4 O 7

Хімічні властивості ЕН=2, 0 Реакційна здатність аморфного В вища, ніж кристалічного, в реакції вступає тільки за високих температур t +3 4 B + 3 O 2 → 2 B 2 O 3 В - відновник t 2 B + 3 Cl 2 → 2 BCl 3 B + H 2 -3 2 B + 3 Mg → Mg 3 B 2 В - окисник

Бориди металів Бориди s-елементів Mg 3 B 2 + H 2 O Mg 3 B 2 + 6 HCl → 3 Mg. Cl 2 + B 2 H 6 (BH 3)2
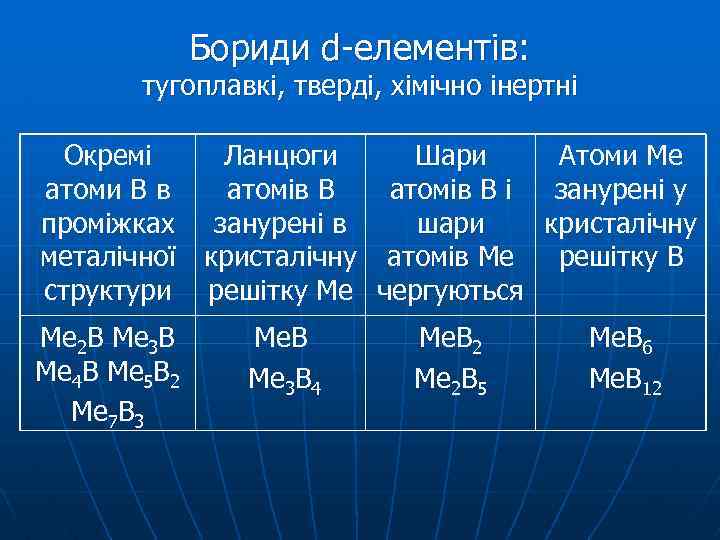
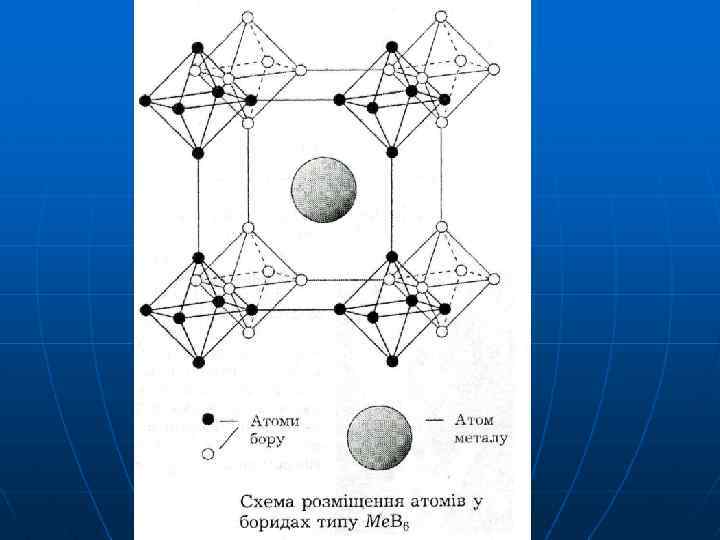
Бориди d-елементів: тугоплавкі, тверді, хімічно інертні Окремі атоми В в проміжках металічної структури Ме 2 В Ме 3 В Ме 4 В Ме 5 В 2 Ме 7 В 3 Ланцюги Шари Атоми Ме атомів В і занурені у занурені в шари кристалічну атомів Ме решітку В решітку Ме чергуються Ме. В Ме 3 В 4 Ме. В 2 Ме 2 В 5 Ме. В 6 Ме. В 12

Бороводні(борани) Вn. Hn+4 i Bn. Hn+6 (ВН 3)2 або В 2 Н 6, B 5 H 9, B 6 H 10, . . . , В 4 Н 10, B 5 H 11, . . . а також B 8 H 18, B 20 H 16
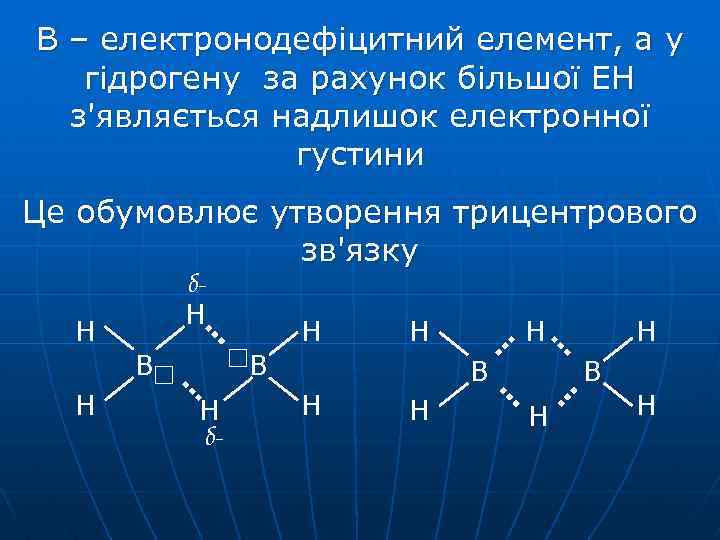
В – електронодефіцитний елемент, а у гідрогену за рахунок більшої ЕН з'являється надлишок електронної густини Це обумовлює утворення трицентрового зв'язку δН Н В Н δ- Н В Н Н
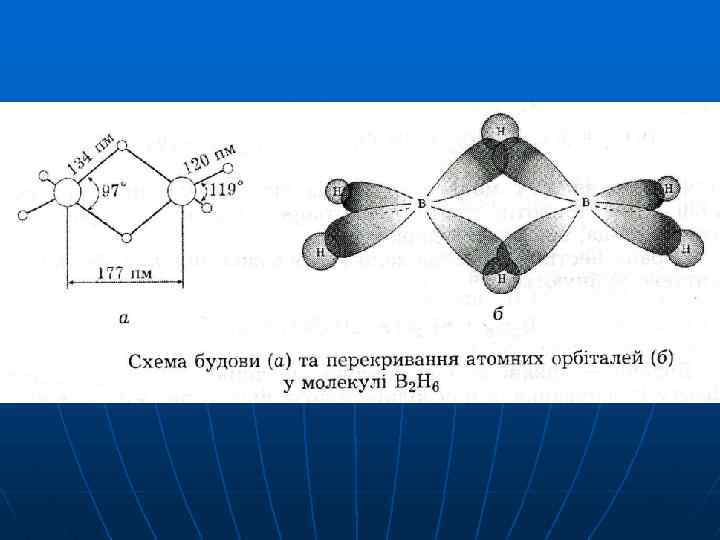

Мg 3 В 2 + 6 НCl → 3 Mg. Cl 2 + B 2 H 6 3 Mg. В 2 + 6 НCl → 3 Mg. Cl 2 + В 2 Н 6 + 4 В 2, 0 2, 1 δ+ δ- В—Н B—H борани - гідриди В 2 Н 6 нестійкий В 2 Н 6 → 2 В + 3 Н 2 на повітрі самозаймається
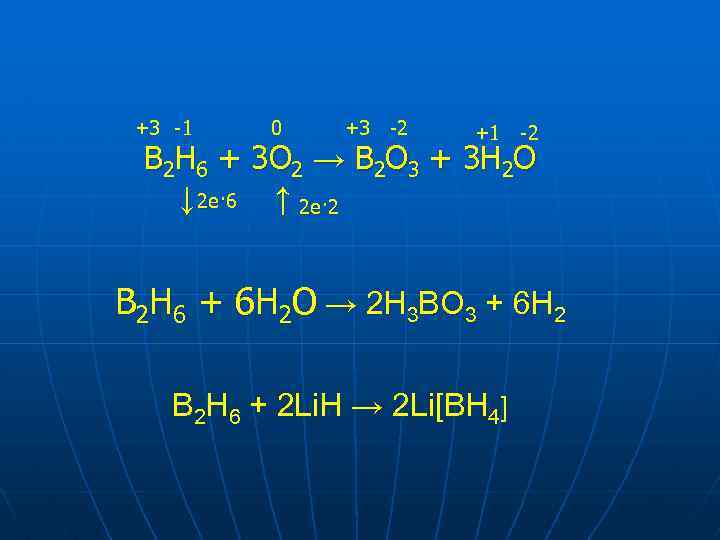
+3 -1 0 +3 -2 +1 -2 В 2 Н 6 + 3 О 2 → В 2 О 3 + 3 Н 2 О ↓ 2 е· 6 ↑ 2 е· 2 B 2 H 6 + 6 H 2 O → 2 H 3 BO 3 + 6 H 2 B 2 H 6 + 2 Li. H → 2 Li[BH 4]
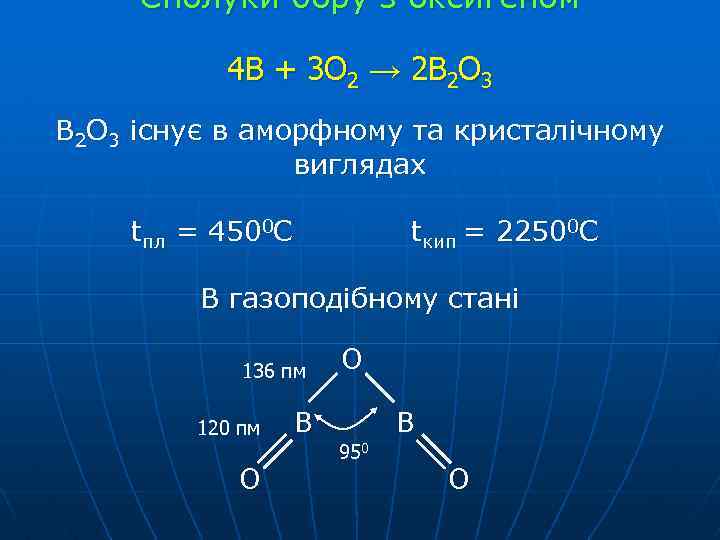
Сполуки бору з оксигеном 4 В + 3 О 2 → 2 В 2 О 3 існує в аморфному та кристалічному виглядах tпл = 4500 C tкип = 22500 C В газоподібному стані 136 пм 120 пм О О В В 950 О
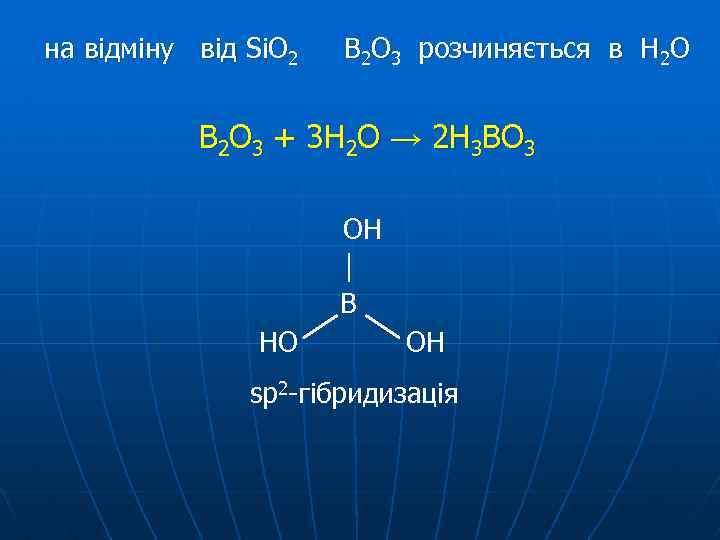
на відміну від Si. O 2 В 2 О 3 розчиняється в Н 2 О В 2 О 3 + 3 Н 2 О → 2 Н 3 ВО 3 ОН В НО ОН sp 2 -гібридизація
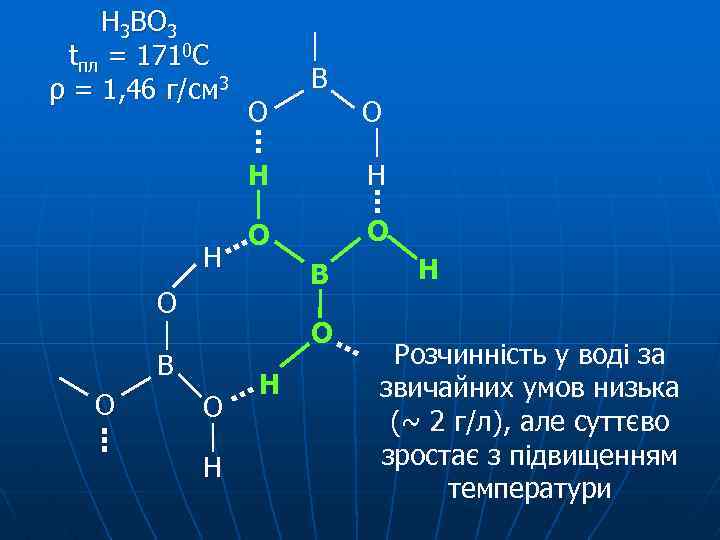
Н 3 ВО 3 tпл = 1710 C ρ = 1, 46 г/см 3 В О Н Н О О В О О Н Н Н Розчинність у воді за звичайних умов низька (~ 2 г/л), але суттєво зростає з підвищенням температури
![H 3 BO 3 + H 2 O ⇆ [B(OH)4]- + H+ K = H 3 BO 3 + H 2 O ⇆ [B(OH)4]- + H+ K =](https://present5.com/presentation/-101136264_416167028/image-23.jpg)
H 3 BO 3 + H 2 O ⇆ [B(OH)4]- + H+ K = 7, 3 · 10 -10 ОН В OH + HО — Н ⇆ B HO НО ОН + Н+ OH HO
![Збільшення концентрації (> 0, 025 моль/л) супроводжується полімеризацією 3 H[B(OH)4] ⇆ [B 3 O Збільшення концентрації (> 0, 025 моль/л) супроводжується полімеризацією 3 H[B(OH)4] ⇆ [B 3 O](https://present5.com/presentation/-101136264_416167028/image-24.jpg)
Збільшення концентрації (> 0, 025 моль/л) супроводжується полімеризацією 3 H[B(OH)4] ⇆ [B 3 O 3(OH)4]- + H+ + 5 H 2 O OH B O B HO O B O (HBO 2)3 + HO OH ⇆ [B 3 O 3(OH)4]- + H+ H

t t H 3 BO 3 ⇆ (HBO 2)n ⇆ (B 2 O 3)x(H 2 O)y ⇆ В 2 О 3·(Н 2 О)3 В 2 О 3 · Н 2 О t t ⇆ H 2 B 4 O 7 ⇆ B 2 O 3 2 В 2 О 3 · Н 2 О сила кислот. . . H 3 BO 3 – ортоборна кислота HBO 2 – метаборна кислота H 2 B 4 O 7 – тетраборна кислота t

H 3 BO 3 – не утворює власних солей Існують солі типу Na 2 B 4 O 7 або Na. BO 2, але кислоти Н 2 В 4 О 7 або НВО 2 не виділяються, так як переходять у Н 3 ВО 3 4 Н 3 ВО 3 + 2 Na. OH → Na 2 B 4 O 7 + 7 H 2 O Na 2 B 4 O 7 має надлишокt кислотного оксиду Na 2 O·(B 2 O 3)2 t Na 2 B 4 O 7 + 2 Na. OH → 4 Na. BO 2 + H 2 O осн оксид t Na 2 B 4 O 7 + Cu. O → Cu(BO 2)2 + 2 Na. BO 2

Бура – сіль слабкої кислоти Na 2 B 4 O 7 + H 2 SO 4 + 5 H 2 O → 4 H 3 BO 3 + Na 2 SO 4 2 - B 4 O 7 + 2 H+ + 5 H 2 O → 4 H 3 BO 3↓ Na 2 B 4 O 7 у водному розчині гідролізує 2 - В 4 О 7 + 7 Н 2 О ⇆ 4 Н 3 ВО 3 + 2 ОН-

Сполуки з галогенами 2 В + 3 F 2 → 2 ВF 3 t 2 B + Г 2 → 2 BГ 3 B 2 O 3 + 6 HF → 2 BF 3 + 3 H 2 O t B 2 O 3 + 3 Cl 2 + 3 C → 2 BCl 3 + 3 CO BГ 3 + 3 H 2 O → H 3 BO 3 + 3 HГ за винятком BF 3

BF 3 + : NH 3 → H 3 NBF 3 + HF: → HBF 4 BF + Na. F → Na. BF 4 2 BF 3 + 3 H 2 O → H 3 BO 3 + HBF 4 + 2 HF (повільно)

Сполуки з нітрогеном t 2 B + N 2 → 2 BN нітрид бору B 3 e 8 e N 5 e C 4 e 8 e У BN є графітоподібна (білий графіт) і алмазоподібна (боразон) модифікації
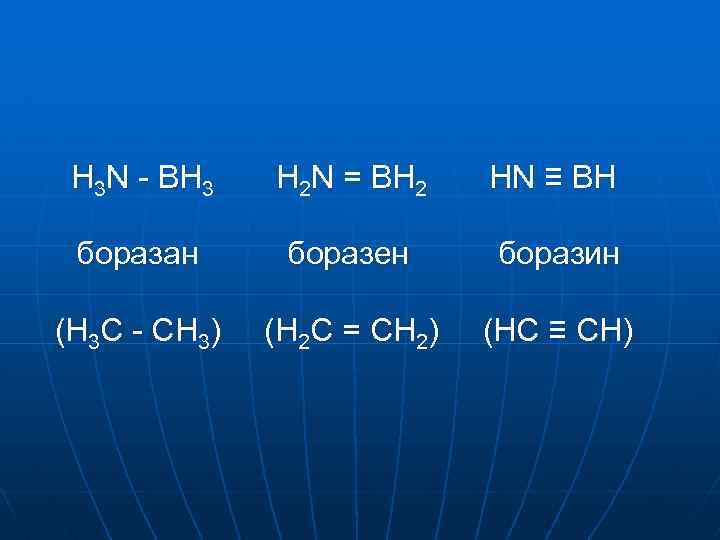
H 3 N - BH 3 H 2 N = BH 2 HN ≡ BH боразан боразен боразин (H 3 C - CH 3) (H 2 C = CH 2) (HC ≡ CH)

Застосування В – напівпроідник, ∆Е = 1, 42 е. В. Бор використовують у металургії, його вводять у поверхневий шар деяких металів. Борування металів підвищує їх твердість, корозійну стійкість, жаротривкість, зносостійкість. Бориди металів використовують для виготовлення тугоплавких і твердих матеріалів.

Широке використання має нітрид бора. Алмазоподібний BN (боразон, кубаніт) – надтвердий, термостійкий матеріал, що заміняє алмаз. Графітоподібний BN використовують як мастильний матеріал. Na 2 B 4 O 7 використовується при зварюванні та пайці металів. В 2 О 3 додають при варці термостійкого скла.

Na 2 B 4 O 7 та Н 3 ВО 3 мають бактерицидні властивості і використовуються в медицині. Солі борної кислоти входять до складу багатьох миючих засобів. ВF 3 – Kat в багатьох органічних реакціях (полімеризація, еcтерифікація) Карбід бору 2 B 2 O 3 + 7 C → B 4 C + 6 CO tпл = 23600 С за твердістю поступається лише алмазу та ВN.