7-ЭЛЕКТРОХИМИЯ.ppt
- Количество слайдов: 19
 Электрохимические процессы (взаимные превращения электрич. и хим. форм энергии). Основные понятия Ок. -восст. реакция – переход электронов от восстановителя к окислителю – основа эл. хим. процесса, если ∆G < 0 - самопроизв. процесс, ∆G > 0 - нет Zn 0 + Cu 2+ Zn 2+ + Cu 0 ∆G < 0 самопроизв. Схема эл. хим. системы Zn|Zn. SO 4||Cu. SO 4|Cu Zn 0 Zn 2+ + 2ē – окисление восстановителя Cu 2+ + 2ē Cu 0 – восстановление окислителя Zn|Zn+2||Cu+2|Cu Если полуреакции разделены в пространстве протекает электрический ток Электрохимическая система 1 - электроды (электронная проводимость) 3 4 окисление – анод А, восстановление –катод К электроны (электрод - контакт 2 -х фаз: 1(эл. ) и 2(ионн. ) 1 1 2 - электролиты(проводники с ионной пров. ) А К 3 - внешняя цепь для перехода электронов, 5 проводник электрического тока 2 2 ионы 4 –внешний источник тока 5 - внутренняя цепь(ионная проводимость)
Электрохимические процессы (взаимные превращения электрич. и хим. форм энергии). Основные понятия Ок. -восст. реакция – переход электронов от восстановителя к окислителю – основа эл. хим. процесса, если ∆G < 0 - самопроизв. процесс, ∆G > 0 - нет Zn 0 + Cu 2+ Zn 2+ + Cu 0 ∆G < 0 самопроизв. Схема эл. хим. системы Zn|Zn. SO 4||Cu. SO 4|Cu Zn 0 Zn 2+ + 2ē – окисление восстановителя Cu 2+ + 2ē Cu 0 – восстановление окислителя Zn|Zn+2||Cu+2|Cu Если полуреакции разделены в пространстве протекает электрический ток Электрохимическая система 1 - электроды (электронная проводимость) 3 4 окисление – анод А, восстановление –катод К электроны (электрод - контакт 2 -х фаз: 1(эл. ) и 2(ионн. ) 1 1 2 - электролиты(проводники с ионной пров. ) А К 3 - внешняя цепь для перехода электронов, 5 проводник электрического тока 2 2 ионы 4 –внешний источник тока 5 - внутренняя цепь(ионная проводимость)
 Электрохимическая система (ЭХС) При равновесии G = 0 , то ток в цепи: I = 0 G= r. G + Wэ; r. G-протекание хим. реакции; Wэ- работа переноса электрических зарядов Wэ = n F E E = ∆φ = К – А разность потенциалов F = NA ē 96500 Кл/моль - число Фарадея n – число молей электронов I 0 r. G 0 Самопроизвольн. процесс - r. G 0, →Е>0 К > А ЭХС - гальванический элемент (химический источник тока - ХИТ). Получение электрической энергии - результат протекания О-ВР. Потенциалы: Катод «+» , Анод «-» Вынужденный процесс - r. G >0, →Е<0 К < А ЭХС – электролизер. Электролиз за счет электрической энергии внешнего источника тока. Протекают вынужденные окислит. -восст. реакции. Потенциалы: Катод «-» , Анод «+»
Электрохимическая система (ЭХС) При равновесии G = 0 , то ток в цепи: I = 0 G= r. G + Wэ; r. G-протекание хим. реакции; Wэ- работа переноса электрических зарядов Wэ = n F E E = ∆φ = К – А разность потенциалов F = NA ē 96500 Кл/моль - число Фарадея n – число молей электронов I 0 r. G 0 Самопроизвольн. процесс - r. G 0, →Е>0 К > А ЭХС - гальванический элемент (химический источник тока - ХИТ). Получение электрической энергии - результат протекания О-ВР. Потенциалы: Катод «+» , Анод «-» Вынужденный процесс - r. G >0, →Е<0 К < А ЭХС – электролизер. Электролиз за счет электрической энергии внешнего источника тока. Протекают вынужденные окислит. -восст. реакции. Потенциалы: Катод «-» , Анод «+»
 Соотношение количество вещества - величина тока в электрохимических(электродных) процессах анодный процесс катодный процесс Ме 1 Mе 1+n + nē Ме 2+n+ nē Mе 2 Превращение 1 атома q = n ē (Кл) [единичный акт] за время t (с) при токе в системе веществ Ме 1 – nē Mе 1+n 1 моль q = n ē NA = n F (Кл/моль); I (А) q = I t (Кл) и превратится ν моль Электролиз: - коэффициент выхода по току =m/mp ; М- мол. масса ХИТ(ГЭ): - коэффициент использования материалов =q/qp, ν = m / M Кл А час – емкость ХИТ
Соотношение количество вещества - величина тока в электрохимических(электродных) процессах анодный процесс катодный процесс Ме 1 Mе 1+n + nē Ме 2+n+ nē Mе 2 Превращение 1 атома q = n ē (Кл) [единичный акт] за время t (с) при токе в системе веществ Ме 1 – nē Mе 1+n 1 моль q = n ē NA = n F (Кл/моль); I (А) q = I t (Кл) и превратится ν моль Электролиз: - коэффициент выхода по току =m/mp ; М- мол. масса ХИТ(ГЭ): - коэффициент использования материалов =q/qp, ν = m / M Кл А час – емкость ХИТ
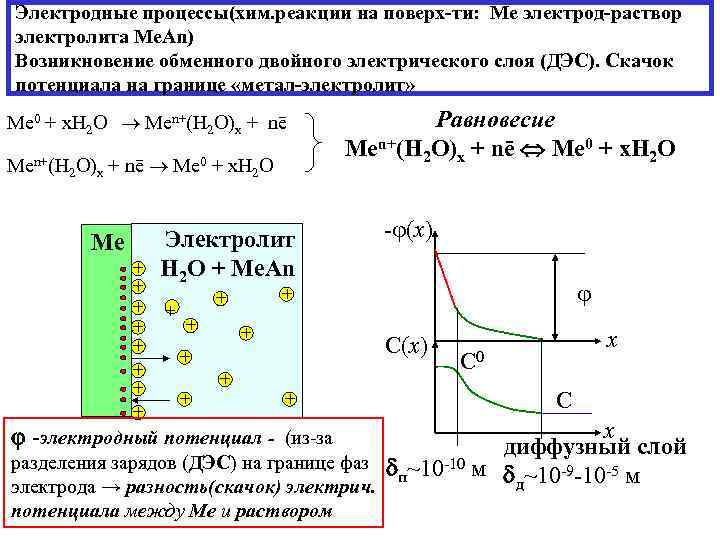 Электродные процессы(хим. реакции на поверх-ти: Ме электрод-раствор электролита Me. An) Возникновение обменного двойного электрического слоя (ДЭС). Скачок потенциала на границе «метал-электролит» Me 0 + х. Н 2 О Men+(H 2 O)x + nē Me 0 + х. Н 2 О Ме + + + + Электролит Н 2 О + Ме. Аn + + + С(x) + + - (x) + + + Равновесие Men+(H 2 O)x + nē Me 0 + x. H 2 O + x С 0 С x диффузный слой разделения зарядов (ДЭС) на границе фаз ~10 -10 м п д~10 -9 -10 -5 м электрода → разность(скачок) электрич. -электродный потенциал - (из-за потенциала между Ме и раствором
Электродные процессы(хим. реакции на поверх-ти: Ме электрод-раствор электролита Me. An) Возникновение обменного двойного электрического слоя (ДЭС). Скачок потенциала на границе «метал-электролит» Me 0 + х. Н 2 О Men+(H 2 O)x + nē Me 0 + х. Н 2 О Ме + + + + Электролит Н 2 О + Ме. Аn + + + С(x) + + - (x) + + + Равновесие Men+(H 2 O)x + nē Me 0 + x. H 2 O + x С 0 С x диффузный слой разделения зарядов (ДЭС) на границе фаз ~10 -10 м п д~10 -9 -10 -5 м электрода → разность(скачок) электрич. -электродный потенциал - (из-за потенциала между Ме и раствором
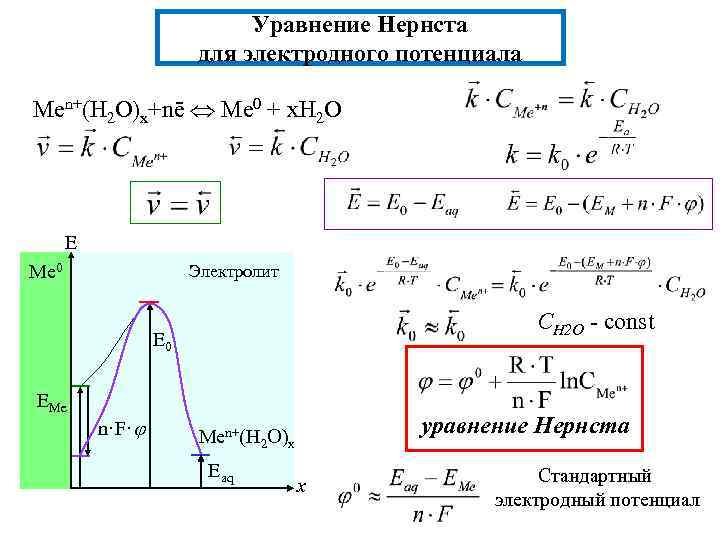 Уравнение Нернста для электродного потенциала Men+(H 2 O)x+nē Me 0 + x. H 2 O E Me 0 Электролит СН 2 О - const E 0 EМе n·F· уравнение Нернста Men+(H 2 O)x Eaq x Стандартный электродный потенциал
Уравнение Нернста для электродного потенциала Men+(H 2 O)x+nē Me 0 + x. H 2 O E Me 0 Электролит СН 2 О - const E 0 EМе n·F· уравнение Нернста Men+(H 2 O)x Eaq x Стандартный электродный потенциал
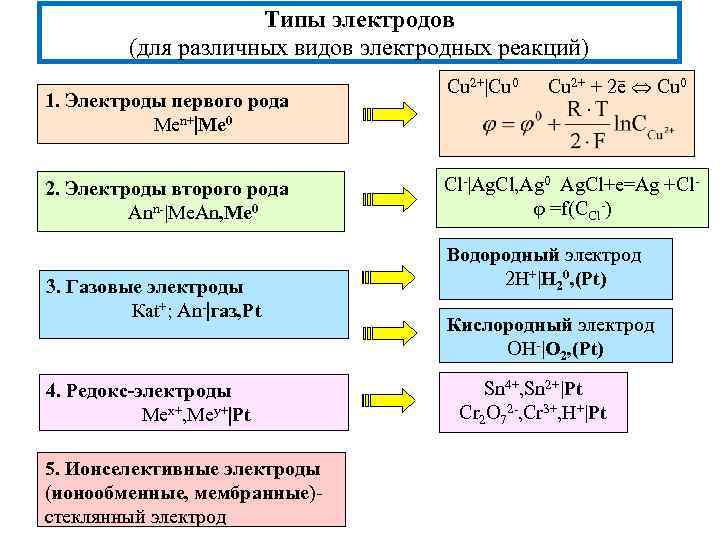 Типы электродов (для различных видов электродных реакций) 1. Электроды первого рода Men+ Me 0 2. Электроды второго рода Ann- Me. An, Me 0 3. Газовые электроды Кat+; An- газ, Pt 4. Редокс-электроды Меx+, Меy+ Pt 5. Ионселективные электроды (ионообменные, мембранные)стеклянный электрод Cu 2+ Cu 0 Cu 2+ + 2ē Cu 0 Cl- Ag. Cl, Ag 0 Ag. Cl+e=Ag +Cl =f(CCl-) Водородный электрод 2 H+ H 20, (Pt) Кислородный электрод OH- O 2, (Pt) Sn 4+, Sn 2+ Pt Cr 2 O 72 -, Cr 3+, H+ Pt
Типы электродов (для различных видов электродных реакций) 1. Электроды первого рода Men+ Me 0 2. Электроды второго рода Ann- Me. An, Me 0 3. Газовые электроды Кat+; An- газ, Pt 4. Редокс-электроды Меx+, Меy+ Pt 5. Ионселективные электроды (ионообменные, мембранные)стеклянный электрод Cu 2+ Cu 0 Cu 2+ + 2ē Cu 0 Cl- Ag. Cl, Ag 0 Ag. Cl+e=Ag +Cl =f(CCl-) Водородный электрод 2 H+ H 20, (Pt) Кислородный электрод OH- O 2, (Pt) Sn 4+, Sn 2+ Pt Cr 2 O 72 -, Cr 3+, H+ Pt
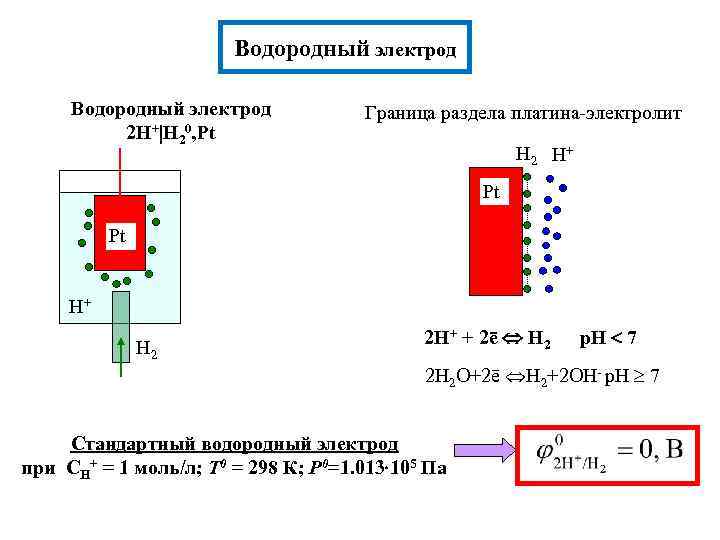 Водородный электрод 2 H+ H 20, Pt Граница раздела платина-электролит H 2 H+ Pt Pt H+ H 2 2 H+ + 2ē H 2 p. H 7 2 H 2 O+2ē H 2+2 OH- p. H 7 Стандартный водородный электрод при CH+ = 1 моль/л; Т 0 = 298 К; Р 0=1. 013 105 Па
Водородный электрод 2 H+ H 20, Pt Граница раздела платина-электролит H 2 H+ Pt Pt H+ H 2 2 H+ + 2ē H 2 p. H 7 2 H 2 O+2ē H 2+2 OH- p. H 7 Стандартный водородный электрод при CH+ = 1 моль/л; Т 0 = 298 К; Р 0=1. 013 105 Па
 Водородная шкала электродных потенциалов А( ) Me 0|Men+||2 H+|H 20(Pt) (+)К если или А( ) (Pt)H 20, |2 H+||Men+|Me 0 (+)К CH+ = 1 моль/л; Т 0 = 298 К; Р 0=1. 013 105 Па; I = 0, А CМе+ = 1 моль/л 0 Men+/ Me 0 = Е Стандартные электродные потенциалы ( 0, В)
Водородная шкала электродных потенциалов А( ) Me 0|Men+||2 H+|H 20(Pt) (+)К если или А( ) (Pt)H 20, |2 H+||Men+|Me 0 (+)К CH+ = 1 моль/л; Т 0 = 298 К; Р 0=1. 013 105 Па; I = 0, А CМе+ = 1 моль/л 0 Men+/ Me 0 = Е Стандартные электродные потенциалы ( 0, В)
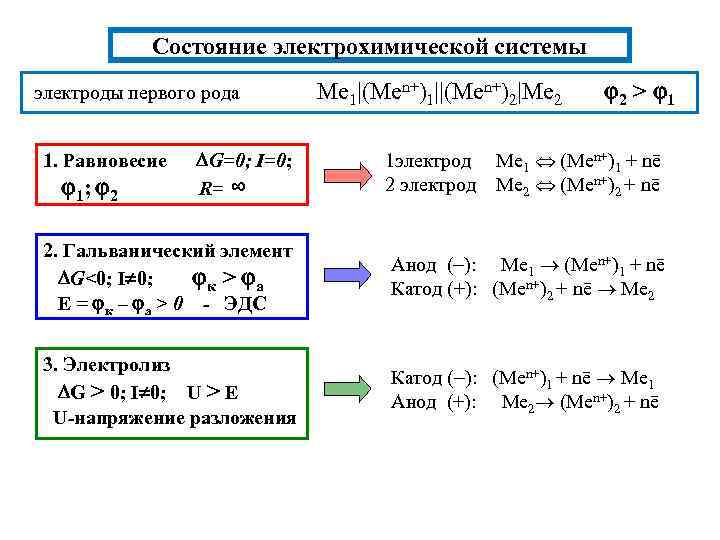 Состояние электрохимической системы электроды первого рода Me 1|(Men+)1||(Men+)2|Me 2 2 > 1 G=0; I=0; R= ∞ 1 электрод Me 1 (Men+)1 + nē 2 электрод Me 2 (Men+)2 + nē 2. Гальванический элемент G<0; I 0; к > а E = к – а > 0 - ЭДС Анод ( ): Me 1 (Men+)1 + nē Катод (+): (Men+)2 + nē Me 2 3. Электролиз G > 0; I 0; U > E U-напряжение разложения Катод ( ): (Men+)1 + nē Me 1 Анод (+): Me 2 (Men+)2 + nē 1. Равновесие 1; 2
Состояние электрохимической системы электроды первого рода Me 1|(Men+)1||(Men+)2|Me 2 2 > 1 G=0; I=0; R= ∞ 1 электрод Me 1 (Men+)1 + nē 2 электрод Me 2 (Men+)2 + nē 2. Гальванический элемент G<0; I 0; к > а E = к – а > 0 - ЭДС Анод ( ): Me 1 (Men+)1 + nē Катод (+): (Men+)2 + nē Me 2 3. Электролиз G > 0; I 0; U > E U-напряжение разложения Катод ( ): (Men+)1 + nē Me 1 Анод (+): Me 2 (Men+)2 + nē 1. Равновесие 1; 2
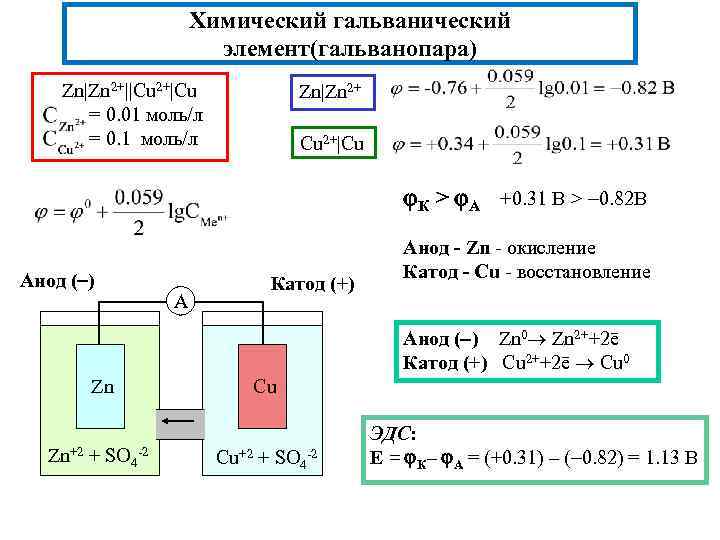 Химический гальванический элемент(гальванопара) Zn|Zn 2+||Cu 2+|Cu = 0. 01 моль/л = 0. 1 моль/л Zn|Zn 2+ Cu 2+|Cu К > А +0. 31 В > 0. 82 В Анод ( ) А Катод (+) Анод - Zn - окисление Катод - Cu - восстановление Анод ( ) Zn 0 Zn 2++2ē Катод (+) Cu 2++2ē Cu 0 Zn Zn+2 + SO 4 -2 Cu Cu+2 + SO 4 -2 ЭДС: E = К– А = (+0. 31) – ( 0. 82) = 1. 13 В
Химический гальванический элемент(гальванопара) Zn|Zn 2+||Cu 2+|Cu = 0. 01 моль/л = 0. 1 моль/л Zn|Zn 2+ Cu 2+|Cu К > А +0. 31 В > 0. 82 В Анод ( ) А Катод (+) Анод - Zn - окисление Катод - Cu - восстановление Анод ( ) Zn 0 Zn 2++2ē Катод (+) Cu 2++2ē Cu 0 Zn Zn+2 + SO 4 -2 Cu Cu+2 + SO 4 -2 ЭДС: E = К– А = (+0. 31) – ( 0. 82) = 1. 13 В
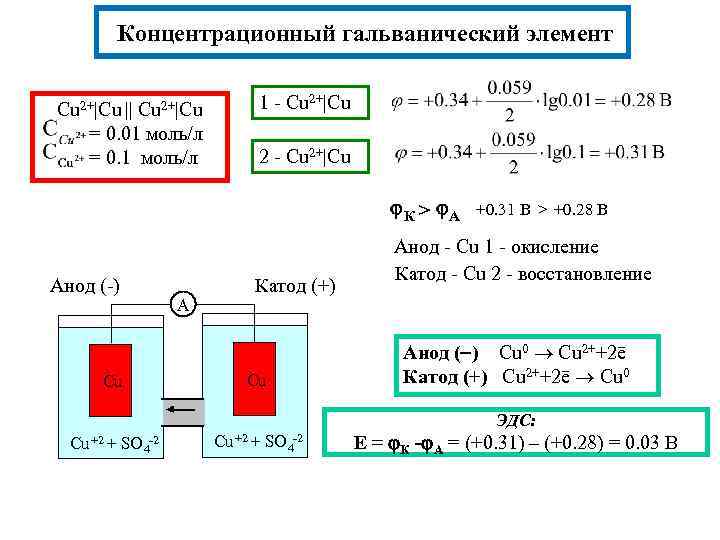 Концентрационный гальванический элемент Cu 2+|Cu 1 - Cu 2+|Cu = 0. 01 моль/л = 0. 1 моль/л 2 - Cu 2+|Cu || К > А +0. 31 В > +0. 28 В Анод (-) Cu А Катод (+) Cu Анод - Cu 1 - окисление Катод - Cu 2 - восстановление Анод ( ) Cu 0 Cu 2++2ē Катод (+) Cu 2++2ē Cu 0 ЭДС: Cu +2 + SO 4 -2 Е = К - А = (+0. 31) – (+0. 28) = 0. 03 В
Концентрационный гальванический элемент Cu 2+|Cu 1 - Cu 2+|Cu = 0. 01 моль/л = 0. 1 моль/л 2 - Cu 2+|Cu || К > А +0. 31 В > +0. 28 В Анод (-) Cu А Катод (+) Cu Анод - Cu 1 - окисление Катод - Cu 2 - восстановление Анод ( ) Cu 0 Cu 2++2ē Катод (+) Cu 2++2ē Cu 0 ЭДС: Cu +2 + SO 4 -2 Е = К - А = (+0. 31) – (+0. 28) = 0. 03 В
 Скорость электрохимических процессов Скорость электродного процесса (эл. хим. реакции) – r - это число молей вещества - образовавшегося (израсходовавшегося) на единице поверхности электрода - S в единицу времени - t - плотность тока
Скорость электрохимических процессов Скорость электродного процесса (эл. хим. реакции) – r - это число молей вещества - образовавшегося (израсходовавшегося) на единице поверхности электрода - S в единицу времени - t - плотность тока
![Поляризация электродов – [ ] (сближение потенциалов катода и анода и уменьшение ∆φ) при Поляризация электродов – [ ] (сближение потенциалов катода и анода и уменьшение ∆φ) при](https://present5.com/presentation/114931184_450311048/image-13.jpg) Поляризация электродов – [ ] (сближение потенциалов катода и анода и уменьшение ∆φ) при работе ГЭ = I явл. [f(i)] Поляризация-разность потенциалов электрода при прохождении тока I и равновесным значением Диффузионная(концентраци. Электрохимическая Фазовые онная) поляризация; (катодная)поляризация; превращения перенапряжение - (для перенапряжение лимитирующей стадии) Стадии электрохимического процесса (сложной гетерогенной хим. реакции), определяющего потенциал электродов: 1) подвод реагирующих частиц(диффузия) из объема электролита к поверхности электрода (ур. Нернста); 2) собственно электрохимическая реакция на электродах (сближение потенциалов электродов); 3) отвод продуктов реакции(диффузия) от электрода (ур. Нернста). [Скорость переноса электронов во внешней цепи выше скорости отдельных стадий → изменение Анод >0 I = + (i) потенциалов электродов → Катод <0 I = - (i) поляризация]
Поляризация электродов – [ ] (сближение потенциалов катода и анода и уменьшение ∆φ) при работе ГЭ = I явл. [f(i)] Поляризация-разность потенциалов электрода при прохождении тока I и равновесным значением Диффузионная(концентраци. Электрохимическая Фазовые онная) поляризация; (катодная)поляризация; превращения перенапряжение - (для перенапряжение лимитирующей стадии) Стадии электрохимического процесса (сложной гетерогенной хим. реакции), определяющего потенциал электродов: 1) подвод реагирующих частиц(диффузия) из объема электролита к поверхности электрода (ур. Нернста); 2) собственно электрохимическая реакция на электродах (сближение потенциалов электродов); 3) отвод продуктов реакции(диффузия) от электрода (ур. Нернста). [Скорость переноса электронов во внешней цепи выше скорости отдельных стадий → изменение Анод >0 I = + (i) потенциалов электродов → Катод <0 I = - (i) поляризация]
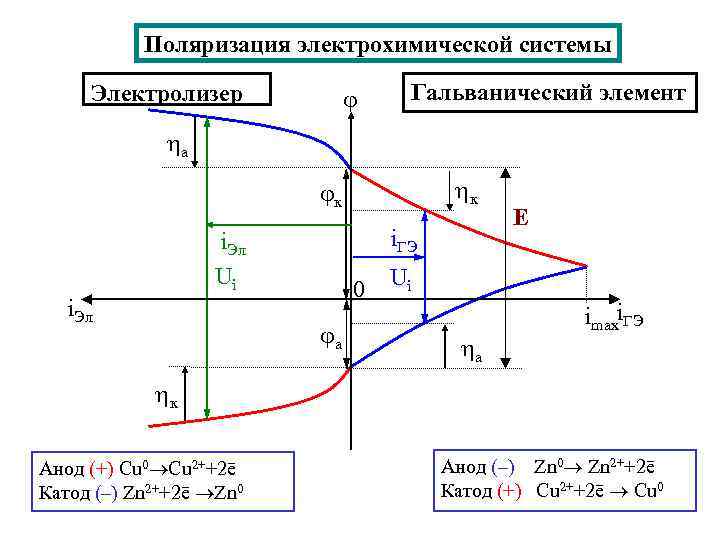 Поляризация электрохимической системы Электролизер Гальванический элемент а к к i. ГЭ i. Эл Ui i. Эл 0 а Е Ui а imaxi. ГЭ к Анод (+) Cu 0 Cu 2++2ē Катод (–) Zn 2++2ē Zn 0 Анод (–) Zn 0 Zn 2++2ē Катод (+) Cu 2++2ē Cu 0
Поляризация электрохимической системы Электролизер Гальванический элемент а к к i. ГЭ i. Эл Ui i. Эл 0 а Е Ui а imaxi. ГЭ к Анод (+) Cu 0 Cu 2++2ē Катод (–) Zn 2++2ē Zn 0 Анод (–) Zn 0 Zn 2++2ē Катод (+) Cu 2++2ē Cu 0
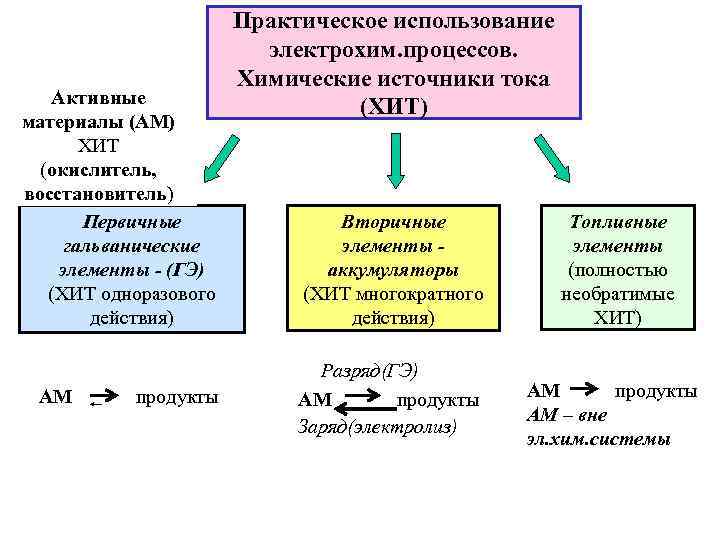 Активные материалы (АМ) ХИТ (окислитель, восстановитель) Первичные гальванические элементы - (ГЭ) (ХИТ одноразового действия) АМ продукты Практическое использование электрохим. процессов. Химические источники тока (ХИТ) Вторичные элементы аккумуляторы (ХИТ многократного действия) Разряд(ГЭ) АМ продукты Заряд(электролиз) Топливные элементы (полностью необратимые ХИТ) АМ продукты АМ – вне эл. хим. системы
Активные материалы (АМ) ХИТ (окислитель, восстановитель) Первичные гальванические элементы - (ГЭ) (ХИТ одноразового действия) АМ продукты Практическое использование электрохим. процессов. Химические источники тока (ХИТ) Вторичные элементы аккумуляторы (ХИТ многократного действия) Разряд(ГЭ) АМ продукты Заряд(электролиз) Топливные элементы (полностью необратимые ХИТ) АМ продукты АМ – вне эл. хим. системы
 Основные характеристики ХИТ • ЭДС гальванического элемента (Е, В) -напряжение без нагрузки • Номинальное напряжение (U, В) -напряжение в средней части разрядной характеристики (учитывает поляризацию ГЭ) • Номинальная ёмкость(C)-ампер-час А ч - кол-во эл-ва, отдаваемое ХИТ во внешнюю цепь; также используется для характеристики ёмкости ХИТ удельная энергия (Вт ч/кг) • Удельная мощность(N, Вт/кг) – макс. допустимая разрядная мощность (показывает макс. возможный ток при номинальном напряжении) • Срок хранения (Тхр) –время, когда ёмкость ХИТ существенно не уменьшается из-за саморазряда(хим. процессы на элетродах с потреблением АМ без генерирования эл. тока) • Число циклов разряд-заряд(для аккумуляторов); ресурс работы - ТЭ
Основные характеристики ХИТ • ЭДС гальванического элемента (Е, В) -напряжение без нагрузки • Номинальное напряжение (U, В) -напряжение в средней части разрядной характеристики (учитывает поляризацию ГЭ) • Номинальная ёмкость(C)-ампер-час А ч - кол-во эл-ва, отдаваемое ХИТ во внешнюю цепь; также используется для характеристики ёмкости ХИТ удельная энергия (Вт ч/кг) • Удельная мощность(N, Вт/кг) – макс. допустимая разрядная мощность (показывает макс. возможный ток при номинальном напряжении) • Срок хранения (Тхр) –время, когда ёмкость ХИТ существенно не уменьшается из-за саморазряда(хим. процессы на элетродах с потреблением АМ без генерирования эл. тока) • Число циклов разряд-заряд(для аккумуляторов); ресурс работы - ТЭ
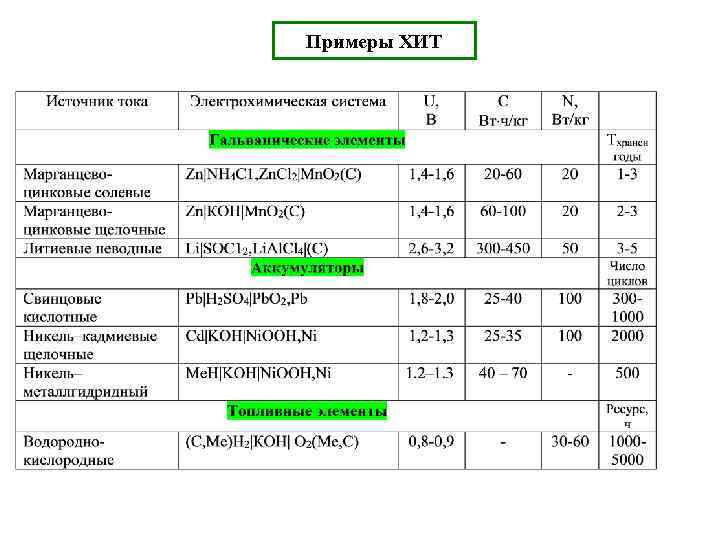 Примеры ХИТ
Примеры ХИТ
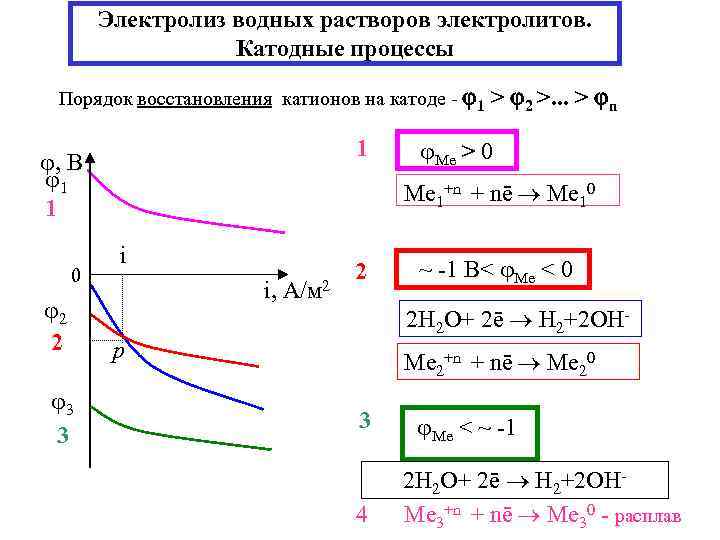 Электролиз водных растворов электролитов. Катодные процессы Порядок восстановления катионов на катоде - 1 1 , В 1 1 0 2 2 3 3 > 2 >. . . > n Ме > 0 Ме 1+n + nē Ме 10 i i, А/м 2 2 ~ -1 В< Ме < 0 2 H 2 O+ 2ē H 2+2 OH- р Ме 2+n + nē Ме 20 3 4 Ме < ~ -1 2 H 2 O+ 2ē H 2+2 OHМе 3+n + nē Ме 30 - расплав
Электролиз водных растворов электролитов. Катодные процессы Порядок восстановления катионов на катоде - 1 1 , В 1 1 0 2 2 3 3 > 2 >. . . > n Ме > 0 Ме 1+n + nē Ме 10 i i, А/м 2 2 ~ -1 В< Ме < 0 2 H 2 O+ 2ē H 2+2 OH- р Ме 2+n + nē Ме 20 3 4 Ме < ~ -1 2 H 2 O+ 2ē H 2+2 OHМе 3+n + nē Ме 30 - расплав
 Электролиз Анодные процессы Порядок окисления анионов(б) на аноде - 1 < 2 <. . . < n а) пассивный (инертный) анод - Ме φ Меn+/Ме > φ ОН-/О 2 , В 1) - SO 42 -, NO 3 -, PO 43 - … 2 H 2 O О 2 + 4 H+ + 4ē 2) Cl-, Br-, I 2 Cl- 2ē + Cl 2 б) активный (растворимый) Ме 0 А анод φ Меn+/Ме < φ ОН-/О 2 Ме. А 0 Ме. А+n + nē 0 i, А/м 2
Электролиз Анодные процессы Порядок окисления анионов(б) на аноде - 1 < 2 <. . . < n а) пассивный (инертный) анод - Ме φ Меn+/Ме > φ ОН-/О 2 , В 1) - SO 42 -, NO 3 -, PO 43 - … 2 H 2 O О 2 + 4 H+ + 4ē 2) Cl-, Br-, I 2 Cl- 2ē + Cl 2 б) активный (растворимый) Ме 0 А анод φ Меn+/Ме < φ ОН-/О 2 Ме. А 0 Ме. А+n + nē 0 i, А/м 2


