Lektsia_4_po_IMIS_ElKhim.ppt
- Количество слайдов: 28
 ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Электрохимические методы анализа и исследования основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Электрод – ионный проводник, находящийся в контакте с ионным проводником.
ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Электрохимические методы анализа и исследования основаны на изучении и использовании процессов, протекающих на поверхности электрода или в приэлектродном пространстве. Электрод – ионный проводник, находящийся в контакте с ионным проводником.
 ПРИРОДА АНАЛИТИЧЕСКИХ СИГНАЛОВ В ЭЛЕКТРОХИМИЧЕСКИХ МЕТОДАХ АНАЛИЗА Любая электрическая величина (потенциал, сила тока, электрическое сопротивление), функционально связанная с концентрацией анализируемого раствора и поддающаяся правильному измерению, может служить аналитическим сигналом.
ПРИРОДА АНАЛИТИЧЕСКИХ СИГНАЛОВ В ЭЛЕКТРОХИМИЧЕСКИХ МЕТОДАХ АНАЛИЗА Любая электрическая величина (потенциал, сила тока, электрическое сопротивление), функционально связанная с концентрацией анализируемого раствора и поддающаяся правильному измерению, может служить аналитическим сигналом.
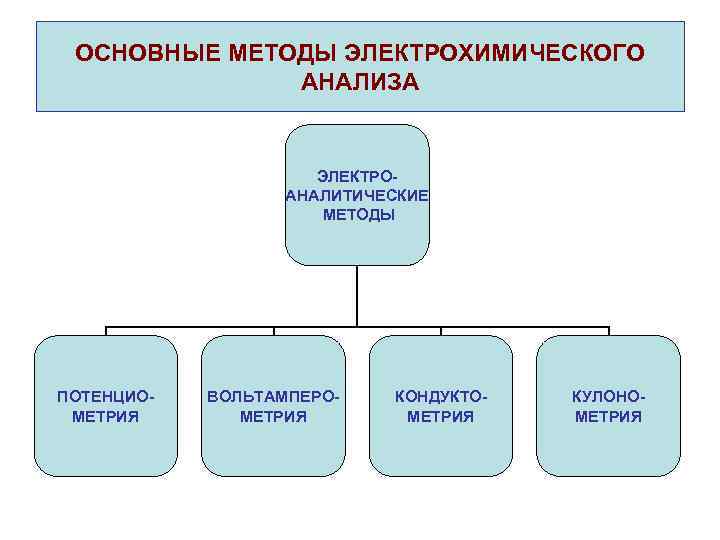 ОСНОВНЫЕ МЕТОДЫ ЭЛЕКТРОХИМИЧЕСКОГО АНАЛИЗА ЭЛЕКТРОАНАЛИТИЧЕСКИЕ МЕТОДЫ ПОТЕНЦИОМЕТРИЯ ВОЛЬТАМПЕРОМЕТРИЯ КОНДУКТОМЕТРИЯ КУЛОНОМЕТРИЯ
ОСНОВНЫЕ МЕТОДЫ ЭЛЕКТРОХИМИЧЕСКОГО АНАЛИЗА ЭЛЕКТРОАНАЛИТИЧЕСКИЕ МЕТОДЫ ПОТЕНЦИОМЕТРИЯ ВОЛЬТАМПЕРОМЕТРИЯ КОНДУКТОМЕТРИЯ КУЛОНОМЕТРИЯ
 ПОТЕНЦИОМЕТРИЯ Потенциометрический анализ – метод определения активности ионов потенциалопределяющих веществ по значению равновесного электродного потенциала. Основан на уравнении Нернста. Вальтер Герман Нернст (Walther Hermann Nernst, 1864 – 1941), лауреат Нобелевской премии по химии (1920)
ПОТЕНЦИОМЕТРИЯ Потенциометрический анализ – метод определения активности ионов потенциалопределяющих веществ по значению равновесного электродного потенциала. Основан на уравнении Нернста. Вальтер Герман Нернст (Walther Hermann Nernst, 1864 – 1941), лауреат Нобелевской премии по химии (1920)
 УРАВНЕНИЕ НЕРНСТА Е = Еº + S lga где: Еº - стандартный электродный потенциал, а - активность анализируемых ионов в растворе, S - крутизна электродной функции (S = 2, 3 RT/n. F, где n – число электронов, которое окисленная форма анализируемого иона отдает восстановленной форме).
УРАВНЕНИЕ НЕРНСТА Е = Еº + S lga где: Еº - стандартный электродный потенциал, а - активность анализируемых ионов в растворе, S - крутизна электродной функции (S = 2, 3 RT/n. F, где n – число электронов, которое окисленная форма анализируемого иона отдает восстановленной форме).
 ИЗМЕРЕНИЕ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА Потенциал одного, отдельно взятого электрода измерить невозможно. Его можно оценить только по сравнению с потенциалом другого электрода.
ИЗМЕРЕНИЕ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА Потенциал одного, отдельно взятого электрода измерить невозможно. Его можно оценить только по сравнению с потенциалом другого электрода.
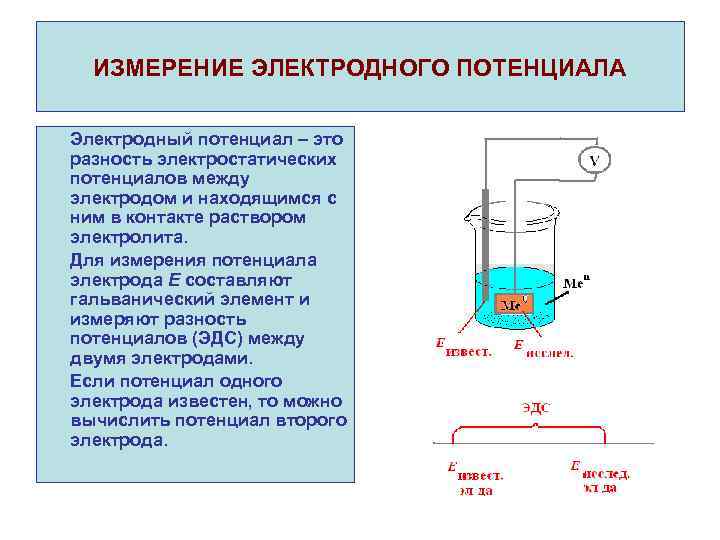 ИЗМЕРЕНИЕ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА Электродный потенциал – это разность электростатических потенциалов между электродом и находящимся с ним в контакте раствором электролита. Для измерения потенциала электрода Е составляют гальванический элемент и измеряют разность потенциалов (ЭДС) между двумя электродами. Если потенциал одного электрода известен, то можно вычислить потенциал второго электрода.
ИЗМЕРЕНИЕ ЭЛЕКТРОДНОГО ПОТЕНЦИАЛА Электродный потенциал – это разность электростатических потенциалов между электродом и находящимся с ним в контакте раствором электролита. Для измерения потенциала электрода Е составляют гальванический элемент и измеряют разность потенциалов (ЭДС) между двумя электродами. Если потенциал одного электрода известен, то можно вычислить потенциал второго электрода.
 ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Электрод, потенциал которого известен, называют электродом сравнения. Электрод, потенциал которого зависит от активности определяемого иона, называют индикаторным электродом.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ Электрод, потенциал которого известен, называют электродом сравнения. Электрод, потенциал которого зависит от активности определяемого иона, называют индикаторным электродом.
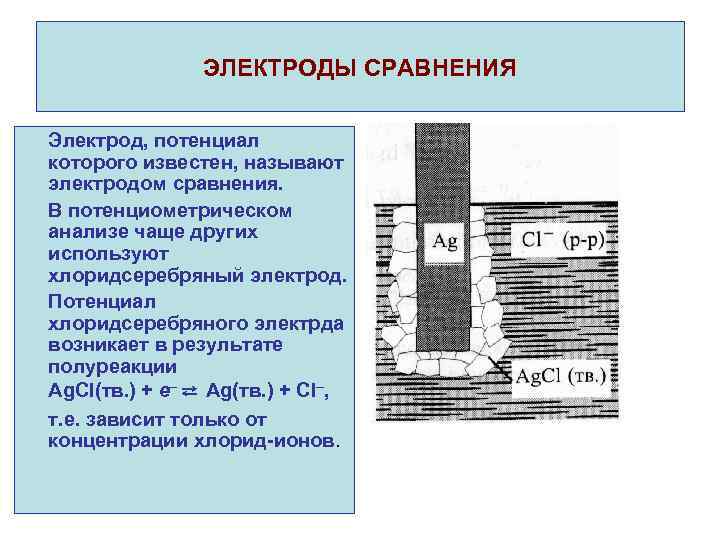 ЭЛЕКТРОДЫ СРАВНЕНИЯ Электрод, потенциал которого известен, называют электродом сравнения. В потенциометрическом анализе чаще других используют хлоридсеребряный электрод. Потенциал хлоридсеребряного электрда возникает в результате полуреакции Ag. Cl(тв. ) + e ⇄ Ag(тв. ) + Cl , т. е. зависит только от концентрации хлорид-ионов.
ЭЛЕКТРОДЫ СРАВНЕНИЯ Электрод, потенциал которого известен, называют электродом сравнения. В потенциометрическом анализе чаще других используют хлоридсеребряный электрод. Потенциал хлоридсеребряного электрда возникает в результате полуреакции Ag. Cl(тв. ) + e ⇄ Ag(тв. ) + Cl , т. е. зависит только от концентрации хлорид-ионов.
 ХЛОРИДСЕРЕБРЯНЫЙ ЭЛЕКТРОД Устройство хлоридсеребряного электрода: 1 – серебряная проволока, покрытая хлоридом серебра; 2 – раствор хлорида калия и хлорида серебра, насыщенный по Ag. Cl; 3 – жидкостное соединение (пористая керамическая пробка) 1 2 3
ХЛОРИДСЕРЕБРЯНЫЙ ЭЛЕКТРОД Устройство хлоридсеребряного электрода: 1 – серебряная проволока, покрытая хлоридом серебра; 2 – раствор хлорида калия и хлорида серебра, насыщенный по Ag. Cl; 3 – жидкостное соединение (пористая керамическая пробка) 1 2 3
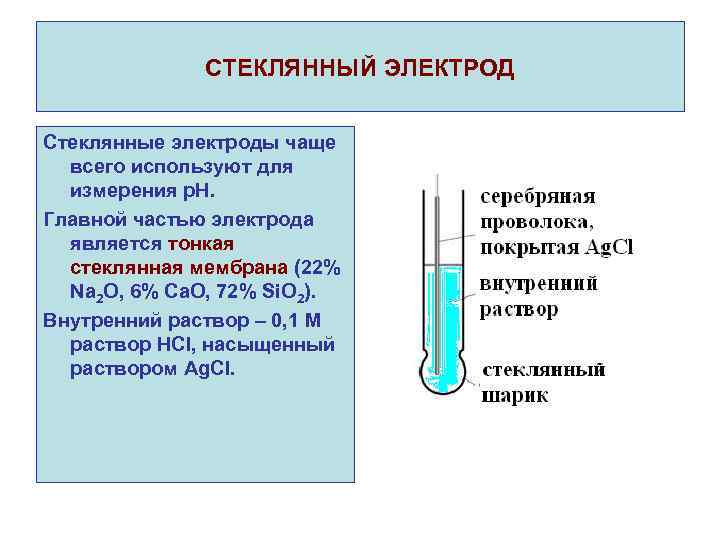 СТЕКЛЯННЫЙ ЭЛЕКТРОД Стеклянные электроды чаще всего используют для измерения р. Н. Главной частью электрода является тонкая стеклянная мембрана (22% Na 2 O, 6% Ca. O, 72% Si. O 2). Внутренний раствор – 0, 1 М раствор HCl, насыщенный раствором Ag. Cl.
СТЕКЛЯННЫЙ ЭЛЕКТРОД Стеклянные электроды чаще всего используют для измерения р. Н. Главной частью электрода является тонкая стеклянная мембрана (22% Na 2 O, 6% Ca. O, 72% Si. O 2). Внутренний раствор – 0, 1 М раствор HCl, насыщенный раствором Ag. Cl.
 СТЕКЛЯННАЯ МЕМБРАНА При длительном контакте с водными растворами на обеих сторонах мембраны образуется тонкий (10 -4 мм) слой гидратированного геля Si. O 2. Все пустоты в трехмерной сетке из атомов кремния и кислорода занимают катионы Н+, вытесняя находившиеся там катионы щелочного металла. Через слой сухого стекла внутри мембраны катионы водорода не проходят, там носителями тока служат катионы металла.
СТЕКЛЯННАЯ МЕМБРАНА При длительном контакте с водными растворами на обеих сторонах мембраны образуется тонкий (10 -4 мм) слой гидратированного геля Si. O 2. Все пустоты в трехмерной сетке из атомов кремния и кислорода занимают катионы Н+, вытесняя находившиеся там катионы щелочного металла. Через слой сухого стекла внутри мембраны катионы водорода не проходят, там носителями тока служат катионы металла.
 ПОТЕНЦИАЛ СТЕКЛЯННОГО ЭЛЕКТРОДА Потенциал хорошо вымоченного стеклянного электрода описывается уравнением: E = const + 0, 059 lg a(Н+) Стеклянный электрод пригоден для измерения р. Н в диапазоне от 0 до 10 единиц р. Н. В сильнокислых растворах происходит разрушение стекла. В сильнощелочных растворах электрод реагирует не только на катионы водорода, но и на катионы щелочных металлов.
ПОТЕНЦИАЛ СТЕКЛЯННОГО ЭЛЕКТРОДА Потенциал хорошо вымоченного стеклянного электрода описывается уравнением: E = const + 0, 059 lg a(Н+) Стеклянный электрод пригоден для измерения р. Н в диапазоне от 0 до 10 единиц р. Н. В сильнокислых растворах происходит разрушение стекла. В сильнощелочных растворах электрод реагирует не только на катионы водорода, но и на катионы щелочных металлов.
 КОМБИНИРОВАННЫЙ СТЕКЛЯНННЫЙ ЭЛЕКТРОД
КОМБИНИРОВАННЫЙ СТЕКЛЯНННЫЙ ЭЛЕКТРОД
 ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ С ТВЕРДЫМИ КРИСТАЛЛИЧЕСКИМИ МЕМБРАНАМИ ЭЛЕКТРОДЫ С ПОДВИЖНЫМИ РОСИТЕЛЯМИ
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ С ТВЕРДЫМИ КРИСТАЛЛИЧЕСКИМИ МЕМБРАНАМИ ЭЛЕКТРОДЫ С ПОДВИЖНЫМИ РОСИТЕЛЯМИ
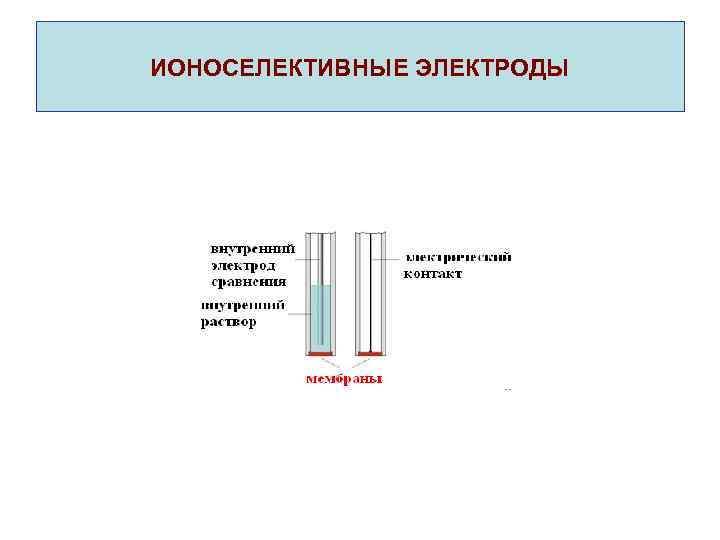 ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ
ИОНОСЕЛЕКТИВНЫЕ ЭЛЕКТРОДЫ
 ИНЕРТНЫЙ ЭЛЕКТРОД Инертным называется электрод, роль которого сводится к переносу электронов между частицами, находящимися в растворе. Таким электродом может служить платиновая проволока, погруженная в раствор соответствующего состава.
ИНЕРТНЫЙ ЭЛЕКТРОД Инертным называется электрод, роль которого сводится к переносу электронов между частицами, находящимися в растворе. Таким электродом может служить платиновая проволока, погруженная в раствор соответствующего состава.
 ИОНОМЕР Прибор для измерения р. Н, ЭДС и концентрации ионов называется иономер.
ИОНОМЕР Прибор для измерения р. Н, ЭДС и концентрации ионов называется иономер.
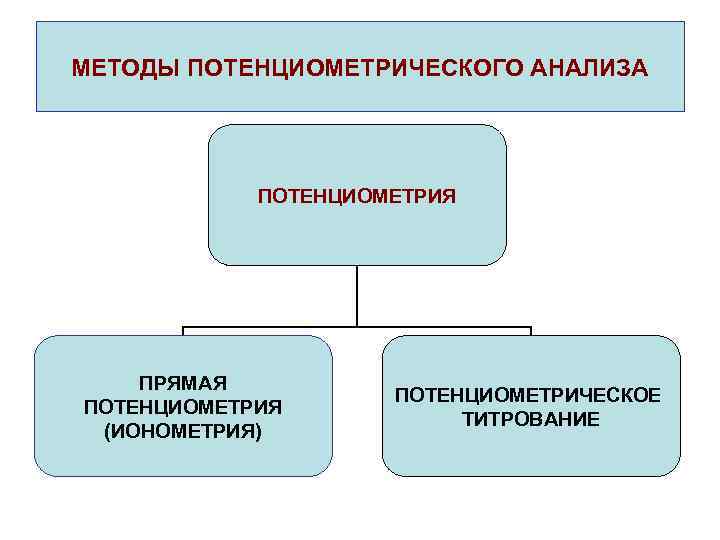 МЕТОДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА ПОТЕНЦИОМЕТРИЯ ПРЯМАЯ ПОТЕНЦИОМЕТРИЯ (ИОНОМЕТРИЯ) ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
МЕТОДЫ ПОТЕНЦИОМЕТРИЧЕСКОГО АНАЛИЗА ПОТЕНЦИОМЕТРИЯ ПРЯМАЯ ПОТЕНЦИОМЕТРИЯ (ИОНОМЕТРИЯ) ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
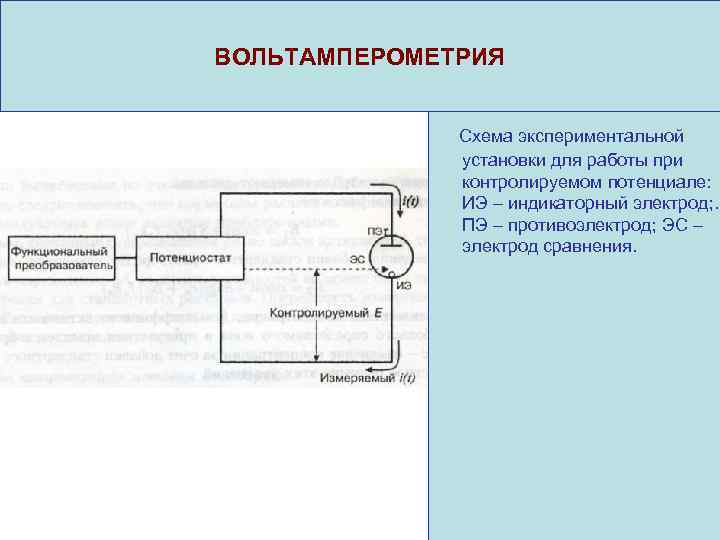 ВОЛЬТАМПЕРОМЕТРИЯ Схема экспериментальной установки для работы при контролируемом потенциале: ИЭ – индикаторный электрод; . ПЭ – противоэлектрод; ЭС – электрод сравнения.
ВОЛЬТАМПЕРОМЕТРИЯ Схема экспериментальной установки для работы при контролируемом потенциале: ИЭ – индикаторный электрод; . ПЭ – противоэлектрод; ЭС – электрод сравнения.
 ИНВЕРСИОННАЯ ВОЛЬТАМПЕРОМЕТРИЯ Анодная инверсионная вольтамперометрия: а – развертка потенциала на стадии накопления и регистрации вольтамперограммы, б – анодная инверсионная вольтамперограмма с линейной разверткой потенциала.
ИНВЕРСИОННАЯ ВОЛЬТАМПЕРОМЕТРИЯ Анодная инверсионная вольтамперометрия: а – развертка потенциала на стадии накопления и регистрации вольтамперограммы, б – анодная инверсионная вольтамперограмма с линейной разверткой потенциала.
 КОНДУКТОМЕТРИЯ или кондуктометрический метод анализа основана на измерении электрической проводимости анализируемых растворов
КОНДУКТОМЕТРИЯ или кондуктометрический метод анализа основана на измерении электрической проводимости анализируемых растворов
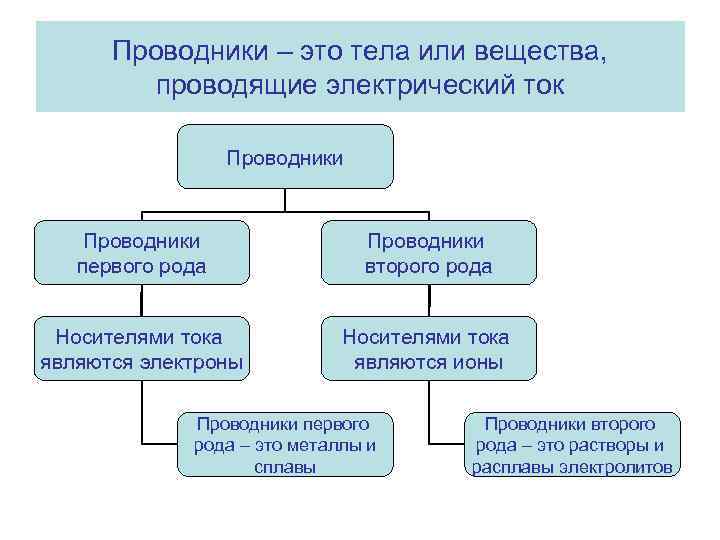 Проводники – это тела или вещества, проводящие электрический ток Проводники первого рода Проводники второго рода Носителями тока являются электроны Носителями тока являются ионы Проводники первого рода – это металлы и сплавы Проводники второго рода – это растворы и расплавы электролитов
Проводники – это тела или вещества, проводящие электрический ток Проводники первого рода Проводники второго рода Носителями тока являются электроны Носителями тока являются ионы Проводники первого рода – это металлы и сплавы Проводники второго рода – это растворы и расплавы электролитов
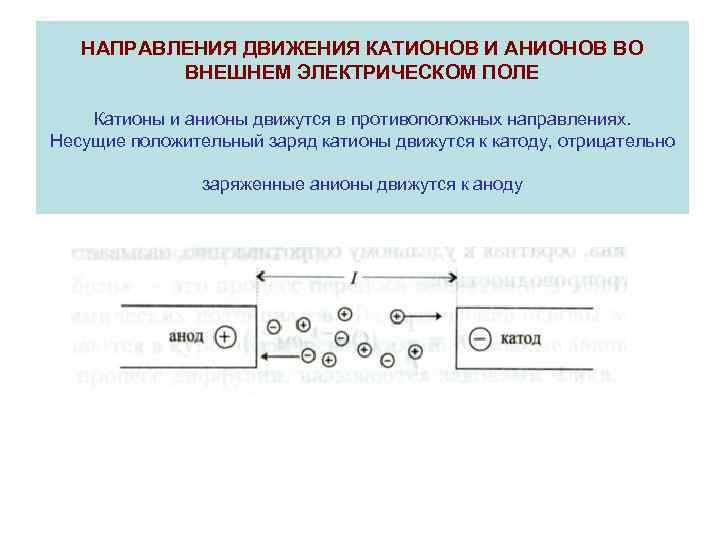 НАПРАВЛЕНИЯ ДВИЖЕНИЯ КАТИОНОВ И АНИОНОВ ВО ВНЕШНЕМ ЭЛЕКТРИЧЕСКОМ ПОЛЕ Катионы и анионы движутся в противоположных направлениях. Несущие положительный заряд катионы движутся к катоду, отрицательно заряженные анионы движутся к аноду
НАПРАВЛЕНИЯ ДВИЖЕНИЯ КАТИОНОВ И АНИОНОВ ВО ВНЕШНЕМ ЭЛЕКТРИЧЕСКОМ ПОЛЕ Катионы и анионы движутся в противоположных направлениях. Несущие положительный заряд катионы движутся к катоду, отрицательно заряженные анионы движутся к аноду
 УДЕЛЬНАЯ ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ Удельная электрическая проводимость равна электрической проводимости 1 кубического сантиметра раствора, находящегося между параллельными электродами площадью 1 квадратный сантиметр при расстоянии между ними 1 см. Единицей измерения удельной электрической проводимости является См/см. На рисунке цифрами обозначены зависимости для: 1 – HCl; 2 – KOH; 3 – уксусной кислоты Зависимость удельной электрической проводимости от концентрации растворов
УДЕЛЬНАЯ ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ Удельная электрическая проводимость равна электрической проводимости 1 кубического сантиметра раствора, находящегося между параллельными электродами площадью 1 квадратный сантиметр при расстоянии между ними 1 см. Единицей измерения удельной электрической проводимости является См/см. На рисунке цифрами обозначены зависимости для: 1 – HCl; 2 – KOH; 3 – уксусной кислоты Зависимость удельной электрической проводимости от концентрации растворов
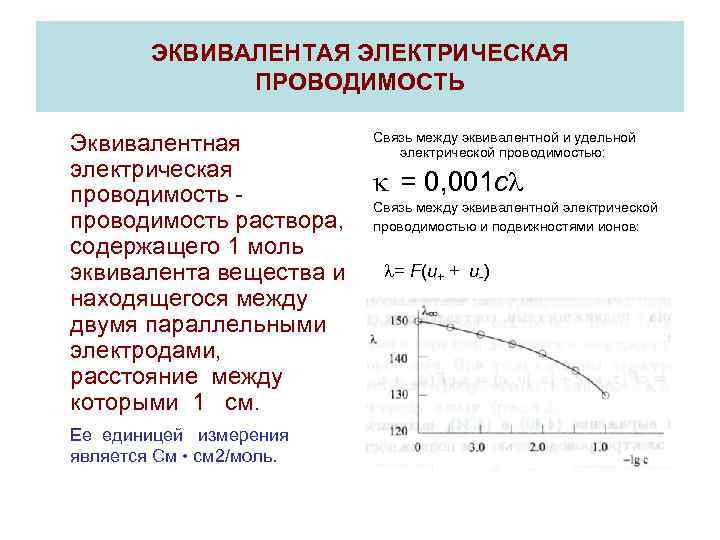 ЭКВИВАЛЕНТАЯ ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ Эквивалентная электрическая проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Ее единицей измерения является См • см 2/моль. Связь между эквивалентной и удельной электрической проводимостью: k = 0, 001 с Связь между эквивалентной электрической проводимостью и подвижностями ионов: = F(u+ + u-)
ЭКВИВАЛЕНТАЯ ЭЛЕКТРИЧЕСКАЯ ПРОВОДИМОСТЬ Эквивалентная электрическая проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося между двумя параллельными электродами, расстояние между которыми 1 см. Ее единицей измерения является См • см 2/моль. Связь между эквивалентной и удельной электрической проводимостью: k = 0, 001 с Связь между эквивалентной электрической проводимостью и подвижностями ионов: = F(u+ + u-)
 ЭКВИВАЛЕНТНЫЕ ЭЛЕКТРИЧЕСКИЕ ПРОВОДИМОСТИ НЕКОТОРЫХ ИОНОВ ПРИ БЕСКОНЕЧНОМ РАЗБАВЛЕНИИ (18 С)
ЭКВИВАЛЕНТНЫЕ ЭЛЕКТРИЧЕСКИЕ ПРОВОДИМОСТИ НЕКОТОРЫХ ИОНОВ ПРИ БЕСКОНЕЧНОМ РАЗБАВЛЕНИИ (18 С)
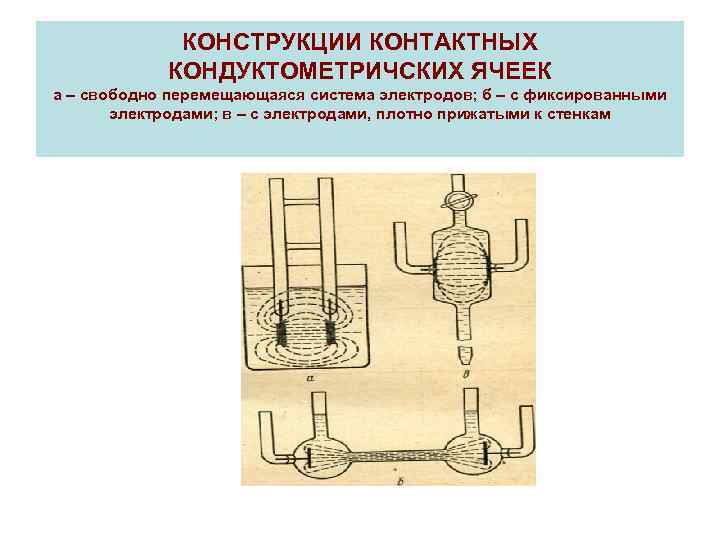 КОНСТРУКЦИИ КОНТАКТНЫХ КОНДУКТОМЕТРИЧСКИХ ЯЧЕЕК а – свободно перемещающаяся система электродов; б – с фиксированными электродами; в – с электродами, плотно прижатыми к стенкам
КОНСТРУКЦИИ КОНТАКТНЫХ КОНДУКТОМЕТРИЧСКИХ ЯЧЕЕК а – свободно перемещающаяся система электродов; б – с фиксированными электродами; в – с электродами, плотно прижатыми к стенкам


