adsorbtsia-3.pptx
- Количество слайдов: 26

ЭЛЕКТРОСТАТИЧЕСКИЕ СИЛЫ Адсорбция неполярных молекул на поверхности ионных решёток. Возникают индукционные силы взаимодействия, притяжение диполя, индуцированного в молекуле адсорбата электрическим полем, создаваемым решётки сорбента 1) (12) FI зависят от заряда иона, типов решётки и грани. В случае грани [100] – чередование ионов противоположны знаков 1

2) Адсорбция полярных молекул на неполярном адсорбенте Постоянный дипольный момент адсорбата поляризует атомы адсорбента, т. е. индуцирует в них электрические моменты. Возникает индукционное притяжение, которое добавляется к дисперсионному (13) на графите с поляризуемостью α 1 сорбция сорбата с дипольным моментом μ 2. Предельный случай – сорбция диполей на металлах. . 2
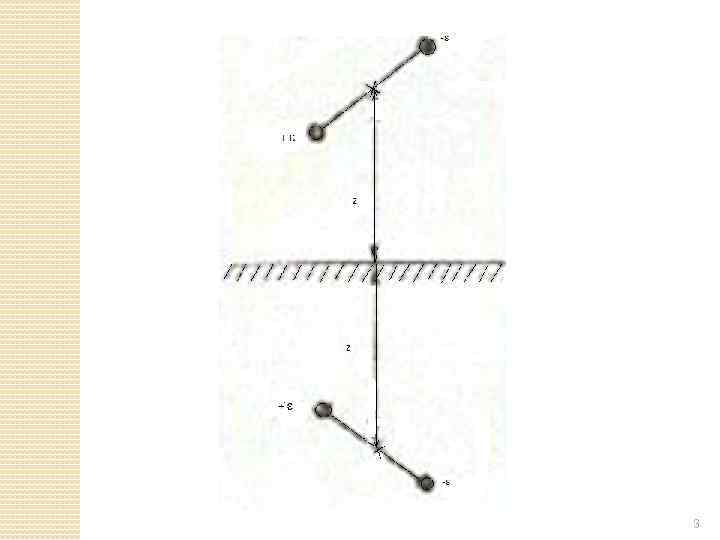
3

АДСОРБЦИЯ ПОЛЯРНЫХ МОЛЕКУЛ НА ПОВЕРХНОСТЯХ, ИМЕЮЩИХ ЭЛЕКТРИЧЕСКИЕ ЗАРЯДЫ Возникают ориентационные взаимодействия (кулоновские) v – валентность иона ε – заряд электрона l – расстояние между зарядами

В расчёте на моль При адсорбции спиртов с большим углеводородным радикалом или фенола энергия дисперсионных сил больше энергии электростатического взаимодействия. Так, например, фенол ориентируется плоскостью бензольного кольца параллельно поверхности адсорбента. Ось диполя оказывается расположенной под углом к направлению электростатического поля поверхности.
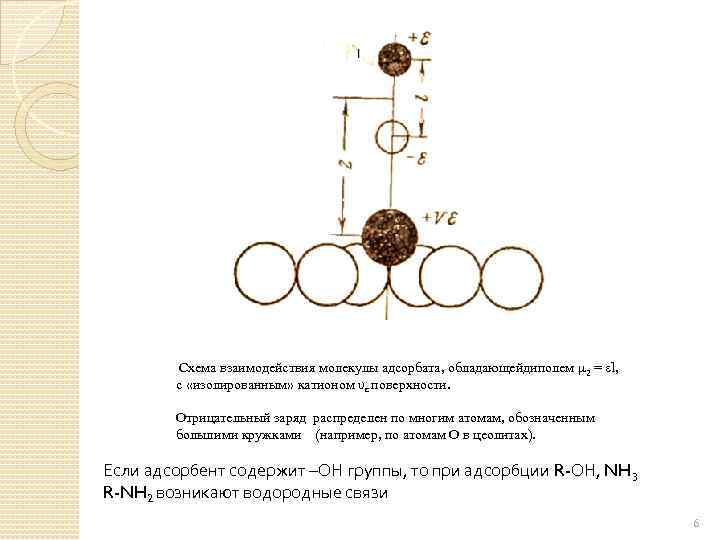
Схема взаимодействия молекулы адсорбата, обладающейдиполем μ 2 = εl, с «изолированным» катионом υε поверхности. Отрицательный заряд распределен по многим атомам, обозначенным большими кружками (например, по атомам О в цеолитах). Если адсорбент содержит –ОН группы, то при адсорбции R-ОН, NH 3 R-NH 2 возникают водородные связи 6
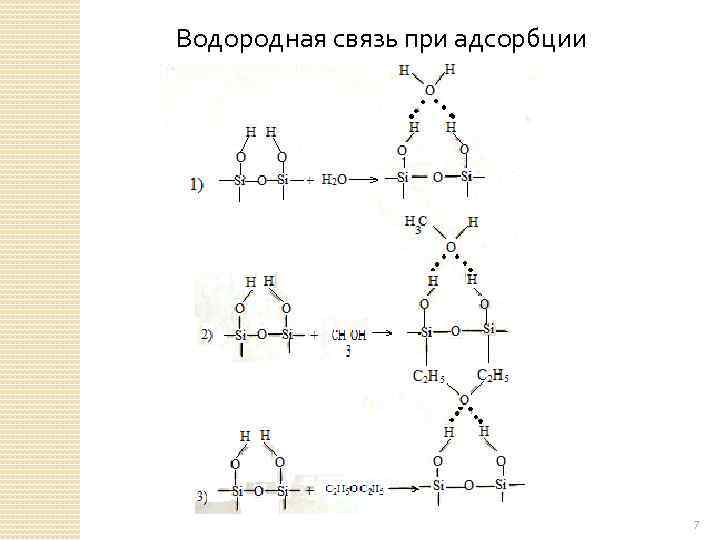
Водородная связь при адсорбции 7

При водородной связи общая энергия взаимодействия увеличивается Взаимодействие неполярных молекул, обладающих π–электронными связями с ОН-группами и ионами поверхности сорбента Непредельные углеводороды, ароматические углеводороды - это мультидиполи, т. Е. молекула в целом неполярна, однако в некоторых местах распределения электронной плотности является неравномерным. При адсорбции С 2 Н 4 или С 6 Н 6 располагаются на поверхности плоско. Возникают специфические взаимодействия, аналогичные водородной связи. Эта энергия на силикагеле 2 -4 ккал/моль Если брать С 6 Н 14 и С 6 Н 6 и рассмотреть теплоты адсорбции на графитированной саже при одинаковой степени заполнения, то они близки. 8
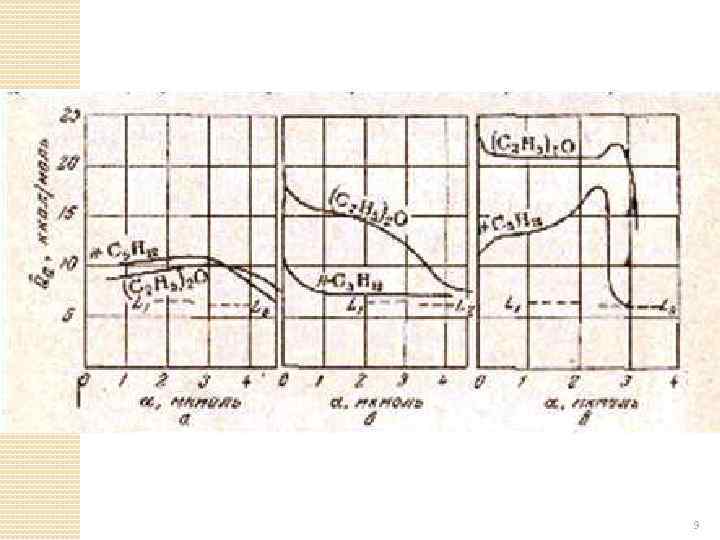
9
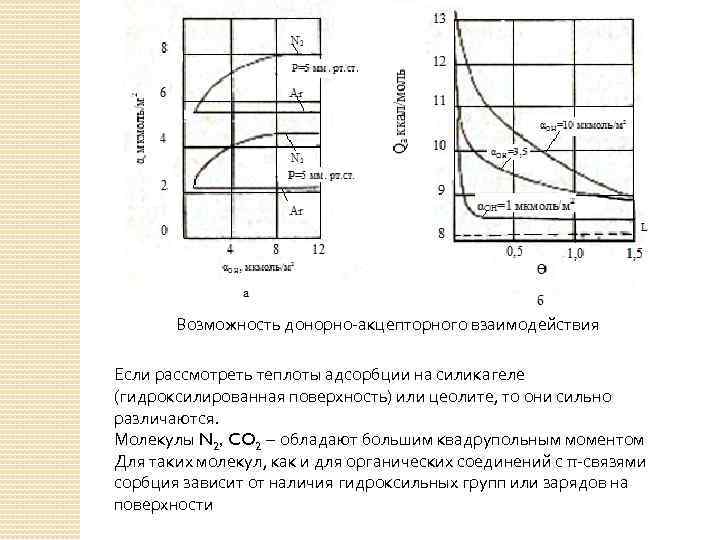
Возможность донорно-акцепторного взаимодействия Если рассмотреть теплоты адсорбции на силикагеле (гидроксилированная поверхность) или цеолите, то они сильно различаются. Молекулы N 2, CO 2 – обладают большим квадрупольным моментом Для таких молекул, как и для органических соединений с π-связями сорбция зависит от наличия гидроксильных групп или зарядов на поверхности

Энергия взаимодействия адсорбат-адсорбат При адсорбции необходимо учитывать взаимодействия сорбат-сорбат. Как правило, с увеличением степени заполнения поверхности энергия взаимодействия молекул сорбата с поверхностью сначала возрастает (или постоянна), а затем падает и при некоторых заполнениях становится равной теплоте конденсации.

Энергия взаимодействия адсорбат -адсорбат (латеральные взаимодействия) Молекулы адсорбата притягиваются не только к сорбенту, но и друг к другу. Оно увеличивается с увеличением заполнения до некоторого предела, при плотном заполнении заменяются силами отталкивания. Это в основном дисперсионные силы взаимодействия, а также в случае диполей или зарядов – электростатические взаимодействия. При адсорбции на очень неоднородных поверхностях взаимодействия адсорбат маскируется влиянием неоднородности и теплота адсорбции с увеличением заполнения не меняется 12

СОРБЕНТЫ Получение активных углей 1. Исходный материал подвергается термической обработке без доступа воздуха. При этом удаляются летучие частицы, влага, смолы. Получается крупнопористый уголь 2. Для получение микропористой структуры используется активация: а) парогазовая активация CO 2 (900 0 C ) C+CO→ 2 CO б) окисление водяным паром (850 0 С) С+H 2 O→CO+H 2 побочная реакция CO+H 2 O→CO 2+H 2+4, 2 к. Дж/моль Реакция экзотермическая. Катализаторы процесса –окислы и карбонаты щелочных металлов, соединения Cu и Fe. 13

в) активация воздухом С+О 2→СО 2+376 к. Дж/моль С+О 2→ 2 СО+227 к. Дж/моль Из-за большой экзотермичности и большой скорости реакции применяются редко. г) Обработка угля солями, которые при высокой температуре выделяют CO 2 (карбонаты, сульфаты , нитраты) 3. Химическая активация проводится при температурах 200 -650 о С 14

Силикагели Гидратированный аморфный кремнезем: Si. O 2∙Nh 2 o Превращения протекают по механизму поликонденсации: n (Si(OH)4)→Sin. O 2 n-m+(2 n-m)∙H 2 O Процесс поликонденсации ведет к образованию частиц коллоидных растворов, форма близкая к сферической 20200 Ao При высушивании гидрогеля кремниевой структурная сетка из связанных между собой сферических частиц сохраняется. На свойства силикагеля влияет группы ≡Si-OH. OH- группы занимают вершины тетраэдров. 15

Получение силикагеля Сырьем является твердый силикат Na Na 2 O∙ 3 Si. O 2+H 2 SO 4→ 3(Si. O 2+H 2 O)+Na 2 SO 4 аморфный кремнезем 16

ОКСИД АЛЮМИНИЯ Получают осаждением алюминиевых солей раствором аммиака или разложением алюмината натрия Адсорбционная активность зависит от температуры прокаливания Часто используется с нанесёнными на поверхность неорганическими солями и щелочами, для разделени углеводородов вплоть до С 36 Обезвоженный оксид алюминия применяют для разделения лёгких газов

ЦЕОЛИТЫ Обладают свойствами молекулярных сит Используются как природные, так и синтетические цеолиты Существуют цеолиты марки A, X и Y в зависимости от строения кристаллической решётки Цеолит Na. A: Na 2 O∙Al 2 O 3∙ 2 Si. O 2∙ 4, 5 H 2 O Кремнезем Si. O 2: Al 2 O 3 не более 2 Обладают высокой полярностью и высоким сродством к воде Широко используются для нужд осушки различных объектов
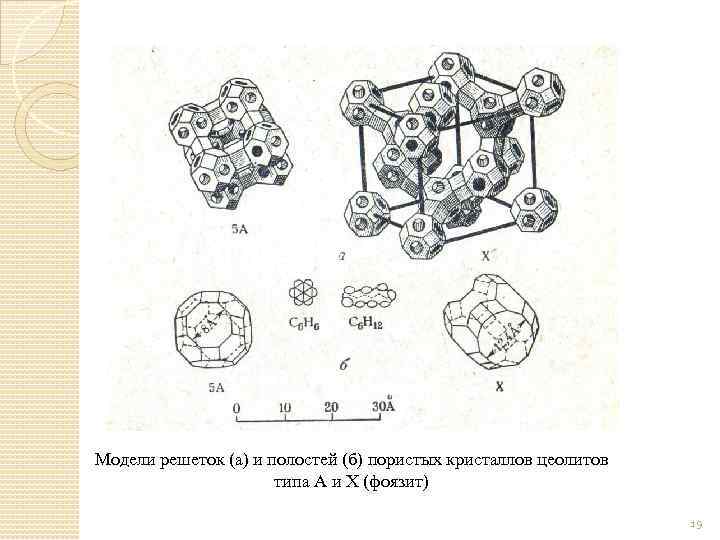
Модели решеток (а) и полостей (б) пористых кристаллов цеолитов типа А и X (фоязит) 19
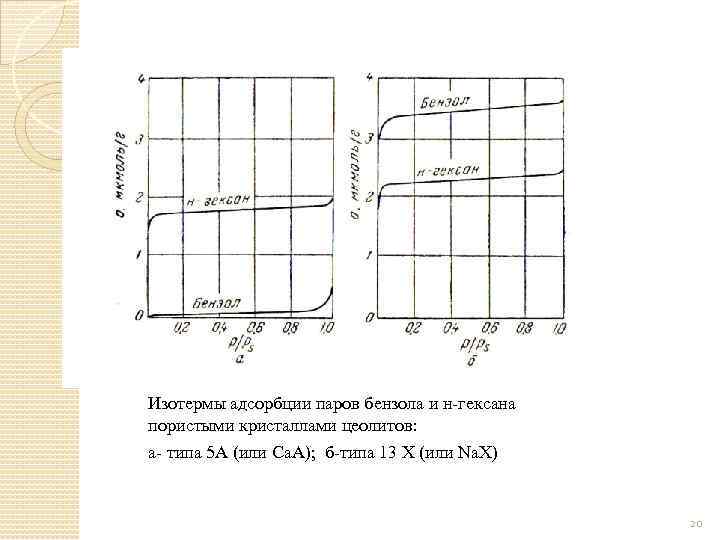
Изотермы адсорбции паров бензола и н-гексана пористыми кристаллами цеолитов: а- типа 5 А (или Са. А); б-типа 13 Х (или Na. X) 20

Модификация неорганических адсорбентов 1. Обработка кислотами и щелочами (неорганические соли, удаление примесей) 2. Связывание гидроксильных групп, расположенных на поверхности хлометисиланами 3. Насыщение парами воды (дезактивация) 4. Геометрическая модификация (прокаливание адсорбента при 900 -1000 о. С, изменяется поровая структура, остаются крупные поры; поверхность также дегидрокилируется). 21

ПОРИСТЫЕ СТЁКЛА Получаются обработкой боросиликатного стекла минеральными кислотами Можно варьировать условия получения, что позволяет синтезировать как объёмно-пористые, так и поверхностнопористые стёкла Могут иметь свойства молекулярного сита Обладают однородной поверхностью – основное преимущество Применяются для разделения низкокипящих газов и паров, макропористые стёкла могут применяться для разделения смесей нормальных и ароматических углеводородов

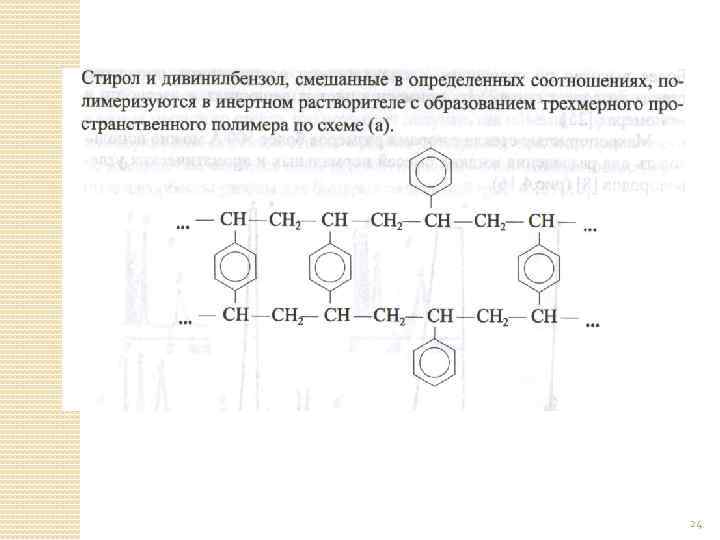
ПОРИСТЫЕ ПОЛИМЕРЫ Получаются полимеризацией мономеров с различными функциональными группами (стирол, этилстирол, метакрилат, акриловая кислота, акрилонитрил и т. д. ) в присутствии инертного разбавителя (толуол или изо-октан), который плохо растворяет полимеры и хорошо – мономеры. Для сшивки полимерных цепей добавляют сшивающий агент (дивинилбензол) в соотношении 80 -100% к массе мономеров
24

ПРЕИМУЩЕСТВА ПОРИСТЫХ ПОЛИМЕРОВ ü ü ü Значительная сорбционная активность Высокая чистота поверхности сорбентов Большая скорость сорбции Способность регулировать как химию поверхности, так и пористость при синтезе Удобство при заполнении колонок и картриджей Способность к многократной регенерации

ТИПЫ ПОРИСТЫХ ПОЛИМЕРОВ ПО КЛАССИФИКАЦИИ В. А. ДАВАНКОВА поколение пористых полимеров – гелеобразные полимеры с малым количеством сшивающего агента (до 8%). Низкая сорбционная активность. ØI поколение пористых полимеров – большое количество сшивающего агента (80 -100%), высокая сорбционная активность. Марки полимеров: полисорб, Porapack, Amberlite, Dowex, Chromosorb ØII поколение пористых полимеров – сверхсшитый полистирол, очень высокая сорбционная активность. Марки полимеров: Purolite MN, Стиросорб ØIII
adsorbtsia-3.pptx