Электропроводность растворов электролитов.ppt
- Количество слайдов: 45

Электропроводность растворов электролитов Электропроводностью называют способность веществ проводить электрический ток. Электропроводность L обозначает величину, обратную сопротивлению проводника тока R: Ом– 1; Ом– 1 — обратный Ом или См [сименс], или сим.

n n n n n На скорость движения ионов в растворе влияют : 1. Природа иона [размер, плотность заряда, гидратация]. чем >заряд и чем <радиус иона, тем сильнее гидратируется ион. Лиотропные ряды Офмейстера : по уменьшению гид-ти: SO 4 2 -…. Cl -…. CNS- для катионов: Li+…. Na+…K+ Ba 2+ 2. Температура - прямопропорционально т. к. уменьшается вязкость растворов и гидратация частиц. 3. Величина заряда — прямопропорционально. 4. Природа растворителя. 5. Концентрация растворённого вещества. Разбавление способствует повышению скорости ионов 6. Наибольшей подвижностью обладают H+, OH-, т. к. они перемещаются путём передачи H+ от одной молекулы воды к другой с образованием гидроксония (эстафетный механизм)
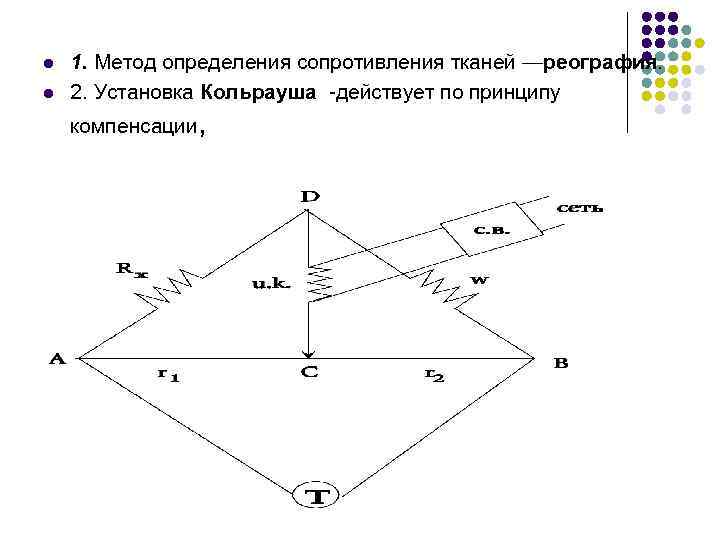
l l 1. Метод определения сопротивления тканей —реография. 2. Установка Кольрауша -действует по принципу компенсации,

§ 1. У начала реохорда АВ ток будет разветвляться на две ветви: § ----через сопротивления r 1 и r 2, § === RX и магазин сопротивлений W. § 2. При отсутствии тока в мостике АВ будет наблюдаться минимум звука в наушниках телефона. § При отношении § тока в мостике АВ не будет. § r 1 и r 2 можно заменить длиной отрезков струны реохорда: § — это основная формула
![Сопротивление раствора RX будет прямо пропорционально удельному сопротивлению [ро] и расстоянию между электродами l Сопротивление раствора RX будет прямо пропорционально удельному сопротивлению [ро] и расстоянию между электродами l](https://present5.com/presentation/39285485_266819371/image-5.jpg)
Сопротивление раствора RX будет прямо пропорционально удельному сопротивлению [ро] и расстоянию между электродами l и обратно пропорционально площади электродов S: n n n Величина, обратная удельному сопротивлению - удельная электропроводность [каппа] , отсюда Отношение обозначают как КС — постоянная сосуда. , отсюда , следовательно, .

n n n n Удельная электропроводность - это электропроводность одного кубического метра раствора электролита, помещённого между двумя электродами, имеющими площадь, равную одному квадратному метру, и находящимися на расстоянии 1 м друг от друга [СИ]. Размерность = Ом– 1 см– 1 [СГС]; = См м– 1 [СИ]. Удельная электропроводность зависит : 1. Температуры [т. к. температура меняет вязкость растворов и гидратацию частиц]. 2. Природы растворённого вещества [от этого зависят размеры ионов, величина их заряда и степень гидратации]. 3. Концентрации растворённого вещества [определяющей количество в растворе ионов, переносящих электричество].
![n n n молярная электропроводность [лямда]. электропроводность раствора, содержащего 1 моль электролита, помещённого между n n n молярная электропроводность [лямда]. электропроводность раствора, содержащего 1 моль электролита, помещённого между](https://present5.com/presentation/39285485_266819371/image-7.jpg)
n n n молярная электропроводность [лямда]. электропроводность раствора, содержащего 1 моль электролита, помещённого между электродами, отстоящими один от другого на расстоянии 1 м [СИ]. = V, где V — объём в мл, содержащий 1 моль. Если объём, содержащий 1 моль, выражен в литрах, то , где С — концентрация. Размерность = См моль– 1 м 2 [СИ]

l l l Молярная электропроводность зависит: 1. От скорости движения ионов. 2. От количества ионов в растворе.

• Закон Кольрауша : • молярная электропроводность при бесконечном разведении равна сумме электропроводностей катионов и анионов. • = к + а, где к и а — подвижности катиона и аниона. • к = F uк, а = F uа, где • F — число Фарадея; • u — абсолютная скорость иона.

n Пользуясь установкой Кольрауша, можно рассчитать степень диссоциации , используя формулу Аррениуса: n , v — мольная электропроводность [находят экспериментально]; — мольная электропроводность при бесконечном разведении [находят по таблице

n n С помощью мостика Кольрауша можно определить не только удельную и мольную электропроводность, степень диссоциации, но и константу диссоциации. закон разведения Оствальда:

l l l применении кондуктометрических методов 1. реография 2. точные и чувствительные методы. 3. Для насыщенного раствора труднорастворимых электролитов можно определить растворимость и произведение растворимости. 4. Создан электронный счётчик форменных элементов крови. Принцип действия этого автомата основан на различной электропроводности частиц и жидкости, в которой они находятся. 5. К кондуктометрическим методам относится определение полного электрического сопротивления — импеданса крови, причём для определения требуется всего 0, 15 мл крови.

l l l l l В целях диагностики применяется определение удельной электропроводности биологических жидкостей. 1. удельная электропроводность мочи в норме составляет [165‑ 299] 10– 2 Ом– 1. Этот показатель уменьшается при заболеваниях почек и сахарном диабете, т. к. увеличивается выведение солей из организма. 2. В норме удельная электропроводность сыворотки крови [108‑ 115] 10– 2 Ом– 1. Она увеличивается в случае цирроза печени и застойной печени, обусловленной сердечной недостаточностью. 3. В норме удельная электропроводность желудочного сока [100‑ 125] 10– 2 Ом– 1; менее 80 10– 2 Ом– 1— бескислотность; [80 -100] 10– 2 Ом– 1— гипокислотность; свыше 125 10– 2 Ом– 1— гиперкислотность. Малые значения удельной электропроводности желудочного сока отмечаются при застарелой язве желудка, большие значения — при свежей язве желудка и кислотных [гиперацидных] гастритах.

l l l Явление электропроводности в физиотерапии: . а/ Если на тело наложить два электрода постоянного тока, то под катодом будут накапливаться более подвижные ионы водорода, натрия и калия. Ионы натрия и калия разрыхляют клеточные оболочки, повышают их проницаемость и в клетки проникают лекарственные препараты, наносимые на кожу под катодом. б/ Наложение катода рекомендуется для восстановления функций нервов после травм, так как возбудимость клеток при этом повышается. в/ При болях для снижения возбудимости применяется наложение анода. . г/ для лечения кожных язв и пролежней. Под влиянием бальнеогрязелечения, в свою очередь, изменяется электропроводность кожи у больных хроническими дерматозами. д/ для устранения искривления позвоночника и сращивания костей.

n n n n n е/ Электростимулирование применяется во время хирургических операций для предотвращения ателектаза [спадения лёгочных альвеол] и кишечной непроходимости. ж/ стимуляция мозга для лечения больных эпилепсией, не поддающейся излечению лекарствами. з/ Стимулирование таламуса в мозге способствует улучшению памяти. и/ Разработан прибор для стимулирования мышц у парализованных больных. к/ Лечение близорукости. Все эффекты а)-к) можно объяснить ===перераспределением ионов под влиянием электрического тока, === повышение обмена веществ, что и способствует рассасыванию рубцов, ускоряет регенерацию, ликвидирует воспалительные процессы
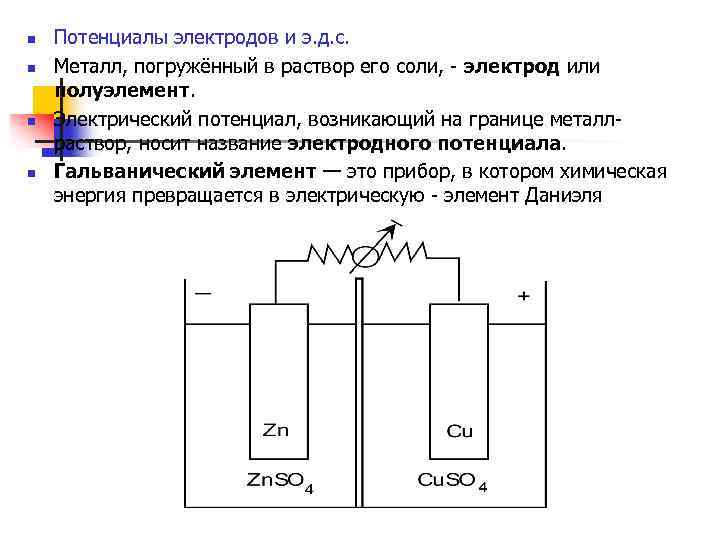
n n Потенциалы электродов и э. д. с. Металл, погружённый в раствор его соли, - электрод или полуэлемент. Электрический потенциал, возникающий на границе металлраствор, носит название электродного потенциала. Гальванический элемент — это прибор, в котором химическая энергия превращается в электрическую - элемент Даниэля
![n n n n Разность потенциалов между двумя электродами - электродвижущая сила [ЭДС] гальванического n n n n Разность потенциалов между двумя электродами - электродвижущая сила [ЭДС] гальванического](https://present5.com/presentation/39285485_266819371/image-17.jpg)
n n n n Разность потенциалов между двумя электродами - электродвижущая сила [ЭДС] гальванического элемента. . = е+Cu – e–Zn Гальванической цепью называют совокупность всех скачков потенциалов на различных поверхностях раздела данного гальванического элемента. Zn 2+ + 2ē Cu 2+ + 2ē Cu Zn + Cu 2+ Zn 2+ + Cu Обычно принята следующая форма записи гальванической цепи: А [-] Zn | Zn 2+ | KCl | Cu 2+ | Cu [+] К

n n n Если реакция в элементе может быть полностью обращена в противоположном направлении приложении к нему внешней противоположно направленной ЭДС, такой элемент называется обратимым (Эл-т Даниэля) Если в раствор сульфата меди опустить и медную и цинковую пластинки, такая гальваническая цепь будет необратимой. Если электрод работает на основе обмена катионами между электродом и раствором, такой электрод называют обратимым относительно катиона [например, водородный электрод]. , обратимые относительно аниона - хлорный или каломельный электроды]. Если электрод обратим только относительно одного из ионов [например, цинка в цинковом электроде], то электрод I рода. Электроды II рода обратимы относительно и катионов, и анионов. [каломельный электрод].

n n n n n Классификация электродов: 1. обратимые и необратимые 2. 1 и II рода 3. мембранные 4. ионноселективные 5. окислительно-восстановительные 6. по функциям: а)электроды сравнения -Нормальный водородный и хлорсеребряный Б)электроды определения р. Н –водородный и ионноселективный (стеклянный)

n n n Величина электродного потенциала зависит 1. от природы металла, от его положения в так называемом ряду напряжений. 2. от температуры. С повышением температуры он возрастает в силу молекулярно-кинетического движения. 3. от концентрации электродной жидкости. Чем выше эта концентрация, тем меньше потенциал. 4. от природы растворителя, от степени полярности его молекул, отрывающих ионы от кристаллической решётки металла.

n уравнение Нернста. n Для электродов, обратимых относительно катиона, это уравнение выглядит так: n Для электродов, обратимых относительно аниона, уравнение выглядит так: n n n n n , где е — электродный потенциал, В; е 0 — нормальный потенциал электрода [потенциал при активности ионов металла в растворе, равной 1 моль/л]; R — газовая постоянная [8, 31 Дж/моль К]; Т — абсолютная температура; Z — валентность — количество электронов, которое теряет или приобретает атом или ион; F — число Фарадея [96500]; а — активность ионов металла в растворе [моль/л]; а– — активность аниона в растворе [моль/л]; ln — натуральный логарифм.

n n n Для разбавленных растворов активность можно заменить концентрацией- уравнение Нернста. Тюрина: , где С — концентрация электродной жидкости; n Умножением на 2, 303 натуральный логарифм можно заменить десятичным, кроме того, можно подставить значения R, F и Т, тогда при температуре 18 С уравнение примет вид: [в милливольтах] n или [в вольтах]: n
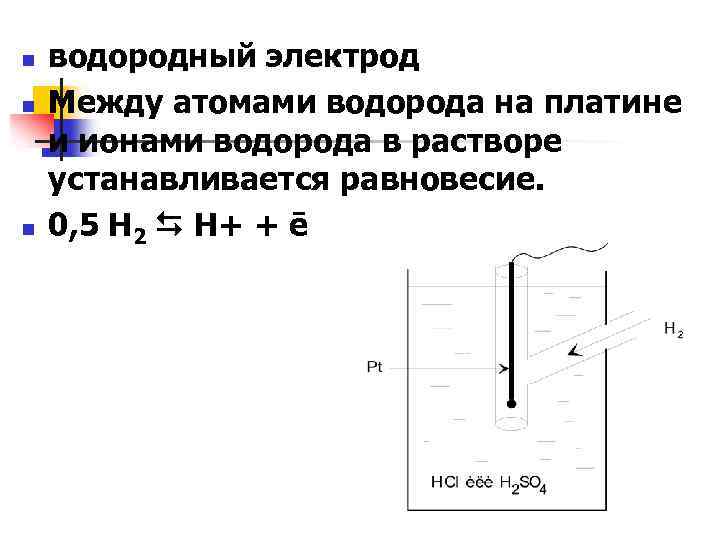
n n n водородный электрод Между атомами водорода на платине и ионами водорода в растворе устанавливается равновесие. 0, 5 Н 2 Н+ + ē

n n n В качестве нормального водородного электрода принимается водородный электрод, работающий 1/ t = 298, 15 К; 2/ давление 1 атм [1, 01325 105 Па]; 3/ концентрация или активность С Н+ = 1 гион/л; а Н+ = 1 моль/л. потенциал его равен нулю. е = 0: Нормальный водородный электрод используется для сравнения с электродами, имеющими неизвестный потенциал, поэтому его называют электродом сравнения.

n n Нормальные электродные потенциалы Нормальный электродный потенциал — этот потенциал, возникающий на металлической пластинке, погружённой в раствор соли этого же металла, с активностью ионов данного металла, равной 1 моль/л при сравнении с потенциалом нормального водородного электрода.

n n n n Хлорсеребряный электрод –эл-дсравнения Ag/ Ag. Cl/ KClнасыщ состоит из серебряной проволоки, покрытой твёрдой солью Ag. Cl и погружённой в раствор KCl. КCl К+ + Сl. Ag Ag+ + ē Ag+ + Cl– Ag. Cl Потенциал электрода, зависит обратно пропорционально от концентрации ионов хлора в растворе т. е. от концентрации KCl При 25 С в насыщенном растворе KCl потенциал хлорсеребряного электрода +245, 8 м. В.
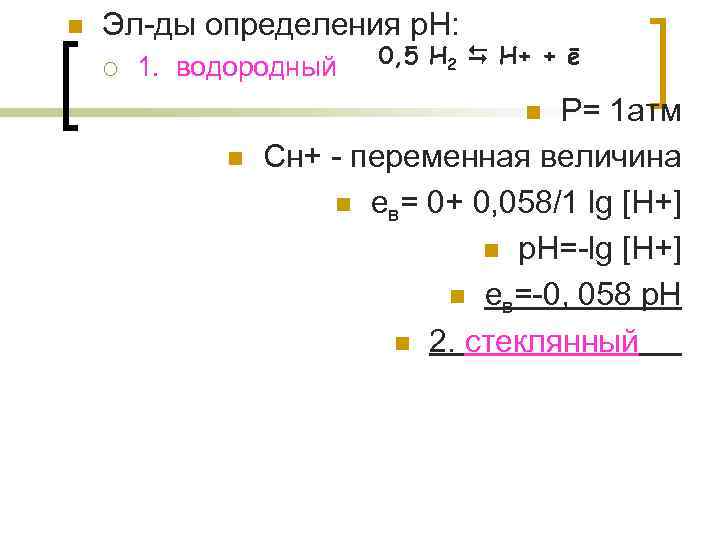
n Эл-ды определения р. Н: ¡ 1. водородный 0, 5 Н 2 Н+ + ē Р= 1 атм Сн+ - переменная величина n ев= 0+ 0, 058/1 lg [H+] n p. H=-lg [H+] n eв=-0, 058 p. H n 2. стеклянный n n
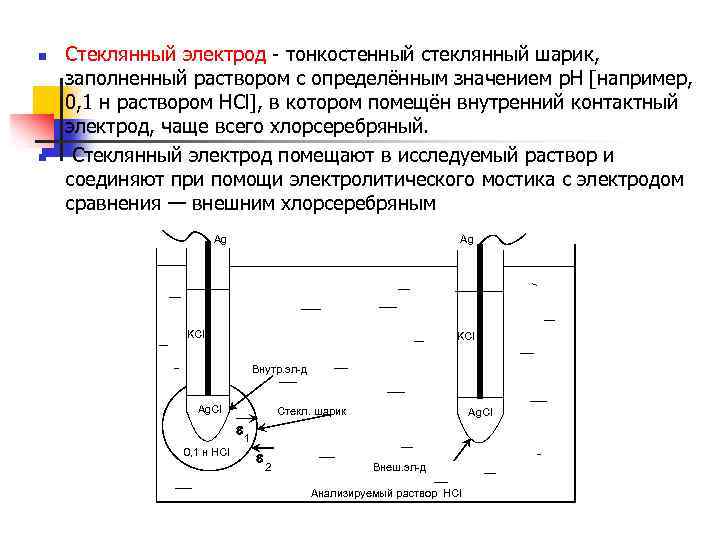
n n Стеклянный электрод - тонкостенный стеклянный шарик, заполненный раствором с определённым значением р. Н [например, 0, 1 н раствором HCl], в котором помещён внутренний контактный электрод, чаще всего хлорсеребряный. Стеклянный электрод помещают в исследуемый раствор и соединяют при помощи электролитического мостика с электродом сравнения — внешним хлорсеребряным Ag Ag KCl Внутр. эл-д Ag. Cl Стекл. шарик Ag. Cl e 1 0, 1 н HCl e 2 Внеш. эл-д Анализируемый раствор HCl

• Применение стеклянного электрода основано на том, • что стекло содержит катионы, которые могут обмениваться с катионами, находящимися в растворе: • Na+(стекло) + Н+ (р-р) = Н+ (ст. ) +Na+ (р-р) • По обе стороны стеклянной мембраны возникают потенциалы Е 1 и Е 2, зависящие от активности обоих растворов HCl. • Ag/ Ag. Cl/ KClнасыщ/ Н+ внутри/Н+ снаружи •

• 1. Стеклянный электрод не обменивает электроны, только ионы водорода. • 2. Потенциал стеклянного электрода очень мал, его можно измерить только в специальных приборах — р. Н-метрах, где он усиливается. • 3. он позволяет определить [от 0 до 14]. • 4. недостатки: хрупкость, отравляется As и Hg.

При соприкосновении растворов разных концентраций растворённое вещество диффундирует в раствор с меньшей концентрацией. l Если диффундирующие ионы имеют разную скорость, то более подвижные ионы оказываются впереди. l На границе раздела растворов возникает так называемый диффузионный потенциал, который усредняет скорости движения ионов. l Диффузионные потенциалы могут возникать при повреждении поверхностного слоя клеток. При этом нарушается избирательность их проницаемости. Возникает потенциал повреждения= 30 -40 м. В. l

l l l Мембранный потенциал Диффузионный потенциал может сильно возрасти, если растворы электролитов разных концентраций разделить мембраной, проницаемой только для ионов с каким-либо одним зарядом 1. концентрация ионов К+ внутри эритроцитов приблизительно в 35 раз выше, чем в плазме крови. 2. Концентрация ионов Nа+ снаружи в 15 раз выше, чем внутри клетки. в состоянии покоя поверхность клетки заряжена положительно по отношению к её внутреннему содержимому: K + +

l l l Мембранный потенциал нервной клетки равен – 75 м. В и почти целиком определяется ионами калия. В момент возбуждения избирательная проницаемость мембран утрачивается и сквозь них устремляется поток ионов — возникает электрический ток. При возбуждении участок поверхности приобретает отрицательный заряд. При возбуждения ионы натрия движутся внутрь клетки и мембранный потенциал становится +50 м. В. Обращение знака заряда при движении ионов Na+ деполяризует мембрану. Внезапное повышение и падение мембранного потенциала называется + потенциалом действия. + K + Na

l l l Формирование потенциала действия обусловлено двумя ионными потоками через мембрану: поток ионов Na+ внутрь клетки приводит к перезарядке мембраны, а противоположно направленный поток ионов К+ обусловливает восстановление исходного потенциала покоя. В периоды покоя концентрационные градиенты ионов калия и натрия восстанавливаются в результате работы натрий-калиевого насоса, обеспечивающего перенос этих ионов против градиента концентрации. Перенос веществ против градиента концентрации — за счет энергии гидролиза АТФ. При гидролизе 1 молекулы АТФ 3 иона Na+ выводятся из клетки, а 2 иона К+ поступают внутрь клетки.
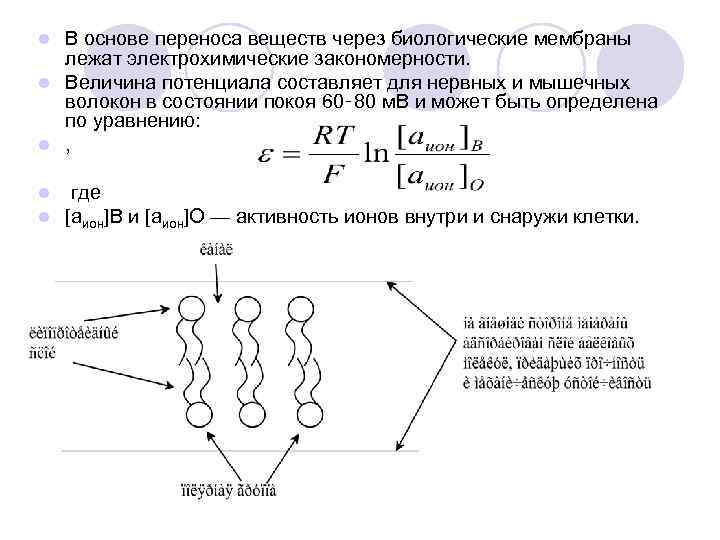
В основе переноса веществ через биологические мембраны лежат электрохимические закономерности. l Величина потенциала составляет для нервных и мышечных волокон в состоянии покоя 60‑ 80 м. В и может быть определена по уравнению: l , l l l где [аион]В и [аион]О — активность ионов внутри и снаружи клетки.
![В узкие канальцы липопротеидного слоя [в состоянии покоя] могут проходить ионы К+ и не В узкие канальцы липопротеидного слоя [в состоянии покоя] могут проходить ионы К+ и не](https://present5.com/presentation/39285485_266819371/image-36.jpg)
В узкие канальцы липопротеидного слоя [в состоянии покоя] могут проходить ионы К+ и не проходят ионы Na+. l ==== При действии раздражителя на нервное или мышечное волокно мембранный потенциал Е в месте раздражения нарушается l ===поляризация мембраны меняется на обратную, поток ионов Na+ засасывается внутрь, l ===. Нервный импульс, потенциал действия передаётся дальше по нервному волокну. l

l l l l В транспорте ионов К+ через мембрану важную роль играет комплексообразование с ферментами и субстратами. Биологической моделью такого процесса является образование прочного комплекса антибиотика валиномицина с ионами К+. Ионы натрия связываются с валиномицином в очень незначительной степени [играет роль радиус иона]. Валиномицин относят к ионофорам. Ионофоры формируют молекулярную полость, в которой катион удерживается. Резко ослабляется связь катиона с растворителем и противоионами. Комплекс претерпевает конформационную перестройку, а его внешняя часть заполняется углеводородными радикалами. Это обеспечивает растворимость комплекса в липидах. Комплекс иона калия с ионофором переносит К через мембрану, после чего комплекс диссоциирует и катион переходит в водную фазу.

l Компенсационный метод Поггендорфа l При работе гальванического элемента его ЭДС не сохраняет строго постоянного значения вследствие изменения концентрации растворов и других причин. l Поэтому точные измерения ЭДС должны производиться при минимальном прохождении тока. - компенсационный метод измерения ЭДС [метод Поггендорфа
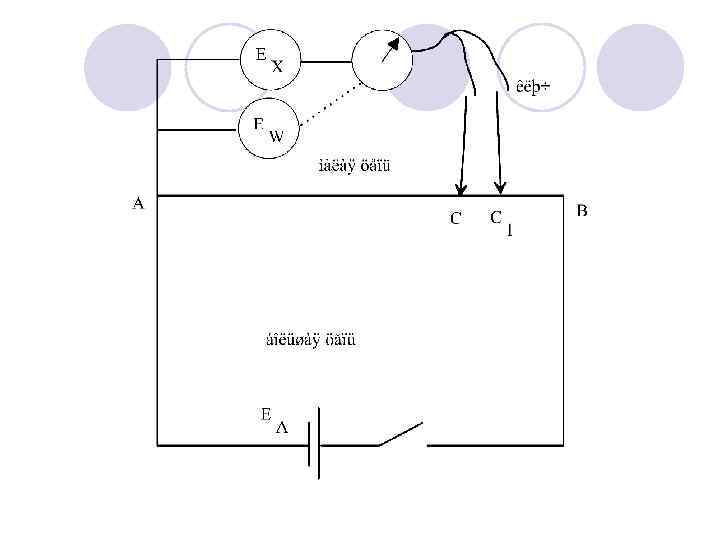

Перемещая подвижной контакт, можно подобрать такое положение его, при котором ЭДС элемента будет точно компенсироваться и в малой цепи ток проходить не будет. l Это означает, что падение потенциала вдоль проволоки на участке АС точно равно ЭДС измеряемого элемента ЕХ. Зная длину АС этого участка проволоки, длину остальной части проволоки ВС и ЭДС источника тока ЕА, можно рассчитать ЭДС измеряемого элемента: l l

l Если вместо аккумулятора использовать сетевой ток, то сначала нужно рассчитать ЭДС сети. Для этого в компенсационную установку в малую цепь включают вспомогательный элемент с известной и устойчивой ЭДС [элемент Вестона], находят новую точку компенсации и по приведённой выше формуле рассчитывают ЕСЕТИ.
![Нормальный элемент [элемент Вестона]. l (-) –электрод- амальгама Cd + Hg l (+) электрод Нормальный элемент [элемент Вестона]. l (-) –электрод- амальгама Cd + Hg l (+) электрод](https://present5.com/presentation/39285485_266819371/image-42.jpg)
Нормальный элемент [элемент Вестона]. l (-) –электрод- амальгама Cd + Hg l (+) электрод –паста Hg + Hg 2 SO 4 реакция: l Cd + Hg 2 SO 4 + 8/3 H 2 O 2 Hg + Cd. SO 4 8/3 H 2 O l l . При 20 С его ЭДС = 1, 01830 В.
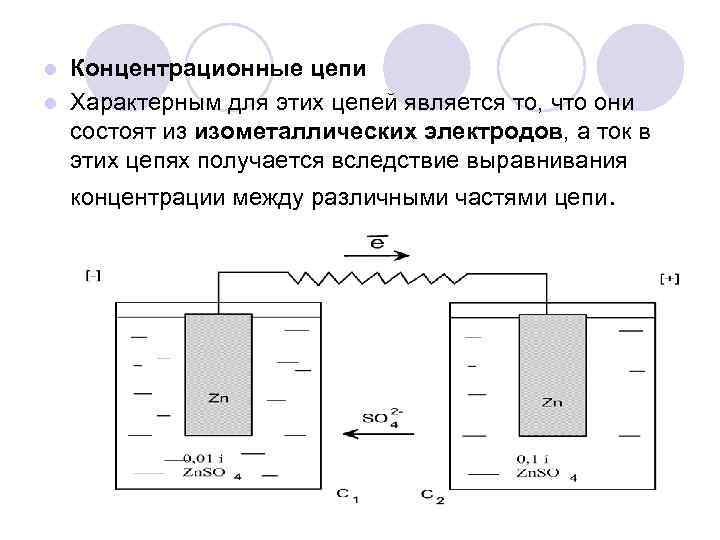
Концентрационные цепи l Характерным для этих цепей является то, что они состоят из изометаллических электродов, а ток в этих цепях получается вследствие выравнивания l концентрации между различными частями цепи.

l l l Поток электронов устремится слева направо. На правом электроде будет выделяться цинк, а левый будет растворяться Ион SО 4 2– будет в избытке в правом сосуде и будет переходить по агар‑агаровому сифону влево, в раствор с меньшей концентрацией. ЭДС концентрационной цепи можно рассчитать по формуле: , где С 2 — концентрация электродной жидкости [большая]; l С 1 — концентрация электродной жидкости [меньшая]; l

l l l l Применение электродов 1. Концентрацию К+ и Са 2+ в крови [в Англии, США и Японии] измеряют с помощью миниатюрных датчиков, которые вводят в вену. Между веществом покрытия и растворёнными в крови солями происходит химическое взаимодействие. . Потенциал фиксируется на индикаторе для диагностики. 2. Ферментные электроды - со слоем иммобилизованного фермента. - на определении продуктов ферментной реакции, или на выявлении изменения [уменьшения] количества субстрата, поступающего на электрод. 3. ионо-селективные электроды. Это электроды с чётко выраженной селективностью [избирательностью] к определённым ионам: а/ твёрдые ионоселективные электроды на основе ионообменных смол, стёкол, осадков. Например, стёкла с добавлением 3% Mg или бериллия имеют хорошую натриевую функцию, т. е. определяют ион Na+ в щелочных растворах; б/ жидкостные — на основе хелатов [например, биологически активные вещества]; в/ плёночные [матричные] — на основе активных веществ, полимерной матрицы и пластификатора.
Электропроводность растворов электролитов.ppt