 Электропроводность растворов. 1. Проводники 1 -го 2 -го рода. L – проводимость. L= ом-1 Х – удельная электрическая проводимость ; она характерезует свойства проводящей ток среды, не зависит от формы и размеров электродов. Х равна количеству электричества, перенесенному ионами через раствор S=1 см 2 на расстояние в 1 см в электрическом поле напряженностью в 1 в/см.
Электропроводность растворов. 1. Проводники 1 -го 2 -го рода. L – проводимость. L= ом-1 Х – удельная электрическая проводимость ; она характерезует свойства проводящей ток среды, не зависит от формы и размеров электродов. Х равна количеству электричества, перенесенному ионами через раствор S=1 см 2 на расстояние в 1 см в электрическом поле напряженностью в 1 в/см.
 -ג молярная (эквивалентная) проводимость электролита объмом в 1 см 3 на расстоянии 1 см между электродами =ג ом-1∙см 2∙моль-1 Пример: х0, 01 э HCl=0. 001413 ом-1, тогда = ג = = 141, 3 см 1∙см 2∙моль-1
-ג молярная (эквивалентная) проводимость электролита объмом в 1 см 3 на расстоянии 1 см между электродами =ג ом-1∙см 2∙моль-1 Пример: х0, 01 э HCl=0. 001413 ом-1, тогда = ג = = 141, 3 см 1∙см 2∙моль-1
 При с→ 0, т. е. при разбавлении, растворов электролитов ג увеличивается и принимает значение . ∞ג В сильных электролитах (Na. Cl, Na. OH) ∞ג не зависит от концентрации электоролита. Для слабых электролитов: @g= ∞ ג/ג
При с→ 0, т. е. при разбавлении, растворов электролитов ג увеличивается и принимает значение . ∞ג В сильных электролитах (Na. Cl, Na. OH) ∞ג не зависит от концентрации электоролита. Для слабых электролитов: @g= ∞ ג/ג
 Задача Х 0, 5 э H 3 C-C O при 250 С=0, 0009 ом-1∙см-1 OH 5, 43= ∞ ג ом-1∙см 2∙моль-1. Вычислить р. Нр-ра; степень диссоциации кислоты Решение: 5, 0 - ג э к-ты= = 1, 8 ом-1∙см 2∙моль-1. @g= 12500. 0 = ∞ג / ג p. H=-lg[H+]= -lg См∙ @g = -lg 0, 5∙ 0, 00521= =-lg 2, 62∙ 10 -3 = 2, 58 См=Сэ
Задача Х 0, 5 э H 3 C-C O при 250 С=0, 0009 ом-1∙см-1 OH 5, 43= ∞ ג ом-1∙см 2∙моль-1. Вычислить р. Нр-ра; степень диссоциации кислоты Решение: 5, 0 - ג э к-ты= = 1, 8 ом-1∙см 2∙моль-1. @g= 12500. 0 = ∞ג / ג p. H=-lg[H+]= -lg См∙ @g = -lg 0, 5∙ 0, 00521= =-lg 2, 62∙ 10 -3 = 2, 58 См=Сэ
 Закон Кольрауша: Рассчитать ∞ ג для H 2 SO 4; Решение: ∞ ג H 2 SO 4=2 ∞ ג H++ ∞ ג SO 4 Их значение находим в таблице. Ответ: 630, 0 = ∞ ג ом-1∙см 2∙моль-1. Электрическая проводимость биологических жидкостей
Закон Кольрауша: Рассчитать ∞ ג для H 2 SO 4; Решение: ∞ ג H 2 SO 4=2 ∞ ג H++ ∞ ג SO 4 Их значение находим в таблице. Ответ: 630, 0 = ∞ ג ом-1∙см 2∙моль-1. Электрическая проводимость биологических жидкостей
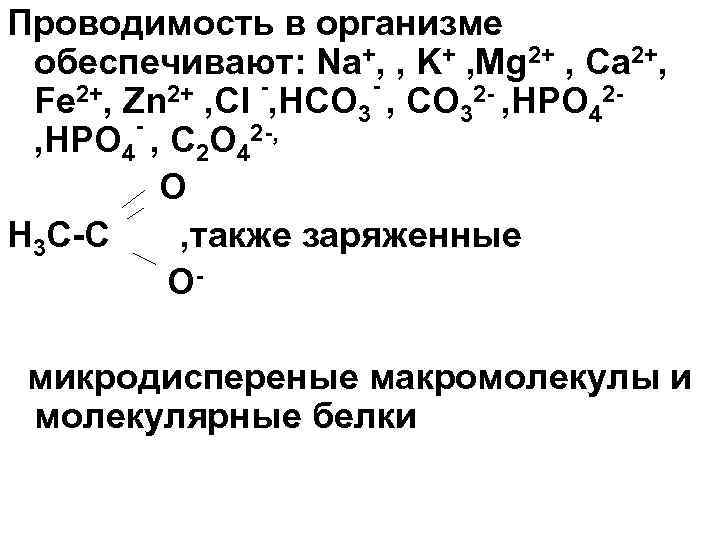 Проводимость в организме обеспечивают: Na+, , K+ , Mg 2+ , Ca 2+, Zn 2+ , Cl -, HCO - , CO 2 - , HPO 2 Fe 3 3 4 , HPO 4 , C 2 O 42 -, O H 3 C-C , также заряженные Омикродиспереные макромолекулы и молекулярные белки
Проводимость в организме обеспечивают: Na+, , K+ , Mg 2+ , Ca 2+, Zn 2+ , Cl -, HCO - , CO 2 - , HPO 2 Fe 3 3 4 , HPO 4 , C 2 O 42 -, O H 3 C-C , также заряженные Омикродиспереные макромолекулы и молекулярные белки
 Название Кровь Плазма крови Жел. Сок СМЖ Моча Мышечная ткань Нервная ткань Жировая ткань Кожа Кость Хом-1∙см-1 (370 С) 0, 54 1, 6/1, 47 1, 0/1, 25 1, 8 1, 6/2, 3 0, 86 0, 04 0, 02 0, 0003 5∙ 10 -7
Название Кровь Плазма крови Жел. Сок СМЖ Моча Мышечная ткань Нервная ткань Жировая ткань Кожа Кость Хом-1∙см-1 (370 С) 0, 54 1, 6/1, 47 1, 0/1, 25 1, 8 1, 6/2, 3 0, 86 0, 04 0, 02 0, 0003 5∙ 10 -7
 При заболевании почек Х мочи Уменьшается→ 1, 38→ 0, 06 При диабете→ 1, 44→ 0, 9 Электродный потенциал : - это работа движения 96500 кулонов электричества при растворении металла или неметалла в собственных ионах. Е= + ∙ ln [Ме. Z+]В.
При заболевании почек Х мочи Уменьшается→ 1, 38→ 0, 06 При диабете→ 1, 44→ 0, 9 Электродный потенциал : - это работа движения 96500 кулонов электричества при растворении металла или неметалла в собственных ионах. Е= + ∙ ln [Ме. Z+]В.
 Строение водородного электрода использование его в качестве. Электрода строения: =0, 0 в Элемент Якоби-Даниеля. Э. д. с. = Еа-Ек
Строение водородного электрода использование его в качестве. Электрода строения: =0, 0 в Элемент Якоби-Даниеля. Э. д. с. = Еа-Ек