el_stroenite_i_pz.pptx
- Количество слайдов: 40
 Электронное строение атома и периодический закон
Электронное строение атома и периодический закон
 Особенности состояния электронов в атоме Свойства элементов определяются количеством электронов и их пространственным расположением относительно ядра в атоме.
Особенности состояния электронов в атоме Свойства элементов определяются количеством электронов и их пространственным расположением относительно ядра в атоме.
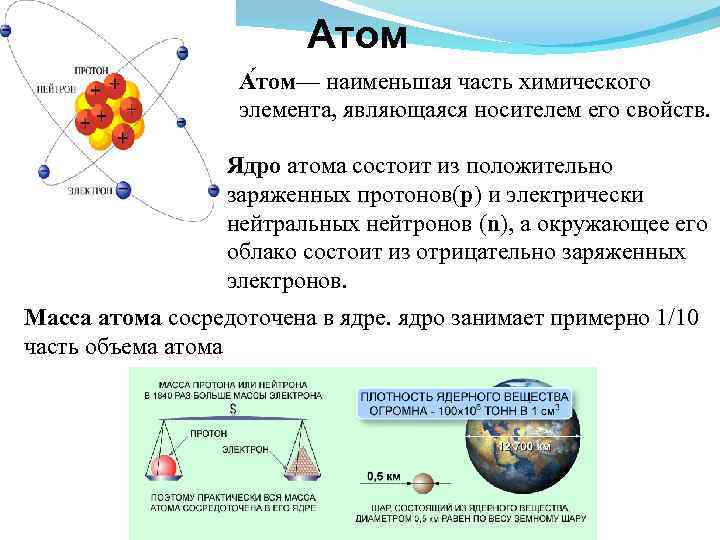 Атом А том— наименьшая часть химического элемента, являющаяся носителем его свойств. Ядро атома состоит из положительно заряженных протонов(p) и электрически нейтральных нейтронов (n), а окружающее его облако состоит из отрицательно заряженных электронов. Масса атома сосредоточена в ядре. ядро занимает примерно 1/10 часть объема атома
Атом А том— наименьшая часть химического элемента, являющаяся носителем его свойств. Ядро атома состоит из положительно заряженных протонов(p) и электрически нейтральных нейтронов (n), а окружающее его облако состоит из отрицательно заряженных электронов. Масса атома сосредоточена в ядре. ядро занимает примерно 1/10 часть объема атома
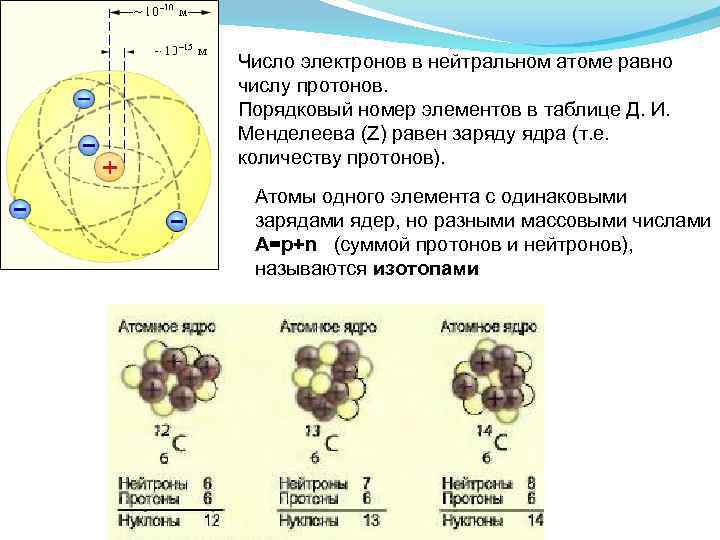 Число электронов в нейтральном атоме равно числу протонов. Порядковый номер элементов в таблице Д. И. Менделеева (Z) равен заряду ядра (т. е. количеству протонов). Атомы одного элемента с одинаковыми зарядами ядер, но разными массовыми числами A=p+n (суммой протонов и нейтронов), называются изотопами Изотопы аргона: Ar, Ar. Изотопы калия: K, K.
Число электронов в нейтральном атоме равно числу протонов. Порядковый номер элементов в таблице Д. И. Менделеева (Z) равен заряду ядра (т. е. количеству протонов). Атомы одного элемента с одинаковыми зарядами ядер, но разными массовыми числами A=p+n (суммой протонов и нейтронов), называются изотопами Изотопы аргона: Ar, Ar. Изотопы калия: K, K.
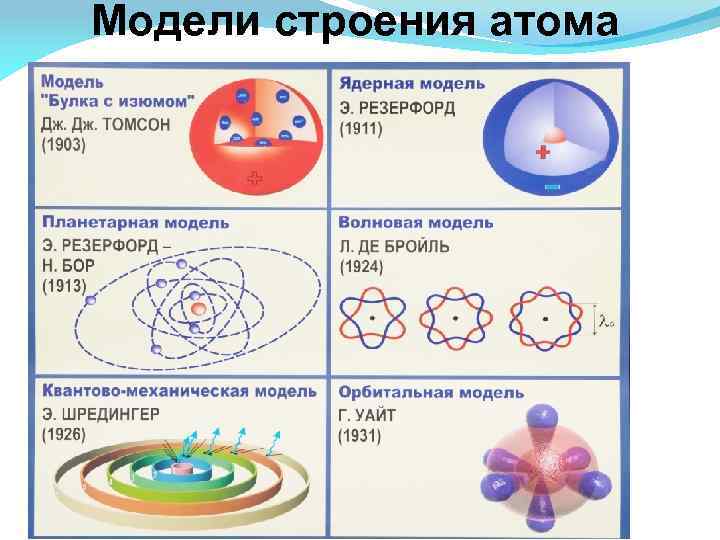 Модели строения атома
Модели строения атома
 Квантово-механическая модель атома Уравнение Шредингера Двойственная природа электрона: e
Квантово-механическая модель атома Уравнение Шредингера Двойственная природа электрона: e
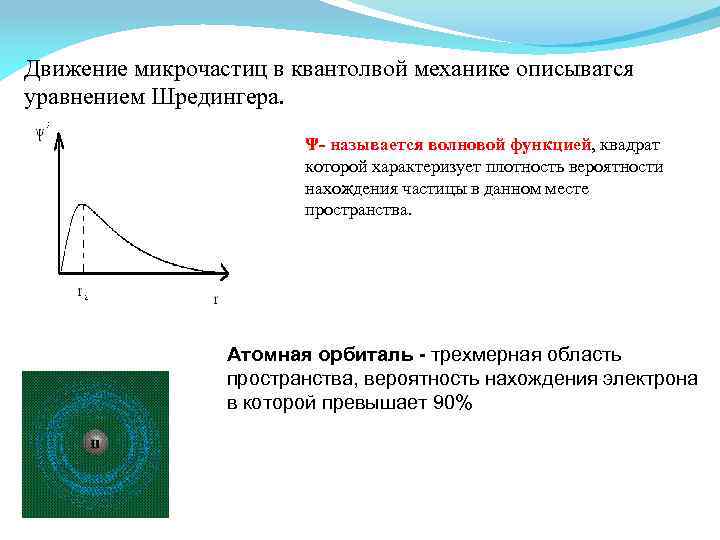 Движение микрочастиц в квантолвой механике описыватся уравнением Шредингера. Ψ- называется волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данном месте пространства. Атомная орбиталь - трехмерная область пространства, вероятность нахождения электрона в которой превышает 90%
Движение микрочастиц в квантолвой механике описыватся уравнением Шредингера. Ψ- называется волновой функцией, квадрат которой характеризует плотность вероятности нахождения частицы в данном месте пространства. Атомная орбиталь - трехмерная область пространства, вероятность нахождения электрона в которой превышает 90%
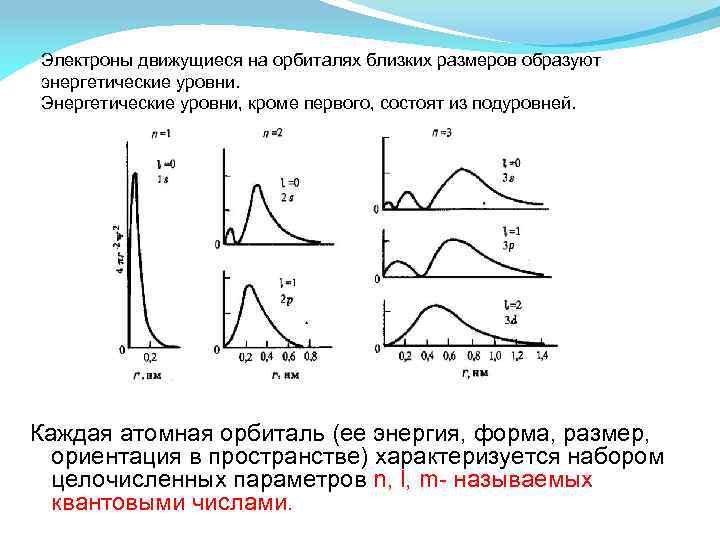 Электроны движущиеся на орбиталях близких размеров образуют энергетические уровни. Энергетические уровни, кроме первого, состоят из подуровней. Каждая атомная орбиталь (ее энергия, форма, размер, ориентация в пространстве) характеризуется набором целочисленных параметров n, l, m- называемых квантовыми числами.
Электроны движущиеся на орбиталях близких размеров образуют энергетические уровни. Энергетические уровни, кроме первого, состоят из подуровней. Каждая атомная орбиталь (ее энергия, форма, размер, ориентация в пространстве) характеризуется набором целочисленных параметров n, l, m- называемых квантовыми числами.
 Квантовые числа § Главное квантовое число n § Орбитальное квантовое число l § Магнитное квантовое число m Спиновое квантовое число s
Квантовые числа § Главное квантовое число n § Орбитальное квантовое число l § Магнитное квантовое число m Спиновое квантовое число s
 Главное квантовое число может принимать положительные целочисленные значения: n=1, 2, 3, . . 7. . , ∞ Главное квантовое число характеризует: * удаленность уровня от ядра *уровень энергии электрона в атоме *количество подуровней на данном уровне.
Главное квантовое число может принимать положительные целочисленные значения: n=1, 2, 3, . . 7. . , ∞ Главное квантовое число характеризует: * удаленность уровня от ядра *уровень энергии электрона в атоме *количество подуровней на данном уровне.
 Орбитальное квантовое число, принимает целочисленные значения l=0, 1…(n-1) Орбитальное квантовое число характеризует тип энергетического подуровня и форму атомной орбитали. 0 1 2 3 Тип S подуровня p d f l Форма атомной орбитали -
Орбитальное квантовое число, принимает целочисленные значения l=0, 1…(n-1) Орбитальное квантовое число характеризует тип энергетического подуровня и форму атомной орбитали. 0 1 2 3 Тип S подуровня p d f l Форма атомной орбитали -
 Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например, 1 Обозначение l подуровня 0 (одно значение) 1 s 2 3 0; 1 (два) 0; 1; 2 (три) n 2 s 2 р 3 s 3 р 3 d Т. о. , энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и l.
Число подуровней, на которые расщепляется энергетический уровень равно номеру уровня. Например, 1 Обозначение l подуровня 0 (одно значение) 1 s 2 3 0; 1 (два) 0; 1; 2 (три) n 2 s 2 р 3 s 3 р 3 d Т. о. , энергетический подуровень – это совокупность электронных состояний, характеризующихся определенным набором квантовых чисел n и l.
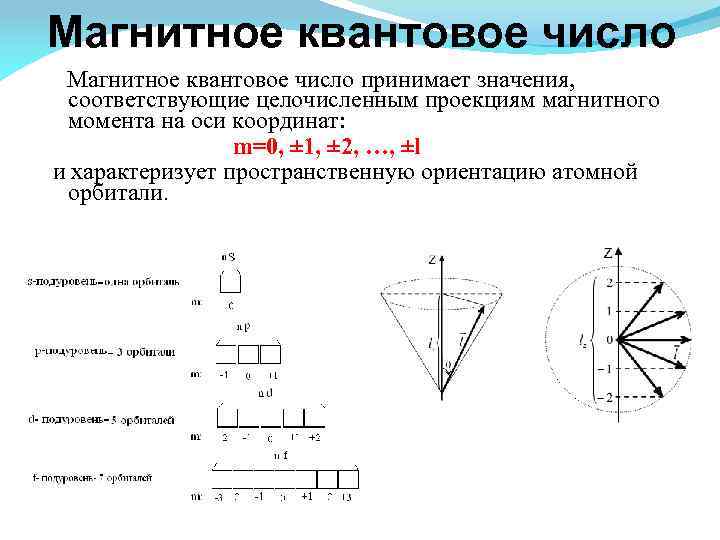 Магнитное квантовое число принимает значения, соответствующие целочисленным проекциям магнитного момента на оси координат: m=0, ± 1, ± 2, …, ±l и характеризует пространственную ориентацию атомной орбитали.
Магнитное квантовое число принимает значения, соответствующие целочисленным проекциям магнитного момента на оси координат: m=0, ± 1, ± 2, …, ±l и характеризует пространственную ориентацию атомной орбитали.
 Оно принимает все целочисленные значения от – l до + l. Например, при l =0 ml = 0; при l =1 ml = -1; 0 ; +1; при l =2 ml = -2; -1; 0 ; +1; +2; Любому значению l соответствует (2 l+1) возможных расположений электронного облака данного типа в пространстве. Все орбитали, принадлежащие одному подуровню данного энергетического уровня, имеют одинаковую энергию в отсутствии магнитного поля (вырожденные).
Оно принимает все целочисленные значения от – l до + l. Например, при l =0 ml = 0; при l =1 ml = -1; 0 ; +1; при l =2 ml = -2; -1; 0 ; +1; +2; Любому значению l соответствует (2 l+1) возможных расположений электронного облака данного типа в пространстве. Все орбитали, принадлежащие одному подуровню данного энергетического уровня, имеют одинаковую энергию в отсутствии магнитного поля (вырожденные).
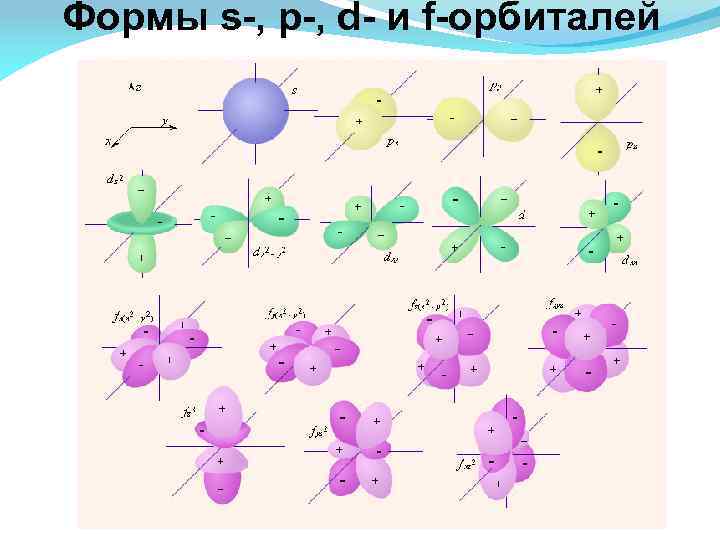 Формы s-, p-, d- и f-орбиталей
Формы s-, p-, d- и f-орбиталей
 Спиновое число - «СПИН» - определяется собственным моментом вращения электрона в двух противоположных направлениях. S= ± 1/2 обозначение Графическое обозначение Направление вращения +1/2 ↑ по часовой стрелке -1/2 ↓ против часовой стрелки
Спиновое число - «СПИН» - определяется собственным моментом вращения электрона в двух противоположных направлениях. S= ± 1/2 обозначение Графическое обозначение Направление вращения +1/2 ↑ по часовой стрелке -1/2 ↓ против часовой стрелки
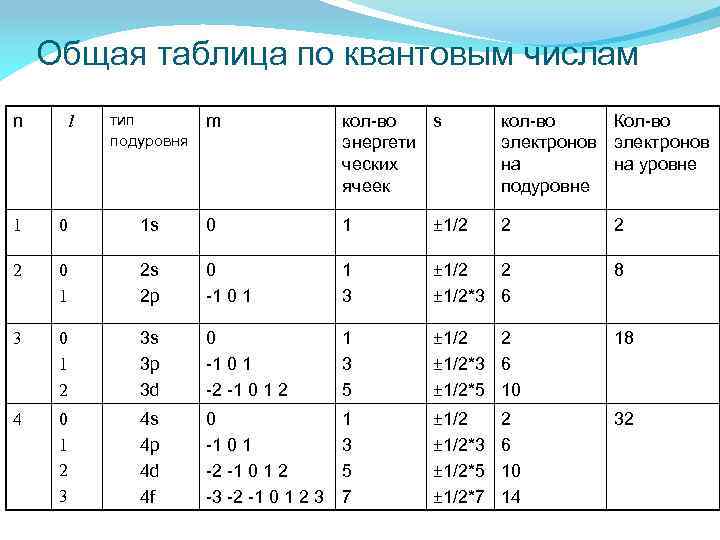 Общая таблица по квантовым числам n l тип m подуровня кол-во s энергети ческих ячеек кол-во Кол-во электронов на на уровне подуровне 1 0 1 s 0 1 ± 1/2 2 0 1 2 s 2 p 0 -1 0 1 1 3 ± 1/2 2 ± 1/2*3 6 8 3 0 1 2 3 s 3 p 3 d 0 -1 0 1 -2 -1 0 1 2 1 3 5 ± 1/2 2 ± 1/2*3 6 ± 1/2*5 10 18 4 0 1 2 3 4 s 4 p 4 d 4 f 0 -1 0 1 -2 -1 0 1 2 -3 -2 -1 0 1 2 3 1 3 5 7 ± 1/2*3 ± 1/2*5 ± 1/2*7 32 2 6 10 14
Общая таблица по квантовым числам n l тип m подуровня кол-во s энергети ческих ячеек кол-во Кол-во электронов на на уровне подуровне 1 0 1 s 0 1 ± 1/2 2 0 1 2 s 2 p 0 -1 0 1 1 3 ± 1/2 2 ± 1/2*3 6 8 3 0 1 2 3 s 3 p 3 d 0 -1 0 1 -2 -1 0 1 2 1 3 5 ± 1/2 2 ± 1/2*3 6 ± 1/2*5 10 18 4 0 1 2 3 4 s 4 p 4 d 4 f 0 -1 0 1 -2 -1 0 1 2 -3 -2 -1 0 1 2 3 1 3 5 7 ± 1/2*3 ± 1/2*5 ± 1/2*7 32 2 6 10 14
 Энергетический уровень Совокупность всех орбиталей с одинаковым значением главного квантового числа, т. е. орбиталей с близкими значениями энергий.
Энергетический уровень Совокупность всех орбиталей с одинаковым значением главного квантового числа, т. е. орбиталей с близкими значениями энергий.
 При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии правило Клечковского принцип Паули правило Хунда
При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии правило Клечковского принцип Паули правило Хунда
 Последовательность заполнения электронных подуровней 1. Принцип минимума энергии Наиболее устойчивое состояние электрона в атоме соответствует наименьшему возможному значению его энергии. В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке: n. S < (n-1)d ≤ (n-2)f ≤ (n-3)g < np 2. Правило Клечковского Заполнение электронных оболочек в атомах элемента происходит в порядке возрастания суммы (n+l). При равенстве этой суммы вначале заполняется подуровень с меньшим значением n.
Последовательность заполнения электронных подуровней 1. Принцип минимума энергии Наиболее устойчивое состояние электрона в атоме соответствует наименьшему возможному значению его энергии. В результате возрастание энергии по энергетическим подуровням происходит примерно в следующем порядке: n. S < (n-1)d ≤ (n-2)f ≤ (n-3)g < np 2. Правило Клечковского Заполнение электронных оболочек в атомах элемента происходит в порядке возрастания суммы (n+l). При равенстве этой суммы вначале заполняется подуровень с меньшим значением n.
 Применим правило Клечковского … 3 s 3 p 3 d 4 s 4 p… (3+0) (3+1) (3+2) 3 4 (4+0) (4+1) 5 4 5 Последовательность заполнения этих подуровней : … 3 s 3 p 4 s 3 d 4 p… Увеличение Е
Применим правило Клечковского … 3 s 3 p 3 d 4 s 4 p… (3+0) (3+1) (3+2) 3 4 (4+0) (4+1) 5 4 5 Последовательность заполнения этих подуровней : … 3 s 3 p 4 s 3 d 4 p… Увеличение Е
 1 s < 2 p < 3 s < 3 p < 3 d ≈4 s < 4 p < 4 d≈5 s < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p.
1 s < 2 p < 3 s < 3 p < 3 d ≈4 s < 4 p < 4 d≈5 s < 5 p < 6 s ≈ 4 f ≈ 5 d < 6 p < 7 s ≈ 5 f ≈ 6 d < 7 p.
 3. Запрет Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: х=2 п 2 4. Правило Хунда Минимальной энергией обладает конфигурация с максимальным суммарным спином.
3. Запрет Паули В атоме не может быть двух электронов с одинаковым набором всех четырех квантовых чисел. Из принципа Паули вытекает следствие: максимально возможное число электронов на каждом энергетическом уровне равно удвоенному значению квадрата главного квантового числа: х=2 п 2 4. Правило Хунда Минимальной энергией обладает конфигурация с максимальным суммарным спином.
 При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Например, 2 p 2 p 1 ж 1 ц 1 1 + з - ч+ = 2 и 2 ш 2 2 2 p 1 1 ж 1 ц 1 + + з- ч= 2 2 и 2 ш 2 2 p 1 ж 1 ц 1 1 + з - ч+ = 2 и 2 ш 2 2 2 p ж 1 ц 1 з - ч+ + з - ч = и 2 ш 2 1 1 1 3 + + = 2 2 max суммарный спин
При наличии однотипных орбиталей их заполнение происходит в соответствии с правилом Хунда: в пределах энергетического подуровня электроны располагаются так, чтобы их суммарный спин был максимальным. Например, 2 p 2 p 1 ж 1 ц 1 1 + з - ч+ = 2 и 2 ш 2 2 2 p 1 1 ж 1 ц 1 + + з- ч= 2 2 и 2 ш 2 2 p 1 ж 1 ц 1 1 + з - ч+ = 2 и 2 ш 2 2 2 p ж 1 ц 1 з - ч+ + з - ч = и 2 ш 2 1 1 1 3 + + = 2 2 max суммарный спин
 Составление электронных формул 1. полная электронная формула показывает распределение электронов атома по его уровням и подуровням. Независимо от последовательности формирования подуровня в электронной формуле он записывается на своем энергетическом уровне. 2. сокращенная электронная формула показывает распределение валентных электронов на формирующихся атомных орбиталях.
Составление электронных формул 1. полная электронная формула показывает распределение электронов атома по его уровням и подуровням. Независимо от последовательности формирования подуровня в электронной формуле он записывается на своем энергетическом уровне. 2. сокращенная электронная формула показывает распределение валентных электронов на формирующихся атомных орбиталях.
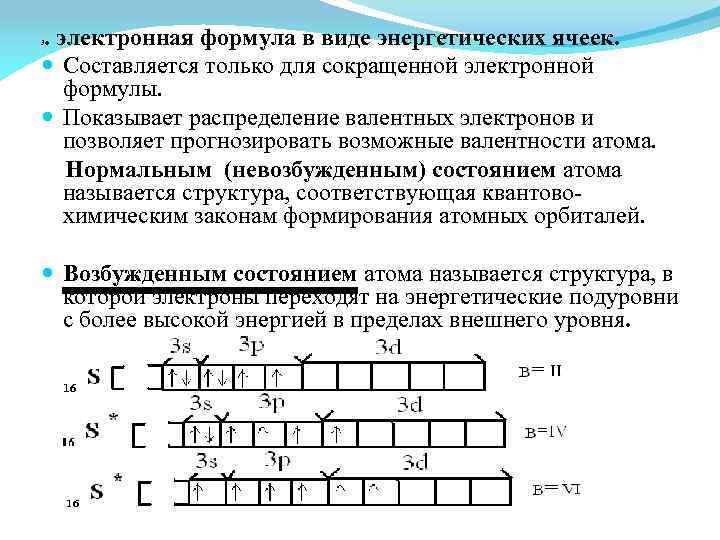 . электронная формула в виде энергетических ячеек. Составляется только для сокращенной электронной формулы. Показывает распределение валентных электронов и позволяет прогнозировать возможные валентности атома. Нормальным (невозбужденным) состоянием атома называется структура, соответствующая квантовохимическим законам формирования атомных орбиталей. 3 Возбужденным состоянием атома называется структура, в которой электроны переходят на энергетические подуровни с более высокой энергией в пределах внешнего уровня.
. электронная формула в виде энергетических ячеек. Составляется только для сокращенной электронной формулы. Показывает распределение валентных электронов и позволяет прогнозировать возможные валентности атома. Нормальным (невозбужденным) состоянием атома называется структура, соответствующая квантовохимическим законам формирования атомных орбиталей. 3 Возбужденным состоянием атома называется структура, в которой электроны переходят на энергетические подуровни с более высокой энергией в пределах внешнего уровня.
 Валентность - способность атома к образованию химических связей Валентность определяется числом неспаренных электронов на внешних орбиталях в атоме.
Валентность - способность атома к образованию химических связей Валентность определяется числом неспаренных электронов на внешних орбиталях в атоме.
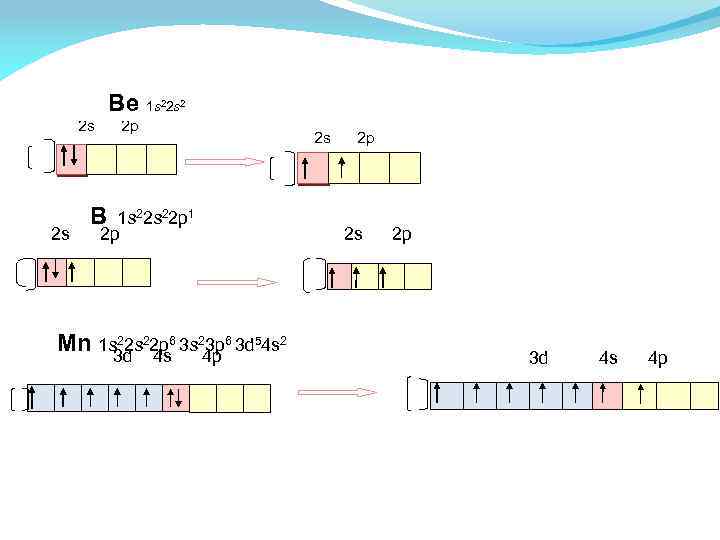 1 s 22 s 2 Ве 2 s 2 p В 1 s 22 p 1 2 s 2 p 22 s 22 p 6 3 s 23 p Mn 1 s 3 d 4 s 4 p 6 3 d 54 s 2 3 d 4 s 4 p
1 s 22 s 2 Ве 2 s 2 p В 1 s 22 p 1 2 s 2 p 22 s 22 p 6 3 s 23 p Mn 1 s 3 d 4 s 4 p 6 3 d 54 s 2 3 d 4 s 4 p
 Периодический закон Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядковый номер). Периодический закон был открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). Периодические изменения свойств химических элементов обусловлены повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
Периодический закон Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра (порядковый номер). Периодический закон был открыт Д. И. Менделеевым в марте 1869 года при сопоставлении свойств всех известных в то время элементов и величин их атомных масс (весов). Периодические изменения свойств химических элементов обусловлены повторением электронной конфигурации внешнего энергетического уровня (валентных электронов) их атомов с увеличением заряда ядра.
 Атомный радиус Орбитальный атомный радиус- это условная величина, которая равна расстоянию между ядром и самой дальней из стабильных орбиталей в в электронной оболочке этого атома. В периоде с увеличением порядкового номера атомный радиус уменьшается за счёт более сильного взаимодействия между ядром и внешними электронами. В группе с увеличением порядкового номера атомный радиус растет, так как увеличивается число уровней.
Атомный радиус Орбитальный атомный радиус- это условная величина, которая равна расстоянию между ядром и самой дальней из стабильных орбиталей в в электронной оболочке этого атома. В периоде с увеличением порядкового номера атомный радиус уменьшается за счёт более сильного взаимодействия между ядром и внешними электронами. В группе с увеличением порядкового номера атомный радиус растет, так как увеличивается число уровней.
 увеличение уменьшение при этом в главных подгруппах такое увеличение происходит в большей степени, чем в побочных подгруппах.
увеличение уменьшение при этом в главных подгруппах такое увеличение происходит в большей степени, чем в побочных подгруппах.
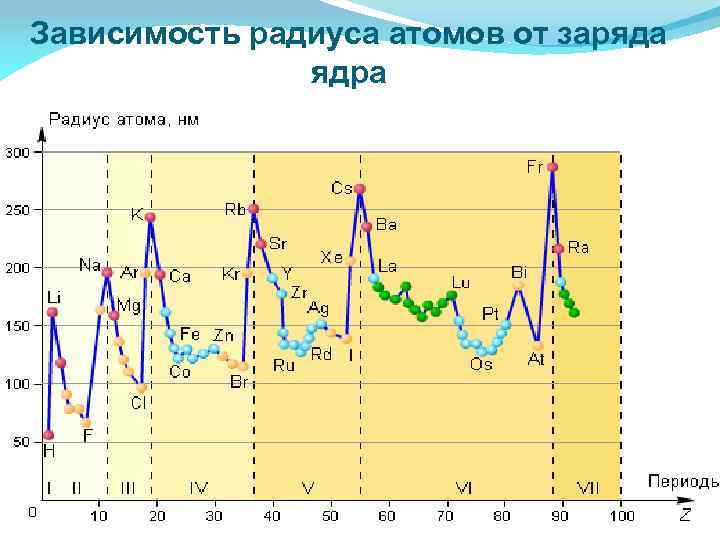 Зависимость радиуса атомов от заряда ядра
Зависимость радиуса атомов от заряда ядра
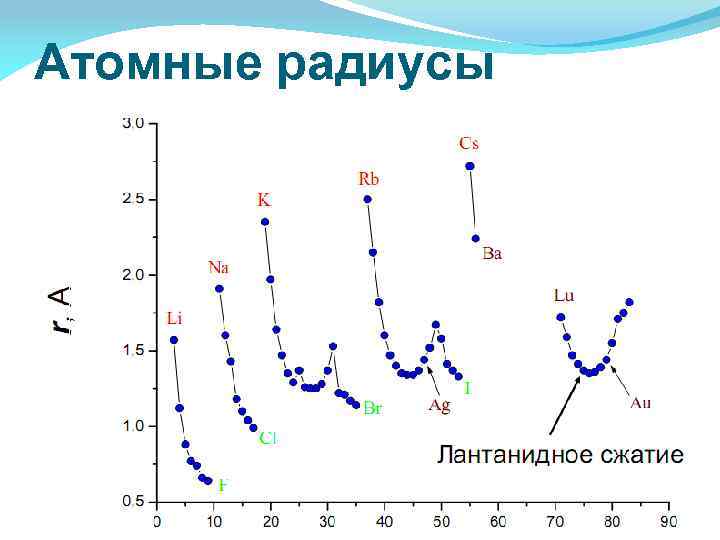 Атомные радиусы
Атомные радиусы
 Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве электрона от атома образуется соответствующий катион. Энергия, которая выделяется присоединении к атому одного электрона, называется энергией сродства к электрону Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
Энергия ионизации — это энергия, необходимая для отрыва наиболее слабо связанного электрона от атома. При отрыве электрона от атома образуется соответствующий катион. Энергия, которая выделяется присоединении к атому одного электрона, называется энергией сродства к электрону Энергия ионизации для элементов одного периода возрастает слева направо с возрастанием заряда ядра. В подгруппе она уменьшается сверху вниз вследствие увеличения расстояния электрона от ядра.
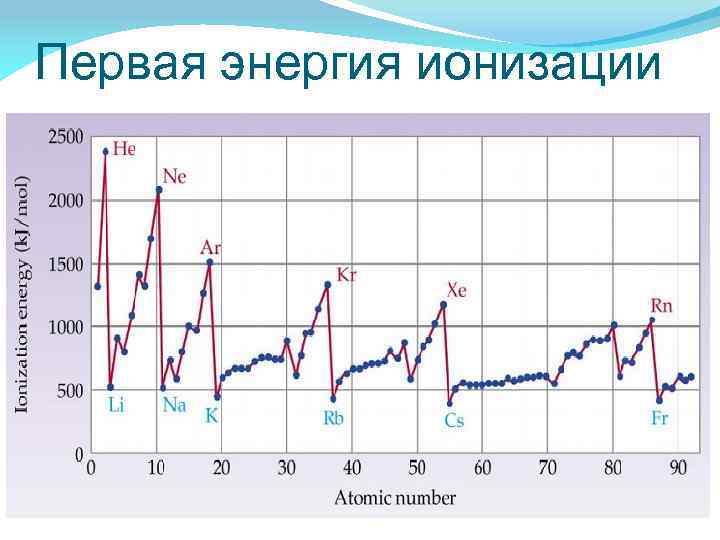 Первая энергия ионизации
Первая энергия ионизации
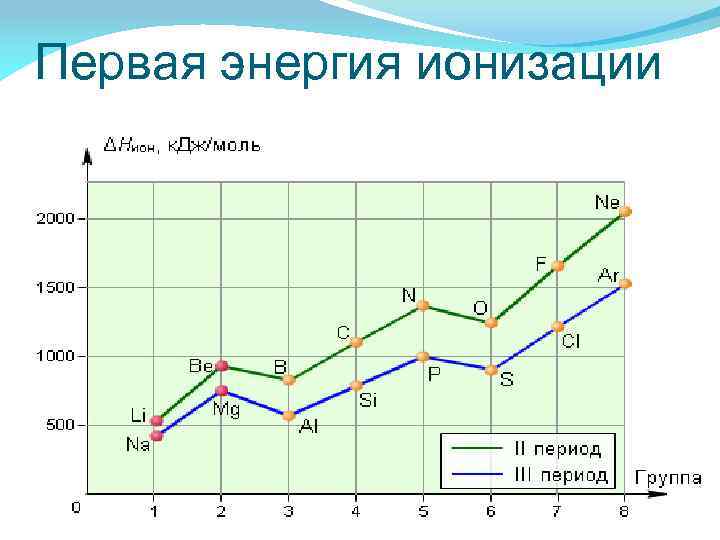 Первая энергия ионизации
Первая энергия ионизации
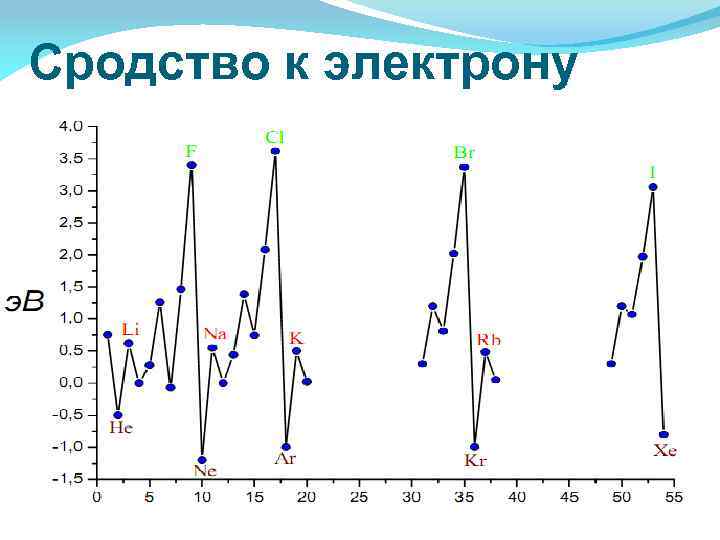 Сродство к электрону
Сродство к электрону
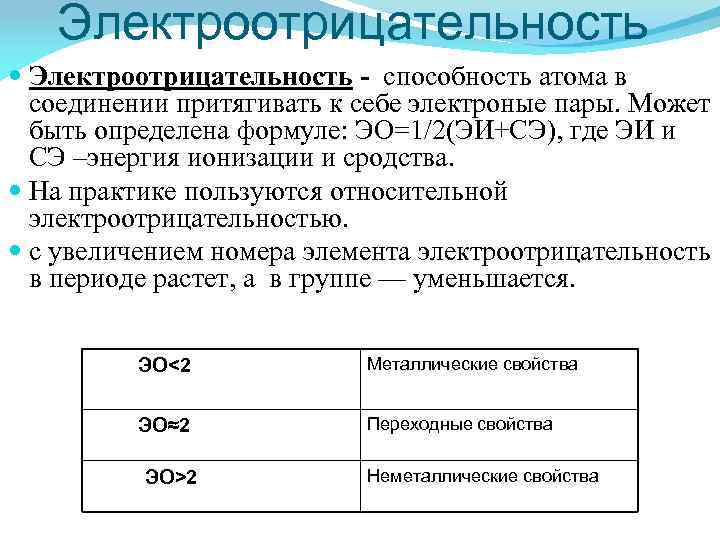 Электроотрицательность - способность атома в соединении притягивать к себе электроные пары. Может быть определена формуле: ЭО=1/2(ЭИ+СЭ), где ЭИ и СЭ –энергия ионизации и сродства. На практике пользуются относительной электроотрицательностью. с увеличением номера элемента электроотрицательность в периоде растет, а в группе — уменьшается. ЭО<2 Металлические свойства ЭО≈2 Переходные свойства ЭО>2 Неметаллические свойства
Электроотрицательность - способность атома в соединении притягивать к себе электроные пары. Может быть определена формуле: ЭО=1/2(ЭИ+СЭ), где ЭИ и СЭ –энергия ионизации и сродства. На практике пользуются относительной электроотрицательностью. с увеличением номера элемента электроотрицательность в периоде растет, а в группе — уменьшается. ЭО<2 Металлические свойства ЭО≈2 Переходные свойства ЭО>2 Неметаллические свойства
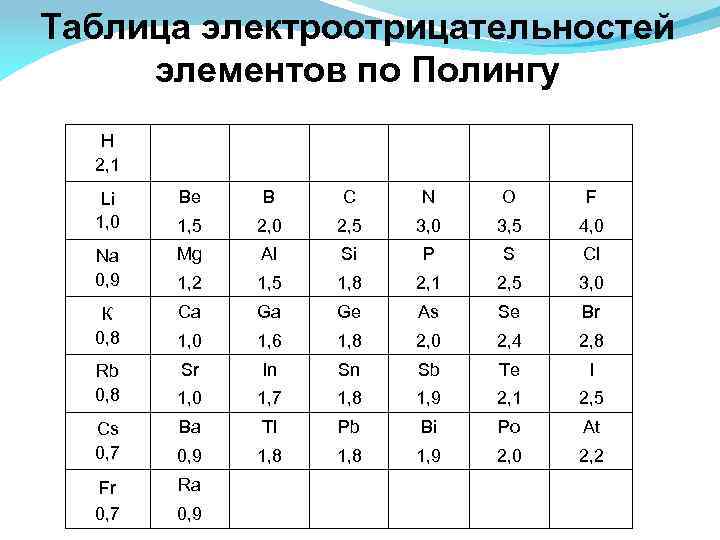 Таблица электроотрицательностей элементов по Полингу H 2, 1 Li 1, 0 Na 0, 9 К 0, 8 Rb 0, 8 Cs 0, 7 Fr 0, 7 Be В С N О F 1, 5 2, 0 2, 5 3, 0 3, 5 4, 0 Mg Al Si P S Cl 1, 2 1, 5 1, 8 2, 1 2, 5 3, 0 Ca Ga Ge As Se Br 1, 0 1, 6 1, 8 2, 0 2, 4 2, 8 Sr In Sn Sb Те I 1, 0 1, 7 1, 8 1, 9 2, 1 2, 5 Ba Tl Pb Bi Po At 0, 9 1, 8 1, 9 2, 0 2, 2 Ra 0, 9
Таблица электроотрицательностей элементов по Полингу H 2, 1 Li 1, 0 Na 0, 9 К 0, 8 Rb 0, 8 Cs 0, 7 Fr 0, 7 Be В С N О F 1, 5 2, 0 2, 5 3, 0 3, 5 4, 0 Mg Al Si P S Cl 1, 2 1, 5 1, 8 2, 1 2, 5 3, 0 Ca Ga Ge As Se Br 1, 0 1, 6 1, 8 2, 0 2, 4 2, 8 Sr In Sn Sb Те I 1, 0 1, 7 1, 8 1, 9 2, 1 2, 5 Ba Tl Pb Bi Po At 0, 9 1, 8 1, 9 2, 0 2, 2 Ra 0, 9
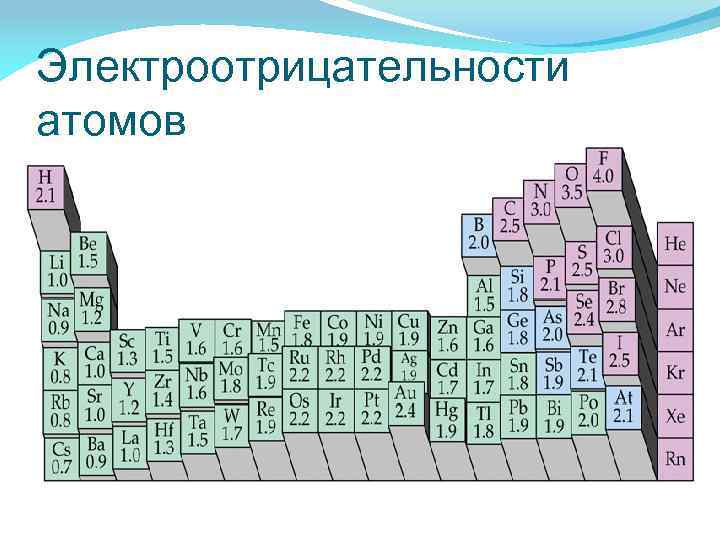 Электроотрицательности атомов
Электроотрицательности атомов


