136_Ypl.ppt
- Количество слайдов: 21
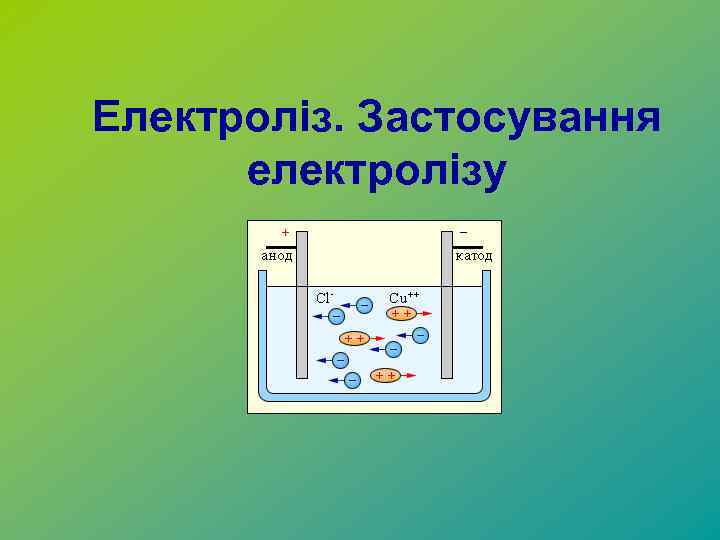 Електроліз. Застосування електролізу
Електроліз. Застосування електролізу
 Історія відкриття • Початок вивчення співвідношень і зв’язків між хімічними і електричними явищами, дослідження дії струму на різні речовини в розчинах здійснили англійські вчені В. Нікольсон і А. Карлейль. • У 1800 р. вони здійснили електроліз води. В. Нікольсон (1753 – 1815)
Історія відкриття • Початок вивчення співвідношень і зв’язків між хімічними і електричними явищами, дослідження дії струму на різні речовини в розчинах здійснили англійські вчені В. Нікольсон і А. Карлейль. • У 1800 р. вони здійснили електроліз води. В. Нікольсон (1753 – 1815)
 • 1803 – 1807 р. р. – Я. Берцеліус, В. Гізінгер вивчали явища електролізу розчинів різних солей і сірчаної кислоти. Я. Берцеліус (1770 – 1848)
• 1803 – 1807 р. р. – Я. Берцеліус, В. Гізінгер вивчали явища електролізу розчинів різних солей і сірчаної кислоти. Я. Берцеліус (1770 – 1848)
 • Англійський фізик Г. Деві довів, що електричний струм спричиняє розклад кислот і солей, у 1807 р. одержав за допомогою електоролізу металічні калій та натрій, за що отримав премію Вольта. Г. Деві (1778 – 1829)
• Англійський фізик Г. Деві довів, що електричний струм спричиняє розклад кислот і солей, у 1807 р. одержав за допомогою електоролізу металічні калій та натрій, за що отримав премію Вольта. Г. Деві (1778 – 1829)
 • Висновок, зроблений в результаті експериментів 1800 – 1807 р. р. : • Кожна складна речовина незалежно від її складу може бути розділена на дві частини, одна з яких електропозитивна, а друга – електронегативна.
• Висновок, зроблений в результаті експериментів 1800 – 1807 р. р. : • Кожна складна речовина незалежно від її складу може бути розділена на дві частини, одна з яких електропозитивна, а друга – електронегативна.
 • М. Фарадей з 1813 р. працював асистентом у лабораторії Г. Деві, з 1825 р. директором цієї лабораторії. • Основні закони електролізу встановив у 1833 – 1834 р. р. М. Фарадей (1791 – 1867)
• М. Фарадей з 1813 р. працював асистентом у лабораторії Г. Деві, з 1825 р. директором цієї лабораторії. • Основні закони електролізу встановив у 1833 – 1834 р. р. М. Фарадей (1791 – 1867)
 Лабораторія М. Фарадея
Лабораторія М. Фарадея
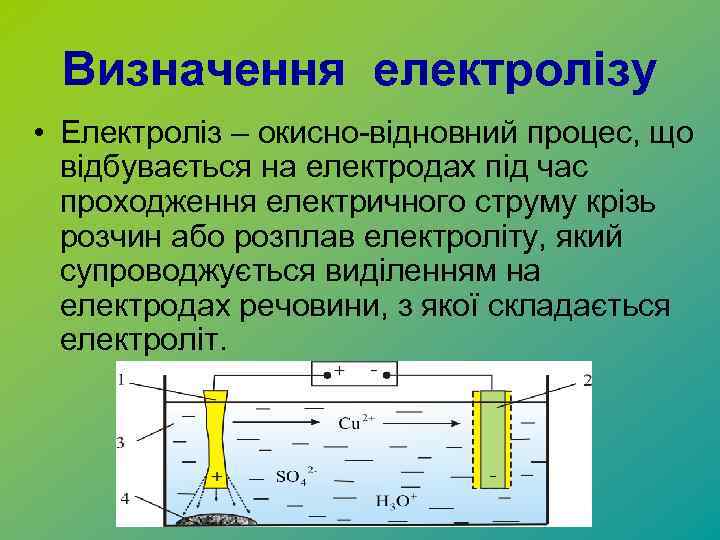 Визначення електролізу • Електроліз – окисно-відновний процес, що відбувається на електродах під час проходження електричного струму крізь розчин або розплав електроліту, який супроводжується виділенням на електродах речовини, з якої складається електроліт.
Визначення електролізу • Електроліз – окисно-відновний процес, що відбувається на електродах під час проходження електричного струму крізь розчин або розплав електроліту, який супроводжується виділенням на електродах речовини, з якої складається електроліт.
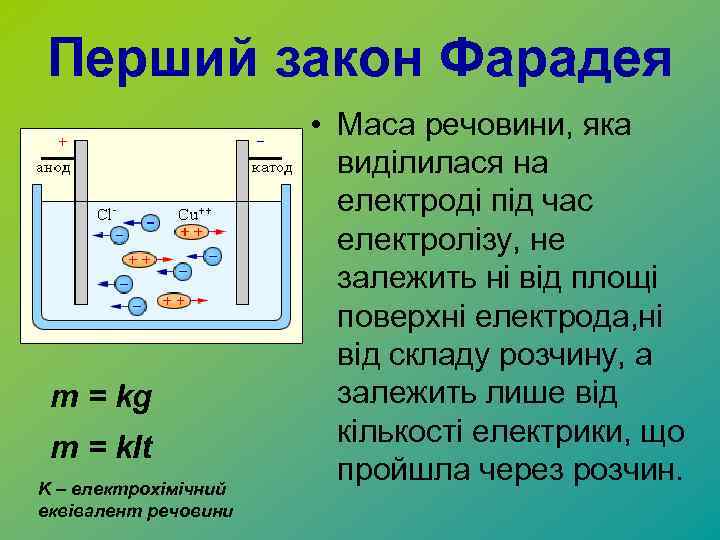 Перший закон Фарадея m = kg m = k. It K – електрохімічний еквівалент речовини • Маса речовини, яка виділилася на електроді під час електролізу, не залежить ні від площі поверхні електрода, ні від складу розчину, а залежить лише від кількості електрики, що пройшла через розчин.
Перший закон Фарадея m = kg m = k. It K – електрохімічний еквівалент речовини • Маса речовини, яка виділилася на електроді під час електролізу, не залежить ні від площі поверхні електрода, ні від складу розчину, а залежить лише від кількості електрики, що пройшла через розчин.
 Другий закон Фарадея • При проходженні через різні електроліти тієї самої кількості електрики маса речовини, яка виділилася на електроді, пропорційна хімічному еквіваленту А цієї речовини, тобто електрохімічний еквівалент речовини пропорційний її хімічному еквіваленту. F – стала Фарадея; М – молярна маса речовини; Z – заряд йона цієї речовини.
Другий закон Фарадея • При проходженні через різні електроліти тієї самої кількості електрики маса речовини, яка виділилася на електроді, пропорційна хімічному еквіваленту А цієї речовини, тобто електрохімічний еквівалент речовини пропорційний її хімічному еквіваленту. F – стала Фарадея; М – молярна маса речовини; Z – заряд йона цієї речовини.
 Застосування електролізу • Добування активних металів (Na, K, Ca, Mg, Al); • Добування хлору та фтору; • Добування лугів • (KOH, Na. OH)
Застосування електролізу • Добування активних металів (Na, K, Ca, Mg, Al); • Добування хлору та фтору; • Добування лугів • (KOH, Na. OH)
 Застосування електролізу • Рафінування – спосіб очищення металів за допомогою електролізу
Застосування електролізу • Рафінування – спосіб очищення металів за допомогою електролізу
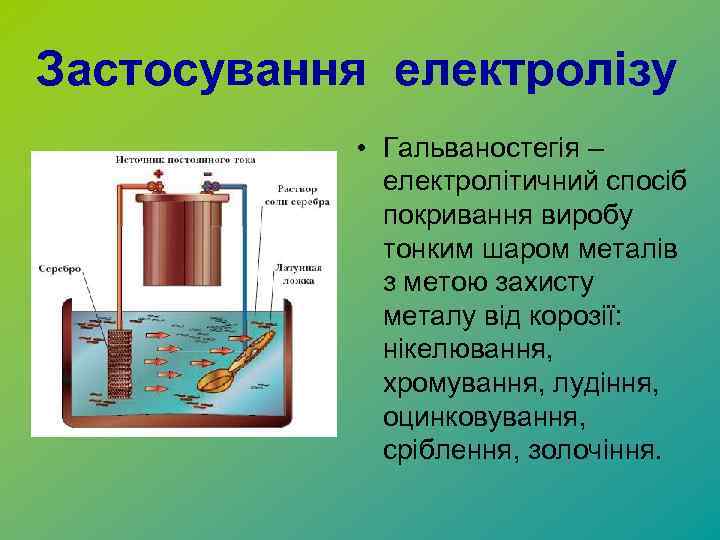 Застосування електролізу • Гальваностегія – електролітичний спосіб покривання виробу тонким шаром металів з метою захисту металу від корозії: нікелювання, хромування, лудіння, оцинковування, сріблення, золочіння.
Застосування електролізу • Гальваностегія – електролітичний спосіб покривання виробу тонким шаром металів з метою захисту металу від корозії: нікелювання, хромування, лудіння, оцинковування, сріблення, золочіння.
 Гальваностегія
Гальваностегія
 Застосування електролізу Б. С. Якобі (1801 – 1874) • У 1836 – 1837 р. р. Б. Якобі відкрив гальванопластику і багато зробив для впровадження її в друкарську й монетну справу та для виготовлення художніх виробів.
Застосування електролізу Б. С. Якобі (1801 – 1874) • У 1836 – 1837 р. р. Б. Якобі відкрив гальванопластику і багато зробив для впровадження її в друкарську й монетну справу та для виготовлення художніх виробів.
 Застосування електролізу • Гальванопластика – одержання за допомогою електролізу точних копій рельєфних виробів. • Цим способом виготовляють друкарські кліше, безшовні труби, металеві деталі складної форми, монети.
Застосування електролізу • Гальванопластика – одержання за допомогою електролізу точних копій рельєфних виробів. • Цим способом виготовляють друкарські кліше, безшовні труби, металеві деталі складної форми, монети.
 Гальванопластика Колісниця Аполона на фронтоні Большого театру м. Москва
Гальванопластика Колісниця Аполона на фронтоні Большого театру м. Москва
 Гальванопластика
Гальванопластика
 Ісаакіївський собор. м. Санкт-Петербург
Ісаакіївський собор. м. Санкт-Петербург
 Гальванопластика
Гальванопластика
 Гальванопластика
Гальванопластика


