12-Lec-Electrolys.ppt
- Количество слайдов: 25
 Электролиз Э. – превращение электрической энергии в химическую. Химические реакции идут под действием электрического тока.
Электролиз Э. – превращение электрической энергии в химическую. Химические реакции идут под действием электрического тока.
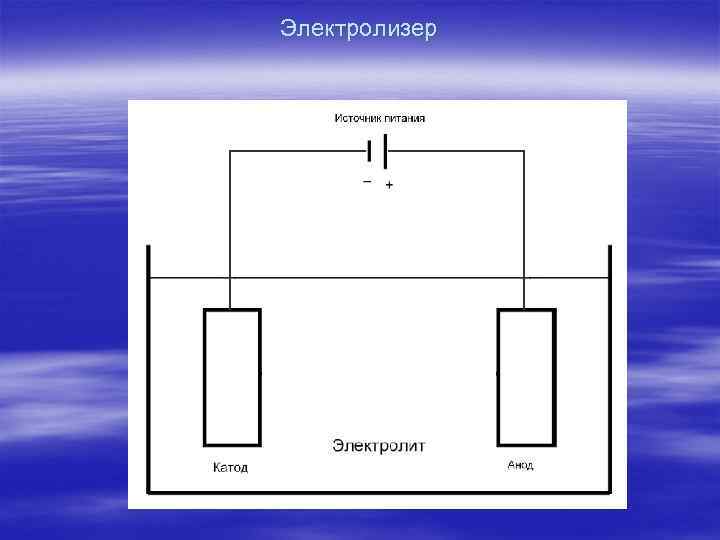 Электролизер
Электролизер
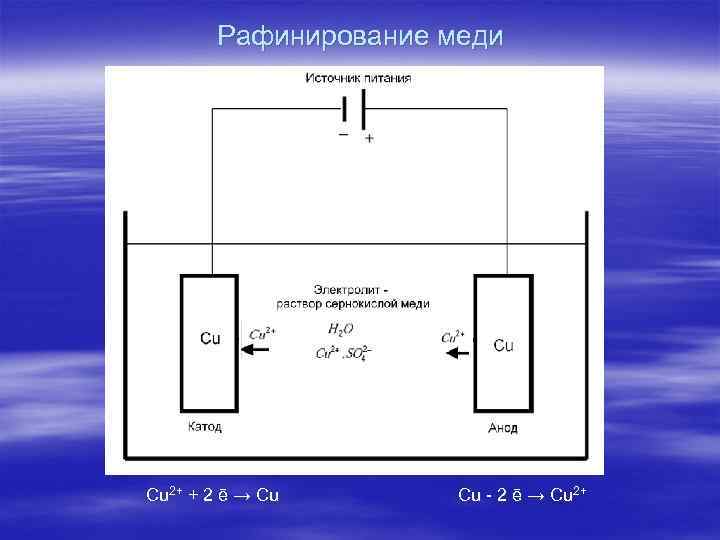 Рафинирование меди Cu 2+ + 2 ē → Cu Cu - 2 ē → Cu 2+
Рафинирование меди Cu 2+ + 2 ē → Cu Cu - 2 ē → Cu 2+
 Электролиз расплавов Au. Cl 3 (расплав) ↓ Au 3+ ← Au 3+ K: Au 3+ + 3 ē → Au ↓ Cl. Cl- → A: 2 Cl- - 2 ē → Cl 2
Электролиз расплавов Au. Cl 3 (расплав) ↓ Au 3+ ← Au 3+ K: Au 3+ + 3 ē → Au ↓ Cl. Cl- → A: 2 Cl- - 2 ē → Cl 2
 Электролиз водных растворов Присутствует несколько веществ – вода + растворенные вещества. Может идти несколько реакций.
Электролиз водных растворов Присутствует несколько веществ – вода + растворенные вещества. Может идти несколько реакций.

 Последовательность разряда веществ на электродах при электролизе водных растворов I. Катодные реакции – восстановление 3 группы веществ ( по величине Eo. Ox/Red) 1. Сильные окислители – катионы и молекулы с Eo > 0 В Реакции: Men+ + n ē → Me (для ионов металлов) или A 2 + 2 ē → 2 A- (для молекул-окислителей) Примеры: Au 3+ + 3 ē Au, Eo = 1. 69 В Ag+ + ē Ag, Eo = 0. 80 В Сl 2 + 2 ē 2 Сl–, Eo = 1. 36 В
Последовательность разряда веществ на электродах при электролизе водных растворов I. Катодные реакции – восстановление 3 группы веществ ( по величине Eo. Ox/Red) 1. Сильные окислители – катионы и молекулы с Eo > 0 В Реакции: Men+ + n ē → Me (для ионов металлов) или A 2 + 2 ē → 2 A- (для молекул-окислителей) Примеры: Au 3+ + 3 ē Au, Eo = 1. 69 В Ag+ + ē Ag, Eo = 0. 80 В Сl 2 + 2 ē 2 Сl–, Eo = 1. 36 В
 2. Слабые окислители – катионы с Eo < -1. 6 В Катионы не восстанавливаются. Восстанавливаются Н+ или Н 2 О. В кислой среде (p. H < 7) : 2 H + + 2 ē H 2↑ В нейтральной и щелочной среде (p. H ≥ 7) 2 H 2 О + 2 ē H 2 ↑ + 2 ОН-
2. Слабые окислители – катионы с Eo < -1. 6 В Катионы не восстанавливаются. Восстанавливаются Н+ или Н 2 О. В кислой среде (p. H < 7) : 2 H + + 2 ē H 2↑ В нейтральной и щелочной среде (p. H ≥ 7) 2 H 2 О + 2 ē H 2 ↑ + 2 ОН-
 3. Катионы металлов с -1. 6 < Eo < 0 В Одновременно идут две реакции – восстанавливаются катионы Men+ и Н+ или Н 2 О. В кислой среде (p. H < 7) : Men+ + n ē → Me 2 H + + 2 ē H 2 ↑ В нейтральной и щелочной среде (p. H ≥ 7) Men+ + n ē → Me 2 H 2 О + 2 ē H 2 ↑ + 2 ОН-
3. Катионы металлов с -1. 6 < Eo < 0 В Одновременно идут две реакции – восстанавливаются катионы Men+ и Н+ или Н 2 О. В кислой среде (p. H < 7) : Men+ + n ē → Me 2 H + + 2 ē H 2 ↑ В нейтральной и щелочной среде (p. H ≥ 7) Men+ + n ē → Me 2 H 2 О + 2 ē H 2 ↑ + 2 ОН-
 Примеры: Восстановление ионов Fe 3+ в кислой среде : Fe 3+ + 3 ē → Fe 2 H + + 2 ē H 2 Восстановление ионов Zn 2+ в щелочной среде : Zn 2+ + 2 ē → Zn 2 H 2 О + 2 ē H 2 + 2 ОН-
Примеры: Восстановление ионов Fe 3+ в кислой среде : Fe 3+ + 3 ē → Fe 2 H + + 2 ē H 2 Восстановление ионов Zn 2+ в щелочной среде : Zn 2+ + 2 ē → Zn 2 H 2 О + 2 ē H 2 + 2 ОН-

 II. Анодные реакции - окисление 2 группы веществ ( по величине Eo. Ox/Red) 1. Металлы с Eo < 0. 8 В (до Ag). Me - n ē → Men+ Название - электролиз с растворимым анодом. Примеры: Cu - 2 ē Cu 2+ Cr - 3 ē Cr 3+
II. Анодные реакции - окисление 2 группы веществ ( по величине Eo. Ox/Red) 1. Металлы с Eo < 0. 8 В (до Ag). Me - n ē → Men+ Название - электролиз с растворимым анодом. Примеры: Cu - 2 ē Cu 2+ Cr - 3 ē Cr 3+
 (примечание) Для металлов с несколькими степенями окисления Окисление протекает по реакции с меньшей величиной Е 0 Cu - 2 ē Cu 2+ Fe - 2 ē Fe 2+
(примечание) Для металлов с несколькими степенями окисления Окисление протекает по реакции с меньшей величиной Е 0 Cu - 2 ē Cu 2+ Fe - 2 ē Fe 2+
 2. Металлы с Eo > 0. 8 В (с Ag) и графит (C) - инертные материалы. Электрод не окисляется. Название - электролиз с нерастворимым анодом Окисляются вещества раствора.
2. Металлы с Eo > 0. 8 В (с Ag) и графит (C) - инертные материалы. Электрод не окисляется. Название - электролиз с нерастворимым анодом Окисляются вещества раствора.
 Порядок окисления веществ при электролизе с нерастворимым анодом 1. Простые анионы с Е 0 < 1. 5 В – S 2 -, I–, Вr–, Сl–. ( m An- - n ē Am) Примечание F– - не окисляется 2. Растворы, содержащие анионы кислородсодержащих кислот (NO 3 -, SO 42 -, CO 32 -, …. ) а) в кислых и нейтральных средах 2 H 2 O – 4 ē O 2↑ + 4 H + б) в щелочных средах 2 OH- – 4 ē O 2↑ + 2 H 2 O
Порядок окисления веществ при электролизе с нерастворимым анодом 1. Простые анионы с Е 0 < 1. 5 В – S 2 -, I–, Вr–, Сl–. ( m An- - n ē Am) Примечание F– - не окисляется 2. Растворы, содержащие анионы кислородсодержащих кислот (NO 3 -, SO 42 -, CO 32 -, …. ) а) в кислых и нейтральных средах 2 H 2 O – 4 ē O 2↑ + 4 H + б) в щелочных средах 2 OH- – 4 ē O 2↑ + 2 H 2 O
 Примеры: 1) Анодная реакция на графитовом электроде (C) в растворе KCl: 2 Cl- - 2 ē Cl 2 2) Анодная реакция на золотом электроде (Au) в растворе H 2 SO 4: 2 H 2 O – 4 ē O 2↑ + 4 H + 2) Анодная реакция на платиновом электроде (Pt) в растворе Na. OH: 4 OH- – 4 ē O 2↑ + 2 H 2 O
Примеры: 1) Анодная реакция на графитовом электроде (C) в растворе KCl: 2 Cl- - 2 ē Cl 2 2) Анодная реакция на золотом электроде (Au) в растворе H 2 SO 4: 2 H 2 O – 4 ē O 2↑ + 4 H + 2) Анодная реакция на платиновом электроде (Pt) в растворе Na. OH: 4 OH- – 4 ē O 2↑ + 2 H 2 O
 Вторичные химические реакции (ВХР) При электролизе с растворимым анодом для металлов, образующих труднорастворимые или окси- соединения с компонентами раствора: I. Анодное окисление: Me – nē Men+ II. ВХР: а) В растворе с анионами малорастворимых веществ: Men+ + m A- Me. Am↓ б) Металлы, образующие оксианионы: Men+ + 2 m OH- Me. Omz- + m H 2 O
Вторичные химические реакции (ВХР) При электролизе с растворимым анодом для металлов, образующих труднорастворимые или окси- соединения с компонентами раствора: I. Анодное окисление: Me – nē Men+ II. ВХР: а) В растворе с анионами малорастворимых веществ: Men+ + m A- Me. Am↓ б) Металлы, образующие оксианионы: Men+ + 2 m OH- Me. Omz- + m H 2 O
 Примеры анодных реакций с ВХР А) Cu в растворе с S 2 -: A: Cu – 2 ē → Cu 2+ ВХР: Cu 2+ + S 2 - → Cu. S↓ B) Ni в щелочном растворе: A: Ni – 2 ē → Ni 2+ ВХР: Ni 2+ + 2 OH- → Ni(OH)2↓ В сильнощелочном растворе реакция идет дальше: ВХР 2: Ni(OH)2↓ → Ni. O↓ + H 2 O C) Zn в сильнощелочном растворе: A: Zn – 2 ē → Zn 2+ ВХР: Zn 2+ + 4 OH- → Zn. O 22 - + 2 H 2 O
Примеры анодных реакций с ВХР А) Cu в растворе с S 2 -: A: Cu – 2 ē → Cu 2+ ВХР: Cu 2+ + S 2 - → Cu. S↓ B) Ni в щелочном растворе: A: Ni – 2 ē → Ni 2+ ВХР: Ni 2+ + 2 OH- → Ni(OH)2↓ В сильнощелочном растворе реакция идет дальше: ВХР 2: Ni(OH)2↓ → Ni. O↓ + H 2 O C) Zn в сильнощелочном растворе: A: Zn – 2 ē → Zn 2+ ВХР: Zn 2+ + 4 OH- → Zn. O 22 - + 2 H 2 O
 Пассивация электродов § Пассивация электродов – торможение анодного растворения металлов в результате образования труднорастворимых солевых, гидроксидных или оксидных пленок. Причина - вторичные химические реакции. Реакции пассивации на аноде: Fe + S 2 - – 2 ē → Fe. S↓ Cu + 2 OH- – 2 ē → Cu(OH)2↓ Pb + 2 OH- – 2 ē → Pb. O↓ + H 2 O
Пассивация электродов § Пассивация электродов – торможение анодного растворения металлов в результате образования труднорастворимых солевых, гидроксидных или оксидных пленок. Причина - вторичные химические реакции. Реакции пассивации на аноде: Fe + S 2 - – 2 ē → Fe. S↓ Cu + 2 OH- – 2 ē → Cu(OH)2↓ Pb + 2 OH- – 2 ē → Pb. O↓ + H 2 O
 Закон Фарадея m = f(M, Q) или Q = f(M, m) 1) m ~ Q 2) m ~ M/n (Q = const) Объединенный закон: или Q = I∙t →
Закон Фарадея m = f(M, Q) или Q = f(M, m) 1) m ~ Q 2) m ~ M/n (Q = const) Объединенный закон: или Q = I∙t →
 Выход по току Для металлов с -1. 6 < E 0 < 0 В 2 катодных реакции: 1) Men+ + n ē → Me 2) 2 H+ + 2 ē H 2↑ или 2 H 2 О + 2 ē H 2 ↑ + 2 ОНВыход по току (ВТ) – доля электричества или тока, расходуемая на основной процесс. Закон Фарадея: или
Выход по току Для металлов с -1. 6 < E 0 < 0 В 2 катодных реакции: 1) Men+ + n ē → Me 2) 2 H+ + 2 ē H 2↑ или 2 H 2 О + 2 ē H 2 ↑ + 2 ОНВыход по току (ВТ) – доля электричества или тока, расходуемая на основной процесс. Закон Фарадея: или
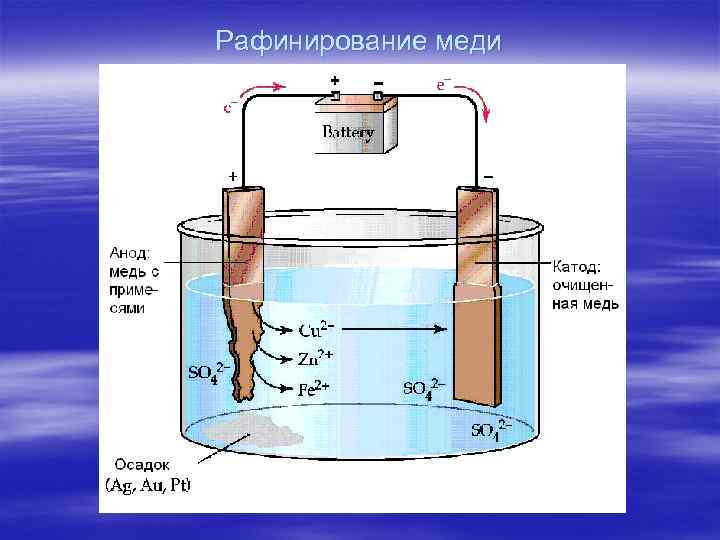 Рафинирование меди
Рафинирование меди
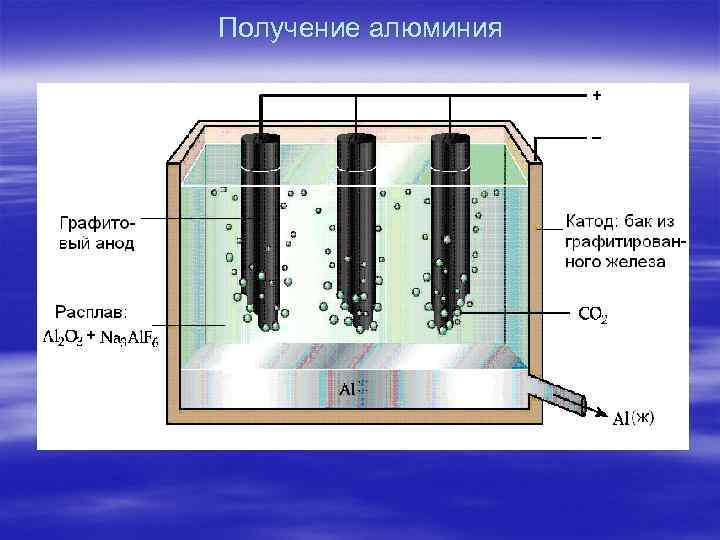 Получение алюминия
Получение алюминия
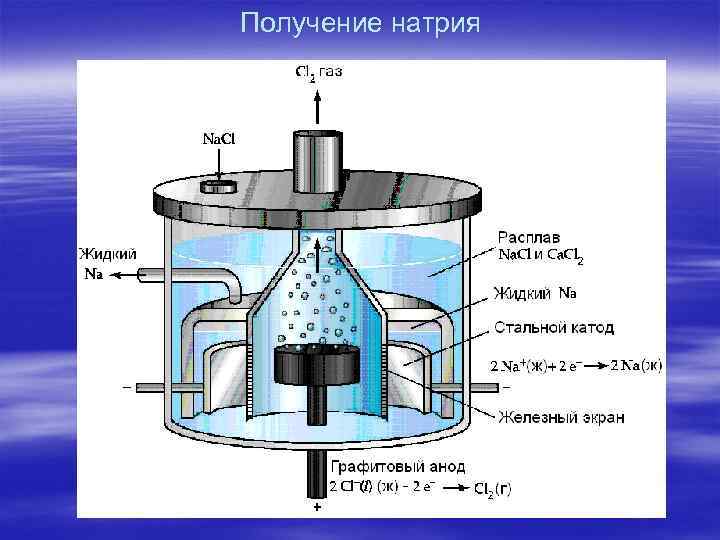 Получение натрия
Получение натрия
 Декоративные покрытия
Декоративные покрытия


