Электролитическая диссоциация.pptx
- Количество слайдов: 19
 Электролитическая диссоциация
Электролитическая диссоциация
 Определение Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.
Определение Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.
 Электролитическая диссоциация 1. 2. 3. 4. 5. 6. Электролиты и неэлектролиты Электролитическая диссоциация Механизм электролитической диссоциации Сильные и слабые электролиты Диссоциация кислот, оснований, солей Значение электролитов
Электролитическая диссоциация 1. 2. 3. 4. 5. 6. Электролиты и неэлектролиты Электролитическая диссоциация Механизм электролитической диссоциации Сильные и слабые электролиты Диссоциация кислот, оснований, солей Значение электролитов
 Электролитическая диссоциация химических элементов Основные положения теории: 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома – это простые ионы или из нескольких атомов – сложные ионы
Электролитическая диссоциация химических элементов Основные положения теории: 1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы – положительные и отрицательные. Ионы находятся в более устойчивых электронных состояниях, чем атомы. Они могут состоять из одного атома – это простые ионы или из нескольких атомов – сложные ионы
 Основные положения теории: 2. При действии электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются катионами, а вторые – анионами. Направленное движение ионов происходит в результате притяжения их к противоположено заряженным электродам
Основные положения теории: 2. При действии электрического тока ионы приобретают направленное движение: положительно заряженные ионы движутся к катоду, отрицательно заряженные – к аноду. Поэтому первые называются катионами, а вторые – анионами. Направленное движение ионов происходит в результате притяжения их к противоположено заряженным электродам
 Основные положения теории: 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
Основные положения теории: 3. Диссоциация – обратимый процесс: параллельно с распадом молекул на ионы (диссоциацией) протекает процесс соединения ионов (ассоциация). Поэтому в уравнениях электролитической диссоциации вместо знака равенства ставят знак обратимости.
 Электролиты Электролиты- это вещества, растворы и расплавы которых проводят электический ток. Кислоты HCl; HNO 3; H 2 SO 4 Щелочи Na. OH; KOH; Ba(OH)2 Соли Na. Cl; Cu. SO 4; Al(NO 3)3
Электролиты Электролиты- это вещества, растворы и расплавы которых проводят электический ток. Кислоты HCl; HNO 3; H 2 SO 4 Щелочи Na. OH; KOH; Ba(OH)2 Соли Na. Cl; Cu. SO 4; Al(NO 3)3
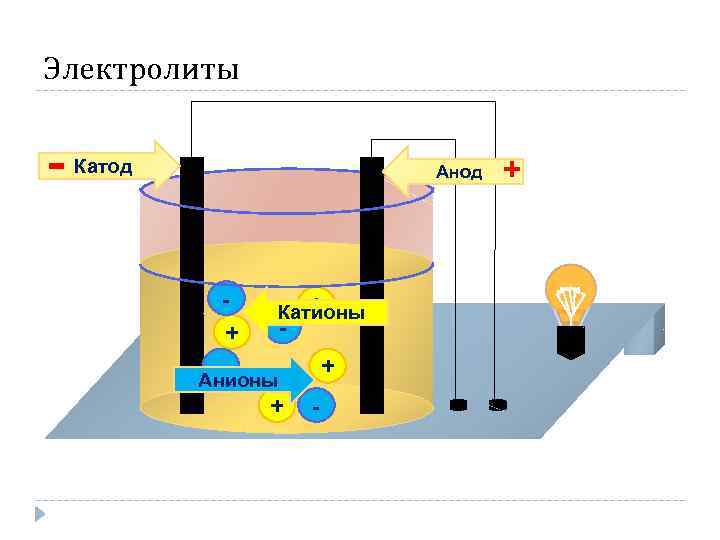 Электролиты - Катод Анод + - + Катионы - + Анионы + - +
Электролиты - Катод Анод + - + Катионы - + Анионы + - +
 Неэлектролиты- это вещества, растворы или расплавы которых не проводят электрический ток. Органический вещества: сахар, ацетон, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот и др.
Неэлектролиты- это вещества, растворы или расплавы которых не проводят электрический ток. Органический вещества: сахар, ацетон, керосин, глицерин, этиловый спирт, бензол и др. Газы: кислород, водород, азот и др.
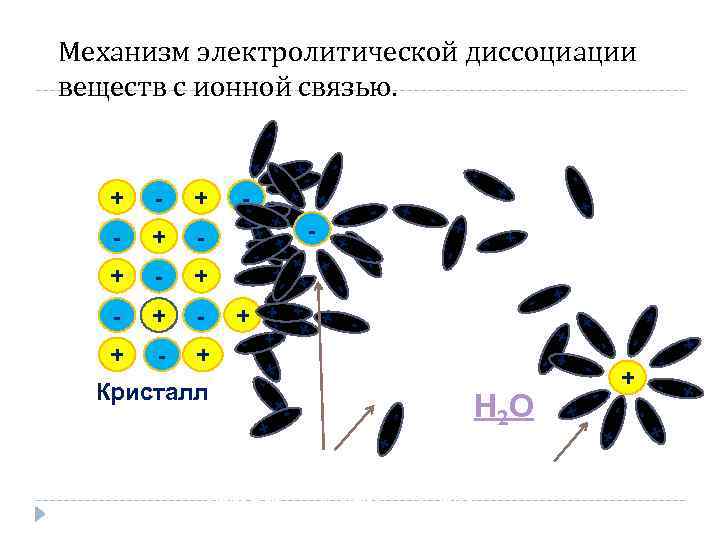 - + + - - - +- - + + + - - - + - Na. Cl → Na+ + Cl - + + + Н 2 О + - + - - + Кристалл - - + + + - - + + - - - + + -- + - - - + + + - Механизм электролитической диссоциации веществ с ионной связью.
- + + - - - +- - + + + - - - + - Na. Cl → Na+ + Cl - + + + Н 2 О + - + - - + Кристалл - - + + + - - + + - - - + + -- + - - - + + + - Механизм электролитической диссоциации веществ с ионной связью.
 Степень электролитической диссоциации (α) отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. n α= N Сильные электролиты α > 30% Слабые электролиты α< 30%
Степень электролитической диссоциации (α) отношение числа диссоциированных молекул к общему числу молекул, находящихся в растворе. n α= N Сильные электролиты α > 30% Слабые электролиты α< 30%
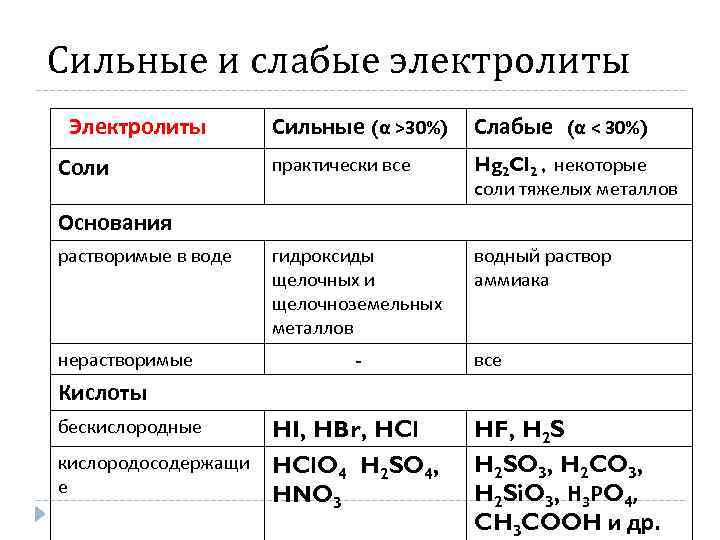 Сильные и слабые электролиты Электролиты Соли Сильные (α >30%) Слабые (α < 30%) практически все Hg 2 Cl 2 , некоторые cоли тяжелых металлов гидроксиды щелочных и щелочноземельных металлов водный раствор аммиака Основания растворимые в воде нерастворимые - все Кислоты бескислородные HI, HBr, HCl кислородосодержащи HCl. O H SO , 4 2 4 е HNO 3 HF, H 2 SO 3, H 2 CO 3, H 2 Si. O 3, Н 3 РO 4, CH 3 COOH и др.
Сильные и слабые электролиты Электролиты Соли Сильные (α >30%) Слабые (α < 30%) практически все Hg 2 Cl 2 , некоторые cоли тяжелых металлов гидроксиды щелочных и щелочноземельных металлов водный раствор аммиака Основания растворимые в воде нерастворимые - все Кислоты бескислородные HI, HBr, HCl кислородосодержащи HCl. O H SO , 4 2 4 е HNO 3 HF, H 2 SO 3, H 2 CO 3, H 2 Si. O 3, Н 3 РO 4, CH 3 COOH и др.
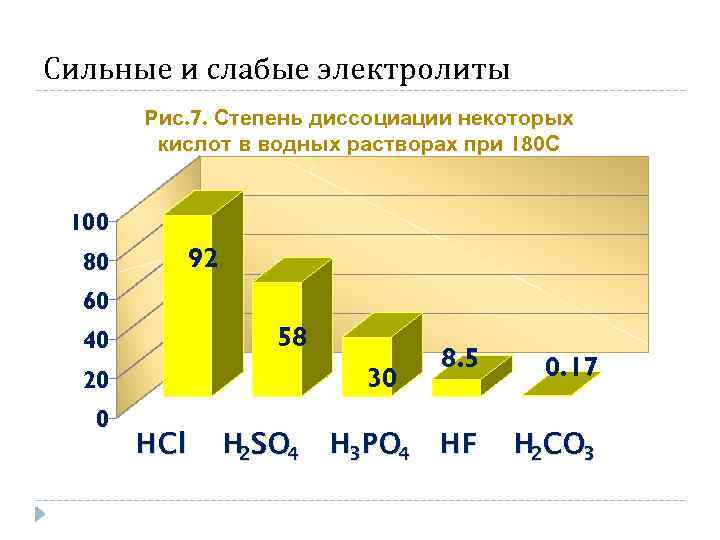 Сильные и слабые электролиты Рис. 7. Степень диссоциации некоторых кислот в водных растворах при 180 С 100 92 80 60 58 40 30 20 0 HCl H 2 SO 4 H 3 PO 4 8. 5 0. 17 HF H 2 CO 3
Сильные и слабые электролиты Рис. 7. Степень диссоциации некоторых кислот в водных растворах при 180 С 100 92 80 60 58 40 30 20 0 HCl H 2 SO 4 H 3 PO 4 8. 5 0. 17 HF H 2 CO 3
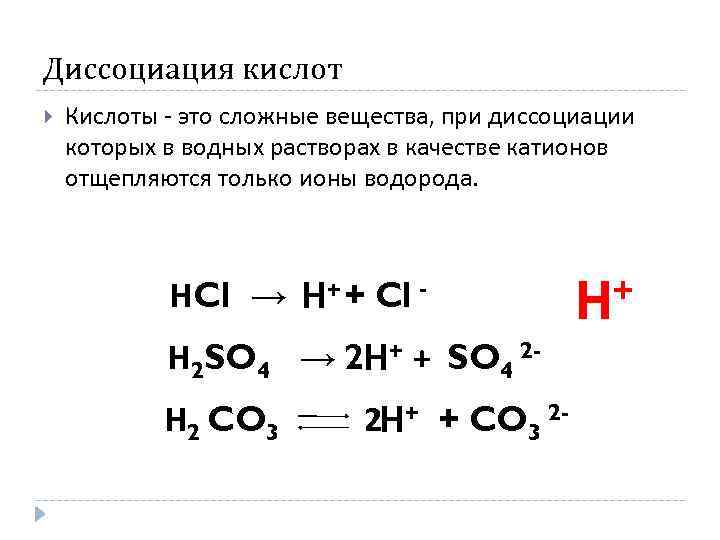 Диссоциация кислот Кислоты - это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы водорода. НCl → Н+ + Cl Н 2 SO 4 → 2 Н+ + SO 4 2 Н 2 CO 3 2 Н+ + CO 3 2 - + Н
Диссоциация кислот Кислоты - это сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются только ионы водорода. НCl → Н+ + Cl Н 2 SO 4 → 2 Н+ + SO 4 2 Н 2 CO 3 2 Н+ + CO 3 2 - + Н
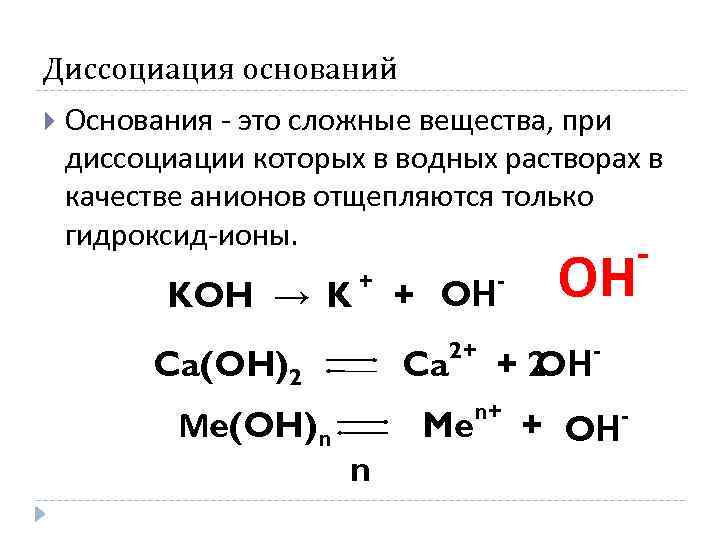 Диссоциация оснований Основания - это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы. KOH → K + Ca(OH)2 Мe(OH)n + OН Ca 2+ Me n - ОН +2 OН n+ - + OН - -
Диссоциация оснований Основания - это сложные вещества, при диссоциации которых в водных растворах в качестве анионов отщепляются только гидроксид-ионы. KOH → K + Ca(OH)2 Мe(OH)n + OН Ca 2+ Me n - ОН +2 OН n+ - + OН - -
 Диссоциация солей Соли- это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. Na. Cl → Na+ + K 2 SO 4 → 2 K+ + Me Сl. SO 4 2 - Al(NO 3)3 →Al 3+ + 3 3 NO n+ (кислотный остаток) в-
Диссоциация солей Соли- это сложные вещества, которые в водных растворах диссоциируют на катионы металла и анионы кислотного остатка. Na. Cl → Na+ + K 2 SO 4 → 2 K+ + Me Сl. SO 4 2 - Al(NO 3)3 →Al 3+ + 3 3 NO n+ (кислотный остаток) в-
 Электролитическая диссоциация Ø Электролиты – составная часть жидкостей и плотных тканей живых организмов. + + 2+ 2+ + -2 Ионы Na , K , Ca , Mg , H ; OH ; Cl ; SO 4 ; имеют большое значение для физиологических и биохимических процессов: + Ø ионы H ; OH играют большую роль в работе ферментов, обмене веществ, переваривании пищи и др. Ø при нарушении водно-солевого обмена в медицине применяется физиологический раствор – 0, 85% раствор Na. Cl; Ø ионы I влияют на работу щитовидной железы.
Электролитическая диссоциация Ø Электролиты – составная часть жидкостей и плотных тканей живых организмов. + + 2+ 2+ + -2 Ионы Na , K , Ca , Mg , H ; OH ; Cl ; SO 4 ; имеют большое значение для физиологических и биохимических процессов: + Ø ионы H ; OH играют большую роль в работе ферментов, обмене веществ, переваривании пищи и др. Ø при нарушении водно-солевого обмена в медицине применяется физиологический раствор – 0, 85% раствор Na. Cl; Ø ионы I влияют на работу щитовидной железы.
 Закон разбавления Оствальда K=a 2 C 1 -a здесь C-молярная концентрация электролита, моль/л. Если степень диссоциации значительно меньше единицы, то приближенных вычислениях можно принять, что 1 a≈1. Тогда выражение закона разбавления упрощается K=a 2 C, откуда a=√K/C
Закон разбавления Оствальда K=a 2 C 1 -a здесь C-молярная концентрация электролита, моль/л. Если степень диссоциации значительно меньше единицы, то приближенных вычислениях можно принять, что 1 a≈1. Тогда выражение закона разбавления упрощается K=a 2 C, откуда a=√K/C



