Elektrolit_eritindilerdi_1187__1179_asietteri.pptx
- Количество слайдов: 21

Электролит ерітінділердің қасиеттері

ЭЛЕКТРОЛИТ ЕРІТІНДІЛЕРІ Электролит ерітінділер –деп, қозғалыстағы иондардың көмегімен электрлік ток өткізетін ерітінділерді айтады. Сол сияқты электрохимия құрамына электролиз процестері мен оларға кері жүретін гальваникалық элементтердегі процестер де енеді. Мұндағы бірінші және екінші процестерде электролиттер ерітінділері (балқыма) мен көбіне металл пластинкасынан (жолақша) жасалған электродтар-дан тұрады. Әдетте, ерітінділердің немесе ерітінді мен электрод-тардық шекаралары белгілі бір себептермен электрлік зарядталған болып келеді. Сондықтан да электрохимияға австралия ғалымы Дж. Бокрис берген “электрохимия зарядталған беттер мен электролиттердің қасиеттерін зерттейді” деген ғылыми анықтаманы еске түсірген артық болмас.

Электролит ертінділері Электролит ерітінділері. Еріген кезде еріткішпен әрекеттесіп, иондарға диссоциацияланып, ерітіндіге ток өткізгіштік кабілет беретін заттарды электролиттер дейді.

Вант-Гофф және Рауль заңдары идеал ерітінділер үшін орындалады. Электр тогын өткізетін ерітінділердің осмостық қысымы Вант-Гофф заңына қарағанда жоғары. Олар Рауль заңымен салыстырғанда жоғарырақ температурада қайнайды, төменірек температурада қатады. Вант-Гофф электролит ерітінділері үшін түзету коэффициентін немесе изотондық коэффициент енгізді. Вант – Гофф пен Рауль заңдарынан электролит ерітінділерінде болатын ауытқуларды швед ғалымы С. Аррениус (1883 -1887) өзінің электролиттік диссоциациясында түсіндірді.

Электролиттер сәйкес еріткіштерде қарама-қарсы зарядталған бөлшектерге, иондарға диссоциацияланады. H 2 SO 4 → H+ + HSO— 4 HSO 4 → H+ + SO 42 KOH → K+ + OH— Al. OHSO 4→ Al+3 + OH— + SO 2 -4 Иондардың арасында әрекеттесу күштері болмайды. Сондықтан олардың ерітінділері өздерін идеал газ жүйелері сияқты ұстайды. Электролиттік диссоциация теориясы электролит ерітінділерінің Вант-Гофф және Рауль заңдарынан ауытқу себебін түсіндіргенімен, электролиттердің химиялық қасиеттерінің ерекшеліктерін түсіндіре алмады. Оларды түсіндіруге талпынып, И. А. Каблуков 1891 жылы гидратты теорияны ұсынды.

Диссоциациялану үдерісін сандық жағынан да сипаттауға болады. Диссоциацияланудың қаншалықты толық жүретіндігін диссоциациялану дәрежесі (α) көрсетеді, α-ны сандық үлеспен (0 -1) немесе пайызбен (0100%) беруге болады. α = диссоциацияланган молекулалар саны/жалпы еріген молекулалар саны Диссоциациялану дәрежесінің мәніне қарай электролиттер үш топка бөлінеді: α > 30% - күшті; 3% < α < 30% - орташа күшті; α < 3% - әлсіз.

Диссоциациялану дәрежесіне заттың және еріткіштің табиғаты, ерітіндінің концентрациясы, температура әсер етеді. c 1=c • α • n Мұндағы: c 1 - ерітіндідегі иондар концентрациясы; с - заттың молярлы концентрациясы; α - диссоциациялану дөрежесі; n - ерітіндіге өтетін иондардың моль саны.
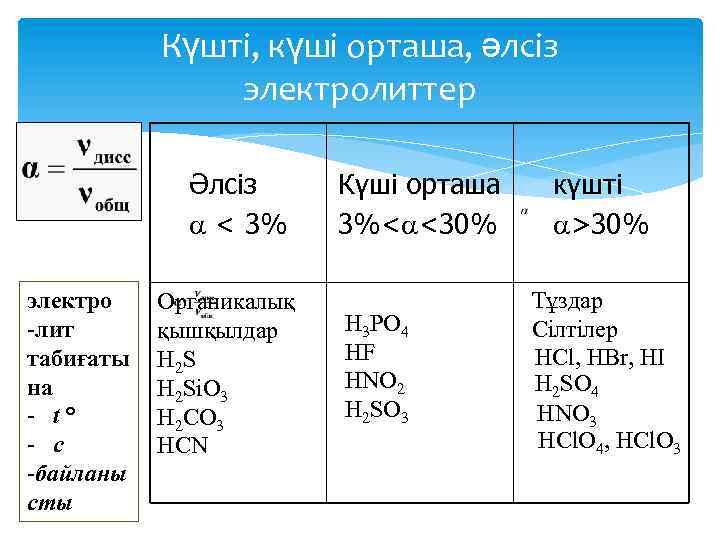
Күшті, күші орташа, әлсіз электролиттер Әлсіз < 3% электро -лит табиғаты на - t° - с -байланы сты Органикалық қышқылдар Н 2 S H 2 Si. O 3 H 2 CO 3 HCN Күші орташа 3%< <30% H 3 PO 4 HF HNO 2 H 2 SO 3 күшті >30% Тұздар Сілтілер HCl, HBr, HI H 2 SO 4 HNO 3 HCl. O 4, HCl. O 3
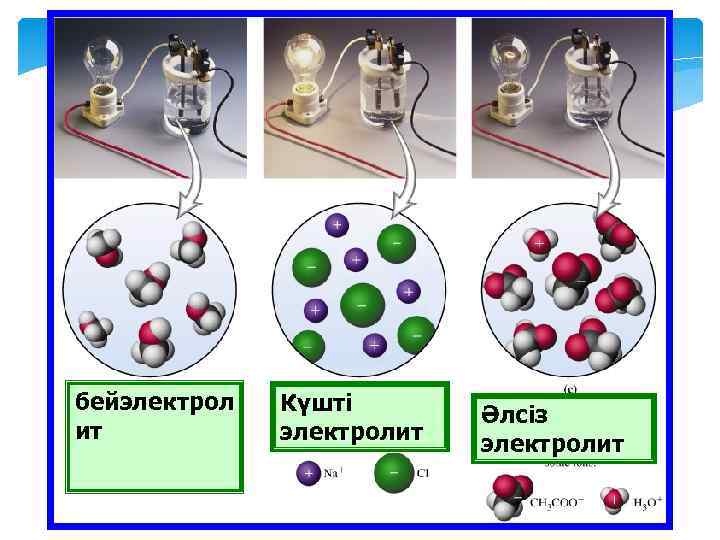
бейэлектрол ит Күшті электролит Әлсіз электролит

Күшті электролиттер Суда еритін орта тұздар Сілтілік және сілтілік жер металдарының гидроксидтері LIOH- Cs. OH Ca(OH)2 - --Ba(OH)2 Минералды қышқылдар H 2 SO 4 , HNO 3 , HCIO 3 , HCIO 4 HBr. O 3 , HJO 3 , HCI , HBr , HJ

Күші орташа электролиттер H 3 PO 4 HPO 3 , HCIO 2, H 4 P 2 O 7 , H 2 SO 3 , HF , Fe(OH)2

Әлсіз электролиттер Органикалық қышқылдар HCOOH CH 3 COOH, C 2 H 5 COOH, Минералды қышқылдар HNO 2, HCIO, , H 2 Si. O 3, H 2 CO 3 H 3 BO 3, H 3 PO 3, H 2 S Белсенділігі аз металдардың гидроксидтері Cu(OH)2, Fe(OH)3, Ae(OH)3, Cr(OH)3, NH 4 OH

1. Электролиттік диссоциация-электролиттердің суда ерігенде оң және теріс зарядталған иондарға ыдырауы. 2. Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды(катиондар), ал оң полюсқа теріс зарядталған иондар жылжиды(аниондар). 3. Диссоциация – қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді. (ассоциация)

1. Электролиттік диссоциацияэлектролиттердің суда ерігенде оң және теріс зарядталған иондарға ыдырауы. 2. Электр тоғының әсерінен теріс полюсқа оң зарядталған иондар жылжиды(катиондар), ал оң полюсқа теріс зарядталған иондар жылжиды(аниондар). 3. Диссоциация – қайтымды процесс. Молекулалардың иондарға ыдырау процесімен қатар иондардың молекулалар процесі жүреді. (ассоциация)

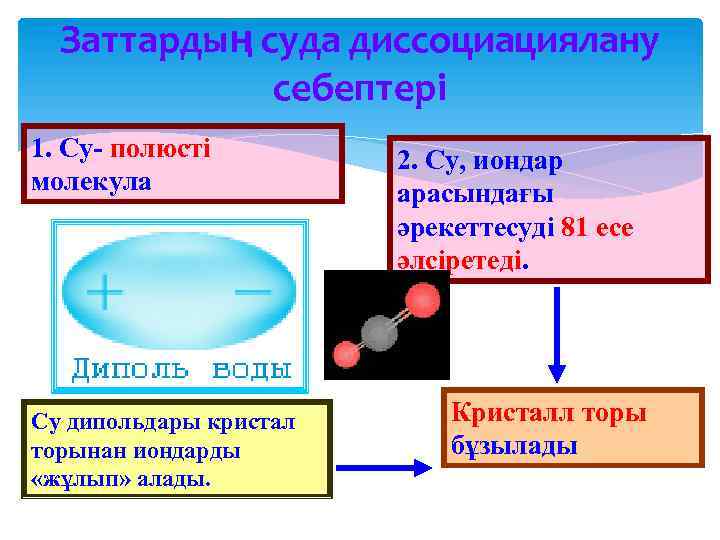
Заттардың суда диссоциациялану себептері 1. Су- полюсті молекула Су дипольдары кристал торынан иондарды «жұлып» алады. 2. Су, иондар арасындағы әрекеттесуді 81 есе әлсіретеді. Кристалл торы бұзылады
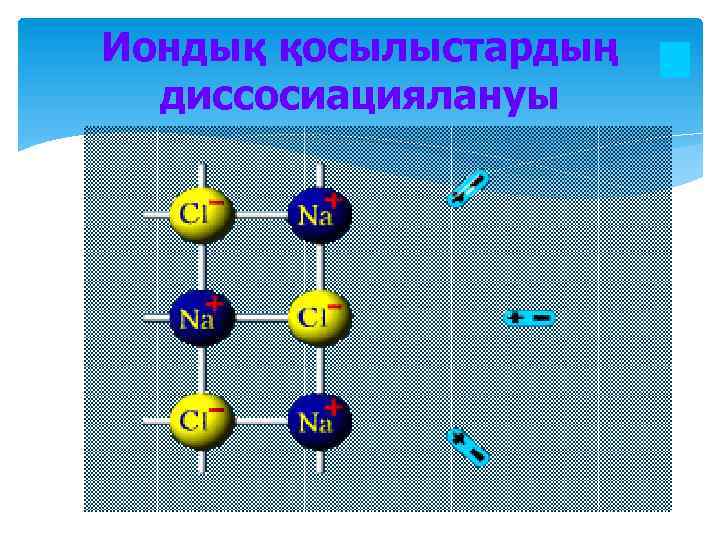
Иондық қосылыстардың диссосиациялануы


Буферлі ерітінділер − бұл қышқыл немесе сілтінің аз мөлшерін қосқанда немесе сұйылту кезінде р. Н мәндерін өзгертпейтін ерітінділер. Буферлі ерітінділердің құрамында әлсіз қышқыл және оның тұзы немесе әлсіз негіз және оның тұзы болады, мысалы: CH 3 COOH+CH 3 COONa − ацетатты буферлі ерітінді; NH 4 OH+NH 4 Cl − аммиакты буферлі ерітінді.

Elektrolit_eritindilerdi_1187__1179_asietteri.pptx