Электрокапилярные явления на ртути и амальгамах металлов Электрокапилярная



























8_lecture_elchem_sea.ppt
- Размер: 1.2 Mегабайта
- Количество слайдов: 43
Описание презентации Электрокапилярные явления на ртути и амальгамах металлов Электрокапилярная по слайдам
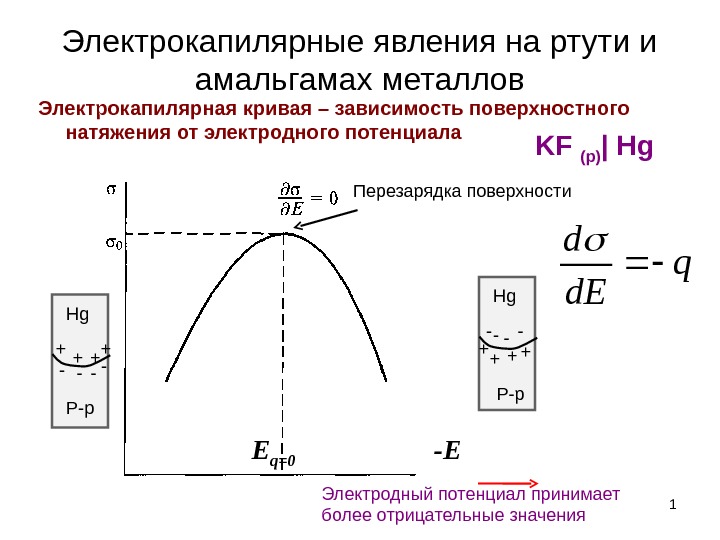
 Электрокапилярные явления на ртути и амальгамах металлов Электрокапилярная кривая – зависимость поверхностного натяжения от электродного потенциала 1 Электродный потенциал принимает более отрицательные значения — EE q=0++ + + — — Р-р. Hg ++ + +- — — Р-р. Hg. Перезарядка поверхности KF (р) | Hgq d. E d
Электрокапилярные явления на ртути и амальгамах металлов Электрокапилярная кривая – зависимость поверхностного натяжения от электродного потенциала 1 Электродный потенциал принимает более отрицательные значения — EE q=0++ + + — — Р-р. Hg ++ + +- — — Р-р. Hg. Перезарядка поверхности KF (р) | Hgq d. E d
 2 Объяснение формы электрокапилярной кривой по модели Гельмгольца. E d q 0 E q d C 0 E d q d. E d 0 Ed. E d d 0 )( 2 2 02 00 0 q. E E EE dd. EE d q
2 Объяснение формы электрокапилярной кривой по модели Гельмгольца. E d q 0 E q d C 0 E d q d. E d 0 Ed. E d d 0 )( 2 2 02 00 0 q. E E EE dd. EE d q
 Поверхностно-активные и поверхностно-неактивные частицы Поверхностно-неактивные : F- , OH- , SO 4 2 — , Cl. O 4 — , HCO 3 — , NO 3 — , катионы щелочных и щелочноземельных металлов и др. ПАВ : С l — , Br- , I- , S 2 — , HS- , Tl+ , Ag+ , [N(R) 4 ] + и др.
Поверхностно-активные и поверхностно-неактивные частицы Поверхностно-неактивные : F- , OH- , SO 4 2 — , Cl. O 4 — , HCO 3 — , NO 3 — , катионы щелочных и щелочноземельных металлов и др. ПАВ : С l — , Br- , I- , S 2 — , HS- , Tl+ , Ag+ , [N(R) 4 ] + и др.
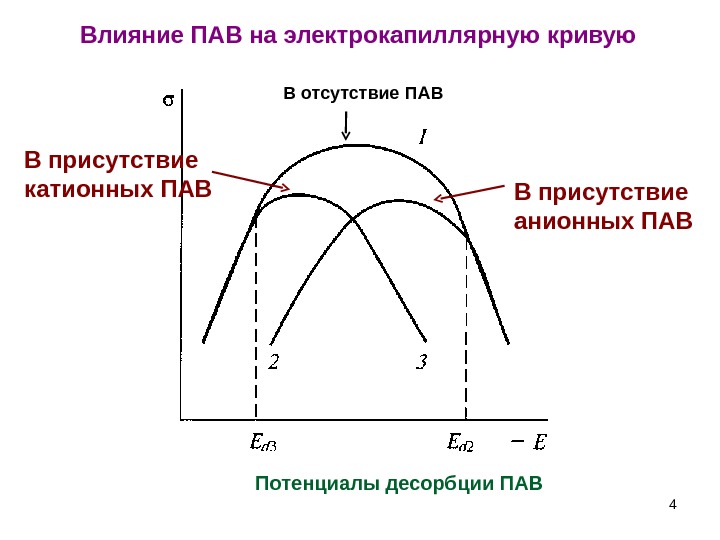
 Влияние ПАВ на электрокапиллярную кривую 4 В отсутствие ПАВ В присутствие анионных ПАВВ присутствие катионных ПАВ Потенциалы десорбции ПАВ
Влияние ПАВ на электрокапиллярную кривую 4 В отсутствие ПАВ В присутствие анионных ПАВВ присутствие катионных ПАВ Потенциалы десорбции ПАВ
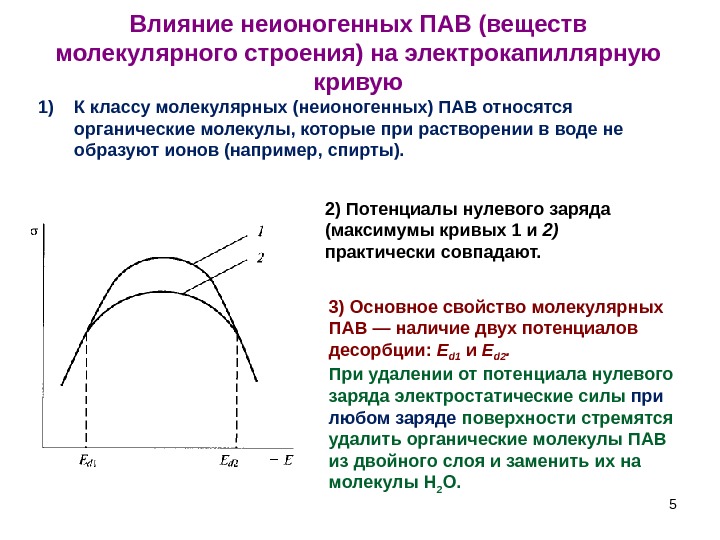
 5 Влияние неионогенных ПАВ (веществ молекулярного строения) на электрокапиллярную кривую 2) Потенциалы нулевого заряда (максимумы кривых 1 и 2) практически совпадают. 1) К классу молекулярных (неионогенных) ПАВ относятся органические молекулы, которые при растворении в воде не образуют ионов (например, спирты). 3) Основное свойство молекулярных ПАВ — наличие двух потенциалов десорбции: E d 1 и Е d 2. При удалении от потенциала нулевого заряда электростатические силы при любом заряде поверхности стремятся удалить органические молекулы ПАВ из двойного слоя и заменить их на молекулы Н 2 O.
5 Влияние неионогенных ПАВ (веществ молекулярного строения) на электрокапиллярную кривую 2) Потенциалы нулевого заряда (максимумы кривых 1 и 2) практически совпадают. 1) К классу молекулярных (неионогенных) ПАВ относятся органические молекулы, которые при растворении в воде не образуют ионов (например, спирты). 3) Основное свойство молекулярных ПАВ — наличие двух потенциалов десорбции: E d 1 и Е d 2. При удалении от потенциала нулевого заряда электростатические силы при любом заряде поверхности стремятся удалить органические молекулы ПАВ из двойного слоя и заменить их на молекулы Н 2 O.
 6 Электрохимическая кинетика. Электрохимическая поляризация и перенапряжение Скорость электрохимических процессов обычно выражается в единицах плотности тока и связана со скоростью v уравнением: i = z. Fv На скорость электрохимических реакций могут влиять не только те же факторы, что и на обычные химические процессы ( C , T , катализаторы и др. ), но и величина электродного потенциала (E). В связи с этим необходим контроль E во время протекания электрохимических процессов. cм моль Кл м
6 Электрохимическая кинетика. Электрохимическая поляризация и перенапряжение Скорость электрохимических процессов обычно выражается в единицах плотности тока и связана со скоростью v уравнением: i = z. Fv На скорость электрохимических реакций могут влиять не только те же факторы, что и на обычные химические процессы ( C , T , катализаторы и др. ), но и величина электродного потенциала (E). В связи с этим необходим контроль E во время протекания электрохимических процессов. cм моль Кл м
 Элементарные стадии электрохимического процесса Электродный процесс, как и любой гетерогенный химический процесс, может включать несколько элементарных стадий. 71) перенос из глубины раствора к поверхности электрода (в результате диффузии, миграции и конвекции); 2) химическая реакция превращения гидратированного или комплексного иона в ион-реагент (т. е. дегидратация иона или отщепление части лигандов); 3) электрохимический процесс, т. е. перенос заряда через границу металл/раствор; 4) фазообразование – образование зародышей и рост новой фазы, если таковая образуется в результате электрохимического процесса. 5) Удаление продукта от поверхности электрода (если не образуется новая фаза)
Элементарные стадии электрохимического процесса Электродный процесс, как и любой гетерогенный химический процесс, может включать несколько элементарных стадий. 71) перенос из глубины раствора к поверхности электрода (в результате диффузии, миграции и конвекции); 2) химическая реакция превращения гидратированного или комплексного иона в ион-реагент (т. е. дегидратация иона или отщепление части лигандов); 3) электрохимический процесс, т. е. перенос заряда через границу металл/раствор; 4) фазообразование – образование зародышей и рост новой фазы, если таковая образуется в результате электрохимического процесса. 5) Удаление продукта от поверхности электрода (если не образуется новая фаза)
 Электрохимическая (электродная) поляризация Разность между потенциалом электрода под током ( Е i ) и его равновесным потенциалом ( Е p ) называется электродной поляризацией. Обычно пользуются абсолютным значением поляризации: Е = | Е i – Е p | 8 Физический смысл величины Е связан с затратой электрической энергии на проведение электродной реакции.
Электрохимическая (электродная) поляризация Разность между потенциалом электрода под током ( Е i ) и его равновесным потенциалом ( Е p ) называется электродной поляризацией. Обычно пользуются абсолютным значением поляризации: Е = | Е i – Е p | 8 Физический смысл величины Е связан с затратой электрической энергии на проведение электродной реакции.
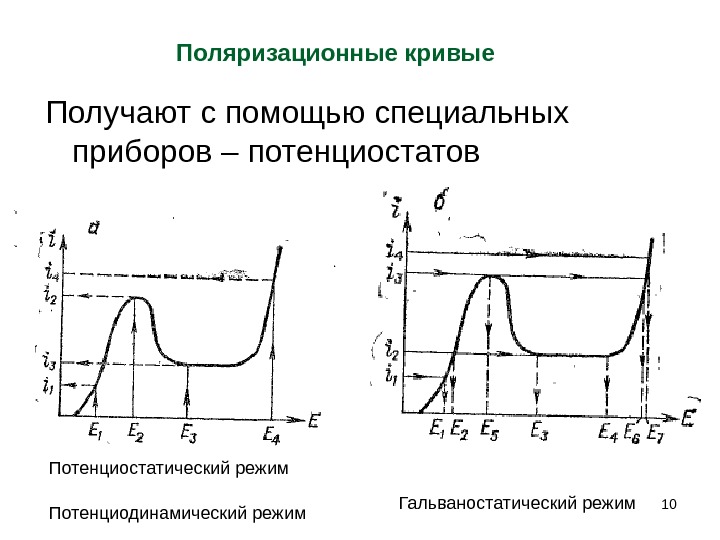
 Поляризационные кривые Зависимости «плотность тока–электродный потенциал» , называют поляризационными кривыми или вольтамперограммами. Их анализ является одним из основных методов исследования электродных процессов. В физике такие зависимости называются вольтамперными характеристиками (ВАХ) электродов.
Поляризационные кривые Зависимости «плотность тока–электродный потенциал» , называют поляризационными кривыми или вольтамперограммами. Их анализ является одним из основных методов исследования электродных процессов. В физике такие зависимости называются вольтамперными характеристиками (ВАХ) электродов.
 Получают с помощью специальных приборов – потенциостатов 10 Поляризационные кривые Потенциостатический режим Гальваностатический режим Потенциодинамический режим
Получают с помощью специальных приборов – потенциостатов 10 Поляризационные кривые Потенциостатический режим Гальваностатический режим Потенциодинамический режим
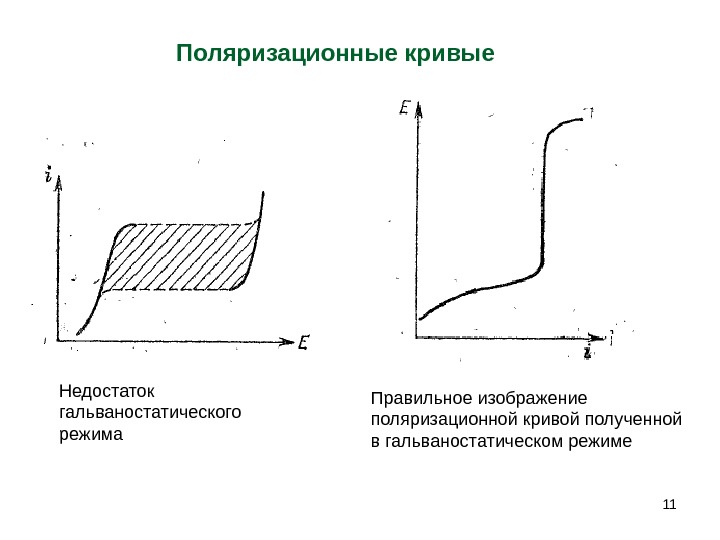
 11 Недостаток гальваностатического режима Поляризационные кривые Правильное изображение поляризационной кривой полученной в гальваностатическом режиме
11 Недостаток гальваностатического режима Поляризационные кривые Правильное изображение поляризационной кривой полученной в гальваностатическом режиме
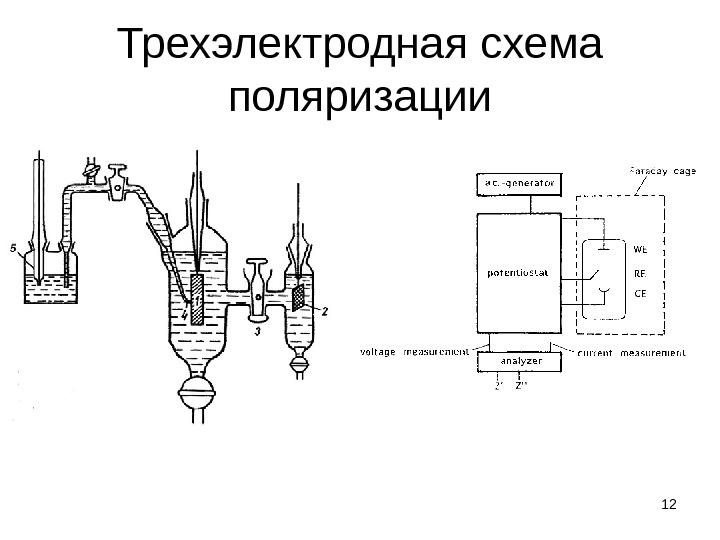
 Трехэлектродная схема поляризации
Трехэлектродная схема поляризации
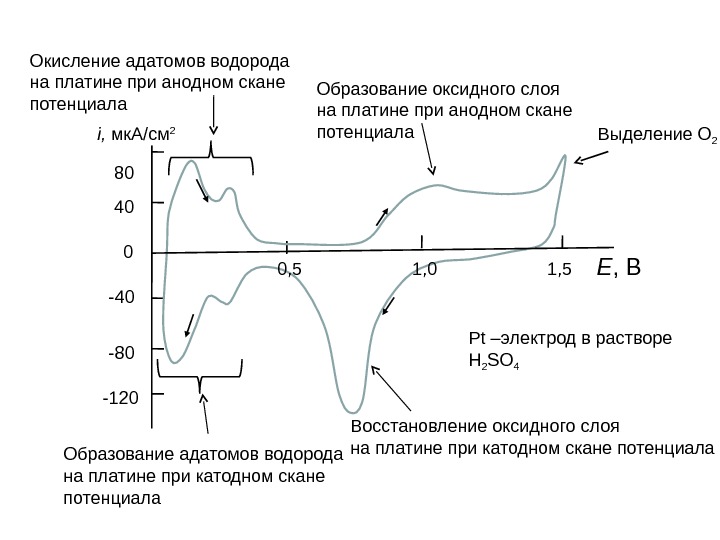
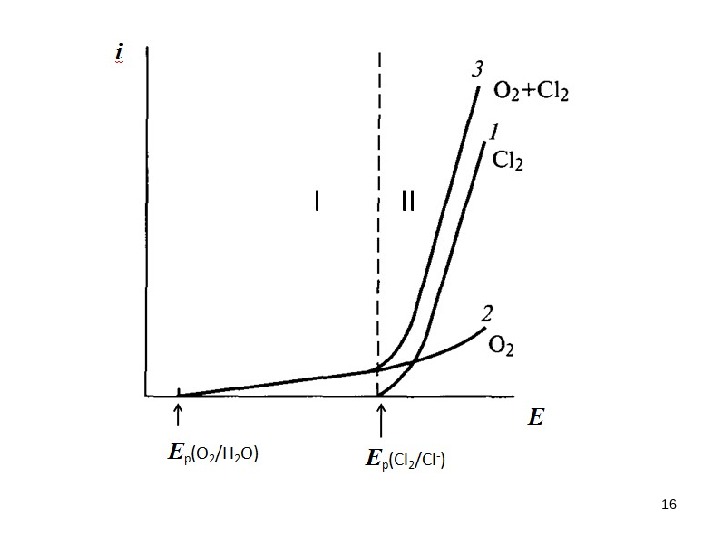
 Образование оксидного слоя на платине при анодном скане потенциала Выделение О 2 Восстановление оксидного слоя на платине при катодном скане потенциала. Окисление адатомов водорода на платине при анодном скане потенциала Образование адатомов водорода на платине при катодном скане потенциала Е , Вi, мк. А/см 2 80 40 -80 -120 0 0 , 5 1, 0 1, 5 Pt – электрод в растворе H 2 SO
Образование оксидного слоя на платине при анодном скане потенциала Выделение О 2 Восстановление оксидного слоя на платине при катодном скане потенциала. Окисление адатомов водорода на платине при анодном скане потенциала Образование адатомов водорода на платине при катодном скане потенциала Е , Вi, мк. А/см 2 80 40 -80 -120 0 0 , 5 1, 0 1, 5 Pt – электрод в растворе H 2 SO
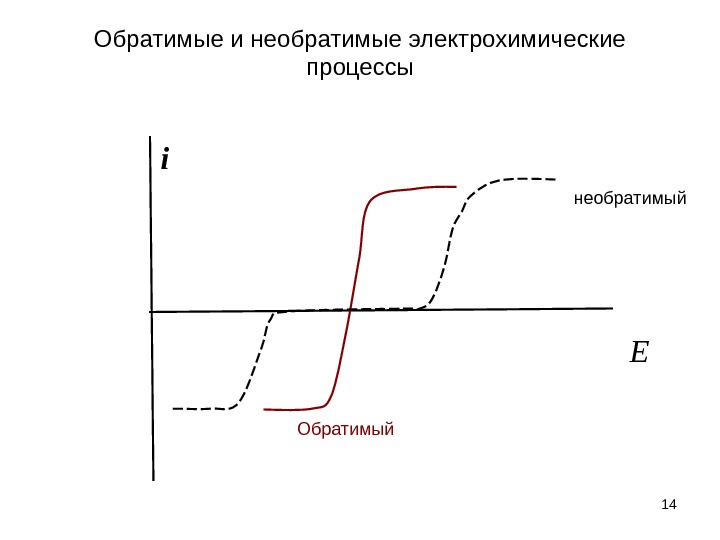
 Обратимые и необратимые электрохимические процессы 14 i Eнеобратимый Обратимый
Обратимые и необратимые электрохимические процессы 14 i Eнеобратимый Обратимый
 Перенапряжение • Термин «перенапряжение» относится не к электроду, а к процессу. Величину перенапряжения обозначают буквой : = | Е i – Е p | где Е i — потенциал электрода под током, a Е p — равновесный потенциал исследуемой реакции.
Перенапряжение • Термин «перенапряжение» относится не к электроду, а к процессу. Величину перенапряжения обозначают буквой : = | Е i – Е p | где Е i — потенциал электрода под током, a Е p — равновесный потенциал исследуемой реакции.

 Виды перенапряжения В соответствии с возможным характером элементарных стадий рассматривают несколько видов перенапряжения. 171) Диффузионное перенапряжение диф. Диффузионным перенапряжением называют вид перенапряжения, связанный с торможением подвода реагентов к электроду или отвода продуктов реакции.
Виды перенапряжения В соответствии с возможным характером элементарных стадий рассматривают несколько видов перенапряжения. 171) Диффузионное перенапряжение диф. Диффузионным перенапряжением называют вид перенапряжения, связанный с торможением подвода реагентов к электроду или отвода продуктов реакции.
 Виды перенапряжения 2) Электрохимическое перенапряжение эл. Электрохимическим перенапряжением называют вид перенапряжения, связанный со стадией замедленного (то есть имеющего конечную скорость) перехода электронов от электрода к реагирующей частице или от реагирующей частицы к электроду. Используются также термины перенапряжение перехода, активационное перенапряжение и перенапряжение разряда.
Виды перенапряжения 2) Электрохимическое перенапряжение эл. Электрохимическим перенапряжением называют вид перенапряжения, связанный со стадией замедленного (то есть имеющего конечную скорость) перехода электронов от электрода к реагирующей частице или от реагирующей частицы к электроду. Используются также термины перенапряжение перехода, активационное перенапряжение и перенапряжение разряда.
 Виды перенапряжения Перенапряжение химической реакции хим. Перенапряжением химической реакции называют вид перенапряжения, обусловленный конечной скоростью химической реакции, которая может быть одной из стадий сложного электродного процесса. Примером может служить образование молекул адсорбированного водорода H 2(ad) : H ad + Had H 2(ad).
Виды перенапряжения Перенапряжение химической реакции хим. Перенапряжением химической реакции называют вид перенапряжения, обусловленный конечной скоростью химической реакции, которая может быть одной из стадий сложного электродного процесса. Примером может служить образование молекул адсорбированного водорода H 2(ad) : H ad + Had H 2(ad).
 Виды перенапряжений Фазовое перенапряжение фаз. Фазовым перенапряжением называют вид перенапряжения, связанный с торможением сложной электродной реакции на стадии образования новой или разрушения старой фазы. Пример: десорбция H 2( ad ) с поверхности электрода и образование газовой фазы H 2(г) : H 2( ad ) H 2(г).
Виды перенапряжений Фазовое перенапряжение фаз. Фазовым перенапряжением называют вид перенапряжения, связанный с торможением сложной электродной реакции на стадии образования новой или разрушения старой фазы. Пример: десорбция H 2( ad ) с поверхности электрода и образование газовой фазы H 2(г) : H 2( ad ) H 2(г).
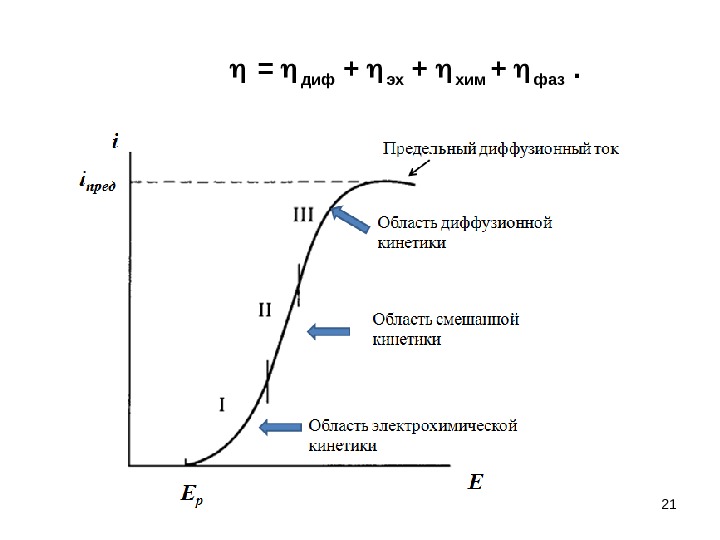
 21 = диф + эх + хим + фаз .
21 = диф + эх + хим + фаз .
 Одноэлектронный перенос В электрохимических (ОВР) процессах рассматривается перенос только одного электрона, так как одновременный перенос нескольких электронов на одну частицу (или с одной частицы) не происходит. Многоэлектронные реакции в действительности являются многостадийными , причем электроны переносятся последовательно. При этом некоторые промежуточные продукты подвергаются очень быстрому превращению (и их не удается зарегистрировать), а другие оказываются достаточно стабильными.
Одноэлектронный перенос В электрохимических (ОВР) процессах рассматривается перенос только одного электрона, так как одновременный перенос нескольких электронов на одну частицу (или с одной частицы) не происходит. Многоэлектронные реакции в действительности являются многостадийными , причем электроны переносятся последовательно. При этом некоторые промежуточные продукты подвергаются очень быстрому превращению (и их не удается зарегистрировать), а другие оказываются достаточно стабильными.
 На электроде процессы переноса одного, двух и (если они есть) последующих электронов происходят одновременно (параллельно), но каждая частица проходит эти стадии последовательно. Поэтому общий ток складывается из токов отдельных электрохимических стадий, но в каждой из них обычно переносится один электрон. Формально такие процессы можно рассматривать как многоэлектронные, то есть с одновременным переносом нескольких ( n ) электронов: 0 x + n e R ed.
На электроде процессы переноса одного, двух и (если они есть) последующих электронов происходят одновременно (параллельно), но каждая частица проходит эти стадии последовательно. Поэтому общий ток складывается из токов отдельных электрохимических стадий, но в каждой из них обычно переносится один электрон. Формально такие процессы можно рассматривать как многоэлектронные, то есть с одновременным переносом нескольких ( n ) электронов: 0 x + n e R ed.
 Перенапряжение электрохимической стадии Пусть для электрохимической стадии протекает полуреакция: Ox + e = Red Такая реакция является реакцией первого порядка. Скорость реакции первого порядка в каждый момент времени пропорциональна концентрации (активности) вещества. v = ka (константа скорости активность ) или в выражении плотности тока: i = z. Fka
Перенапряжение электрохимической стадии Пусть для электрохимической стадии протекает полуреакция: Ox + e = Red Такая реакция является реакцией первого порядка. Скорость реакции первого порядка в каждый момент времени пропорциональна концентрации (активности) вещества. v = ka (константа скорости активность ) или в выражении плотности тока: i = z. Fka
 Константа скорости электрохимической реакции Значения k не зависит от активности вещества, но в электродных реакциях зависит от электродного потенциала E. Это обусловлено изменением энергии активации процесса при поляризации электрода. Константа скорости любого химического процесса (в том числе и электрохимического) может быть выражена уравнением Аррениуса: k = k 0 ∙exp (– G* /RT) В предэкспоненциальный множитель k 0 входят величины, не зависящие от электродного потенциала. i = z. Fa k 0 ∙exp (– G* /RT )
Константа скорости электрохимической реакции Значения k не зависит от активности вещества, но в электродных реакциях зависит от электродного потенциала E. Это обусловлено изменением энергии активации процесса при поляризации электрода. Константа скорости любого химического процесса (в том числе и электрохимического) может быть выражена уравнением Аррениуса: k = k 0 ∙exp (– G* /RT) В предэкспоненциальный множитель k 0 входят величины, не зависящие от электродного потенциала. i = z. Fa k 0 ∙exp (– G* /RT )
 Коэффициент переноса • Фрумкин предложил рассматривать электрохимические реакции, протекающие при различных значениях электродного потенциала, как однотипные химические реакции и использовать для них соотношение Бренстеда-Поляни-Семенова. • Это соотношение гласит: в ряду однотипных химических реакций изменение энергии активации Гиббса составляет некоторую долю от изменения энергии Гиббса реакции: G* = G где получил название коэффициента переноса (не путать с числом переноса). Коэффициент переноса может изменяться от 0 до 1.
Коэффициент переноса • Фрумкин предложил рассматривать электрохимические реакции, протекающие при различных значениях электродного потенциала, как однотипные химические реакции и использовать для них соотношение Бренстеда-Поляни-Семенова. • Это соотношение гласит: в ряду однотипных химических реакций изменение энергии активации Гиббса составляет некоторую долю от изменения энергии Гиббса реакции: G* = G где получил название коэффициента переноса (не путать с числом переноса). Коэффициент переноса может изменяться от 0 до 1.
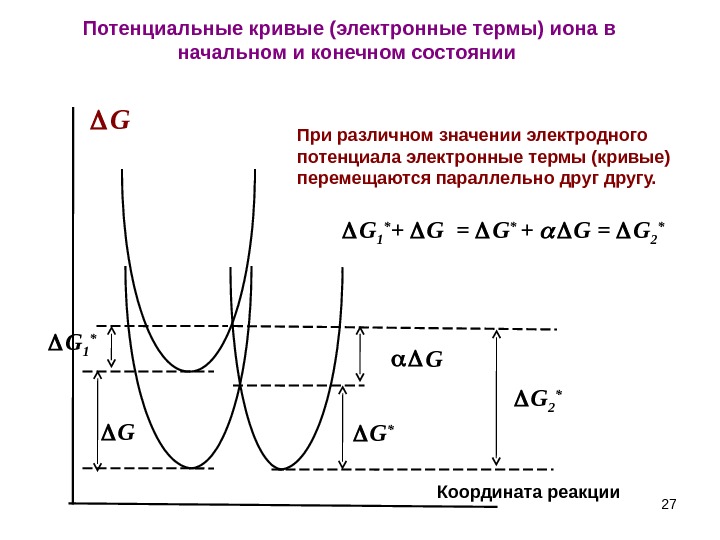
 27 G Координата реакции G GПри различном значении электродного потенциала электронные термы (кривые) перемещаются параллельно другу. Потенциальные кривые (электронные термы) иона в начальном и конечном состоянии G * G 1 * G 2 * G 1 * + G = G * + G = G 2 *
27 G Координата реакции G GПри различном значении электродного потенциала электронные термы (кривые) перемещаются параллельно другу. Потенциальные кривые (электронные термы) иона в начальном и конечном состоянии G * G 1 * G 2 * G 1 * + G = G * + G = G 2 *
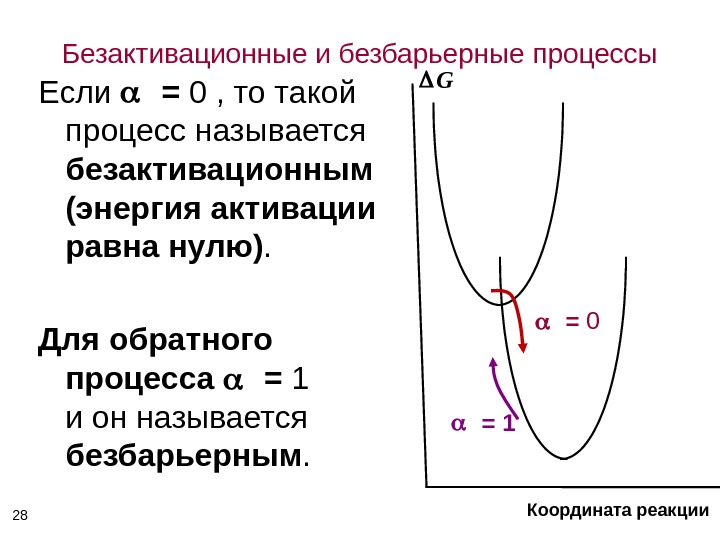
 Безактивационные и безбарьерные процессы Если = 0 , то такой процесс называется безактивационным (энергия активации равна нулю). Для обратного процесса = 1 и он называется безбарьерным. 28 = 0 = 1 G Координата реакции
Безактивационные и безбарьерные процессы Если = 0 , то такой процесс называется безактивационным (энергия активации равна нулю). Для обратного процесса = 1 и он называется безбарьерным. 28 = 0 = 1 G Координата реакции
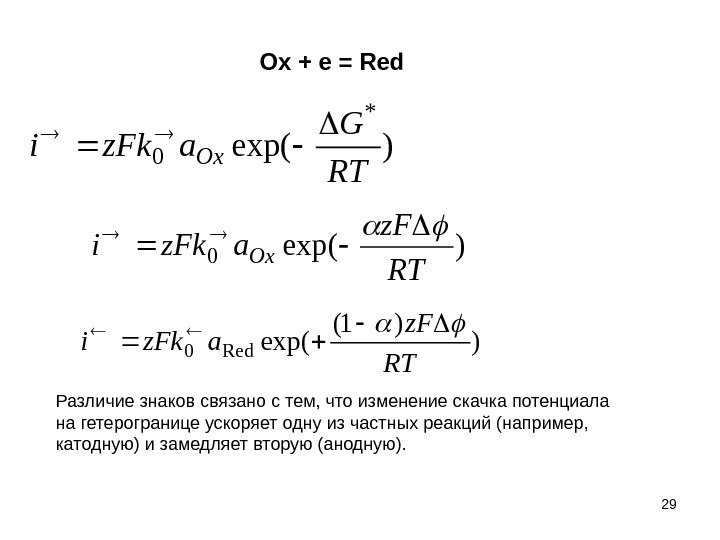
 29)exp(0 RT z. F az. Fki. Ox + e = Red )exp( * 0 RT G az. Fki. Ox ) )1( exp(Red 0 RT z. F az. Fki Различие знаков связано с тем, что изменение скачка потенциала на гетерогранице ускоряет одну из частных реакций (например, катодную) и замедляет вторую (анодную).
29)exp(0 RT z. F az. Fki. Ox + e = Red )exp( * 0 RT G az. Fki. Ox ) )1( exp(Red 0 RT z. F az. Fki Различие знаков связано с тем, что изменение скачка потенциала на гетерогранице ускоряет одну из частных реакций (например, катодную) и замедляет вторую (анодную).
 Ток обмена В условиях равновесия: 300 iii Плотность тока обмена )exp( ) )1( exp( Re 0 0 RT z. F ak ak p p d Ox ) )1( exp()exp(Re 00 RT z. F az. Fk p d p Ox RT z. F a a k kpp d Ox )1( lnln Re 0 0 d Ox p a a z. F RT k k z. F RT Re 0 0 lnln равновесный Уравнение Нернста для гальвани-потенциала
Ток обмена В условиях равновесия: 300 iii Плотность тока обмена )exp( ) )1( exp( Re 0 0 RT z. F ak ak p p d Ox ) )1( exp()exp(Re 00 RT z. F az. Fk p d p Ox RT z. F a a k kpp d Ox )1( lnln Re 0 0 d Ox p a a z. F RT k k z. F RT Re 0 0 lnln равновесный Уравнение Нернста для гальвани-потенциала
 31 Полное уравнение поляризационной кривой) )1( exp()exp(Red 00 RT z. F az. Fkiii. Ox Плотность тока, протекающего через электрод, равна разности частных плотностей тока: )( 00 0 i i ii) )()1( exp() )( (exp(0 RT z. F i pipi pi перенапряжение )] )1( exp()[exp( 0 RT z. F ii Уравнение Батлера-Фольмера
31 Полное уравнение поляризационной кривой) )1( exp()exp(Red 00 RT z. F az. Fkiii. Ox Плотность тока, протекающего через электрод, равна разности частных плотностей тока: )( 00 0 i i ii) )()1( exp() )( (exp(0 RT z. F i pipi pi перенапряжение )] )1( exp()[exp( 0 RT z. F ii Уравнение Батлера-Фольмера
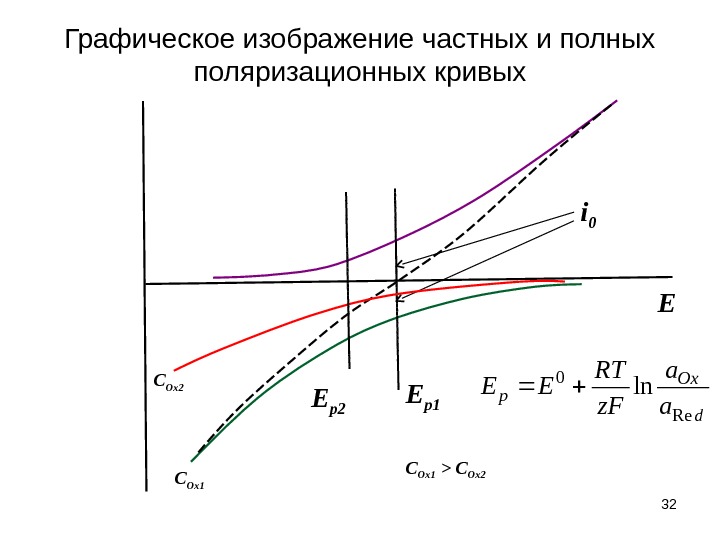
 Графическое изображение частных и полных поляризационных кривых 32 Ei 0 E p 1 E p 2 C Ox 1 C Ox 2 C Ox 1 > C Ox 2 d Ox p a a z. F RT EE Re 0 ln
Графическое изображение частных и полных поляризационных кривых 32 Ei 0 E p 1 E p 2 C Ox 1 C Ox 2 C Ox 1 > C Ox 2 d Ox p a a z. F RT EE Re 0 ln
 Ток обмена При i 0 0 — идеально поляризуемый электрод При i 0 — идеально неполяризуемый электрод
Ток обмена При i 0 0 — идеально поляризуемый электрод При i 0 — идеально неполяризуемый электрод
 Поляризационное сопротивление Допустим, что электрохимическая система незначительно отклоняется от состояния равновесия ( перенапряжение 0 ). Разложим каждую экспоненту в уравнении ППК в ряд и ограничимся первыми двумя членами: 34 RT z. F 1)exp( RT z. F)1( 1) )1( exp( iii 0 RT z. F i 0 0 z. Fi RT Rпз i z. Fi RT 0 Сопротивление переноса заряда или поляризационное сопротивление при электрохимическом перенапряжении )] )1( exp()[exp(0 RT z. F ii
Поляризационное сопротивление Допустим, что электрохимическая система незначительно отклоняется от состояния равновесия ( перенапряжение 0 ). Разложим каждую экспоненту в уравнении ППК в ряд и ограничимся первыми двумя членами: 34 RT z. F 1)exp( RT z. F)1( 1) )1( exp( iii 0 RT z. F i 0 0 z. Fi RT Rпз i z. Fi RT 0 Сопротивление переноса заряда или поляризационное сопротивление при электрохимическом перенапряжении )] )1( exp()[exp(0 RT z. F ii
 Уравнение Тафеля 35 Юлиус Тафель 18 62 – 19 18 гг. Предложил уравнение для связи скорости электрохимической реакции и перенапряжения (1905 г. )
Уравнение Тафеля 35 Юлиус Тафель 18 62 – 19 18 гг. Предложил уравнение для связи скорости электрохимической реакции и перенапряжения (1905 г. )
 Уравнение Тафеля 36 Предположим, что система существенно отклоняется от E p и ii ii Тогда )exp(0 RT z. F ii к к 0 lnln ккi z. F RT lg 3, 2 0 ||lgккккiba iiaai z. F RT lg )1( 3, 2 0 aaaaibalg ||lgiba
Уравнение Тафеля 36 Предположим, что система существенно отклоняется от E p и ii ii Тогда )exp(0 RT z. F ii к к 0 lnln ккi z. F RT lg 3, 2 0 ||lgккккiba iiaai z. F RT lg )1( 3, 2 0 aaaaibalg ||lgiba
 • Экстраполяция линейных участков, подчиняющихся уравнению Тафеля, на нулевое перенапряжение дает значение логарифма плотности тока обмена. • По углам наклона линейных участков в координатах lgi определяют коэффициенты переноса 37 Уравнение Тафеля Линейные тафелевские участки кривых располагаются на достаточном удалении от равновесного потенциала. Вблизи Е р зависимости нелинейны, что объясняется одновременным протеканием реакции в обоих направлениях
• Экстраполяция линейных участков, подчиняющихся уравнению Тафеля, на нулевое перенапряжение дает значение логарифма плотности тока обмена. • По углам наклона линейных участков в координатах lgi определяют коэффициенты переноса 37 Уравнение Тафеля Линейные тафелевские участки кривых располагаются на достаточном удалении от равновесного потенциала. Вблизи Е р зависимости нелинейны, что объясняется одновременным протеканием реакции в обоих направлениях
 Перенапряжение диффузии 38 dx dc Dj i i. DДиффузионным перенапряжением D называют перенапряжение, связанное с заторможенностью стадии диффузионного подвода реагентов из раствора к электроду (или отвода от него продуктов реакции). Когда на электроде происходит электрохимическая реакция, например, Ag + + e Ag то вблизи его поверхности в растворе должен иметь место градиент концентрации (в данном случае ионов серебра), связанный с плотностью тока этого процесса
Перенапряжение диффузии 38 dx dc Dj i i. DДиффузионным перенапряжением D называют перенапряжение, связанное с заторможенностью стадии диффузионного подвода реагентов из раствора к электроду (или отвода от него продуктов реакции). Когда на электроде происходит электрохимическая реакция, например, Ag + + e Ag то вблизи его поверхности в растворе должен иметь место градиент концентрации (в данном случае ионов серебра), связанный с плотностью тока этого процесса
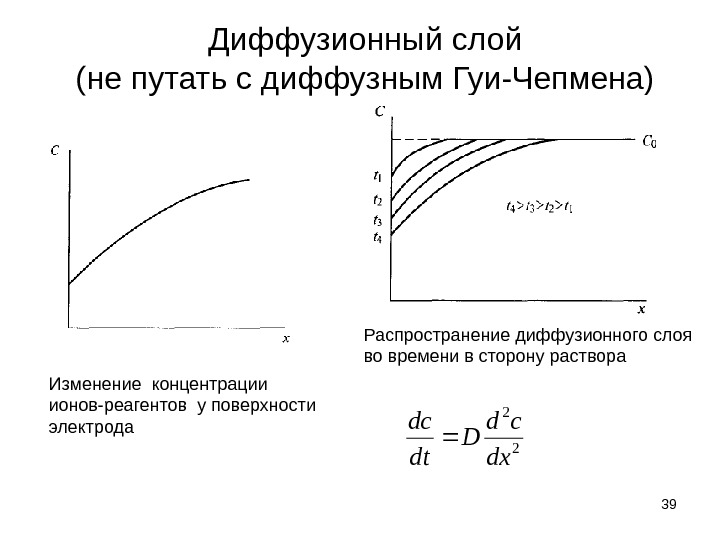
 Диффузионный слой (не путать с диффузным Гуи-Чепмена) 39 Изменение концентрации ионов-реагентов у поверхности электрода Распространение диффузионного слоя во времени в сторону раствора 2 2 dx cd D dt dc
Диффузионный слой (не путать с диффузным Гуи-Чепмена) 39 Изменение концентрации ионов-реагентов у поверхности электрода Распространение диффузионного слоя во времени в сторону раствора 2 2 dx cd D dt dc
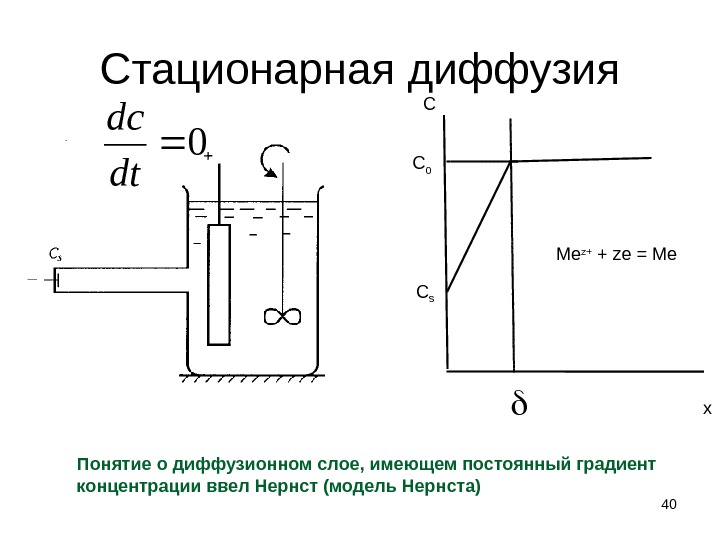
 Стационарная диффузия 40 С С 0 С s x 0 dt dc Понятие о диффузионном слое, имеющем постоянный градиент концентрации ввел Нернст (модель Нернста) Me z+ + ze = Me
Стационарная диффузия 40 С С 0 С s x 0 dt dc Понятие о диффузионном слое, имеющем постоянный градиент концентрации ввел Нернст (модель Нернста) Me z+ + ze = Me
 Предельный диффузионный ток 41 dx dc z. FDi s cc dx dc 0 s cc z. FDi 0 0 c z. FDi пред. Для стационарной диффузии:
Предельный диффузионный ток 41 dx dc z. FDi s cc dx dc 0 s cc z. FDi 0 0 c z. FDi пред. Для стационарной диффузии:
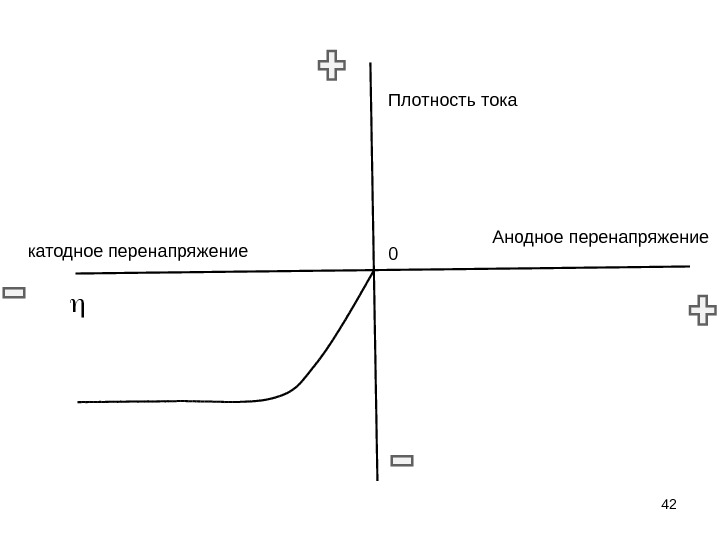
 42 Анодное перенапряжение катодное перенапряжение 0 Плотность тока
42 Анодное перенапряжение катодное перенапряжение 0 Плотность тока
 Три уравнения диффузионной кинетики 43 dx dc z. FDi 2 2 dx cd D dt dc Ox s d d s Ox cс cс z. F RT Re Re lg
Три уравнения диффузионной кинетики 43 dx dc z. FDi 2 2 dx cd D dt dc Ox s d d s Ox cс cс z. F RT Re Re lg

