физкал.лекция.фкх зфо ЭДС.pptx
- Количество слайдов: 26
 ЭЛЕКТРОДВИЖУЩАЯ СИЛА РАСТВОРОВ. 1. Электрохимические процессы. Электрические потенциалы на фазовых границах. 2. Гальванический элемент. 3. Электродный потенциал. Уравнение Нернста. 4. Классификация электродов
ЭЛЕКТРОДВИЖУЩАЯ СИЛА РАСТВОРОВ. 1. Электрохимические процессы. Электрические потенциалы на фазовых границах. 2. Гальванический элемент. 3. Электродный потенциал. Уравнение Нернста. 4. Классификация электродов
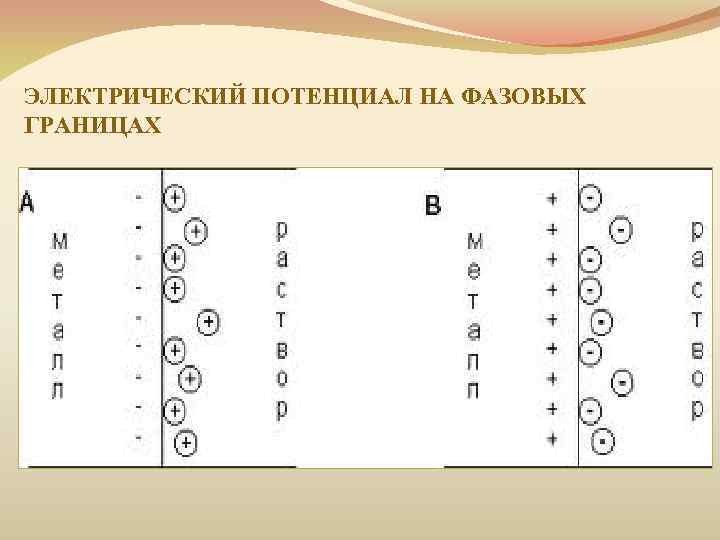 ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ НА ФАЗОВЫХ ГРАНИЦАХ
ЭЛЕКТРИЧЕСКИЙ ПОТЕНЦИАЛ НА ФАЗОВЫХ ГРАНИЦАХ
 ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ устройство, в котором энергия протекающих химических реакций превращается непосредственно в электрическую энергию ü Для осуществления такого превращения надо разбить ОВР на две полуреакции, для каждой полуреакции сконструировать полуэлемент (электрод) и объединить их в единый гальванический элемент.
ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ устройство, в котором энергия протекающих химических реакций превращается непосредственно в электрическую энергию ü Для осуществления такого превращения надо разбить ОВР на две полуреакции, для каждой полуреакции сконструировать полуэлемент (электрод) и объединить их в единый гальванический элемент.
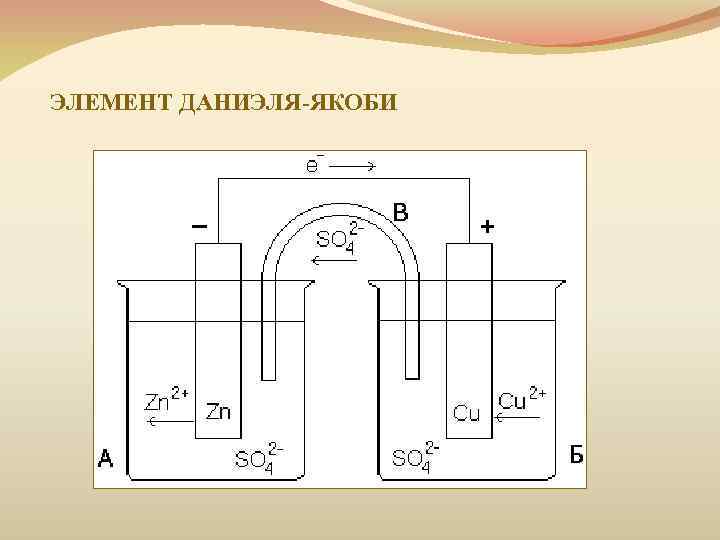 ЭЛЕМЕНТ ДАНИЭЛЯ-ЯКОБИ
ЭЛЕМЕНТ ДАНИЭЛЯ-ЯКОБИ
 ЭЛЕМЕНТ ДАНИЭЛЯ-ЯКОБИ Zn + Cu 2+ → Zn 2+ + Cu 0 +65 -147 0 Zn 0→Zn 2+ + 2 e Cu 2+ + 2 e →Cu 0 Совокупность этих процессов приводит к возникновению электрического тока во внешней цепи.
ЭЛЕМЕНТ ДАНИЭЛЯ-ЯКОБИ Zn + Cu 2+ → Zn 2+ + Cu 0 +65 -147 0 Zn 0→Zn 2+ + 2 e Cu 2+ + 2 e →Cu 0 Совокупность этих процессов приводит к возникновению электрического тока во внешней цепи.
 ЭЛЕКТРОДВИЖУЩАЯ СИЛА между двумя полуэлементами существует разность потенциалов, ∆φ или ЭДС – электродвижущая сила. ü Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью потенциалов между электродами ∆φ и количеством прошедшего по цепи электричества q: d. A = ∆φ dq
ЭЛЕКТРОДВИЖУЩАЯ СИЛА между двумя полуэлементами существует разность потенциалов, ∆φ или ЭДС – электродвижущая сила. ü Работа, которую может совершить электрический ток, вырабатываемый гальваническим элементом, определяется разностью потенциалов между электродами ∆φ и количеством прошедшего по цепи электричества q: d. A = ∆φ dq
 Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала!
Работа тока гальванического элемента (и, следовательно, разность потенциалов), будет максимальна при его обратимой работе, когда процессы на электродах протекают бесконечно медленно и сила тока в цепи бесконечно мала!
 УРАВНЕНИЕ НЕРНСТА Величина электродного потенциала металлического электрода зависит от: • температуры • активности (концентрации) иона металла в растворе, в который опущен электрод; Математически эта уравнением Нернста. зависимость выражается
УРАВНЕНИЕ НЕРНСТА Величина электродного потенциала металлического электрода зависит от: • температуры • активности (концентрации) иона металла в растворе, в который опущен электрод; Математически эта уравнением Нернста. зависимость выражается
 УРАВНЕНИЕ НЕРНСТА
УРАВНЕНИЕ НЕРНСТА
 ЭДС ЭЛЕМЕНТА ДАНИЕЛЯ-ЯКОБИ
ЭДС ЭЛЕМЕНТА ДАНИЕЛЯ-ЯКОБИ
 ЭЛЕКТРОДЫ § Электродом в электрохимии называется поверхность раздела между проводником электрического тока с электронной проводимостью и проводником электрического тока с ионной проводимостью, или, иными словами, место, где электронный механизм переноса электрического заряда изменяется на ионный (и наоборот). § В более узком смысле слова электродом часто называют проводник электрического тока с электронной проводимостью.
ЭЛЕКТРОДЫ § Электродом в электрохимии называется поверхность раздела между проводником электрического тока с электронной проводимостью и проводником электрического тока с ионной проводимостью, или, иными словами, место, где электронный механизм переноса электрического заряда изменяется на ионный (и наоборот). § В более узком смысле слова электродом часто называют проводник электрического тока с электронной проводимостью.
 ЭЛЕКТРОДЫ Классификация электродов. 1). Электроды I рода. 2). Электроды неметаллической природы 3). Газовые электроды. 4). Электроды II рода. 5). Окислительно-восстановительные (ОХ - Rеd ). 6). Ионообменные электроды.
ЭЛЕКТРОДЫ Классификация электродов. 1). Электроды I рода. 2). Электроды неметаллической природы 3). Газовые электроды. 4). Электроды II рода. 5). Окислительно-восстановительные (ОХ - Rеd ). 6). Ионообменные электроды.
 Электроды I рода. Ø состоят из металла, опущенного в раствор с теми же свойствами 1. Zn. SO 4 / Zn; Cu. SO 4 / Cu. 2. Амальгамный электрод (I рода). ü состоят из амальгамы металла, находящейся в контакте с раствором, содержащим ионы этого металла Сd 2+ / Cd(Hg)
Электроды I рода. Ø состоят из металла, опущенного в раствор с теми же свойствами 1. Zn. SO 4 / Zn; Cu. SO 4 / Cu. 2. Амальгамный электрод (I рода). ü состоят из амальгамы металла, находящейся в контакте с раствором, содержащим ионы этого металла Сd 2+ / Cd(Hg)
 Электроды I рода. 3. Газовые электроды ü состоят из инертного металла, который контактирует с газом и с раствором, содержащими ионы этого газа. Обратимы относительно катиона водородный электрод Pt (H 2) / H + Обратимы относительно аниона Хлоридный электрод Pt (Cl 2) / Cl-
Электроды I рода. 3. Газовые электроды ü состоят из инертного металла, который контактирует с газом и с раствором, содержащими ионы этого газа. Обратимы относительно катиона водородный электрод Pt (H 2) / H + Обратимы относительно аниона Хлоридный электрод Pt (Cl 2) / Cl-
 ВОДОРОДНЫЙ ЭЛЕКТРОД Нормальный электрод (водородный) – где давление подачи газообразного водорода = 1 атмосфере; активность ионов водорода =1, и φ0 =0. Н 2 2 H+ + 2 e
ВОДОРОДНЫЙ ЭЛЕКТРОД Нормальный электрод (водородный) – где давление подачи газообразного водорода = 1 атмосфере; активность ионов водорода =1, и φ0 =0. Н 2 2 H+ + 2 e
 Электроды II рода ü это металл, который покрыт трудно растворимой собственной солью и опущенный в раствор, содержащий ионы такие же как и в трудно растворимой соли. 1. Каломельный Нg / Hg 2 Cl 2 KCl 2. Хлорсеребряный Ag / Ag. Cl HCl
Электроды II рода ü это металл, который покрыт трудно растворимой собственной солью и опущенный в раствор, содержащий ионы такие же как и в трудно растворимой соли. 1. Каломельный Нg / Hg 2 Cl 2 KCl 2. Хлорсеребряный Ag / Ag. Cl HCl
 КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД Hg 2 Cl 2 ↔ Hg 22+ + 2 Cl- Чем больше концентрация KCl, тем меньше скачок потенциала KCl - 0, 1 H φ0 = 0, 334 В КСl - 1 Н φ0 = 0, 282 В КСl – насыщ. φ0 = 0, 250 В
КАЛОМЕЛЬНЫЙ ЭЛЕКТРОД Hg 2 Cl 2 ↔ Hg 22+ + 2 Cl- Чем больше концентрация KCl, тем меньше скачок потенциала KCl - 0, 1 H φ0 = 0, 334 В КСl - 1 Н φ0 = 0, 282 В КСl – насыщ. φ0 = 0, 250 В
 ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД Ag 0 – ē + Cl- ↔ Ag. Cl Ø электрод компактный, Ø изготовлен в промышленных условиях, Ø обладает низким температурным коэффициентом, т. е. не зависит от t 0 C
ХЛОРСЕРЕБРЯНЫЙ ЭЛЕКТРОД Ag 0 – ē + Cl- ↔ Ag. Cl Ø электрод компактный, Ø изготовлен в промышленных условиях, Ø обладает низким температурным коэффициентом, т. е. не зависит от t 0 C
 III Окислительно-восстановительные электроды. Ø состоят из инертного металла, погруженного в раствор, содержащий вещества с различной степенью окисления Red и Oх. Пример: Pt/Fe. Cl 2 , Fe. Cl 3 Pt/ Co. Cl 3 , Co. Cl 4 продукты электронных реакций не выделяются на электродах, а остаются в растворе!
III Окислительно-восстановительные электроды. Ø состоят из инертного металла, погруженного в раствор, содержащий вещества с различной степенью окисления Red и Oх. Пример: Pt/Fe. Cl 2 , Fe. Cl 3 Pt/ Co. Cl 3 , Co. Cl 4 продукты электронных реакций не выделяются на электродах, а остаются в растворе!
 III Окислительно-восстановительные электроды. Хингидронный электрод С 6 Н 4(ОН)2 = С 6 Н 4 О 2 + 2 Н+ + 2 е RT a(хинон) * а (Н+)2 φ = φ0 + n. F * ln а(гидрогинон)
III Окислительно-восстановительные электроды. Хингидронный электрод С 6 Н 4(ОН)2 = С 6 Н 4 О 2 + 2 Н+ + 2 е RT a(хинон) * а (Н+)2 φ = φ0 + n. F * ln а(гидрогинон)
 IV. Ионообменные электроды (Ионоселективные электроды)Ø состоят из ионита и раствора Ø потенциал на границе раздела фаз возникает за счет ионообменных процессов между ионитом и раствором Ионоселективные электроды (ИСЭ) ü электрохимические системы, в которых потенциал определяется процессами распределения ионов между мембраной и раствором
IV. Ионообменные электроды (Ионоселективные электроды)Ø состоят из ионита и раствора Ø потенциал на границе раздела фаз возникает за счет ионообменных процессов между ионитом и раствором Ионоселективные электроды (ИСЭ) ü электрохимические системы, в которых потенциал определяется процессами распределения ионов между мембраной и раствором
 Ионоселективные электроды Исследуемый раствор А+ а. А+ В+ а. В+ Мембрана А+, В+ Стандартный раствор А+ а. А+
Ионоселективные электроды Исследуемый раствор А+ а. А+ В+ а. В+ Мембрана А+, В+ Стандартный раствор А+ а. А+
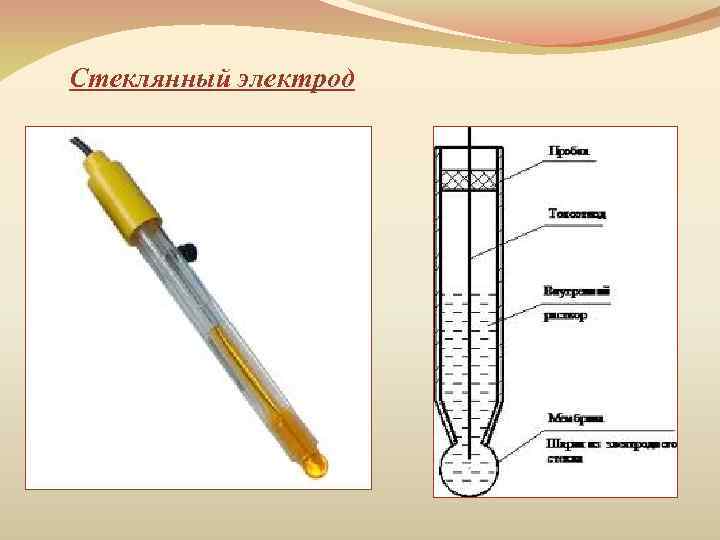 Стеклянный электрод
Стеклянный электрод
 Стеклянный электрод ü состоит из стеклянного тонкостенного шарика, припаянного к стеклянной трубке. ü в шарик налит раствор HCl (внутренний раствор, моль∙л– 1), в который опущен хлорсеребряный электрод. Na+мр + H+р ↔ Na+р + H+мр
Стеклянный электрод ü состоит из стеклянного тонкостенного шарика, припаянного к стеклянной трубке. ü в шарик налит раствор HCl (внутренний раствор, моль∙л– 1), в который опущен хлорсеребряный электрод. Na+мр + H+р ↔ Na+р + H+мр
 ЭЛЕКТРОДЫ СРАВНЕНИЯ Ø это такие электроды, потенциал которых известен и не изменяется во времени. ü водородный ü каломельный ü хлорсеребряный.
ЭЛЕКТРОДЫ СРАВНЕНИЯ Ø это такие электроды, потенциал которых известен и не изменяется во времени. ü водородный ü каломельный ü хлорсеребряный.
 СПАСИБО ЗА ВНИМАНИЕ!
СПАСИБО ЗА ВНИМАНИЕ!


