Эл_понтенциалы.ppt
- Количество слайдов: 21
 Электродные потенциалы
Электродные потенциалы
 УМК «ХИМИЯ» Тема лекции: Электродные потенциалы Лектор – Иванов М. Г.
УМК «ХИМИЯ» Тема лекции: Электродные потенциалы Лектор – Иванов М. Г.
 Цель лекции: изложение основных понятий электродных потенциалов на границе металл- раствор электролита в рамках современной химической теории Компетенции, формируемые у студента: Умения: q прогнозировать на основе современных представлений о строении атомов и химической связи, возможность протекания ОВ реакций в расплавах и растворах электролитов.
Цель лекции: изложение основных понятий электродных потенциалов на границе металл- раствор электролита в рамках современной химической теории Компетенции, формируемые у студента: Умения: q прогнозировать на основе современных представлений о строении атомов и химической связи, возможность протекания ОВ реакций в расплавах и растворах электролитов.
 СОДЕРЖАНИЕ Основные понятия Носители заряда Связь электродного потенциала и энергии Гиббса Водородный электрод Уравнение Нернста Потенциалы газовых электродов Диаграммы Латимера Диаграммы Пурбе Гальванический элемент Элемент Даниэля Гальванический элемент с инертными электродами Литература
СОДЕРЖАНИЕ Основные понятия Носители заряда Связь электродного потенциала и энергии Гиббса Водородный электрод Уравнение Нернста Потенциалы газовых электродов Диаграммы Латимера Диаграммы Пурбе Гальванический элемент Элемент Даниэля Гальванический элемент с инертными электродами Литература
 Основные понятия содержание По типу носителей заряда проводники электрического тока делят на две группы: в проводниках первого рода ток переносят электроны (металлы, полупроводники), в проводниках второго рода – ионы (растворы и расплавы электролитов). Электродом называется проводник первого рода, контактирующий с проводником второго рода:
Основные понятия содержание По типу носителей заряда проводники электрического тока делят на две группы: в проводниках первого рода ток переносят электроны (металлы, полупроводники), в проводниках второго рода – ионы (растворы и расплавы электролитов). Электродом называется проводник первого рода, контактирующий с проводником второго рода:
 Основные понятия содержание При погружении металла M в раствор, содержащий одноименные ионы Mn+ устанавливается динамическое равновесие между катионами Мn+, находящимися в растворе, и атомами М на поверхности электрода: Me – ne + m. H 2 O [Me(H 2 O)m]n+ Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно.
Основные понятия содержание При погружении металла M в раствор, содержащий одноименные ионы Mn+ устанавливается динамическое равновесие между катионами Мn+, находящимися в растворе, и атомами М на поверхности электрода: Me – ne + m. H 2 O [Me(H 2 O)m]n+ Если преобладает прямая реакция, то пластина заряжается положительно, а раствор вблизи электрода отрицательно. Если преимущественно идёт обратная реакция, то пластина заряжается отрицательно, а раствор вблизи электрода – положительно.
 Основные понятия содержание Электродный потенциал служит мерой изменения свободной энергии Гиббса ( G) в системе и указывает на направление окислительно- восстановительного процесса: Gо = – Еоn. F G <0, когда E > 0 Gо = – RT • ln. K Самопроизвольный процесс
Основные понятия содержание Электродный потенциал служит мерой изменения свободной энергии Гиббса ( G) в системе и указывает на направление окислительно- восстановительного процесса: Gо = – Еоn. F G <0, когда E > 0 Gо = – RT • ln. K Самопроизвольный процесс
 Основные понятия содержание За величину электродного потенциала данного электрода в водородной шкале принимают ЭДС гальванического элемента: Me/[Me(H 2 O)m]n+ (H 2, H 2 SO 4)/Pt Стандартные значения потенциалов электродов (E 0), при условиях: температура 298, 15 К, давление газа (для газовых электродов) 1, 013 • 105 Па, концентрация потенциалопределяющих ионов - 1 моль/л.
Основные понятия содержание За величину электродного потенциала данного электрода в водородной шкале принимают ЭДС гальванического элемента: Me/[Me(H 2 O)m]n+ (H 2, H 2 SO 4)/Pt Стандартные значения потенциалов электродов (E 0), при условиях: температура 298, 15 К, давление газа (для газовых электродов) 1, 013 • 105 Па, концентрация потенциалопределяющих ионов - 1 моль/л.
 Уравнение Нернста содержание R = 8, 314 Дж/(моль К) – универсальная газовая постоянная; F = 96500 Кл/моль - постоянная Фарадея (заряд одного моля электронов); T – абсолютная температура, К; n – число электронов; символы в квадратных скобках означает молярную концентрацию вещества.
Уравнение Нернста содержание R = 8, 314 Дж/(моль К) – универсальная газовая постоянная; F = 96500 Кл/моль - постоянная Фарадея (заряд одного моля электронов); T – абсолютная температура, К; n – число электронов; символы в квадратных скобках означает молярную концентрацию вещества.
 Уравнение Нернста содержание для ионно-металлического электрода: для водородного электрода:
Уравнение Нернста содержание для ионно-металлического электрода: для водородного электрода:
 Уравнение Нернста содержание При температуре 298, 15 К уравнение Нернста для, полуреакции Mn. O 4 + 8 H+ + 5 e = Mn 2+ + 4 H 2 O примет вид 0, 059 lg [Mn. O 4 ][H+]8 + 5 [Mn 2+] =
Уравнение Нернста содержание При температуре 298, 15 К уравнение Нернста для, полуреакции Mn. O 4 + 8 H+ + 5 e = Mn 2+ + 4 H 2 O примет вид 0, 059 lg [Mn. O 4 ][H+]8 + 5 [Mn 2+] =
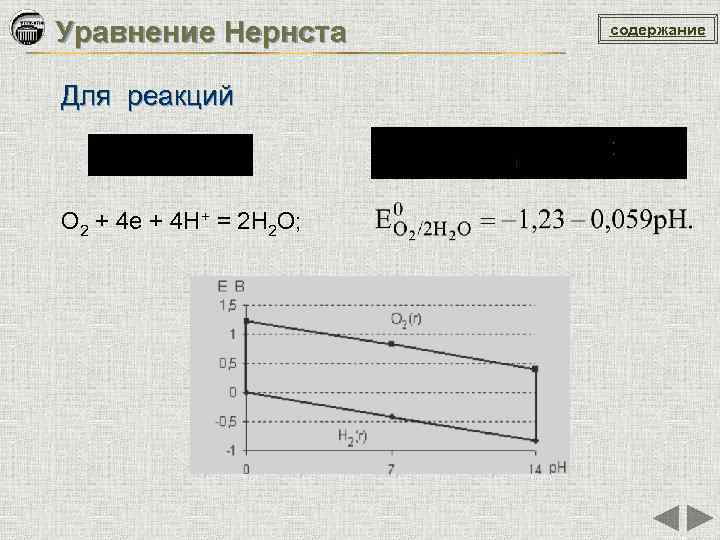 Уравнение Нернста Для реакций O 2 + 4 e + 4 H+ = 2 H 2 O; содержание
Уравнение Нернста Для реакций O 2 + 4 e + 4 H+ = 2 H 2 O; содержание
 Диаграммы Латимера содержание Диаграммы Латимера - это простой и удобный способ описания окислительновосстановительных свойств, проявляемых элементом в различных степенях окисления если Е 2>Е 1, то ион «В» термодинамически неустойчив, и диспропорционирует на «А» и С» .
Диаграммы Латимера содержание Диаграммы Латимера - это простой и удобный способ описания окислительновосстановительных свойств, проявляемых элементом в различных степенях окисления если Е 2>Е 1, то ион «В» термодинамически неустойчив, и диспропорционирует на «А» и С» .
 Диаграммы Латимера p. H = 14 p. H = 0 содержание
Диаграммы Латимера p. H = 14 p. H = 0 содержание
 Диаграммы Латимера содержание (при р. Н = 0) неустойчивыми в кислой среде будут ионы Mn. O 42 - : 1 Mn. O 42¯ + 2 e + 4 H+ = Mn. O 2 + 2 H 2 O 2 Mn. O 42¯ – e = Mn. O 4¯ 3 Mn. O 42¯ + 4 H+ = Mn. O 2 + 2 H 2 O + 2 Mn. O 4¯ ∆Ео = Ео. Ох - Eо. Red = 2, 26 – 0, 56 = 1, 17 B.
Диаграммы Латимера содержание (при р. Н = 0) неустойчивыми в кислой среде будут ионы Mn. O 42 - : 1 Mn. O 42¯ + 2 e + 4 H+ = Mn. O 2 + 2 H 2 O 2 Mn. O 42¯ – e = Mn. O 4¯ 3 Mn. O 42¯ + 4 H+ = Mn. O 2 + 2 H 2 O + 2 Mn. O 4¯ ∆Ео = Ео. Ох - Eо. Red = 2, 26 – 0, 56 = 1, 17 B.
![Диаграммы Пурбе содержание 25°C: [Cu] = 10 -4 M. Диаграммы Пурбе содержание 25°C: [Cu] = 10 -4 M.](https://present5.com/presentation/-43092742_131233535/image-16.jpg) Диаграммы Пурбе содержание 25°C: [Cu] = 10 -4 M.
Диаграммы Пурбе содержание 25°C: [Cu] = 10 -4 M.
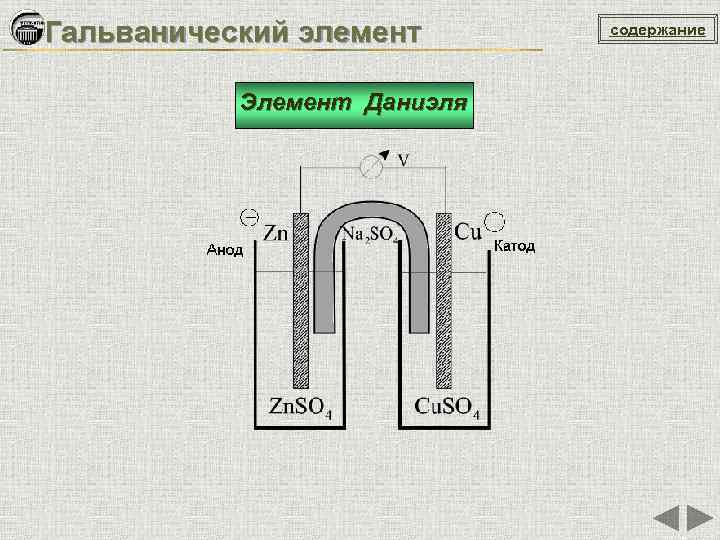 Гальванический элемент Элемент Даниэля содержание
Гальванический элемент Элемент Даниэля содержание
 Гальванический элемент Элемент Даниэля Zn / Zn. SO 4 Cu. SO 4 / Cu Cu 2+ + 2 e = Cuo (катод, восстановление) Zno – 2 e = Zn 2+ (анод, окисление) Zn 0 + Сu 2+ = Zn 2+ + Cu 0 ЭДС = Ео. Ох - Eо. Red = 0, 34 – (– 0, 76) = 1, 1 B содержание
Гальванический элемент Элемент Даниэля Zn / Zn. SO 4 Cu. SO 4 / Cu Cu 2+ + 2 e = Cuo (катод, восстановление) Zno – 2 e = Zn 2+ (анод, окисление) Zn 0 + Сu 2+ = Zn 2+ + Cu 0 ЭДС = Ео. Ох - Eо. Red = 0, 34 – (– 0, 76) = 1, 1 B содержание
 Гальванический элемент с инертным электродом содержание Zn / Zn. SO 4 KMn. O 4, H 2 SO 4, Mn. SO 4, /С 2 Mn. O 4 + 5 e +8 H+ = Mn 2+ + 4 H 2 O (катодный процесс ) 5 Zno - 2 e = Zn 2+ (анодный процесс) 2 Mn. O 4 + 5 Zn + 16 H+ = 2 Mn 2+ + 5 Zn 2+ +8 H 2 O ЭДС = Ео. Ох - Eо. Red = 1, 51 – (– 0, 76) = 2, 27 B
Гальванический элемент с инертным электродом содержание Zn / Zn. SO 4 KMn. O 4, H 2 SO 4, Mn. SO 4, /С 2 Mn. O 4 + 5 e +8 H+ = Mn 2+ + 4 H 2 O (катодный процесс ) 5 Zno - 2 e = Zn 2+ (анодный процесс) 2 Mn. O 4 + 5 Zn + 16 H+ = 2 Mn 2+ + 5 Zn 2+ +8 H 2 O ЭДС = Ео. Ох - Eо. Red = 1, 51 – (– 0, 76) = 2, 27 B
 Выводы и заключения n n Электродные потенциалы является важнейшей является частью неорганической химии. Знание законов Фарадея, а также понятие электродного потенциала позволяет охарактеризовать электрохимические процессы. содержание
Выводы и заключения n n Электродные потенциалы является важнейшей является частью неорганической химии. Знание законов Фарадея, а также понятие электродного потенциала позволяет охарактеризовать электрохимические процессы. содержание
 Список литературы n n n содержание 1. Ахметов Н. С. Общая и неорганическая химия. М. : Высшая школа. 2002. 2. О. М. Полторак, Л. М. Ковба. «Физико-химические основы неорганической химии» . М. : МГУ, 1994. 3. В. И. Горшков, И. А. Кузнецов. «Физическая химия» . М. : МГУ, 1993. 4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М. : Мир. 1985. 5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т. 1. 6. Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М. , Химия, 1987. 7. Фичини Ж. , Ламброзо-Бадер Н. , Депезе Ж. -К. Основы физической химии. М. Мир. 1972. стр. 276 -283. 8. Дж. Кемпбел. Современная общая химия. М. : Мир. 1975 г. Т. 2. стр. 90. гл. 20. , Т 3. 9. Дикерсон Р. , Грей Г. , Хейт Дж. Основные законы химии. М. : Мир, 1982. Т. 2. 10. Б. Б. Дамаскин, О. А. Петрий. Электрохимия. М: Высшая школа, 1987. 11. CRC Hand book of Chemistry and Physics. 82 издание. 2001 -2002
Список литературы n n n содержание 1. Ахметов Н. С. Общая и неорганическая химия. М. : Высшая школа. 2002. 2. О. М. Полторак, Л. М. Ковба. «Физико-химические основы неорганической химии» . М. : МГУ, 1994. 3. В. И. Горшков, И. А. Кузнецов. «Физическая химия» . М. : МГУ, 1993. 4. А. Джонсон. Термодинамические аспекты в курсе неорганической химии. М. : Мир. 1985. 5. Анорганикум. Под ред. Л. Кольдица. М. Мир. 1984. Т. 1. 6. Хьюи Дж. Неорганическая химия. Строение вещества и реакционная способность. М. , Химия, 1987. 7. Фичини Ж. , Ламброзо-Бадер Н. , Депезе Ж. -К. Основы физической химии. М. Мир. 1972. стр. 276 -283. 8. Дж. Кемпбел. Современная общая химия. М. : Мир. 1975 г. Т. 2. стр. 90. гл. 20. , Т 3. 9. Дикерсон Р. , Грей Г. , Хейт Дж. Основные законы химии. М. : Мир, 1982. Т. 2. 10. Б. Б. Дамаскин, О. А. Петрий. Электрохимия. М: Высшая школа, 1987. 11. CRC Hand book of Chemistry and Physics. 82 издание. 2001 -2002


