 Электрический ток в растворах и расплавах. Электролиз
Электрический ток в растворах и расплавах. Электролиз
 Электролиты – вещества, растворы и расплавы которых проводят электрический ток Примеры: р-ры солей р-ры кислот р-ры оснований
Электролиты – вещества, растворы и расплавы которых проводят электрический ток Примеры: р-ры солей р-ры кислот р-ры оснований
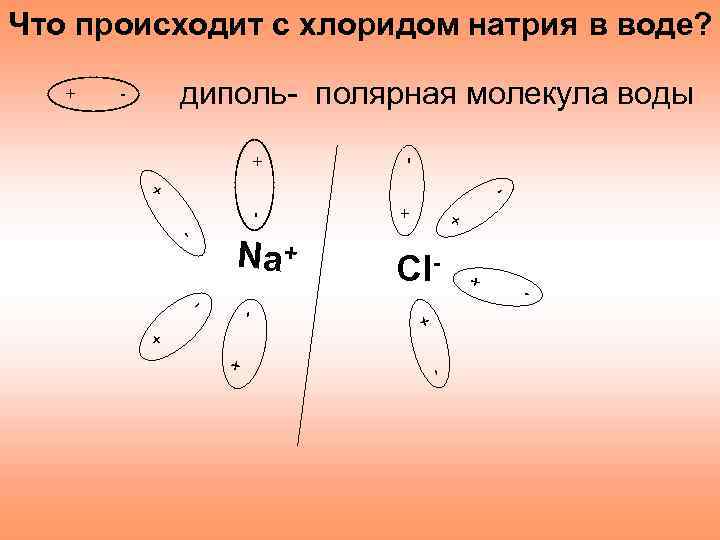 Что происходит с хлоридом натрия в воде? + - диполь- полярная молекула воды - - + Cl+ - - Na+ + + -
Что происходит с хлоридом натрия в воде? + - диполь- полярная молекула воды - - + Cl+ - - Na+ + + -
 - Распад электролита на ионы называется электролитической диссоциацией + + - + + + - Cl+ - - Na+ + + - - - Na+Cl- Na+ рекомбинация + Cl- + -
- Распад электролита на ионы называется электролитической диссоциацией + + - + + + - Cl+ - - Na+ + + - - - Na+Cl- Na+ рекомбинация + Cl- + -
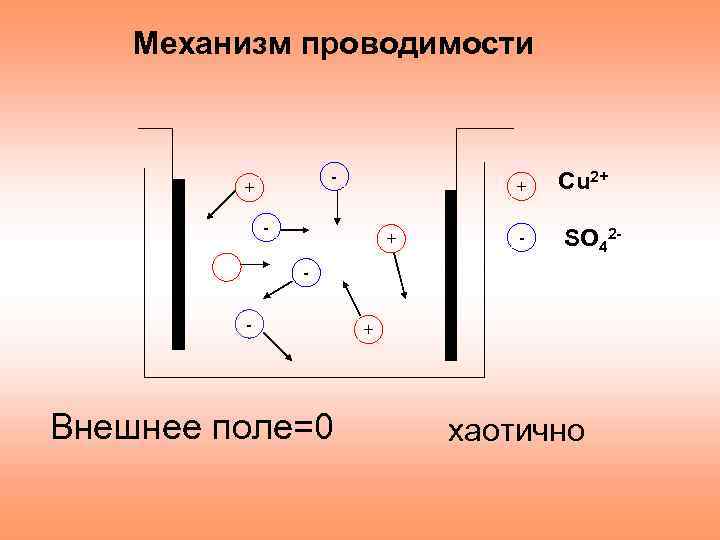 Механизм проводимости - + + - Сu 2+ SO 42 - - Внешнее поле=0 + хаотично
Механизм проводимости - + + - Сu 2+ SO 42 - - Внешнее поле=0 + хаотично
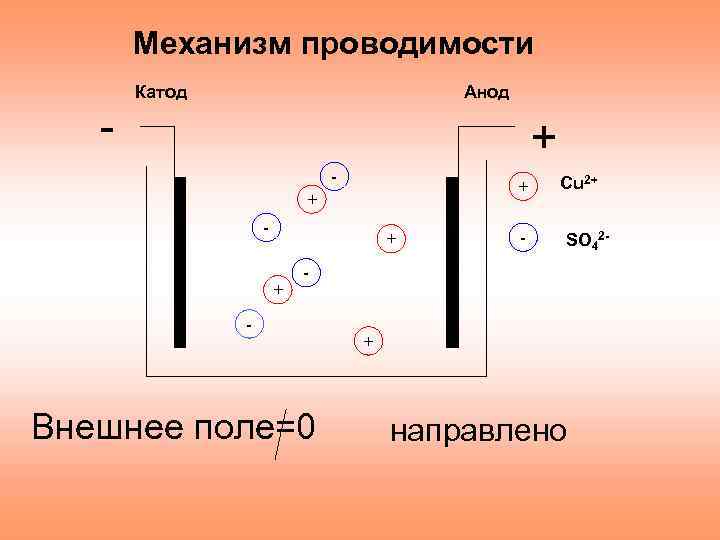 Механизм проводимости - Катод Анод + - + + - Сu 2+ SO 42 - - - Внешнее поле=0 + направлено
Механизм проводимости - Катод Анод + - + + - Сu 2+ SO 42 - - - Внешнее поле=0 + направлено
 Электрический ток в электролитеэто направленное движение положительных и отрицательных ионов
Электрический ток в электролитеэто направленное движение положительных и отрицательных ионов
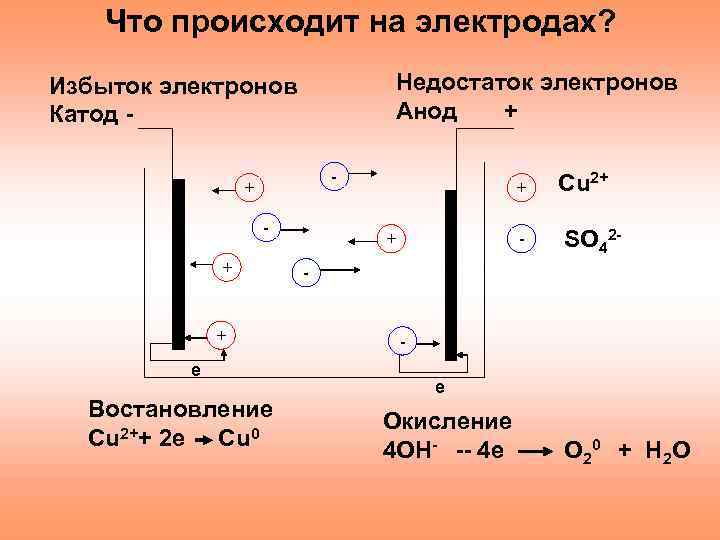 Что происходит на электродах? Недостаток электронов Анод + Избыток электронов Катод - + + + е Востановление Сu 2++ 2 e Cu 0 + + - Сu 2+ SO 42 - - е Окисление 4 OH- -- 4 e O 20 + H 2 O
Что происходит на электродах? Недостаток электронов Анод + Избыток электронов Катод - + + + е Востановление Сu 2++ 2 e Cu 0 + + - Сu 2+ SO 42 - - е Окисление 4 OH- -- 4 e O 20 + H 2 O
 Окислительно – восстановительные процессы под действием электрического тока называются электролизом
Окислительно – восстановительные процессы под действием электрического тока называются электролизом
 Закон электролиза был экспериментально установлен М. Фарадеем в 1832 году. Английский физик Майкл Фарадей родился в предместье Лондона в семье кузнеца. Окончив начальную школу, с двенадцати лет он работал разносчиком газет, а в 1804 г. поступил в ученики к переплетчику Рибо, всячески поощрявшем стремление Фарадея к самообразованию. Фарадея влекли главным образом естественные науки – химия и физика. В 1813 г. один из заказчиков подарил Фарадею пригласительные билеты на лекции Гемфри Дэви в Королевском институте, сыгравшие решающую роль в судьбе юноши. Фарадей с помощью Дэви получил место лабораторного ассистента в Королевском институте.
Закон электролиза был экспериментально установлен М. Фарадеем в 1832 году. Английский физик Майкл Фарадей родился в предместье Лондона в семье кузнеца. Окончив начальную школу, с двенадцати лет он работал разносчиком газет, а в 1804 г. поступил в ученики к переплетчику Рибо, всячески поощрявшем стремление Фарадея к самообразованию. Фарадея влекли главным образом естественные науки – химия и физика. В 1813 г. один из заказчиков подарил Фарадею пригласительные билеты на лекции Гемфри Дэви в Королевском институте, сыгравшие решающую роль в судьбе юноши. Фарадей с помощью Дэви получил место лабораторного ассистента в Королевском институте.
 Обобщенный закон электролиза: m= k q m= k I t Масса вещества, выделившегося на электроде, пропорциональна общему заряду, прошедшему через электролит K – электрохимический эквивалент (таб. величина) q –общий заряд Кл
Обобщенный закон электролиза: m= k q m= k I t Масса вещества, выделившегося на электроде, пропорциональна общему заряду, прошедшему через электролит K – электрохимический эквивалент (таб. величина) q –общий заряд Кл
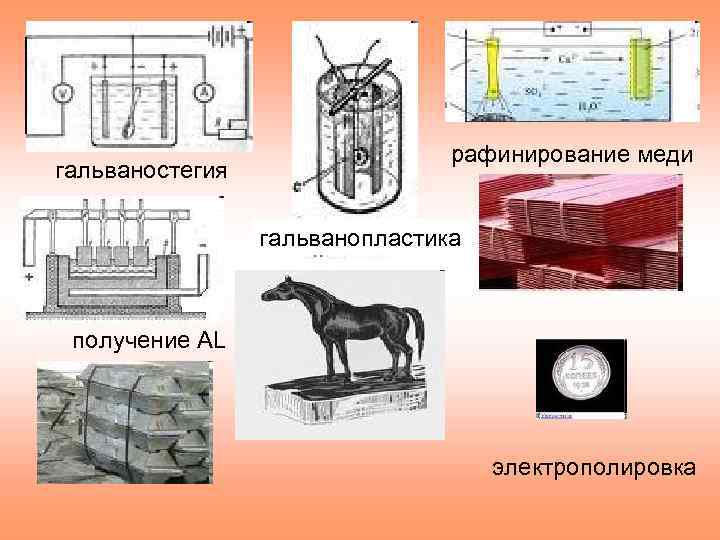 гальваностегия рафинирование меди гальванопластика получение AL электрополировка
гальваностегия рафинирование меди гальванопластика получение AL электрополировка
 Задачи 1. При серебрении изделия пользовались током 5 А в течение 15 мин. Какое количество серебра израсходовано за это время? 2. При каком токе протекал электролиз в растворе медного купороса, если за 5 мин на катоде выделилось 6 г меди? 3. Какой разряд должен пройти через раствор сернокислой меди, чтобы на катоде отложилось 6, 58 г меди? 4. За сколько времени полностью израсходуется медный анод, размеры которого 100*50*2 (мм 3), при условии. Что ток в ванне 3, 0 А? 5. Определите электрохимический эквивалент свинца, если за 5 часов электролиза при силе тока в 5 А на катоде выделилось 96. 66 г серебра
Задачи 1. При серебрении изделия пользовались током 5 А в течение 15 мин. Какое количество серебра израсходовано за это время? 2. При каком токе протекал электролиз в растворе медного купороса, если за 5 мин на катоде выделилось 6 г меди? 3. Какой разряд должен пройти через раствор сернокислой меди, чтобы на катоде отложилось 6, 58 г меди? 4. За сколько времени полностью израсходуется медный анод, размеры которого 100*50*2 (мм 3), при условии. Что ток в ванне 3, 0 А? 5. Определите электрохимический эквивалент свинца, если за 5 часов электролиза при силе тока в 5 А на катоде выделилось 96. 66 г серебра