экстракция.pptx
- Количество слайдов: 20
 Экстракция как метод разделения и определения в аналитической химии
Экстракция как метод разделения и определения в аналитической химии
 Классификации экстракционных процессов 1. Классификация В. В. Фомина (по типу используемого экстрагента) • Кислотные (катиоонообменные: карбоновые кислоты, фенолы, дипиразолонилметаны); • Основные (анионообменные: амины, простые эфиры, диантипирилметаны); • Нейтральные (координационные: тринитробутилфосфат (ТБФ), кетоны, эфиры).
Классификации экстракционных процессов 1. Классификация В. В. Фомина (по типу используемого экстрагента) • Кислотные (катиоонообменные: карбоновые кислоты, фенолы, дипиразолонилметаны); • Основные (анионообменные: амины, простые эфиры, диантипирилметаны); • Нейтральные (координационные: тринитробутилфосфат (ТБФ), кетоны, эфиры).
 2. Классификация Ю. А. Золотова и Н. М. Кузьмина (по характеру экстрагирующегося соединения) • Неионизованные соединения a) координационно несольватированные молекулярые галогениды, например, [Ge. Cl 4], [Asl 3], l. Hgl 2], [Os. O 4], [I 2], [Se. Br 4], и др. ; b) внутрикомплексные соединения – хелаты; c) координационно сольватированные нейтральные комплексы типа [UO 2(NO 3)2∙ 2 TБФ]. • Ионизованные соединения a) комплексные металлокислоты типа H+[Fe. Cl 4]- , H+[Cu. Cl 2]- и др. ; b) координационно несольватированные соли с объемными катионами анионами: As(C 6 H 5)4+- тетрафениларсоний Мn. O 4 - ; c) сильные кислоты (HNO 3, НСl. O 4), которые переходят в органическую фазу в виде ионных ассоциатов: HNO 3(B) + ТБФ → [ТБФ∙HN 03](о); d) гетерополисоединения, типа H 3[H 4 P(Mo 2 O 7)6]
2. Классификация Ю. А. Золотова и Н. М. Кузьмина (по характеру экстрагирующегося соединения) • Неионизованные соединения a) координационно несольватированные молекулярые галогениды, например, [Ge. Cl 4], [Asl 3], l. Hgl 2], [Os. O 4], [I 2], [Se. Br 4], и др. ; b) внутрикомплексные соединения – хелаты; c) координационно сольватированные нейтральные комплексы типа [UO 2(NO 3)2∙ 2 TБФ]. • Ионизованные соединения a) комплексные металлокислоты типа H+[Fe. Cl 4]- , H+[Cu. Cl 2]- и др. ; b) координационно несольватированные соли с объемными катионами анионами: As(C 6 H 5)4+- тетрафениларсоний Мn. O 4 - ; c) сильные кислоты (HNO 3, НСl. O 4), которые переходят в органическую фазу в виде ионных ассоциатов: HNO 3(B) + ТБФ → [ТБФ∙HN 03](о); d) гетерополисоединения, типа H 3[H 4 P(Mo 2 O 7)6]
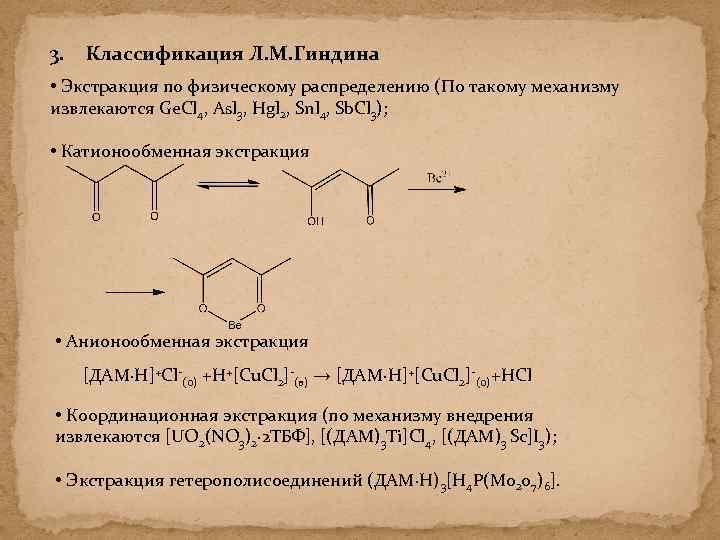 3. Классификация Л. М. Гиндина • Экстракция по физическому распределению (По такому механизму извлекаются Ge. Cl 4, Asl 3, Hgl 2, Snl 4, Sb. Cl 3); • Катионообменная экстракция • Анионообменная экстракция [ДАМ∙H]+Cl-(о) +H+[Cu. Cl 2]-(в) → [ДАМ∙H]+[Cu. Cl 2]-(о)+HCl • Координационная экстракция (по механизму внедрения извлекаются [UO 2(NO 3)2∙ 2 TБФ], [(ДАМ)3 Ti]Cl 4, [(ДАМ)3 Sc]I 3); • Экстракция гетерополисоединений (ДАМ∙Н)3[Н 4 Р(Мо 207)6].
3. Классификация Л. М. Гиндина • Экстракция по физическому распределению (По такому механизму извлекаются Ge. Cl 4, Asl 3, Hgl 2, Snl 4, Sb. Cl 3); • Катионообменная экстракция • Анионообменная экстракция [ДАМ∙H]+Cl-(о) +H+[Cu. Cl 2]-(в) → [ДАМ∙H]+[Cu. Cl 2]-(о)+HCl • Координационная экстракция (по механизму внедрения извлекаются [UO 2(NO 3)2∙ 2 TБФ], [(ДАМ)3 Ti]Cl 4, [(ДАМ)3 Sc]I 3); • Экстракция гетерополисоединений (ДАМ∙Н)3[Н 4 Р(Мо 207)6].
 Основные законы и количественные характеристики экстракции • Закон действия масс. Константа экстракции. UO 2 2+(В) + 2 NO 3(В) - + 2 ТБФ(0) <-> [UO 2(NO 3)2 ∙ 2 ТБФ] Kp= (o)
Основные законы и количественные характеристики экстракции • Закон действия масс. Константа экстракции. UO 2 2+(В) + 2 NO 3(В) - + 2 ТБФ(0) <-> [UO 2(NO 3)2 ∙ 2 ТБФ] Kp= (o)
 • Закон распределения и его современная формулировка Рассматриваемый закон утверждает, что при постоянной температуре и давлении в условиях равновесия отношение концентраций распределяющегося вещества в обеих фазах - величина постоянная, не зависящая от общей концентрации вещества, эта величина называется константой распределения KD. (П. Бертло, Е. Юнгфлейш, в 1872 г. ) у/х = KD Современная форма закона имеет вид α(о)/α(в)=K
• Закон распределения и его современная формулировка Рассматриваемый закон утверждает, что при постоянной температуре и давлении в условиях равновесия отношение концентраций распределяющегося вещества в обеих фазах - величина постоянная, не зависящая от общей концентрации вещества, эта величина называется константой распределения KD. (П. Бертло, Е. Юнгфлейш, в 1872 г. ) у/х = KD Современная форма закона имеет вид α(о)/α(в)=K
 • Коэффициент распределения и его связь со степенью извлечения Коэффициент распределения: D= Степень извлечения: * 100 R, %= *100 R, %= (1) (2) поделив выражение 2 на C(в) V(o) получаем R, %= (3) (4)
• Коэффициент распределения и его связь со степенью извлечения Коэффициент распределения: D= Степень извлечения: * 100 R, %= *100 R, %= (1) (2) поделив выражение 2 на C(в) V(o) получаем R, %= (3) (4)
 Способы осуществления экстракции
Способы осуществления экстракции
 Периодическая
Периодическая
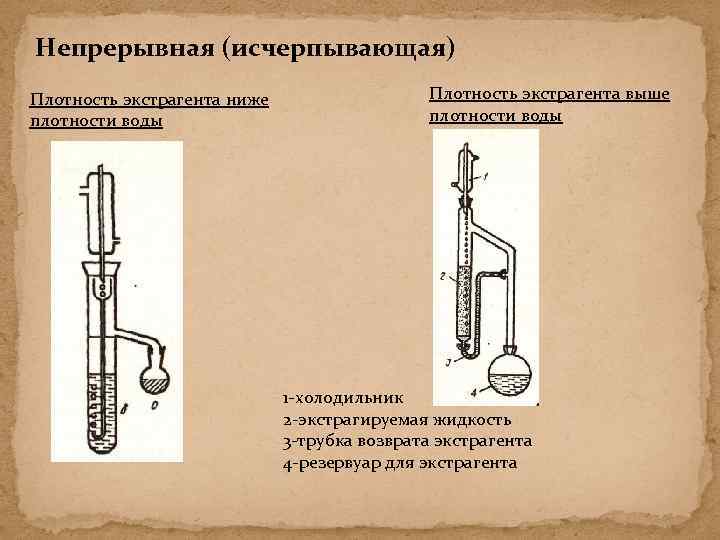 Непрерывная (исчерпывающая) Плотность экстрагента ниже плотности воды Плотность экстрагента выше плотности воды 1 -холодильник 2 -экстрагируемая жидкость 3 -трубка возврата экстрагента 4 -резервуар для экстрагента
Непрерывная (исчерпывающая) Плотность экстрагента ниже плотности воды Плотность экстрагента выше плотности воды 1 -холодильник 2 -экстрагируемая жидкость 3 -трубка возврата экстрагента 4 -резервуар для экстрагента
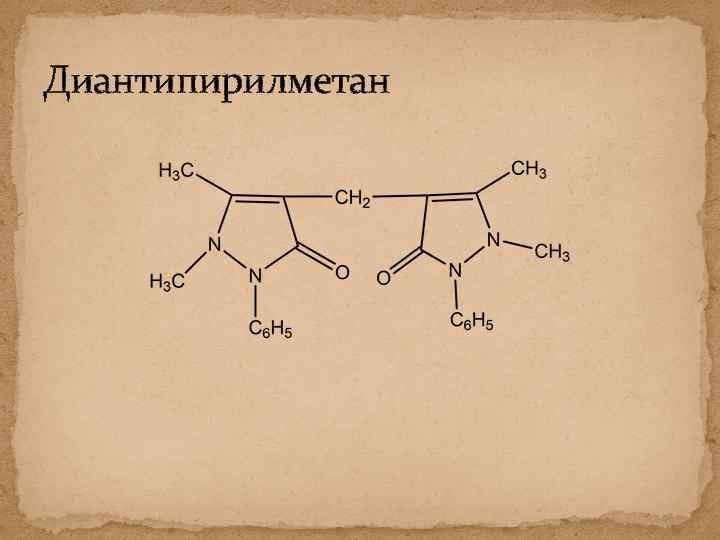 Диантипирилметан
Диантипирилметан
![[ДАМ∙H]Cl [ДАМ∙H]Cl](https://present5.com/presentation/44928319_137429967/image-12.jpg) [ДАМ∙H]Cl
[ДАМ∙H]Cl
 Выполнение эксперимента
Выполнение эксперимента
 Реактивы: HCl, 10 M NH 4 SCN, 30% NH 4 OH, 25% Аскорбиновая кислота Диметилглиоксим Растворы солей: Fe(III), Co(II), Cu(II), Ni(II); 0, 1 M ДАМ 0, 1 М в хлороформе
Реактивы: HCl, 10 M NH 4 SCN, 30% NH 4 OH, 25% Аскорбиновая кислота Диметилглиоксим Растворы солей: Fe(III), Co(II), Cu(II), Ni(II); 0, 1 M ДАМ 0, 1 М в хлороформе
![Извлечение железа (III) ДАМ + HCl [ДАМ∙H]+Cl-+H+[Fe. Cl 4]- → [ДАМ∙H]+[Fe. Cl 4]-+HCl [ДАМ∙H]+[Fe. Извлечение железа (III) ДАМ + HCl [ДАМ∙H]+Cl-+H+[Fe. Cl 4]- → [ДАМ∙H]+[Fe. Cl 4]-+HCl [ДАМ∙H]+[Fe.](https://present5.com/presentation/44928319_137429967/image-15.jpg) Извлечение железа (III) ДАМ + HCl [ДАМ∙H]+Cl-+H+[Fe. Cl 4]- → [ДАМ∙H]+[Fe. Cl 4]-+HCl [ДАМ∙H]+[Fe. Cl 4]- SCN- [Fe(SCN)4]-
Извлечение железа (III) ДАМ + HCl [ДАМ∙H]+Cl-+H+[Fe. Cl 4]- → [ДАМ∙H]+[Fe. Cl 4]-+HCl [ДАМ∙H]+[Fe. Cl 4]- SCN- [Fe(SCN)4]-
![Извлечение меди (II) H 2[Cu. Cl 4] C 6 H 8 O 6 H[Cu. Извлечение меди (II) H 2[Cu. Cl 4] C 6 H 8 O 6 H[Cu.](https://present5.com/presentation/44928319_137429967/image-16.jpg) Извлечение меди (II) H 2[Cu. Cl 4] C 6 H 8 O 6 H[Cu. Cl 2] [ДАМ∙H]+Cl- + H+ [Cu. Cl 2] - [O] [Cu(NH 3)6]2+ [ДАМ∙H]+ [Cu. Cl 2] - + HCl
Извлечение меди (II) H 2[Cu. Cl 4] C 6 H 8 O 6 H[Cu. Cl 2] [ДАМ∙H]+Cl- + H+ [Cu. Cl 2] - [O] [Cu(NH 3)6]2+ [ДАМ∙H]+ [Cu. Cl 2] - + HCl
![Извлечение кобальта (II) [ДАМ∙H]+Cl- + (NH 4)2[Co(SCN)4]2[ДАМ∙H]2[Co(SCN)4]+ 2 NH 4 Cl Извлечение кобальта (II) [ДАМ∙H]+Cl- + (NH 4)2[Co(SCN)4]2[ДАМ∙H]2[Co(SCN)4]+ 2 NH 4 Cl](https://present5.com/presentation/44928319_137429967/image-17.jpg) Извлечение кобальта (II) [ДАМ∙H]+Cl- + (NH 4)2[Co(SCN)4]2[ДАМ∙H]2[Co(SCN)4]+ 2 NH 4 Cl
Извлечение кобальта (II) [ДАМ∙H]+Cl- + (NH 4)2[Co(SCN)4]2[ДАМ∙H]2[Co(SCN)4]+ 2 NH 4 Cl
![Обнаружение никеля (II) [Ni(H 2 O)6]2+ C 4 H 8 N 2 O 2 Обнаружение никеля (II) [Ni(H 2 O)6]2+ C 4 H 8 N 2 O 2](https://present5.com/presentation/44928319_137429967/image-18.jpg) Обнаружение никеля (II) [Ni(H 2 O)6]2+ C 4 H 8 N 2 O 2
Обнаружение никеля (II) [Ni(H 2 O)6]2+ C 4 H 8 N 2 O 2
 Применение экстракции Ядерная технология Разделение многокомпонентных смесей Изучения равновесий, процессов комплексообразования и состояния веществ в растворах
Применение экстракции Ядерная технология Разделение многокомпонентных смесей Изучения равновесий, процессов комплексообразования и состояния веществ в растворах
 Достоинства Экспрессность и простота Универсальность Возможность извлечения малых количеств элементов Возможность разделения сложных многокомпонентных смесей Обеспечивает высокую эффективность концентрирования Не образует примесей и побочных продуктов. Недостатки Использование для элементов токсичных растворителей, огнеопасных, летучих Трудное отделение экстракционного реагента от разбавителя.
Достоинства Экспрессность и простота Универсальность Возможность извлечения малых количеств элементов Возможность разделения сложных многокомпонентных смесей Обеспечивает высокую эффективность концентрирования Не образует примесей и побочных продуктов. Недостатки Использование для элементов токсичных растворителей, огнеопасных, летучих Трудное отделение экстракционного реагента от разбавителя.


