ХиТРРЭ_о_С.ppt
- Количество слайдов: 14
 экстракция Экстракция – процесс селективного извлечения ценного компонента из водной фазы в органическую за счет образования с органическим реагентом комплексных соединений или сольватов. Обязательным условием протекания экстракции – несмешивание водной и органической фаз.
экстракция Экстракция – процесс селективного извлечения ценного компонента из водной фазы в органическую за счет образования с органическим реагентом комплексных соединений или сольватов. Обязательным условием протекания экстракции – несмешивание водной и органической фаз.
 Задачи, решаемые экстракцией. • Избирательное извлечение целевого компонента, даже при малых его концентрациях, при этом, регулируя соотношение объемов органической и водной фаз можно многократно его сконцентрировать. • Глубокая очистка целевого компонента от примесей. • Разделение близких по свойствам металлов (цирконий и гафний; тантал и ниобий; редкоземельные элементы и т. д. ). • В аналитической химии экстракция может использоваться как метод экспресс анализа и как метод концентрирования при анализе высокочистых материалов на примеси.
Задачи, решаемые экстракцией. • Избирательное извлечение целевого компонента, даже при малых его концентрациях, при этом, регулируя соотношение объемов органической и водной фаз можно многократно его сконцентрировать. • Глубокая очистка целевого компонента от примесей. • Разделение близких по свойствам металлов (цирконий и гафний; тантал и ниобий; редкоземельные элементы и т. д. ). • В аналитической химии экстракция может использоваться как метод экспресс анализа и как метод концентрирования при анализе высокочистых материалов на примеси.
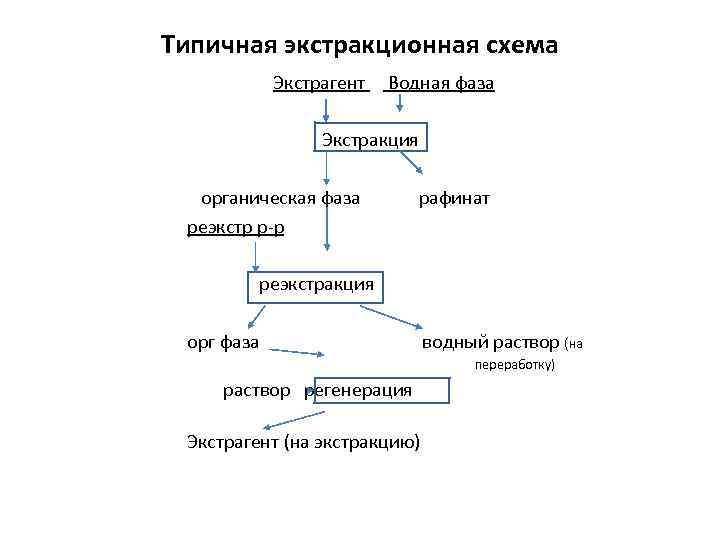 Типичная экстракционная схема Экстрагент Водная фаза Экстракция органическая фаза реэкстр р-р рафинат реэкстракция орг фаза водный раствор (на переработку) раствор регенерация Экстрагент (на экстракцию)
Типичная экстракционная схема Экстрагент Водная фаза Экстракция органическая фаза реэкстр р-р рафинат реэкстракция орг фаза водный раствор (на переработку) раствор регенерация Экстрагент (на экстракцию)
 Основные понятия 1. Экстрагент - органическое соединение способное образовывать с ценным компонентом комплексное соединение или сольват. 2. Разбавитель – органическое соединение в котором растворяют экстрагент. Основное свойство должна быть химическая инертность по отношению к ценному компоненту 3. Процесс обратный экстракции – реэкстракция.
Основные понятия 1. Экстрагент - органическое соединение способное образовывать с ценным компонентом комплексное соединение или сольват. 2. Разбавитель – органическое соединение в котором растворяют экстрагент. Основное свойство должна быть химическая инертность по отношению к ценному компоненту 3. Процесс обратный экстракции – реэкстракция.
 Количественные характеристики 1. Коэффициент распределения (D) - отношение аналитической концентрации распределяющегося вещества в органической фазе (у) к его аналитической концентрации в водной фазе (х): D = y/x. 2. Коэффициентом разделения -отношение коэффициентов распределения двух веществ: 1/2 = D 1/D 2 (D 1>D 2; 1/2>1) 3. Степень извлечения (Е, %): Е= Go /Gисх = y. V 0/( y. V 0+x. Vв)= D/(D+Vв/V 0) если VO = VB; то E = D. 100/(D + 1)
Количественные характеристики 1. Коэффициент распределения (D) - отношение аналитической концентрации распределяющегося вещества в органической фазе (у) к его аналитической концентрации в водной фазе (х): D = y/x. 2. Коэффициентом разделения -отношение коэффициентов распределения двух веществ: 1/2 = D 1/D 2 (D 1>D 2; 1/2>1) 3. Степень извлечения (Е, %): Е= Go /Gисх = y. V 0/( y. V 0+x. Vв)= D/(D+Vв/V 0) если VO = VB; то E = D. 100/(D + 1)
 Основные принципы извлечения из водной фазы в органическую Заряженным ионам энергетически невыгоден переход из сильно полярной высокоупорядочненной фазы (водного раствора) в органическую фазу. Для такого перехода необходима предварительная нейтрализация заряда за счет образования незаряженных соединений(комплексов или ионных ассоциатов). Кроме этого необходимо полное или частичное освобождение от гидратной оболочки – дегидратация. Это становится возможным : • при введении в систему высаливателей или комплексообразователей; • присоединении к экстрагируемому катиону органического аниона; • присоединении к экстрагируемому аниону органического катиона; • при замене воды в аквакомплексе на незаряженный органический лиганд.
Основные принципы извлечения из водной фазы в органическую Заряженным ионам энергетически невыгоден переход из сильно полярной высокоупорядочненной фазы (водного раствора) в органическую фазу. Для такого перехода необходима предварительная нейтрализация заряда за счет образования незаряженных соединений(комплексов или ионных ассоциатов). Кроме этого необходимо полное или частичное освобождение от гидратной оболочки – дегидратация. Это становится возможным : • при введении в систему высаливателей или комплексообразователей; • присоединении к экстрагируемому катиону органического аниона; • присоединении к экстрагируемому аниону органического катиона; • при замене воды в аквакомплексе на незаряженный органический лиганд.
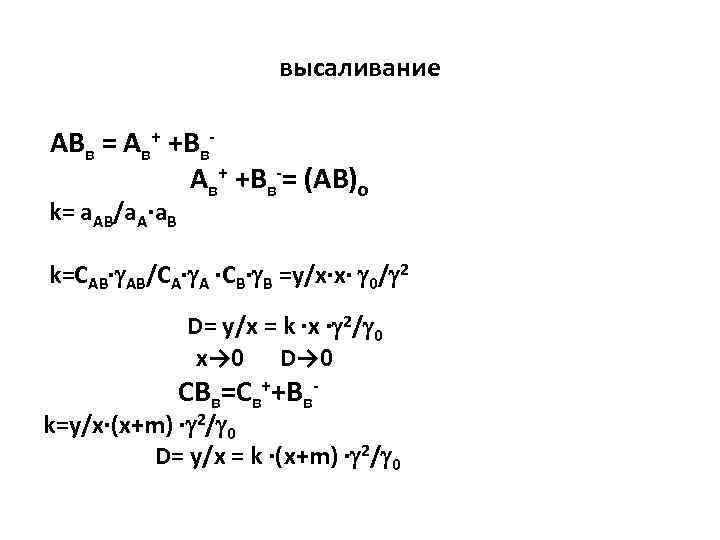 высаливание ABв = Aв+ +Bв-= (AB)o k= a. AB/a. A·a. B k=CAB· AB/CA· A ·CB· B =y/x·x· 0/ 2 D= y/x = k ·x · 2/ 0 x→ 0 D→ 0 CBв=Cв++Bв- k=y/x·(x+m) · 2/ 0 D= y/x = k ·(x+m) · 2/ 0
высаливание ABв = Aв+ +Bв-= (AB)o k= a. AB/a. A·a. B k=CAB· AB/CA· A ·CB· B =y/x·x· 0/ 2 D= y/x = k ·x · 2/ 0 x→ 0 D→ 0 CBв=Cв++Bв- k=y/x·(x+m) · 2/ 0 D= y/x = k ·(x+m) · 2/ 0
 высаливатель • • • Действия одноименного иона Изменения коэффициентов активностей. Из уравнения видно, что введение высаливателя должно увеличить коэффициент активности в водной фазе. Третье действие высаливателя на экстракционную систему заключается в том, что введение в систему высаливателя способствует образованию недиссоциированных молекул, т. е. способствует процессу дегидратации.
высаливатель • • • Действия одноименного иона Изменения коэффициентов активностей. Из уравнения видно, что введение высаливателя должно увеличить коэффициент активности в водной фазе. Третье действие высаливателя на экстракционную систему заключается в том, что введение в систему высаливателя способствует образованию недиссоциированных молекул, т. е. способствует процессу дегидратации.
 Типы экстрагентов и механизмы экстракции Нейтральные экстрагенты. Спирты Cn. H 2 n+1 OH , где n = 7 -9 Простые эфиры C 2 H 5 -O-C 2 H 5 Сложные эфиры Кетоны RC R - C - R 1 O OR 1 O Сульфоксид R 2 SO Трибутилфосфат R-O R - O - P = O, где R - C 4 H 9 R-O
Типы экстрагентов и механизмы экстракции Нейтральные экстрагенты. Спирты Cn. H 2 n+1 OH , где n = 7 -9 Простые эфиры C 2 H 5 -O-C 2 H 5 Сложные эфиры Кетоны RC R - C - R 1 O OR 1 O Сульфоксид R 2 SO Трибутилфосфат R-O R - O - P = O, где R - C 4 H 9 R-O
![Координационный механизм: ROо - + Kвn+ + Aвn- = [RO K]Aо а) сольватный q. Координационный механизм: ROо - + Kвn+ + Aвn- = [RO K]Aо а) сольватный q.](https://present5.com/presentation/7842578_438292231/image-10.jpg) Координационный механизм: ROо - + Kвn+ + Aвn- = [RO K]Aо а) сольватный q. ROо - + Мвn+ + Aвn- = [М·q. RО]Aо б) гидратносольватный q. ROо - + Н 3 Ов++3 Н 2 О + Aв- = [Н 9 О 4·q. RО]Aо в) оксониевый q. ROо - + Нв++ Aв- = НA·q. RОо
Координационный механизм: ROо - + Kвn+ + Aвn- = [RO K]Aо а) сольватный q. ROо - + Мвn+ + Aвn- = [М·q. RО]Aо б) гидратносольватный q. ROо - + Н 3 Ов++3 Н 2 О + Aв- = [Н 9 О 4·q. RО]Aо в) оксониевый q. ROо - + Нв++ Aв- = НA·q. RОо
![Сольватный механизм q. ROо - + Мвn+ + Aвn- = [М·q. RО]Aо k = Сольватный механизм q. ROо - + Мвn+ + Aвn- = [М·q. RО]Aо k =](https://present5.com/presentation/7842578_438292231/image-11.jpg) Сольватный механизм q. ROо - + Мвn+ + Aвn- = [М·q. RО]Aо k = C [М·q. RО]A /CROq·CM·CA D = k· CROq· CA
Сольватный механизм q. ROо - + Мвn+ + Aвn- = [М·q. RО]Aо k = C [М·q. RО]A /CROq·CM·CA D = k· CROq· CA
 Катионообменные экстрагенты монокарбоновые кислоты Cn. H 2 n+1 COOH версатовые кислоты СН 3 R 1 - C – COOH алкилфосфорные кислоты Д 2 ЭГФК RO RO – P = O НO R 2
Катионообменные экстрагенты монокарбоновые кислоты Cn. H 2 n+1 COOH версатовые кислоты СН 3 R 1 - C – COOH алкилфосфорные кислоты Д 2 ЭГФК RO RO – P = O НO R 2
 Катионообменный механизм Mn+ (B) + n/2(HR)2 (O) = MRn (O) + n. H+ (B) lg. D=lgk+n/2 lg. CHR –nlg. CH= lgk+n/2 lg. CHR+np. H
Катионообменный механизм Mn+ (B) + n/2(HR)2 (O) = MRn (O) + n. H+ (B) lg. D=lgk+n/2 lg. CHR –nlg. CH= lgk+n/2 lg. CHR+np. H
 Анионообменные экстрагенты Первичные амины RH 2 N Вторичные амины R 2 HN Третичные амины R 3 N Четвертичные аммониевые основания R 4 NOH R 2 HNo +HClв = [R 2 HNH]Clo
Анионообменные экстрагенты Первичные амины RH 2 N Вторичные амины R 2 HN Третичные амины R 3 N Четвертичные аммониевые основания R 4 NOH R 2 HNo +HClв = [R 2 HNH]Clo


