Лекция No.12.pptx
- Количество слайдов: 91
 Экспериментальные методы исследований доктор физико-математических наук Власова Ольга Леонардовна Санкт-Петербург
Экспериментальные методы исследований доктор физико-математических наук Власова Ольга Леонардовна Санкт-Петербург
 Ионизирующее излучение – это потоки частиц и электромагнитных квантов, взаимодействие которых со средой приводит к ионизации её атомов и молекул. Ионизирующим излучением являются рентгеновское и -излучение, потоки частиц, электронов, позитронов, протонов, нейтронов.
Ионизирующее излучение – это потоки частиц и электромагнитных квантов, взаимодействие которых со средой приводит к ионизации её атомов и молекул. Ионизирующим излучением являются рентгеновское и -излучение, потоки частиц, электронов, позитронов, протонов, нейтронов.
 Рентге новское излуче ние — электромагнитные волны, энергия фотонов которых лежит на шкале электромагнитных волн между ультрафиолетовым излучением и гамма-излучением, что соответствует длинам волн от 10− 2 до 103 Å (от 10− 12 до 10− 7 м)
Рентге новское излуче ние — электромагнитные волны, энергия фотонов которых лежит на шкале электромагнитных волн между ультрафиолетовым излучением и гамма-излучением, что соответствует длинам волн от 10− 2 до 103 Å (от 10− 12 до 10− 7 м)
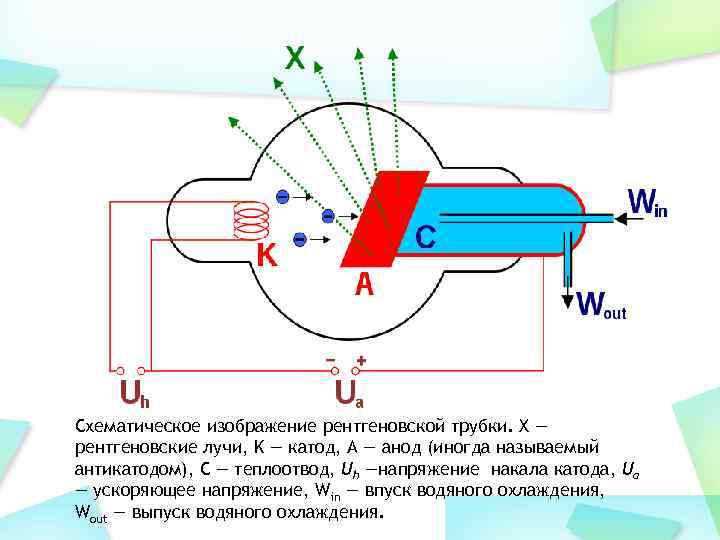 Схематическое изображение рентгеновской трубки. X — рентгеновские лучи, K — катод, А — анод (иногда называемый антикатодом), С — теплоотвод, Uh —напряжение накала катода, Ua — ускоряющее напряжение, Win — впуск водяного охлаждения, Wout — выпуск водяного охлаждения.
Схематическое изображение рентгеновской трубки. X — рентгеновские лучи, K — катод, А — анод (иногда называемый антикатодом), С — теплоотвод, Uh —напряжение накала катода, Ua — ускоряющее напряжение, Win — впуск водяного охлаждения, Wout — выпуск водяного охлаждения.

 Рентгеновское излучение можно получать также и на ускорителях заряженных частиц. Так называемое синхротронное излучение возникает при отклонении пучка частиц в магнитном поле, в результате чего они испытывают ускорение в направлении, перпендикулярном их движению. Синхротронное излучение имеет сплошной спектр с верхней границей. При соответствующим образом выбранных параметрах (величина магнитного поля и энергия частиц) в спектре синхротронного излучения можно получить и рентгеновские лучи.
Рентгеновское излучение можно получать также и на ускорителях заряженных частиц. Так называемое синхротронное излучение возникает при отклонении пучка частиц в магнитном поле, в результате чего они испытывают ускорение в направлении, перпендикулярном их движению. Синхротронное излучение имеет сплошной спектр с верхней границей. При соответствующим образом выбранных параметрах (величина магнитного поля и энергия частиц) в спектре синхротронного излучения можно получить и рентгеновские лучи.
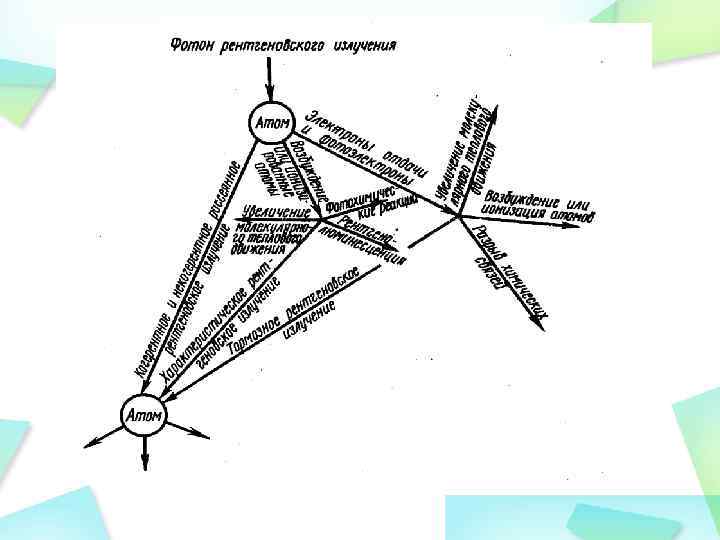
 Действие рентгеновского излучения на вещество определяется первичными процессами взаимодействия рентгеновского фотона с электронами атомов и молекул вещества. Рентгеновское излучение в веществе поглощается и рассеивается. При этом могут происходить различные процессы, которые определяются соотношением энергии рентгеновского фотона hν и энергии ионизации Аи (энергия ионизации Аи – энергия, необходимая для удаления электрона за пределы атома или молекулы).
Действие рентгеновского излучения на вещество определяется первичными процессами взаимодействия рентгеновского фотона с электронами атомов и молекул вещества. Рентгеновское излучение в веществе поглощается и рассеивается. При этом могут происходить различные процессы, которые определяются соотношением энергии рентгеновского фотона hν и энергии ионизации Аи (энергия ионизации Аи – энергия, необходимая для удаления электрона за пределы атома или молекулы).
 1). Энергия рентгеновского фотона hν <Аи(длинноволновое R-излучение). В этом случае имеет место когерентное рассеяние (рассеяние без изменения частоты). При этом у фотонов вследствие взаимодействия с электронами вещества изменяется только направление движения (рис. 1, а), а энергия и длина волны остаются теми же. Когерентное рассеяние не влияет на биологические объекты, но при создании защиты от рентгеновского излучения следует учитывать возможность изменения первичного направления распространения рентгеновых лучей.
1). Энергия рентгеновского фотона hν <Аи(длинноволновое R-излучение). В этом случае имеет место когерентное рассеяние (рассеяние без изменения частоты). При этом у фотонов вследствие взаимодействия с электронами вещества изменяется только направление движения (рис. 1, а), а энергия и длина волны остаются теми же. Когерентное рассеяние не влияет на биологические объекты, но при создании защиты от рентгеновского излучения следует учитывать возможность изменения первичного направления распространения рентгеновых лучей.
 2). Если фотон поглощается веществом, но его энергии недостаточно для отрыва электрона, то происходит возбуждение атома или молекулы (рис. 1, б). Это часто приводит к последующему излучению фотона в области видимого света (рентгенолюминесценция). Фотоэффект происходит тогда, когда hν ≥ Аи. при этом фотон поглощается и электрон отрывается от атома вещества (рис. 1, в). Происходит ионизация. Оторвавшийся электрон приобретает кинетическую энергию Eк = – Aи. Если эта энергия больше Аи, то электрон может ионизировать соседние атомы (вторичная ионизация).
2). Если фотон поглощается веществом, но его энергии недостаточно для отрыва электрона, то происходит возбуждение атома или молекулы (рис. 1, б). Это часто приводит к последующему излучению фотона в области видимого света (рентгенолюминесценция). Фотоэффект происходит тогда, когда hν ≥ Аи. при этом фотон поглощается и электрон отрывается от атома вещества (рис. 1, в). Происходит ионизация. Оторвавшийся электрон приобретает кинетическую энергию Eк = – Aи. Если эта энергия больше Аи, то электрон может ионизировать соседние атомы (вторичная ионизация).
 3). Некогерентное рассеяние (эффект Комптона) происходит тогда, когда энергия фотона намного больше энергии ионизации: hν» Аи. При этом электрон выбивается из атома (такие электроны называются электронами отдачи), приобретая кинетическую энергию Eк, и образуются рассеянный рентгеновский фотон с меньшей энергией (hν/) (рис. 1, г): hν= hν/ +Аи+Ек Образующееся таким образом рентгеновское излучение меньшей частоты называется вторичным. Вторичные рентгеновские фотоны с энергией hν >Аи и электроны отдачи также могут вызывать дальнейшую ионизацию вещества, в котором они распространяются. Отрыв от атома электронов внутренних оболочек при ионизации приводит к образованию фотонов характеристического излучения, тоже вызывающих последующую ионизацию.
3). Некогерентное рассеяние (эффект Комптона) происходит тогда, когда энергия фотона намного больше энергии ионизации: hν» Аи. При этом электрон выбивается из атома (такие электроны называются электронами отдачи), приобретая кинетическую энергию Eк, и образуются рассеянный рентгеновский фотон с меньшей энергией (hν/) (рис. 1, г): hν= hν/ +Аи+Ек Образующееся таким образом рентгеновское излучение меньшей частоты называется вторичным. Вторичные рентгеновские фотоны с энергией hν >Аи и электроны отдачи также могут вызывать дальнейшую ионизацию вещества, в котором они распространяются. Отрыв от атома электронов внутренних оболочек при ионизации приводит к образованию фотонов характеристического излучения, тоже вызывающих последующую ионизацию.
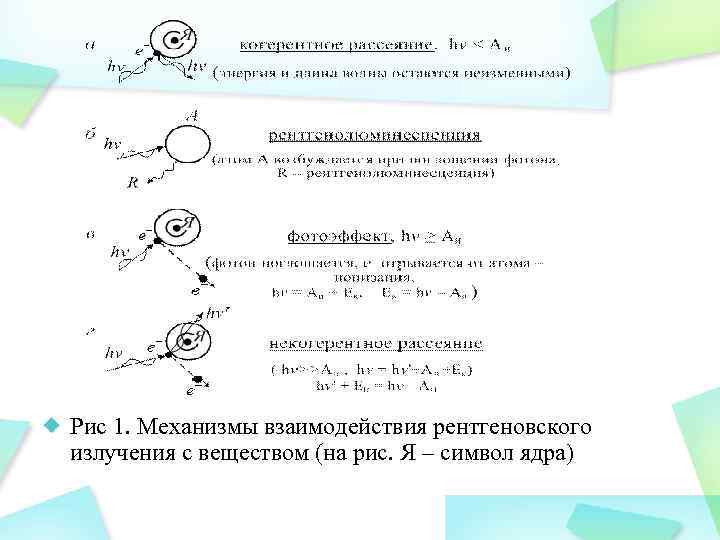 Рис 1. Механизмы взаимодействия рентгеновского излучения с веществом (на рис. Я – символ ядра)
Рис 1. Механизмы взаимодействия рентгеновского излучения с веществом (на рис. Я – символ ядра)
 При падении рентгеновского излучения на вещество оно незначительно отражается от его поверхности, а в основном проходит вглубь, при этом частично поглощается и рассеивается, частично проходит насквозь. В веществе поток рентгеновского излучения ослабляется по закону: Ф=Ф 0 е─ ·x здесь – линейный коэффициент ослабления, который существенно зависит от плотности вещества. Он равен сумме трех слагаемых, соответствующих когерентному рассеянию 1, некогерентному рассеянию 2 и фотоэффекту 3 : = 1+ 2+ 3
При падении рентгеновского излучения на вещество оно незначительно отражается от его поверхности, а в основном проходит вглубь, при этом частично поглощается и рассеивается, частично проходит насквозь. В веществе поток рентгеновского излучения ослабляется по закону: Ф=Ф 0 е─ ·x здесь – линейный коэффициент ослабления, который существенно зависит от плотности вещества. Он равен сумме трех слагаемых, соответствующих когерентному рассеянию 1, некогерентному рассеянию 2 и фотоэффекту 3 : = 1+ 2+ 3
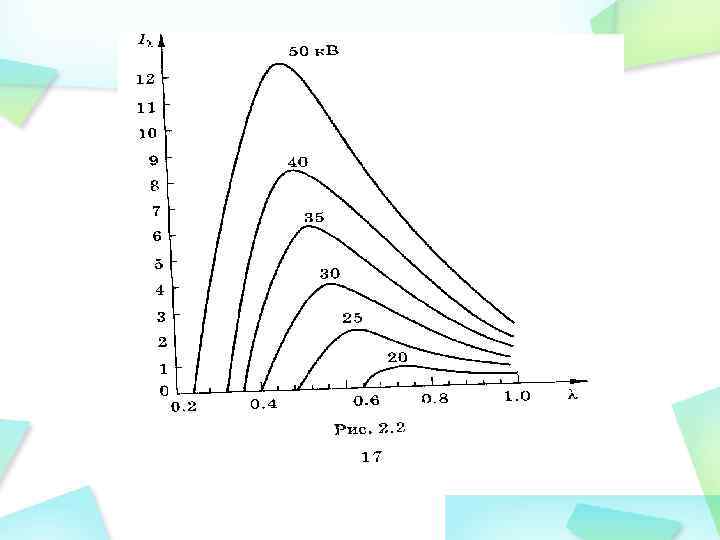
 При рентгенодиагностике используется рентгеновское излучение с энергией фотонов от 60 до 100 -120 кэ. В. Определяющими процессами являются фото- и Комптон- эффекты. Кроме линейного вводится также массовый коэффициент ослабления, который не зависит от плотности вещества ρ : m= /ρ. Массовый коэффициент ослабления зависит от длины волны излучения λ и от атомного номера вещества -поглотителя: m=kλ 3 Z 3 = m ρ =kλ 3 Z 3ρ Из приведенных формул следует, что различные ткани человеческого по-разному ослабляют рентгеновское излучение. Это позволяет в теневой проекции на флюоресцирующем экране или фотопленке, на экране компьютера видеть изображение внутренних органов. Для справки: массовые коэффициенты ослабления кости и мягкой ткани (воды) отличаются в 68 раз: m кости/ m воды = 68. Линейные коэффициенты ослабления еще в большей степени различаются между собой. Именно на этом основана рентгенодиагностика.
При рентгенодиагностике используется рентгеновское излучение с энергией фотонов от 60 до 100 -120 кэ. В. Определяющими процессами являются фото- и Комптон- эффекты. Кроме линейного вводится также массовый коэффициент ослабления, который не зависит от плотности вещества ρ : m= /ρ. Массовый коэффициент ослабления зависит от длины волны излучения λ и от атомного номера вещества -поглотителя: m=kλ 3 Z 3 = m ρ =kλ 3 Z 3ρ Из приведенных формул следует, что различные ткани человеческого по-разному ослабляют рентгеновское излучение. Это позволяет в теневой проекции на флюоресцирующем экране или фотопленке, на экране компьютера видеть изображение внутренних органов. Для справки: массовые коэффициенты ослабления кости и мягкой ткани (воды) отличаются в 68 раз: m кости/ m воды = 68. Линейные коэффициенты ослабления еще в большей степени различаются между собой. Именно на этом основана рентгенодиагностика.
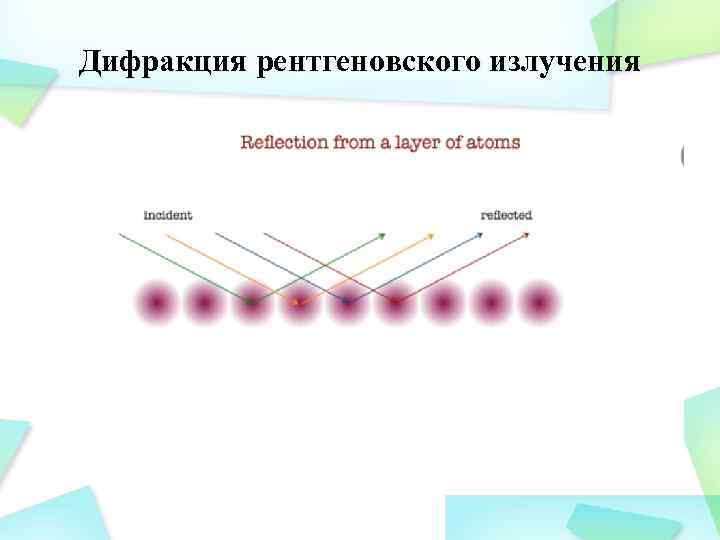
 Рентгеноструктурный анализ наряду с нейтронографией и электронографией является дифракционным структурным методом. В его основе лежит взаимодействие рентгеновского излучения с электронами вещества, в результате которого возникает дифракция рентгеновых лучей. Дифракция рентгеновых лучей - рассеяние рентгеновых лучей кристаллами (или молекулами жидкостей и газов), при котором из начального пучка лучей возникают вторичные отклонённые пучки той же длины волны, появившиеся в результате взаимодействия первичных рентгеновых лучей с электронами вещества; направление и интенсивность вторичных пучков зависят от строения рассеивающего объекта. Дифракционная картина зависит от длины волны используемых рентгеновых лучей и строения объекта. Для исследования атомной структуры применяют излучение с длиной волны 1 Å , т. е. порядка размеров атомов.
Рентгеноструктурный анализ наряду с нейтронографией и электронографией является дифракционным структурным методом. В его основе лежит взаимодействие рентгеновского излучения с электронами вещества, в результате которого возникает дифракция рентгеновых лучей. Дифракция рентгеновых лучей - рассеяние рентгеновых лучей кристаллами (или молекулами жидкостей и газов), при котором из начального пучка лучей возникают вторичные отклонённые пучки той же длины волны, появившиеся в результате взаимодействия первичных рентгеновых лучей с электронами вещества; направление и интенсивность вторичных пучков зависят от строения рассеивающего объекта. Дифракционная картина зависит от длины волны используемых рентгеновых лучей и строения объекта. Для исследования атомной структуры применяют излучение с длиной волны 1 Å , т. е. порядка размеров атомов.
 Наиболее успешно этот метод применяют для установления атомной структуры кристаллических тел. Это обусловлено тем, что кристаллы обладают строгой периодичностью строения и представляют собой созданную самой природой дифракционную решётку для рентгеновых лучей. Очень активно развивается белковая кристаллография – рентгеноструктурный анализ кристаллов белков. Выяснение пространственной организации белков – одно из основных направлений современной биохимии. Во многих случаях знание структуры белка и его комплекса с ингибиторами является решающим фактором при создании лекарственных препаратов.
Наиболее успешно этот метод применяют для установления атомной структуры кристаллических тел. Это обусловлено тем, что кристаллы обладают строгой периодичностью строения и представляют собой созданную самой природой дифракционную решётку для рентгеновых лучей. Очень активно развивается белковая кристаллография – рентгеноструктурный анализ кристаллов белков. Выяснение пространственной организации белков – одно из основных направлений современной биохимии. Во многих случаях знание структуры белка и его комплекса с ингибиторами является решающим фактором при создании лекарственных препаратов.
 Одним из важнейших экспериментальных методов, позволяющих с атомарной точностью узнать, что представляет собой трехмерная структура белка, т. е. определить пространственные координаты всех атомов исследуемого объекта, является рентгеноструктурный, или кристаллографический, анализ. Зная положение каждого атома, можно вычислить межатомные расстояния, валентные углы, углы вращения вокруг связей, распределение поверхностного заряда и другие детали молекулярной геометрии.
Одним из важнейших экспериментальных методов, позволяющих с атомарной точностью узнать, что представляет собой трехмерная структура белка, т. е. определить пространственные координаты всех атомов исследуемого объекта, является рентгеноструктурный, или кристаллографический, анализ. Зная положение каждого атома, можно вычислить межатомные расстояния, валентные углы, углы вращения вокруг связей, распределение поверхностного заряда и другие детали молекулярной геометрии.
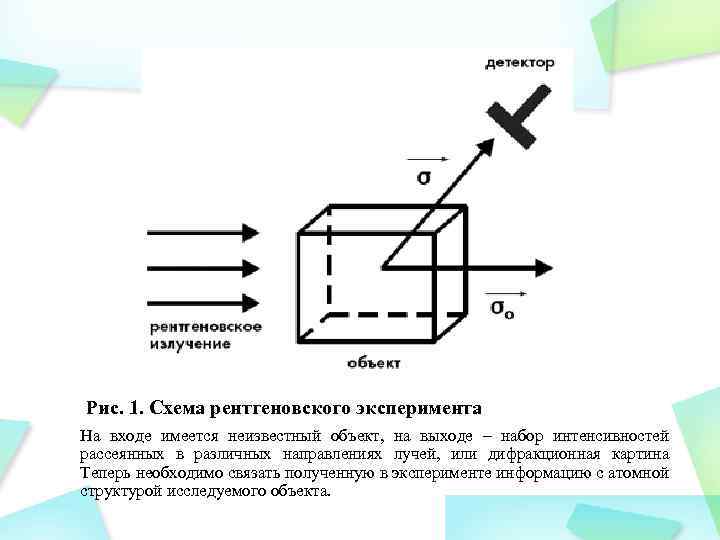 Рис. 1. Схема рентгеновского эксперимента На входе имеется неизвестный объект, на выходе – набор интенсивностей рассеянных в различных направлениях лучей, или дифракционная картина Теперь необходимо связать полученную в эксперименте информацию с атомной структурой исследуемого объекта.
Рис. 1. Схема рентгеновского эксперимента На входе имеется неизвестный объект, на выходе – набор интенсивностей рассеянных в различных направлениях лучей, или дифракционная картина Теперь необходимо связать полученную в эксперименте информацию с атомной структурой исследуемого объекта.
 Основные положения, на которых строится простейшая математическая модель рассеяния рентгеновых лучей: 1) пучок рентгеновых лучей является плоской монохроматической электромагнитной волной; 2) под воздействием этой электромагнитной волны каждый электрон приходит в движение, которое может быть описано уравнениями для свободных зарядов; 3) движущийся электрон является, в свою очередь, источником новой рассеянной сферической электромагнитной волны, распространяющейся во всех направлениях; 4) эти новые волны суммируются и определяют интенсивность излучения в интересующем нас направлении.
Основные положения, на которых строится простейшая математическая модель рассеяния рентгеновых лучей: 1) пучок рентгеновых лучей является плоской монохроматической электромагнитной волной; 2) под воздействием этой электромагнитной волны каждый электрон приходит в движение, которое может быть описано уравнениями для свободных зарядов; 3) движущийся электрон является, в свою очередь, источником новой рассеянной сферической электромагнитной волны, распространяющейся во всех направлениях; 4) эти новые волны суммируются и определяют интенсивность излучения в интересующем нас направлении.
 Рис. 3. В дифракционной картине заключена вся информация о структуре белка Из данных рентгенограммы можно получить карту распределения электронной плотности (r) в кристалле исследуемого объекта.
Рис. 3. В дифракционной картине заключена вся информация о структуре белка Из данных рентгенограммы можно получить карту распределения электронной плотности (r) в кристалле исследуемого объекта.
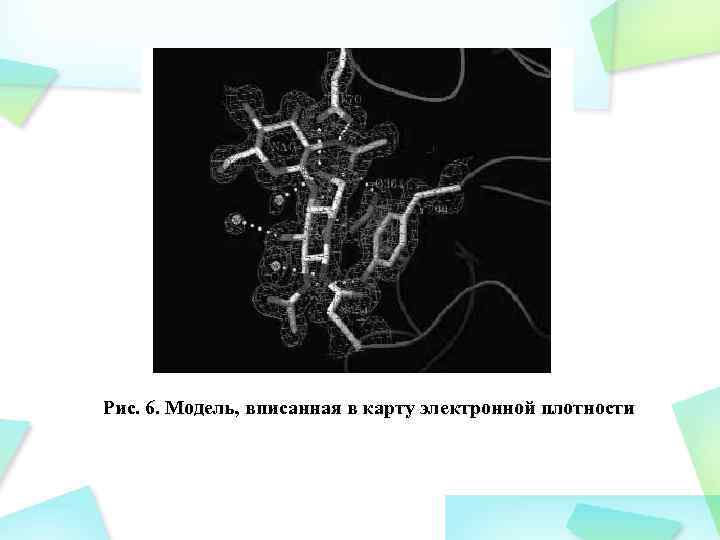 Рис. 6. Модель, вписанная в карту электронной плотности
Рис. 6. Модель, вписанная в карту электронной плотности
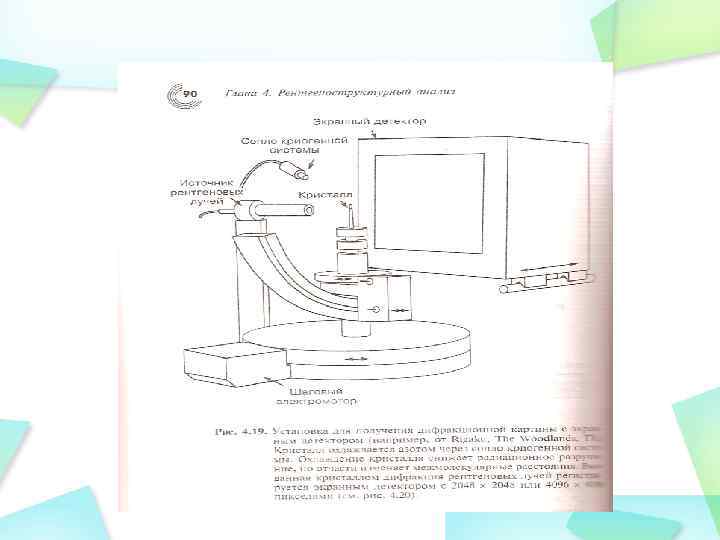
 Рентгеновский дефрактометр состоит из источника рентгеновского излучения, рентгеновского гониометра, в который помещают исследуемый образец, детектора излучения и электронного измерительно-регистрирующего устройства. Детектором в рентгеновском дефрактометре служит не фотоплёнка, как в рентгеновской камере, а счётчики квантов (сцинтилляционные, пропорциональные, полупроводниковые счётчики или Гейгера — Мюллера счётчики). Дифракционную картину образца в рентгеновском дефрактометре получают последовательно: счётчик перемещается в процессе измерения и регистрирует попавшую в него энергию излучения за определённый интервал времени.
Рентгеновский дефрактометр состоит из источника рентгеновского излучения, рентгеновского гониометра, в который помещают исследуемый образец, детектора излучения и электронного измерительно-регистрирующего устройства. Детектором в рентгеновском дефрактометре служит не фотоплёнка, как в рентгеновской камере, а счётчики квантов (сцинтилляционные, пропорциональные, полупроводниковые счётчики или Гейгера — Мюллера счётчики). Дифракционную картину образца в рентгеновском дефрактометре получают последовательно: счётчик перемещается в процессе измерения и регистрирует попавшую в него энергию излучения за определённый интервал времени.
 Рентгеноструктурный анализ Условие Вульфа — Брэгга d — межплоскостное расстояние, θ — угол скольжения, n — порядок дифракционного максимума, λ — длина волны.
Рентгеноструктурный анализ Условие Вульфа — Брэгга d — межплоскостное расстояние, θ — угол скольжения, n — порядок дифракционного максимума, λ — длина волны.
 Кристалл сульфида цинка и картина его дифракционного рассеяния
Кристалл сульфида цинка и картина его дифракционного рассеяния
 Дифракция рентгеновского излучения
Дифракция рентгеновского излучения
 Дифракция рентгеновского излучения
Дифракция рентгеновского излучения
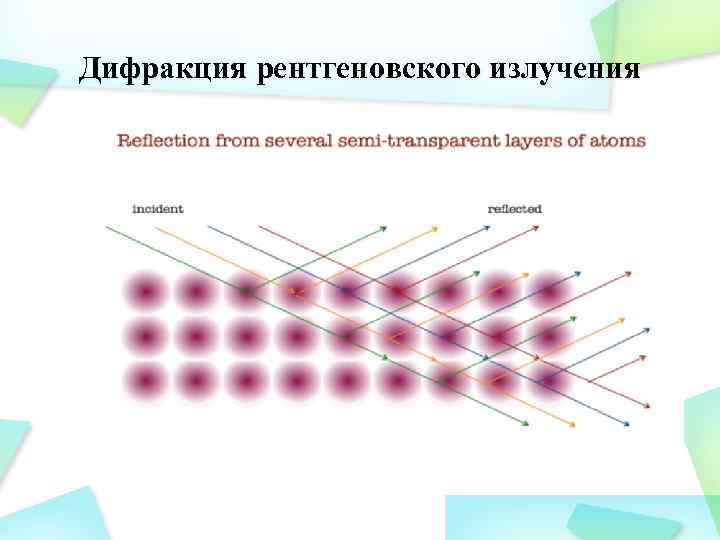 Дифракция рентгеновского излучения
Дифракция рентгеновского излучения
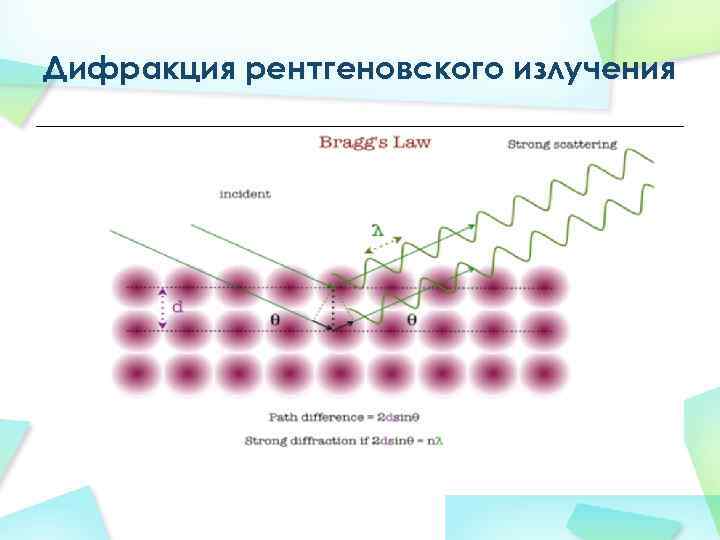 Дифракция рентгеновского излучения
Дифракция рентгеновского излучения
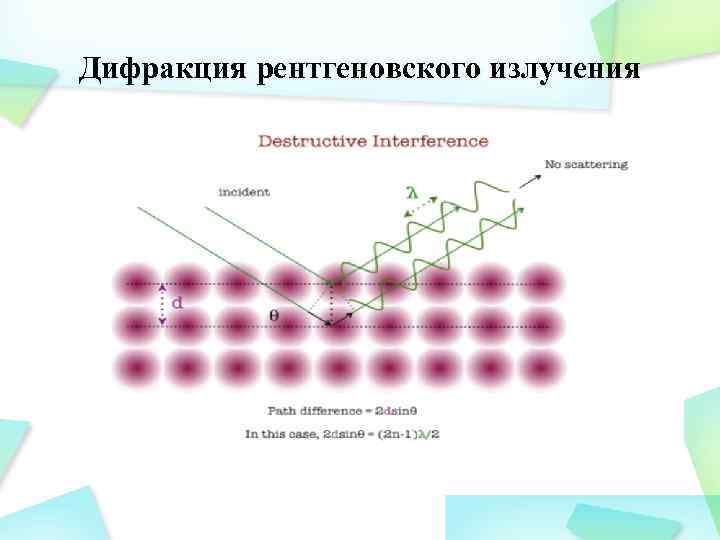 Дифракция рентгеновского излучения
Дифракция рентгеновского излучения
 Кристаллографическое исследование макромолекул
Кристаллографическое исследование макромолекул
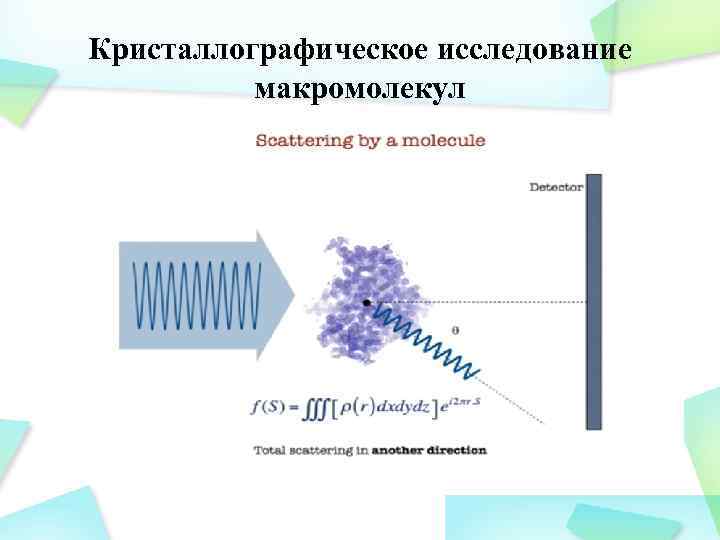 Кристаллографическое исследование макромолекул
Кристаллографическое исследование макромолекул
 Кристаллографическое исследование макромолекул
Кристаллографическое исследование макромолекул
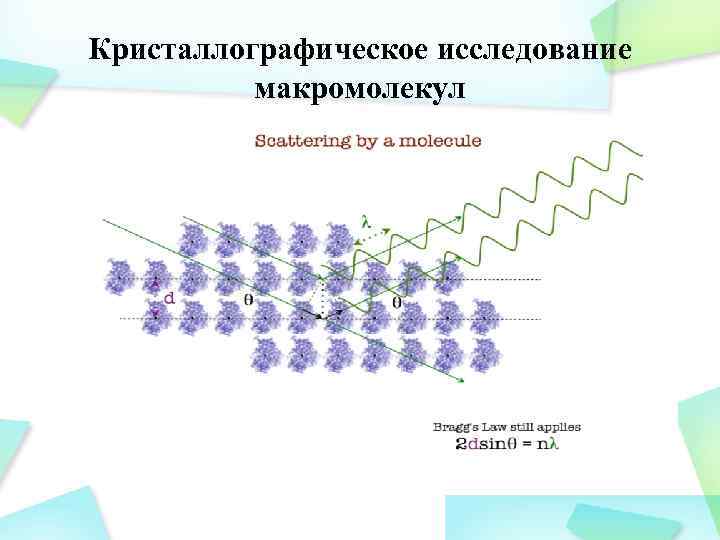 Кристаллографическое исследование макромолекул
Кристаллографическое исследование макромолекул
 2014 International year of crystallography Iycr 2014 год был объявлен Международным годом кристаллографии в ознаменование присуждения первой Нобелевской премии в этой области: Максу фон Лауэ за открытие дифракции рентгеновского излучения
2014 International year of crystallography Iycr 2014 год был объявлен Международным годом кристаллографии в ознаменование присуждения первой Нобелевской премии в этой области: Максу фон Лауэ за открытие дифракции рентгеновского излучения
 Эксперименты М. ф. Лауэ 1912 года Направив пучок рентгеновых лучей на неподвижный кристалл, Лауэ зарегистрировал на фотопластинке дифракционную картину, которая состояла из большого числа закономерно расположенных пятен. Каждое пятно – след дифракционного луча, рассеянного кристаллом. Лауэграмма кристалла берилла
Эксперименты М. ф. Лауэ 1912 года Направив пучок рентгеновых лучей на неподвижный кристалл, Лауэ зарегистрировал на фотопластинке дифракционную картину, которая состояла из большого числа закономерно расположенных пятен. Каждое пятно – след дифракционного луча, рассеянного кристаллом. Лауэграмма кристалла берилла
 Кристаллография - наука о кристаллах, их структуре, возникновении и свойствах. Кристалл – это: 1) твердое тело, способное в определенных условиях самоограняться 2) Твердое тело, в котором атомы расположены закономерно, образуя трехмерно-периодическую пространственную укладку – кристаллическую решетку. Кристалл вируса табачной мозаики
Кристаллография - наука о кристаллах, их структуре, возникновении и свойствах. Кристалл – это: 1) твердое тело, способное в определенных условиях самоограняться 2) Твердое тело, в котором атомы расположены закономерно, образуя трехмерно-периодическую пространственную укладку – кристаллическую решетку. Кристалл вируса табачной мозаики
 Источники рентгеновского излучения Rigaku R-Axis IV Advanced Photon Source in Argonne Lab
Источники рентгеновского излучения Rigaku R-Axis IV Advanced Photon Source in Argonne Lab
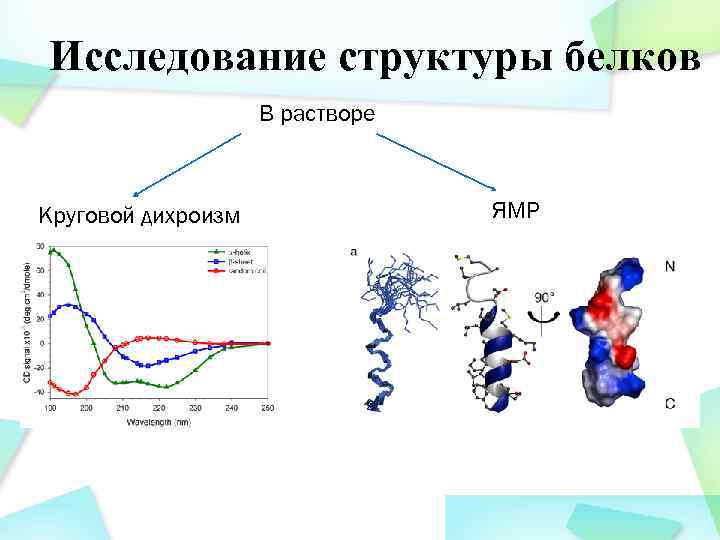 Исследование структуры белков В растворе Круговой дихроизм ЯМР
Исследование структуры белков В растворе Круговой дихроизм ЯМР
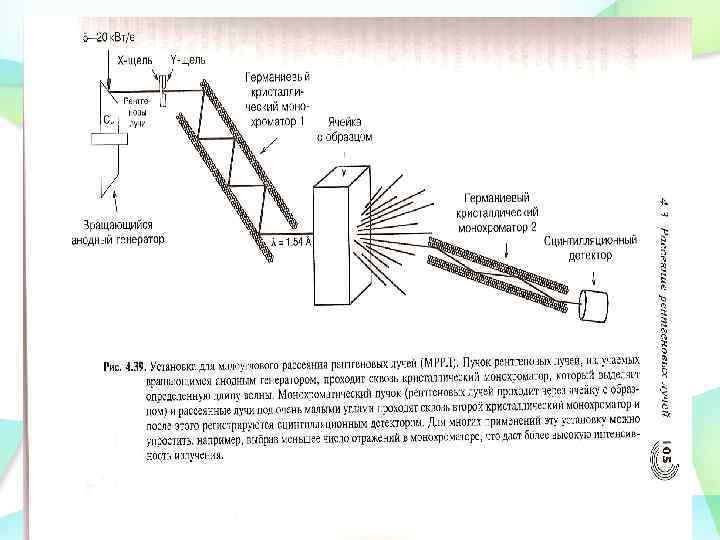
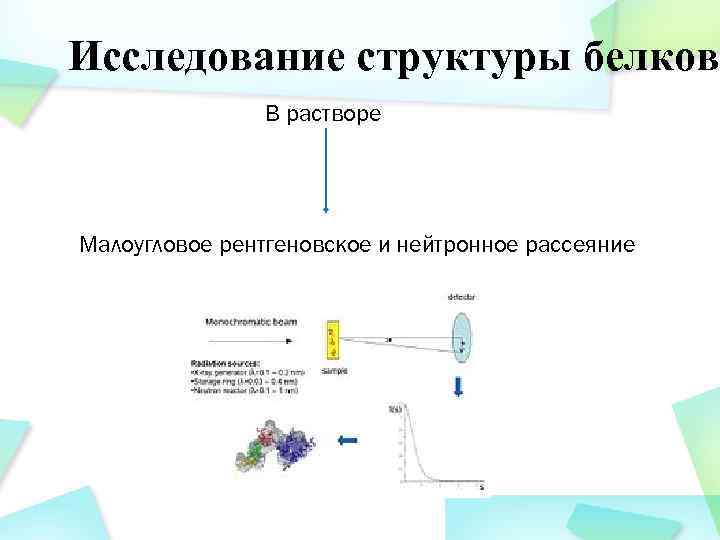 Исследование структуры белков В растворе Малоугловое рентгеновское и нейтронное рассеяние
Исследование структуры белков В растворе Малоугловое рентгеновское и нейтронное рассеяние
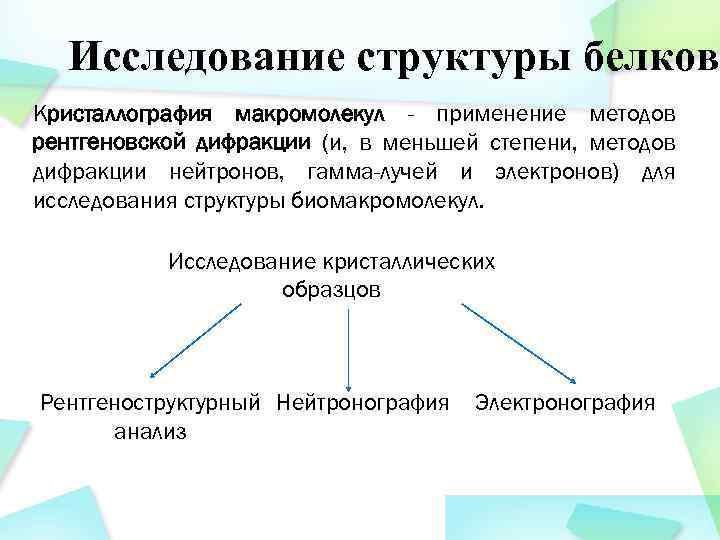 Исследование структуры белков Кристаллография макромолекул - применение методов рентгеновской дифракции (и, в меньшей степени, методов дифракции нейтронов, гамма-лучей и электронов) для исследования структуры биомакромолекул. Исследование кристаллических образцов Рентгеноструктурный Нейтронография анализ Электронография
Исследование структуры белков Кристаллография макромолекул - применение методов рентгеновской дифракции (и, в меньшей степени, методов дифракции нейтронов, гамма-лучей и электронов) для исследования структуры биомакромолекул. Исследование кристаллических образцов Рентгеноструктурный Нейтронография анализ Электронография
 Определение структуры белка Сбор дифракционных данных Индексирование рентгенограммы Шкалирование Индексирование рентгенограммы Решение проблемы фаз Построение модели и ее уточнение
Определение структуры белка Сбор дифракционных данных Индексирование рентгенограммы Шкалирование Индексирование рентгенограммы Решение проблемы фаз Построение модели и ее уточнение
 Сбор дифракционных данных
Сбор дифракционных данных
 Индексирование Поиск пиков и индексирование в HKL 2000 Определение кристаллической системы, симметрии
Индексирование Поиск пиков и индексирование в HKL 2000 Определение кристаллической системы, симметрии
 Шкалирование Интенсивности дифракционных максимумов зависят от условий эксперимента (время экспозиции, напряжение на трубке и т. д. ). Таким образом, необходимо привести интенсивности, полученные в нашем эксперименте привести к стандартной шкале. Процедуру называют шкалированием, или приведением к стандартной шкале.
Шкалирование Интенсивности дифракционных максимумов зависят от условий эксперимента (время экспозиции, напряжение на трубке и т. д. ). Таким образом, необходимо привести интенсивности, полученные в нашем эксперименте привести к стандартной шкале. Процедуру называют шкалированием, или приведением к стандартной шкале.
 Решение проблемы фаз В ходе эксперимента измеряются интенсивности дифрагированных лучей. Основной проблемой РСА является принципиальная невозможность измерения разности фаз между падающей и отраженной волной. Как мы увидим далее, для решения кристаллической структуры необходимо знание двух величин: интенсивности отраженной волны в каждом конкретном направлении и ее фазы. Таким образом, из данных дифракционного эксперимента мы можем получить только половину необходимой информации. Эта проблема получила название проблемы фаз.
Решение проблемы фаз В ходе эксперимента измеряются интенсивности дифрагированных лучей. Основной проблемой РСА является принципиальная невозможность измерения разности фаз между падающей и отраженной волной. Как мы увидим далее, для решения кристаллической структуры необходимо знание двух величин: интенсивности отраженной волны в каждом конкретном направлении и ее фазы. Таким образом, из данных дифракционного эксперимента мы можем получить только половину необходимой информации. Эта проблема получила название проблемы фаз.
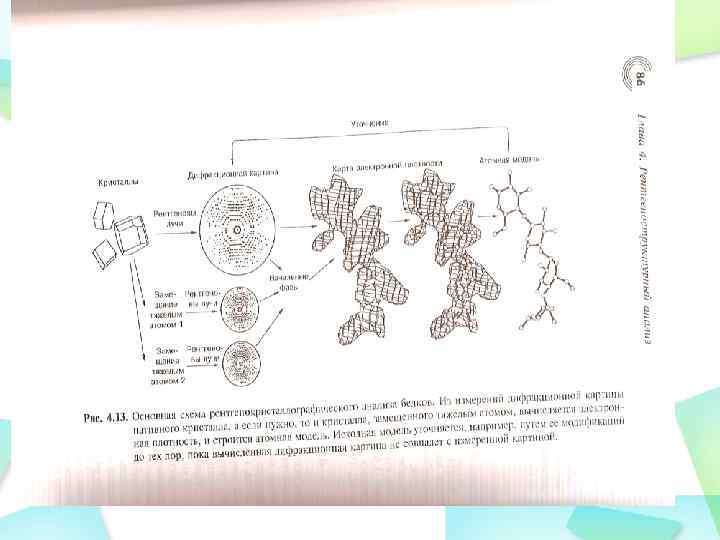
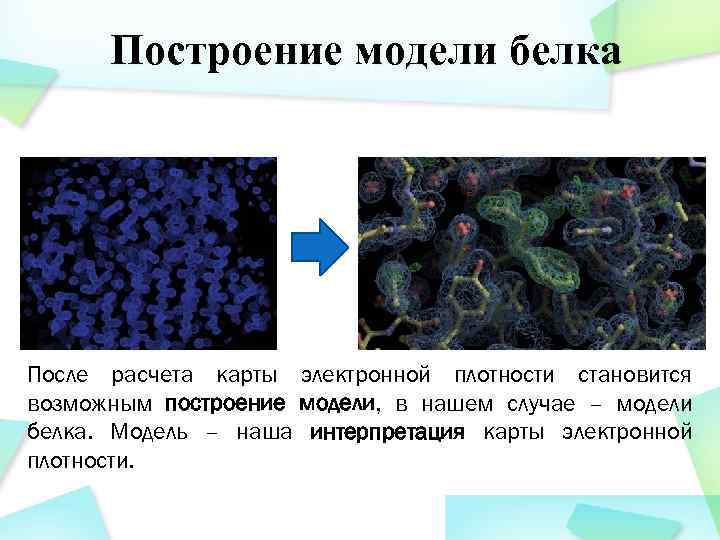 Построение модели белка После расчета карты электронной плотности становится возможным построение модели, в нашем случае – модели белка. Модель – наша интерпретация карты электронной плотности.
Построение модели белка После расчета карты электронной плотности становится возможным построение модели, в нашем случае – модели белка. Модель – наша интерпретация карты электронной плотности.
 Уточнение модели белка После построения модели необходимо ее уточнение. Различные методы уточнения будут рассмотрены в соответствующей лекции. Уточнение основано на сравнении интенсивностей дифракционных максимумов, которые бы давала наша модель, если бы она существовала в кристалле, с интенсивность максимумов, измеренных нами в эксперименте. Понятно, что в случае идеальной модели расхождение равнялось бы нулю. В реальности это не так, и при варьировании углов, длин связей в модели добиваются максимальной сходимости этих двух величин.
Уточнение модели белка После построения модели необходимо ее уточнение. Различные методы уточнения будут рассмотрены в соответствующей лекции. Уточнение основано на сравнении интенсивностей дифракционных максимумов, которые бы давала наша модель, если бы она существовала в кристалле, с интенсивность максимумов, измеренных нами в эксперименте. Понятно, что в случае идеальной модели расхождение равнялось бы нулю. В реальности это не так, и при варьировании углов, длин связей в модели добиваются максимальной сходимости этих двух величин.
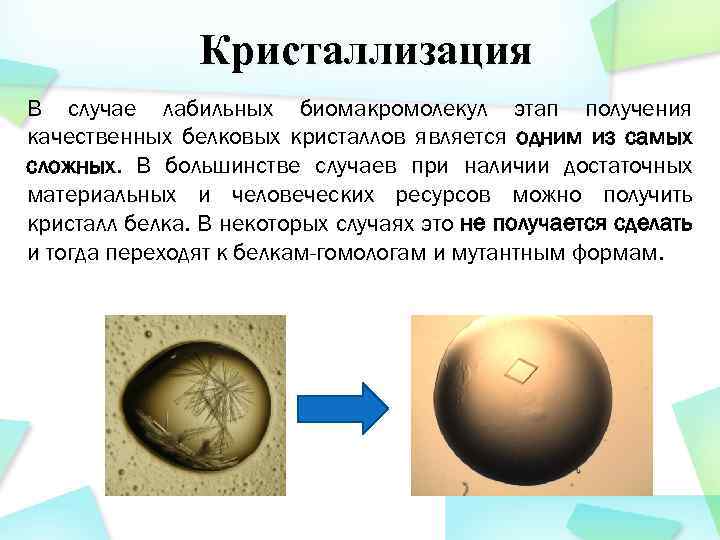 Кристаллизация В случае лабильных биомакромолекул этап получения качественных белковых кристаллов является одним из самых сложных. В большинстве случаев при наличии достаточных материальных и человеческих ресурсов можно получить кристалл белка. В некоторых случаях это не получается сделать и тогда переходят к белкам-гомологам и мутантным формам.
Кристаллизация В случае лабильных биомакромолекул этап получения качественных белковых кристаллов является одним из самых сложных. В большинстве случаев при наличии достаточных материальных и человеческих ресурсов можно получить кристалл белка. В некоторых случаях это не получается сделать и тогда переходят к белкам-гомологам и мутантным формам.
 Определение первых структур белков 1920 -е – работа с фибриллярными белками (фиброин шелка, коллаген) 1930 -е – 1940 -е – У. Астбери предположил наличие альфа и бета форм фибриллярных белков, что объясняло их физические свойства М. Хаггинс предложил количественные геометрические параметры, которым должны удовлетворять модели полипептидных цепей белков. Придал решающее значение водородной связи в формировании структуры полипептидов. .
Определение первых структур белков 1920 -е – работа с фибриллярными белками (фиброин шелка, коллаген) 1930 -е – 1940 -е – У. Астбери предположил наличие альфа и бета форм фибриллярных белков, что объясняло их физические свойства М. Хаггинс предложил количественные геометрические параметры, которым должны удовлетворять модели полипептидных цепей белков. Придал решающее значение водородной связи в формировании структуры полипептидов. .
 Модели Полинга и Кори 1951 г Решающее обстоятельство, которое отличает их работу от всех предшествующих, состоит в том, что помимо строгих геометрических ограничений Полинг и Кори допустили, что спираль может содержать нецелое число остатков на виток. Структуры, предложенные Полингом и Кори, удовлетворяли всем известным в то время экспериментальным данным, в т. ч. рентгеновской дифракции. Дальнейшие доказательства модели альфа-спирали были найдены при изучении синтетических полипептидов.
Модели Полинга и Кори 1951 г Решающее обстоятельство, которое отличает их работу от всех предшествующих, состоит в том, что помимо строгих геометрических ограничений Полинг и Кори допустили, что спираль может содержать нецелое число остатков на виток. Структуры, предложенные Полингом и Кори, удовлетворяли всем известным в то время экспериментальным данным, в т. ч. рентгеновской дифракции. Дальнейшие доказательства модели альфа-спирали были найдены при изучении синтетических полипептидов.
 Глобулярные белки Кристаллизация белков использовалась как метод очистки в биохимии задолго до появления такой области, как кристаллография белка. Однако наблюдать дифракционную картину не получалось. 1934 г. – Дж. Бернал, Д. Кроуфут (Ходжкин) – съемка увлажненных в маточном растворе кристаллов (пепсин)
Глобулярные белки Кристаллизация белков использовалась как метод очистки в биохимии задолго до появления такой области, как кристаллография белка. Однако наблюдать дифракционную картину не получалось. 1934 г. – Дж. Бернал, Д. Кроуфут (Ходжкин) – съемка увлажненных в маточном растворе кристаллов (пепсин)

 Структура гемоглобина и миоглобина 1937 г. – начало работы М. Перутца над установлением структуры гемоглобина 1953 г. – Перутцем успешно применен первый практический метод решения проблемы фаз для белков – метод тяжелоатомных производных 1958 г. – определение структуры миоглобина Дж. Кендрю (работа была начала в 1948 г. ). Структура определена с разрешением 6 А. 1960 г. – определение структуры миоглобина с разрешением 2 А и гемоглобина с разрешением 5 А
Структура гемоглобина и миоглобина 1937 г. – начало работы М. Перутца над установлением структуры гемоглобина 1953 г. – Перутцем успешно применен первый практический метод решения проблемы фаз для белков – метод тяжелоатомных производных 1958 г. – определение структуры миоглобина Дж. Кендрю (работа была начала в 1948 г. ). Структура определена с разрешением 6 А. 1960 г. – определение структуры миоглобина с разрешением 2 А и гемоглобина с разрешением 5 А
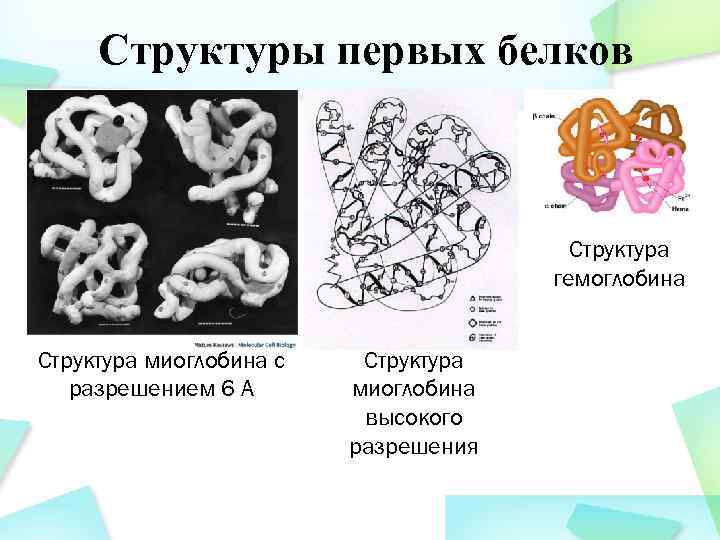 Структуры первых белков Структура гемоглобина Структура миоглобина с разрешением 6 А Структура миоглобина высокого разрешения
Структуры первых белков Структура гемоглобина Структура миоглобина с разрешением 6 А Структура миоглобина высокого разрешения
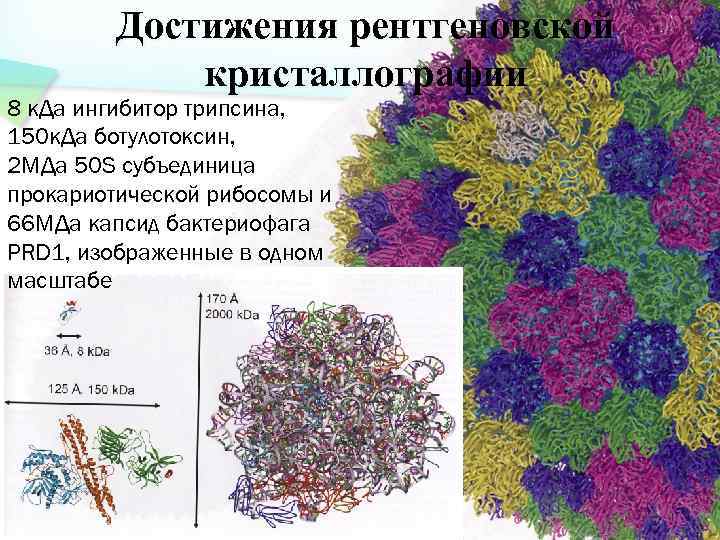 Достижения рентгеновской кристаллографии 8 к. Да ингибитор трипсина, 150 к. Да ботулотоксин, 2 МДа 50 S субъединица прокариотической рибосомы и 66 МДа капсид бактериофага PRD 1, изображенные в одном масштабе
Достижения рентгеновской кристаллографии 8 к. Да ингибитор трипсина, 150 к. Да ботулотоксин, 2 МДа 50 S субъединица прокариотической рибосомы и 66 МДа капсид бактериофага PRD 1, изображенные в одном масштабе
 Кристаллизация мембранных белков Одно из самых значительных достижений РСА последних десятилетий состоит в начавшейся расшифровке трехмерных структур мембранных белков. Мембранные белки ответственны за превращение энергии, выступают в качестве рецепторов и ферментов, образуют каналы активного и пассивного транспорта молекул и различных ионов через Фотосинтетический реакционный мембраны, охраняют организм центр – первый мембранный белок, от проникновения чужеродных структура которого была установлена с антигенов. атомным разрешением
Кристаллизация мембранных белков Одно из самых значительных достижений РСА последних десятилетий состоит в начавшейся расшифровке трехмерных структур мембранных белков. Мембранные белки ответственны за превращение энергии, выступают в качестве рецепторов и ферментов, образуют каналы активного и пассивного транспорта молекул и различных ионов через Фотосинтетический реакционный мембраны, охраняют организм центр – первый мембранный белок, от проникновения чужеродных структура которого была установлена с антигенов. атомным разрешением
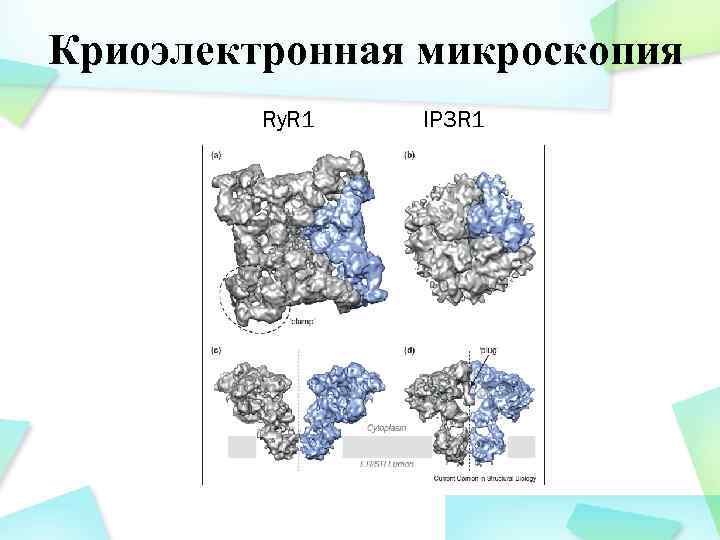 Криоэлектронная микроскопия Ry. R 1 IP 3 R 1
Криоэлектронная микроскопия Ry. R 1 IP 3 R 1
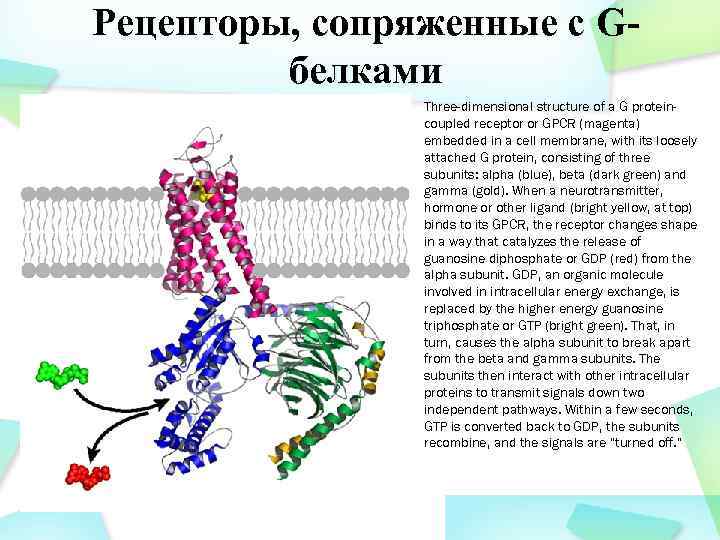 Рецепторы, сопряженные с Gбелками Three-dimensional structure of a G proteincoupled receptor or GPCR (magenta) embedded in a cell membrane, with its loosely attached G protein, consisting of three subunits: alpha (blue), beta (dark green) and gamma (gold). When a neurotransmitter, hormone or other ligand (bright yellow, at top) binds to its GPCR, the receptor changes shape in a way that catalyzes the release of guanosine diphosphate or GDP (red) from the alpha subunit. GDP, an organic molecule involved in intracellular energy exchange, is replaced by the higher energy guanosine triphosphate or GTP (bright green). That, in turn, causes the alpha subunit to break apart from the beta and gamma subunits. The subunits then interact with other intracellular proteins to transmit signals down two independent pathways. Within a few seconds, GTP is converted back to GDP, the subunits recombine, and the signals are “turned off. ”
Рецепторы, сопряженные с Gбелками Three-dimensional structure of a G proteincoupled receptor or GPCR (magenta) embedded in a cell membrane, with its loosely attached G protein, consisting of three subunits: alpha (blue), beta (dark green) and gamma (gold). When a neurotransmitter, hormone or other ligand (bright yellow, at top) binds to its GPCR, the receptor changes shape in a way that catalyzes the release of guanosine diphosphate or GDP (red) from the alpha subunit. GDP, an organic molecule involved in intracellular energy exchange, is replaced by the higher energy guanosine triphosphate or GTP (bright green). That, in turn, causes the alpha subunit to break apart from the beta and gamma subunits. The subunits then interact with other intracellular proteins to transmit signals down two independent pathways. Within a few seconds, GTP is converted back to GDP, the subunits recombine, and the signals are “turned off. ”
 рибосома Первая стадия – инициация – заключается в том, что рибосома распознает особую последовательность м. РНК (последовательность Шайна. Далгарно). Факторы инициации трансляции подставляют м. РНК к малой субъединице, выстраивают т. РНК и помогают связыванию большой субъединицы. м. РНК, т. РНК, белковые факторы находятся между малой и большой субъединицами, т. е. внутри рибосомы.
рибосома Первая стадия – инициация – заключается в том, что рибосома распознает особую последовательность м. РНК (последовательность Шайна. Далгарно). Факторы инициации трансляции подставляют м. РНК к малой субъединице, выстраивают т. РНК и помогают связыванию большой субъединицы. м. РНК, т. РНК, белковые факторы находятся между малой и большой субъединицами, т. е. внутри рибосомы.
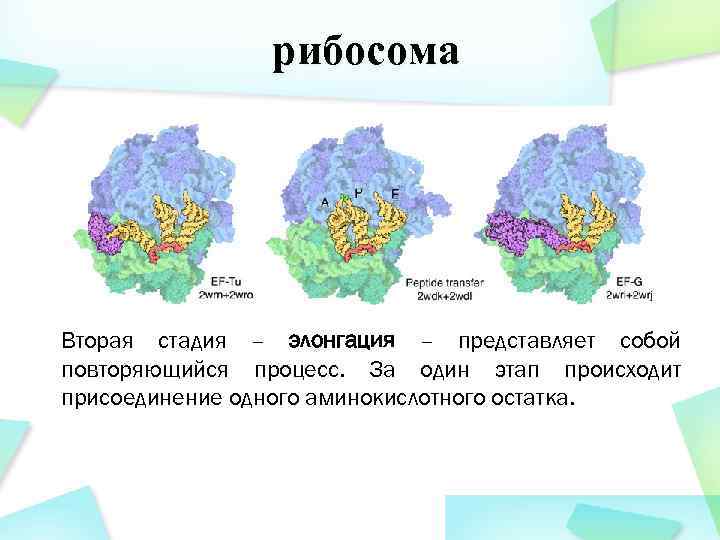 рибосома Вторая стадия – элонгация – представляет собой повторяющийся процесс. За один этап происходит присоединение одного аминокислотного остатка.
рибосома Вторая стадия – элонгация – представляет собой повторяющийся процесс. За один этап происходит присоединение одного аминокислотного остатка.
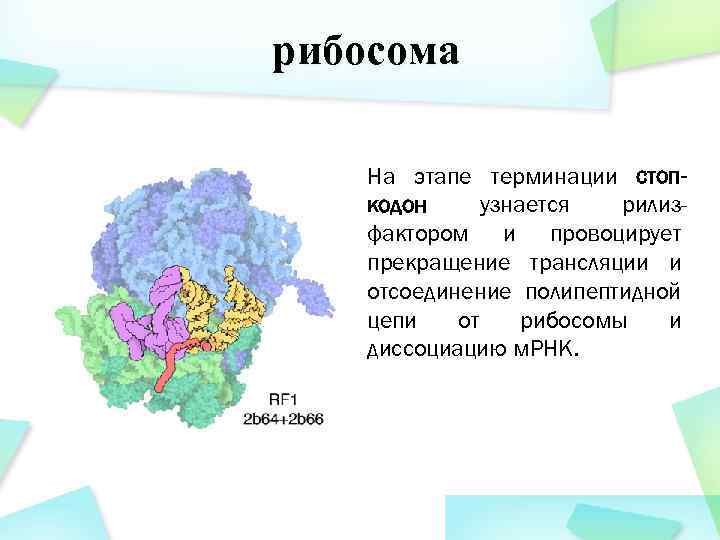 рибосома На этапе терминации стопкодон узнается рилизфактором и провоцирует прекращение трансляции и отсоединение полипептидной цепи от рибосомы и диссоциацию м. РНК.
рибосома На этапе терминации стопкодон узнается рилизфактором и провоцирует прекращение трансляции и отсоединение полипептидной цепи от рибосомы и диссоциацию м. РНК.
 интерференция (от лат. inter — взаимно, между собой и ferio— ударяю, поражаю), сложение в пространстве двух (или нескольких) волн, при котором в разных его точках получается усиление или ослабление амплитуды результирующей волны. Интерференция характерна для волн любой природы; волн на поверхности жидкости, упругих (напр. , звуковых), электромагнитных (например, радиоволн или световых). При интеференции волн результирующее колебание в каждой точке представляет собой геометрическую сумму колебаний, соответствующих каждой из складывающихся волн.
интерференция (от лат. inter — взаимно, между собой и ferio— ударяю, поражаю), сложение в пространстве двух (или нескольких) волн, при котором в разных его точках получается усиление или ослабление амплитуды результирующей волны. Интерференция характерна для волн любой природы; волн на поверхности жидкости, упругих (напр. , звуковых), электромагнитных (например, радиоволн или световых). При интеференции волн результирующее колебание в каждой точке представляет собой геометрическую сумму колебаний, соответствующих каждой из складывающихся волн.
 Кристаллизация Получение пересыщенного раствора: Испарение - постепенное удаление растворителя из раствора Понижение растворимости в процессе охлаждения Использование солей, либо органических растворителей, понижающих растворимость Растворимость белков и нуклеиновых кислот сильно зависит от p. H раствора
Кристаллизация Получение пересыщенного раствора: Испарение - постепенное удаление растворителя из раствора Понижение растворимости в процессе охлаждения Использование солей, либо органических растворителей, понижающих растворимость Растворимость белков и нуклеиновых кислот сильно зависит от p. H раствора
 Выделение и очистка белка Для получения нужного белка используют различные биохимические методы Гомогенизация - измельчение биологического материала Экстракция - извлечение из него белков или перевод белков в растворенное состояние Очистка - выделение исследуемого белка из смеси других белков, и получение индивидуального белка.
Выделение и очистка белка Для получения нужного белка используют различные биохимические методы Гомогенизация - измельчение биологического материала Экстракция - извлечение из него белков или перевод белков в растворенное состояние Очистка - выделение исследуемого белка из смеси других белков, и получение индивидуального белка.
 Фазовая проблема Подходы к решению проблемы: Изоморфное замещение Использование эффекта аномального рассеяния Метод молекулярного замещения «Прямые» методы
Фазовая проблема Подходы к решению проблемы: Изоморфное замещение Использование эффекта аномального рассеяния Метод молекулярного замещения «Прямые» методы
 Источники излучения Рентгеновские трубки Источники синхротронного излучения (синхротроны, лазеры на свободных электронах)
Источники излучения Рентгеновские трубки Источники синхротронного излучения (синхротроны, лазеры на свободных электронах)
 Достижения кристаллографии Холестерол Пенициллин Витамин B 12 Дороти Ходжкин и макет витамина B 12
Достижения кристаллографии Холестерол Пенициллин Витамин B 12 Дороти Ходжкин и макет витамина B 12
 Витамин B 12
Витамин B 12
 Пенициллин
Пенициллин
 ДНК
ДНК
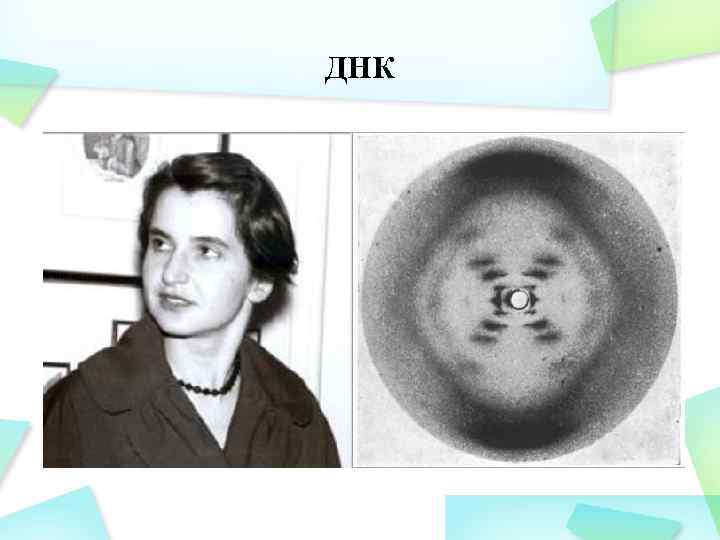 ДНК
ДНК
 Кристалл гемоглобина
Кристалл гемоглобина
 Структура миоглобина
Структура миоглобина
 Структура миоглобина
Структура миоглобина
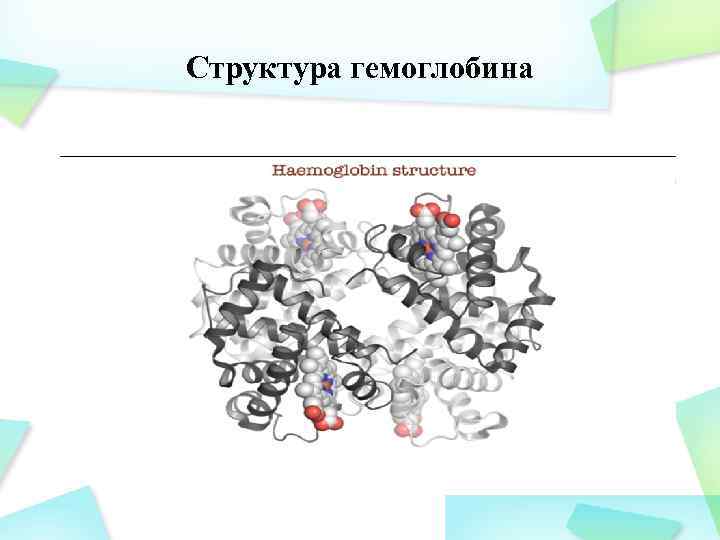 Структура гемоглобина
Структура гемоглобина
 Гемоглобин и миоглобин
Гемоглобин и миоглобин
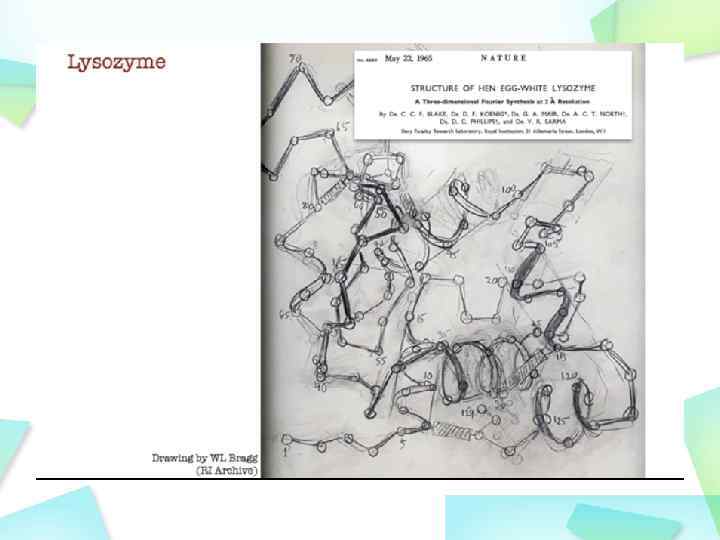
 Лизоцим катализирует распад участка бактериальной клеточной стенки
Лизоцим катализирует распад участка бактериальной клеточной стенки
 Protein data bank Информация, полученная методами рентгеновской кристаллографии или ЯМРспектроскопии занесена в банк данных 3 -D структур белков и нуклеиновых кислот, который содержит на данный момент около 100 000 макромолекул.
Protein data bank Информация, полученная методами рентгеновской кристаллографии или ЯМРспектроскопии занесена в банк данных 3 -D структур белков и нуклеиновых кислот, который содержит на данный момент около 100 000 макромолекул.
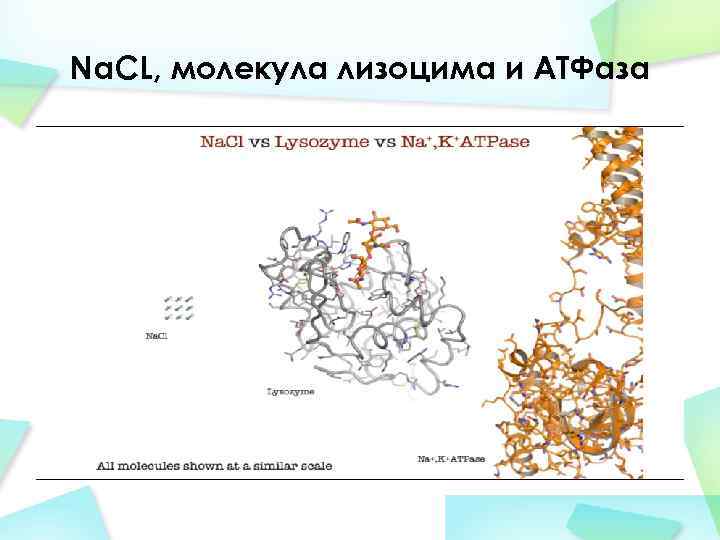 Na. CL, молекула лизоцима и АТФаза
Na. CL, молекула лизоцима и АТФаза
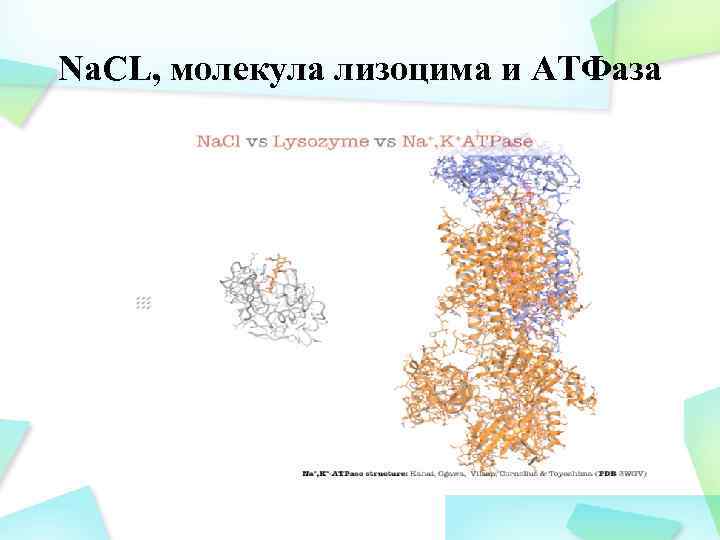 Na. CL, молекула лизоцима и АТФаза
Na. CL, молекула лизоцима и АТФаза
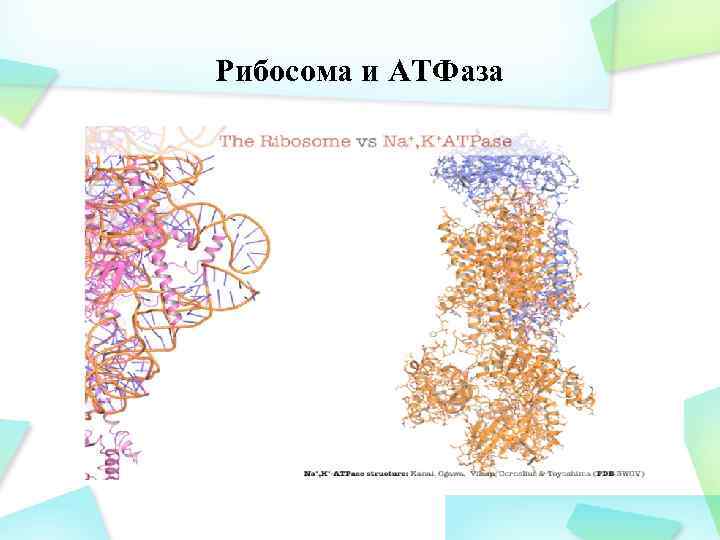 Рибосома и АТФаза
Рибосома и АТФаза
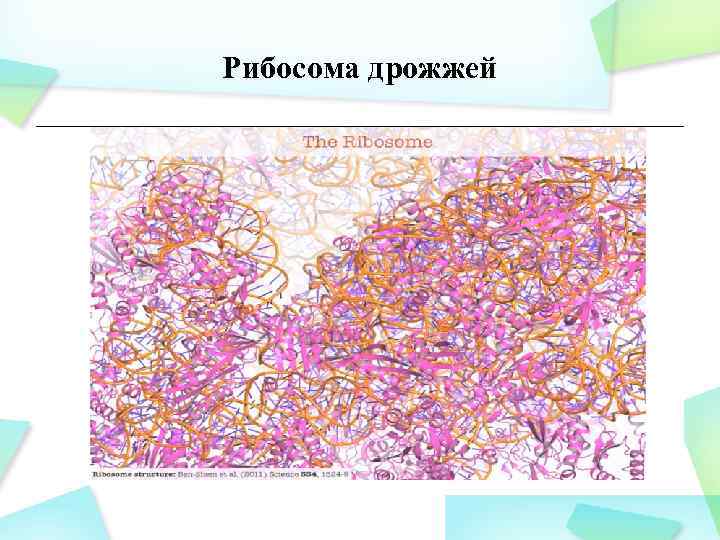 Рибосома дрожжей
Рибосома дрожжей
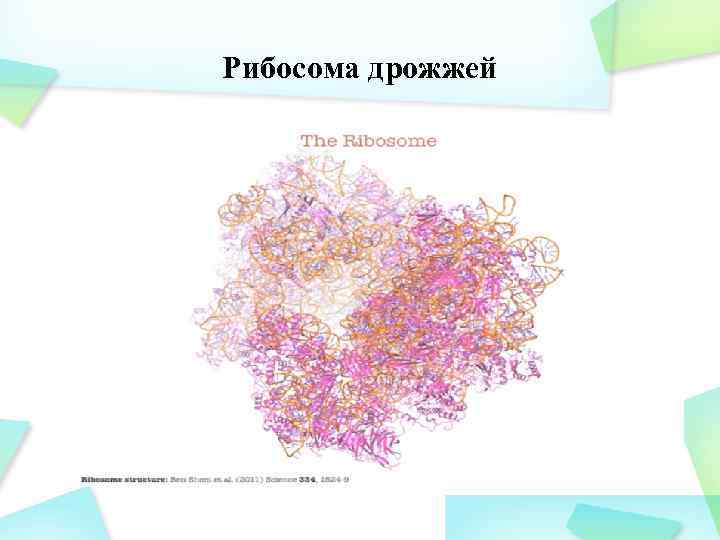 Рибосома дрожжей
Рибосома дрожжей



