Эксклюзионная хроматография.pptx
- Количество слайдов: 35
 Эксклюзионная хроматография
Эксклюзионная хроматография
 Хроматография – это физико химический метод разделения веществ, основанный на распределении компонентов между двумя фазами – подвижной и неподвижной. Неподвижной фазой обычно служит твердое вещество (сорбент) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу. разделение сложных смесей органических и неорганических веществ на отдельные компоненты, очистка веществ от примесей, концентрирование веществ из сильно разбавленных растворов, качественный и количественный анализ исследуемых веществ.
Хроматография – это физико химический метод разделения веществ, основанный на распределении компонентов между двумя фазами – подвижной и неподвижной. Неподвижной фазой обычно служит твердое вещество (сорбент) или пленка жидкости, нанесенная на твердое вещество. Подвижная фаза представляет собой жидкость или газ, протекающий через неподвижную фазу. разделение сложных смесей органических и неорганических веществ на отдельные компоненты, очистка веществ от примесей, концентрирование веществ из сильно разбавленных растворов, качественный и количественный анализ исследуемых веществ.
 В основу классификации многочисленных хроматографических методов положены следующие признаки: 1) агрегатное состояние фаз; 2) механизм взаимодействия сорбент – сорбат; 3) способы проведения хроматографического анализа; 4) аппаратурное оформление (техника выполнения) процесса хроматографирования; 5) цель хроматографирования.
В основу классификации многочисленных хроматографических методов положены следующие признаки: 1) агрегатное состояние фаз; 2) механизм взаимодействия сорбент – сорбат; 3) способы проведения хроматографического анализа; 4) аппаратурное оформление (техника выполнения) процесса хроматографирования; 5) цель хроматографирования.
 По агрегатному состоянию фаз хроматографию разделяют на: газовую (включает газожидкостную и газотвердофазную); Жидкостную (включает жидкостно жидкостную и жидкостно твердофазную) Первое слово в названии метода характеризует агрегатное состояние подвижной фазы, второе – неподвижной.
По агрегатному состоянию фаз хроматографию разделяют на: газовую (включает газожидкостную и газотвердофазную); Жидкостную (включает жидкостно жидкостную и жидкостно твердофазную) Первое слово в названии метода характеризует агрегатное состояние подвижной фазы, второе – неподвижной.
 По механизму взаимодействия сорбента и сорбата: адсорбционная основана на различии в адсорбируемости веществ твердым сорбентом; распределительная основана на различной растворимости разделяемых веществ в неподвижной фазе (газожидкостная хроматография) или на различной растворимости веществ в подвижной и неподвижной фазах (жидкостная хроматография); ионообменная хроматография – на разной способности веществ к ионному обмену; - эксклюзионная хроматография – на различии в размерах и формах молекул разделяемых веществ; - аффинная хроматография – на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов (например, антитело и антиген, гормон и рецептор и др. ).
По механизму взаимодействия сорбента и сорбата: адсорбционная основана на различии в адсорбируемости веществ твердым сорбентом; распределительная основана на различной растворимости разделяемых веществ в неподвижной фазе (газожидкостная хроматография) или на различной растворимости веществ в подвижной и неподвижной фазах (жидкостная хроматография); ионообменная хроматография – на разной способности веществ к ионному обмену; - эксклюзионная хроматография – на различии в размерах и формах молекул разделяемых веществ; - аффинная хроматография – на специфических взаимодействиях, характерных для некоторых биологических и биохимических процессов (например, антитело и антиген, гормон и рецептор и др. ).
 Существует осадочная хроматография, основанная на образовании отличающихся по растворимости осадков разделяемых веществ с сорбентом, адсорбционно-комплексообразовательная, основанная на образовании координационных соединений разной устойчивости в фазе или на поверхности сорбента, и др. Классификация по механизму взаимодействия весьма условна: ее используют в том случае, если известен доминирующий механизм; часто процесс разделения протекает сразу по нескольким механизмам.
Существует осадочная хроматография, основанная на образовании отличающихся по растворимости осадков разделяемых веществ с сорбентом, адсорбционно-комплексообразовательная, основанная на образовании координационных соединений разной устойчивости в фазе или на поверхности сорбента, и др. Классификация по механизму взаимодействия весьма условна: ее используют в том случае, если известен доминирующий механизм; часто процесс разделения протекает сразу по нескольким механизмам.
 По технике выполнения : - колоночная хроматография ( разделение проводится в специальных колонках); плоскостная хроматография (разделение проводится на специальной бумаге (бумажная хроматография) или в тонком слое сорбента (тонкослойная хроматография)). В колоночной хроматографии используют насадочные или капиллярные колонки. Насадочную колонку заполняют сорбентом (насадкой), а внутреннюю стенку капиллярной колонки покрывают пленкой жидкости или пылью адсорбента.
По технике выполнения : - колоночная хроматография ( разделение проводится в специальных колонках); плоскостная хроматография (разделение проводится на специальной бумаге (бумажная хроматография) или в тонком слое сорбента (тонкослойная хроматография)). В колоночной хроматографии используют насадочные или капиллярные колонки. Насадочную колонку заполняют сорбентом (насадкой), а внутреннюю стенку капиллярной колонки покрывают пленкой жидкости или пылью адсорбента.
 В зависимости от цели проведения хроматографического процесса различают: аналитическую хроматографию (качественный и количественный анализ); - препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); - промышленную (производственную) хроматографию для автоматического управления процессом (при этом целевой продукт из колонки поступает в датчик). Хроматографию часто используют для исследовательских целей при изучении растворов, каталитических процессов, кинетики химических процессов и т. п.
В зависимости от цели проведения хроматографического процесса различают: аналитическую хроматографию (качественный и количественный анализ); - препаративную хроматографию (для получения веществ в чистом виде, для концентрирования и выделения микропримесей); - промышленную (производственную) хроматографию для автоматического управления процессом (при этом целевой продукт из колонки поступает в датчик). Хроматографию часто используют для исследовательских целей при изучении растворов, каталитических процессов, кинетики химических процессов и т. п.
 Классификация по способам проведения анализа подразделяет хроматографию на три вида: 1) Фронтальный (эффективен для препаративного выделения чистого вещества из технического образца при условии, что это вещество удерживается в колонке слабее всех других компонентов объекта анализа), 2) Проявительный (позволяет полностью разделить много компонентную смесь), 3) Вытеснительный (разделяемые вещества и на колонке, и в элюате располагаются последовательно друг за другом. Каждый из компонентов выделяется в чистом виде, но не количественно, так как зоны компонентов не разделены промежутками чистого сорбента).
Классификация по способам проведения анализа подразделяет хроматографию на три вида: 1) Фронтальный (эффективен для препаративного выделения чистого вещества из технического образца при условии, что это вещество удерживается в колонке слабее всех других компонентов объекта анализа), 2) Проявительный (позволяет полностью разделить много компонентную смесь), 3) Вытеснительный (разделяемые вещества и на колонке, и в элюате располагаются последовательно друг за другом. Каждый из компонентов выделяется в чистом виде, но не количественно, так как зоны компонентов не разделены промежутками чистого сорбента).
 Эксклюзионная хроматография – это разновидность жидкостной хроматографии, в которой разделение компонентов основано на распределении молекул в соответствии с их размером между растворителем, находящимся в порах сорбента, и растворителем, протекающим между его частицами. В процессе разделения небольшие молекулы попадают в сетку полимера, в порах которой растворитель служит неподвижной фазой, и удерживаются там, большие молекулы не могут проникнуть в полимерную сетку и вымываются из колонки подвижной фазой. Вначале элюируются самые большие, затем средние и потом небольшие молекулы. Поэтому эксклюзионную хроматографию называют также молекулярно ситовой.
Эксклюзионная хроматография – это разновидность жидкостной хроматографии, в которой разделение компонентов основано на распределении молекул в соответствии с их размером между растворителем, находящимся в порах сорбента, и растворителем, протекающим между его частицами. В процессе разделения небольшие молекулы попадают в сетку полимера, в порах которой растворитель служит неподвижной фазой, и удерживаются там, большие молекулы не могут проникнуть в полимерную сетку и вымываются из колонки подвижной фазой. Вначале элюируются самые большие, затем средние и потом небольшие молекулы. Поэтому эксклюзионную хроматографию называют также молекулярно ситовой.
 Эксклюзионная хроматография подразделяется на: 1. гель-проникающую; 2. гель-фильтрационную. В гель проникающей хроматографии разделение осуществляется на полимерах, набухающих в органических растворителях; если же полимеры набухают в воде, то говорят о гель фильтрационном варианте. Проба вводится в колонку, заполненную гелем или пористыми частичками наполнителя, и переносится подвижной фазой через колонку. Распределение в соответствии с размерами происходит в процессе движения и многоразовых обменов молекул растворенного вещества между молекулами растворителя (подвижной фазы) и тем же самым растворителем, находящимся в порах материала, которым заполнена колонка. Диапазон размеров распределенных молекул определяется диапазоном размеров пор наполнителя.
Эксклюзионная хроматография подразделяется на: 1. гель-проникающую; 2. гель-фильтрационную. В гель проникающей хроматографии разделение осуществляется на полимерах, набухающих в органических растворителях; если же полимеры набухают в воде, то говорят о гель фильтрационном варианте. Проба вводится в колонку, заполненную гелем или пористыми частичками наполнителя, и переносится подвижной фазой через колонку. Распределение в соответствии с размерами происходит в процессе движения и многоразовых обменов молекул растворенного вещества между молекулами растворителя (подвижной фазы) и тем же самым растворителем, находящимся в порах материала, которым заполнена колонка. Диапазон размеров распределенных молекул определяется диапазоном размеров пор наполнителя.
 Достаточно маленькие молекулы, способные проникать во все поры материала, элюируются в полном объеме колонки. Молекулы с размерами, превышающими размер всех пор материала колонки, мигрируют лишь сквозь простор между частицами наполнителя, не препятствуя им, и элюируются в свободном объеме колонки. Распределение молекул в соответствии с размерами происходит между свободным объемом и полным объемом колонки; наиболее эффективное распределение происходит в первые две трети данного диапазона.
Достаточно маленькие молекулы, способные проникать во все поры материала, элюируются в полном объеме колонки. Молекулы с размерами, превышающими размер всех пор материала колонки, мигрируют лишь сквозь простор между частицами наполнителя, не препятствуя им, и элюируются в свободном объеме колонки. Распределение молекул в соответствии с размерами происходит между свободным объемом и полным объемом колонки; наиболее эффективное распределение происходит в первые две трети данного диапазона.
 Оборудование. Специфичной частью оборудования является хроматографическая колонка подходящих размеров, заполненная материалом, который обеспечивает распределение молекул соответствующих размеров в необходимом диапазоне. Если необходимо, колонку термостатируют. Через колонку с постоянной скоростью пропускают элюент. К одному концу колонки обычно присоединяют приспособление для введения пробы, например, инжектор с прерывателем потока, шприцевой инжектор с мембраной для введения пробы без приостановки потока или петлевой инжектор с клапаном, который перекрывает поток. К этому же концу колонки также может быть присоединен соответствующий насос для подачи элюента с контролируемой скоростью. Проба может также наноситься непосредственно на сухую поверхность материала колонки или, если вязкость пробы превышает вязкость элюента, проба может наслаиваться на поверхность материала колонки под элюент.
Оборудование. Специфичной частью оборудования является хроматографическая колонка подходящих размеров, заполненная материалом, который обеспечивает распределение молекул соответствующих размеров в необходимом диапазоне. Если необходимо, колонку термостатируют. Через колонку с постоянной скоростью пропускают элюент. К одному концу колонки обычно присоединяют приспособление для введения пробы, например, инжектор с прерывателем потока, шприцевой инжектор с мембраной для введения пробы без приостановки потока или петлевой инжектор с клапаном, который перекрывает поток. К этому же концу колонки также может быть присоединен соответствующий насос для подачи элюента с контролируемой скоростью. Проба может также наноситься непосредственно на сухую поверхность материала колонки или, если вязкость пробы превышает вязкость элюента, проба может наслаиваться на поверхность материала колонки под элюент.
 Другой конец колонки обычно присоединяют к соответствующему детектору с приспособлением, регистрирующим и обеспечивающим контроль соответствующих концентраций распределенных компонентов пробы. Обычно используют детекторы: фотометрический, рефрактометрический или люминесцентный. При необходимости, может быть присоединен автоматический коллектор фракций.
Другой конец колонки обычно присоединяют к соответствующему детектору с приспособлением, регистрирующим и обеспечивающим контроль соответствующих концентраций распределенных компонентов пробы. Обычно используют детекторы: фотометрический, рефрактометрический или люминесцентный. При необходимости, может быть присоединен автоматический коллектор фракций.
 В качестве наполнителя может использоваться или мягкий материал, как набухший гель, или твердый, такой как пористое стекло, силикагель или подходящий для данного растворителя поперечно-сшитый органический полимер. При использовании твердых материалов обычно применяют принудительную подачу подвижной фазы под давлением, что ускоряет разделение. Подвижную фазу выбирают исходя из природы пробы, наполнителя и метода детектирования. Указания по обработке материала для заполнения колонки перед распределения и наполнения колонки представлены в соответствующей частной статье или инструкции изготовителя.
В качестве наполнителя может использоваться или мягкий материал, как набухший гель, или твердый, такой как пористое стекло, силикагель или подходящий для данного растворителя поперечно-сшитый органический полимер. При использовании твердых материалов обычно применяют принудительную подачу подвижной фазы под давлением, что ускоряет разделение. Подвижную фазу выбирают исходя из природы пробы, наполнителя и метода детектирования. Указания по обработке материала для заполнения колонки перед распределения и наполнения колонки представлены в соответствующей частной статье или инструкции изготовителя.
 Условия хроматографирования, такие, например, как размер колонки, скорость подвижной фазы, объем вводимой пробы и другие параметры, обозначенные в частной статье, не являются строго регламентированными и могут варьировать. При этом должны выполняться условия теста «Пригодность хроматографической системы» , и данный тест может учитывать влияние таких изменений на полученные результаты. Тесты на определение пригодности системы являются неотъемлемой частью методики и используются для того, чтобы удостовериться в адекватном функционировании хроматографической системы. Для оценки работы колонки обычно используются следующие параметры: эффективность, концентрационный коэффициент распределения, разрешение, относительное удерживание и фактор асимметрии.
Условия хроматографирования, такие, например, как размер колонки, скорость подвижной фазы, объем вводимой пробы и другие параметры, обозначенные в частной статье, не являются строго регламентированными и могут варьировать. При этом должны выполняться условия теста «Пригодность хроматографической системы» , и данный тест может учитывать влияние таких изменений на полученные результаты. Тесты на определение пригодности системы являются неотъемлемой частью методики и используются для того, чтобы удостовериться в адекватном функционировании хроматографической системы. Для оценки работы колонки обычно используются следующие параметры: эффективность, концентрационный коэффициент распределения, разрешение, относительное удерживание и фактор асимметрии.
 На хроматографическое поведение могут влиять такие факторы, как состав, ионная сила, температура и р. Н подвижной фазы, скорость потока, длина колонки, температура, давление, а также характеристики неподвижной фазы: пористость, размер частиц, удельная площадь поверхности, а в случае обращённой фазы – степень химической модификации (блокирование концевых групп, число атомов углерода и т. д. ). Различные компоненты используемого оборудования должны быть проверены на соответствие их качества и должны обладать точностью измерений требуемой для проведения испытания или количественного определения. Должны быть соблюдены следующие требования при отсутствии других указаний в частной статье:
На хроматографическое поведение могут влиять такие факторы, как состав, ионная сила, температура и р. Н подвижной фазы, скорость потока, длина колонки, температура, давление, а также характеристики неподвижной фазы: пористость, размер частиц, удельная площадь поверхности, а в случае обращённой фазы – степень химической модификации (блокирование концевых групп, число атомов углерода и т. д. ). Различные компоненты используемого оборудования должны быть проверены на соответствие их качества и должны обладать точностью измерений требуемой для проведения испытания или количественного определения. Должны быть соблюдены следующие требования при отсутствии других указаний в частной статье:
 Величина фактора асимметрии основного пика должна находиться в пределах от 0, 8 до 1, 5, если только нет иных указаний в частной статье. Данное требование распространяется как на тесты, так и на количественные определения, описанные в частных статьях. Максимальное допустимое относительное стандартное отклонение для повторных измерений для предписанного раствора сравнения не должно превышать величин, приведенных в Таблице 1. Данное требование распространяется только на количественное определение вещества и не используется в случае проведения испытания на родственные соединения.
Величина фактора асимметрии основного пика должна находиться в пределах от 0, 8 до 1, 5, если только нет иных указаний в частной статье. Данное требование распространяется как на тесты, так и на количественные определения, описанные в частных статьях. Максимальное допустимое относительное стандартное отклонение для повторных измерений для предписанного раствора сравнения не должно превышать величин, приведенных в Таблице 1. Данное требование распространяется только на количественное определение вещества и не используется в случае проведения испытания на родственные соединения.
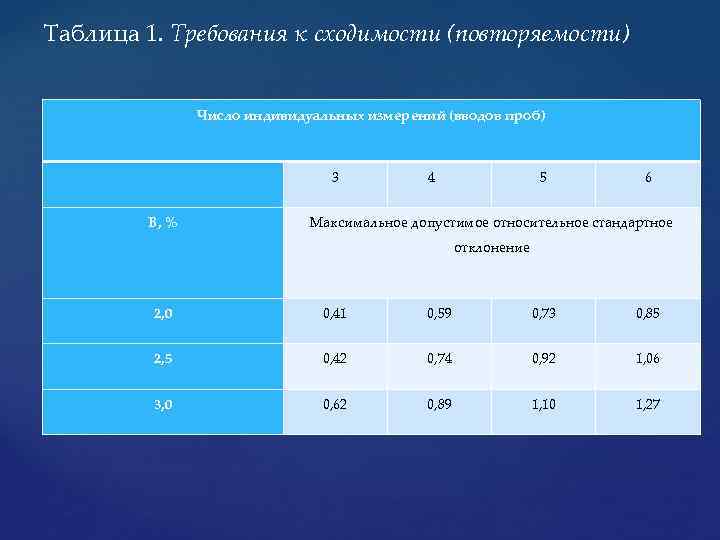 Taблица 1. Требования к сходимости (повторяемости) Число индивидуальных измерений (вводов проб) B, % 3 4 5 6 Максимальное допустимое относительное стандартное отклонение 2, 0 0, 41 0, 59 0, 73 0, 85 2, 5 0, 42 0, 74 0, 92 1, 06 3, 0 0, 62 0, 89 1, 10 1, 27
Taблица 1. Требования к сходимости (повторяемости) Число индивидуальных измерений (вводов проб) B, % 3 4 5 6 Максимальное допустимое относительное стандартное отклонение 2, 0 0, 41 0, 59 0, 73 0, 85 2, 5 0, 42 0, 74 0, 92 1, 06 3, 0 0, 62 0, 89 1, 10 1, 27
 Предел обнаружения пика (соответствующий отношению сигнал/шум равному 3) находится ниже допустимого содержания примеси (порога, ниже которого присутствие примеси отрицается) в тесте на родственные соединения. Предел количественного определения пика (соответствующий отношению сигнал/шум равному 10) равен или меньше, чем порог обнаружения примесей (порог, при котором отрицается присутствие примеси) в тесте на родственные соединения.
Предел обнаружения пика (соответствующий отношению сигнал/шум равному 3) находится ниже допустимого содержания примеси (порога, ниже которого присутствие примеси отрицается) в тесте на родственные соединения. Предел количественного определения пика (соответствующий отношению сигнал/шум равному 10) равен или меньше, чем порог обнаружения примесей (порог, при котором отрицается присутствие примеси) в тесте на родственные соединения.
 Применение эксклюзионной хроматографии Эксклюзионную хроматографию широко используют при исследовании полимеров, определении их молекулярных масс, а также в биологии и меди цине для анализа белков, крови и других объектов. Этот метод удобен для исследования образцов неизвестного состава, так как, можно не опасаться нежелательных превращений веществ в колонках. Метод эксклюзионной хроматографии можно использовать и в неорганическом анализе. Например, можно разделить ионы в зави симости т их о размера.
Применение эксклюзионной хроматографии Эксклюзионную хроматографию широко используют при исследовании полимеров, определении их молекулярных масс, а также в биологии и меди цине для анализа белков, крови и других объектов. Этот метод удобен для исследования образцов неизвестного состава, так как, можно не опасаться нежелательных превращений веществ в колонках. Метод эксклюзионной хроматографии можно использовать и в неорганическом анализе. Например, можно разделить ионы в зави симости т их о размера.
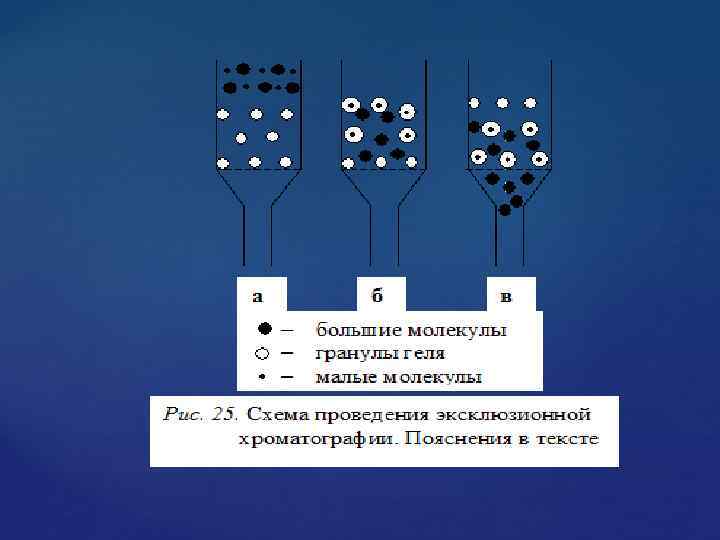
 На рис. 1 схематически представлен процесс гель фильтрации на сефадексе. На первой стадии процесса (рис. 1 а) изображена разделяемая смесь больших и малых молекул над гранулами геля. На второй стадии (рис. 1 б) малые молекулы равномерно распределяются по всему объему геля, причем малые молекулы задерживаются в гранулах геля, а большие молекулы не проникают в гранулы и остаются во внешнем объеме колонки. При промывании колонки растворителем в первую очередь начинают двигаться большие молекулы веществ (рис. 1 в), поскольку движение малых молекул тормозится их диффузией в неподвижную фазу (гель). Это третья стадия процесса.
На рис. 1 схематически представлен процесс гель фильтрации на сефадексе. На первой стадии процесса (рис. 1 а) изображена разделяемая смесь больших и малых молекул над гранулами геля. На второй стадии (рис. 1 б) малые молекулы равномерно распределяются по всему объему геля, причем малые молекулы задерживаются в гранулах геля, а большие молекулы не проникают в гранулы и остаются во внешнем объеме колонки. При промывании колонки растворителем в первую очередь начинают двигаться большие молекулы веществ (рис. 1 в), поскольку движение малых молекул тормозится их диффузией в неподвижную фазу (гель). Это третья стадия процесса.
 Разделение веществ в эксклюзионной хроматографии (колоночный вариант). Пусть общий объем колонки, заполненной гелем, – V = Vв + Vн + Vм (Vв – объем воды в гранулах геля – неподвижная фаза; Vн – объем воды, окружающий гранулы – подвижная фаза; Vм – объем, занимаемый матрицей геля). Растворенное вещество распределяется между водой, находящейся в гранулах геля, и водой, окружающей их. Это распределение характеризуется коэффициентом распределения К. Молекулы веществ большого размера, не попадающие в поры неподвижной фазы, элюируются из колонки вместе с подвижной фазой, для них К = 0.
Разделение веществ в эксклюзионной хроматографии (колоночный вариант). Пусть общий объем колонки, заполненной гелем, – V = Vв + Vн + Vм (Vв – объем воды в гранулах геля – неподвижная фаза; Vн – объем воды, окружающий гранулы – подвижная фаза; Vм – объем, занимаемый матрицей геля). Растворенное вещество распределяется между водой, находящейся в гранулах геля, и водой, окружающей их. Это распределение характеризуется коэффициентом распределения К. Молекулы веществ большого размера, не попадающие в поры неподвижной фазы, элюируются из колонки вместе с подвижной фазой, для них К = 0.
 В том случае, когда К = 1, вещества равномерно распределяются между подвижной и неподвижной фазами, наконец, молекулы веществ могут лишь частично проникать в гранулы геля, если диапазон значений К лежит в интервале 0
В том случае, когда К = 1, вещества равномерно распределяются между подвижной и неподвижной фазами, наконец, молекулы веществ могут лишь частично проникать в гранулы геля, если диапазон значений К лежит в интервале 0
 При обессоливании подбирают мелкопористые носители (сефадексы G– 10, 15 или 25 и биогели Р– 2, 6 или 10). Высокомолекулярные вещества (ВМВ) не проникают в поры таких носителей – они проходят в свободном объеме колонки и выходят из нее первыми. Соли же диффундируют в поры геля и выходят из колонки значительно позже. Гель фильтрация используется для фракционирования полимеров в соответствии с их относительной молекулярной массой, а также для определения последней.
При обессоливании подбирают мелкопористые носители (сефадексы G– 10, 15 или 25 и биогели Р– 2, 6 или 10). Высокомолекулярные вещества (ВМВ) не проникают в поры таких носителей – они проходят в свободном объеме колонки и выходят из нее первыми. Соли же диффундируют в поры геля и выходят из колонки значительно позже. Гель фильтрация используется для фракционирования полимеров в соответствии с их относительной молекулярной массой, а также для определения последней.
 При гель фильтрации объем выхода белков с колонки (появление фракции, отвечающей максимуму пика на хроматограмме) соответствует их относительным молекулярным массам и не изменяется при повторном пропускании вещества через одну и ту же колонку. Если заполненную гелем колонку откалибровать с помощью специального набора белков с известными относительными молекулярными массами, а затем пропустить через нее анализируемый белок, то путем измерения объема его выхода можно рассчитать относительную молекулярную массу данного белка.
При гель фильтрации объем выхода белков с колонки (появление фракции, отвечающей максимуму пика на хроматограмме) соответствует их относительным молекулярным массам и не изменяется при повторном пропускании вещества через одну и ту же колонку. Если заполненную гелем колонку откалибровать с помощью специального набора белков с известными относительными молекулярными массами, а затем пропустить через нее анализируемый белок, то путем измерения объема его выхода можно рассчитать относительную молекулярную массу данного белка.
 На практике фракционирование полимеров и определение их относительных молекулярных масс осуществляют следующим образом. В хроматографическую колонку, заполненную сефадексом G– 100 вводят смесь белков с известной относительной молекулярной массой: альбумина (Мr=65000) и инсулина (Мr= 5000), а также голубой декстран – вещество с высокой относительной молекулярной массой (Мr=2000000). Затем через колонку пропускают растворитель. На выходе элюат собирают в ряд пробирок и определяют концентрацию веществ. По полученным данным строят графическую зависимость концентрации компонентов от объема элюата (рис. 2).
На практике фракционирование полимеров и определение их относительных молекулярных масс осуществляют следующим образом. В хроматографическую колонку, заполненную сефадексом G– 100 вводят смесь белков с известной относительной молекулярной массой: альбумина (Мr=65000) и инсулина (Мr= 5000), а также голубой декстран – вещество с высокой относительной молекулярной массой (Мr=2000000). Затем через колонку пропускают растворитель. На выходе элюат собирают в ряд пробирок и определяют концентрацию веществ. По полученным данным строят графическую зависимость концентрации компонентов от объема элюата (рис. 2).
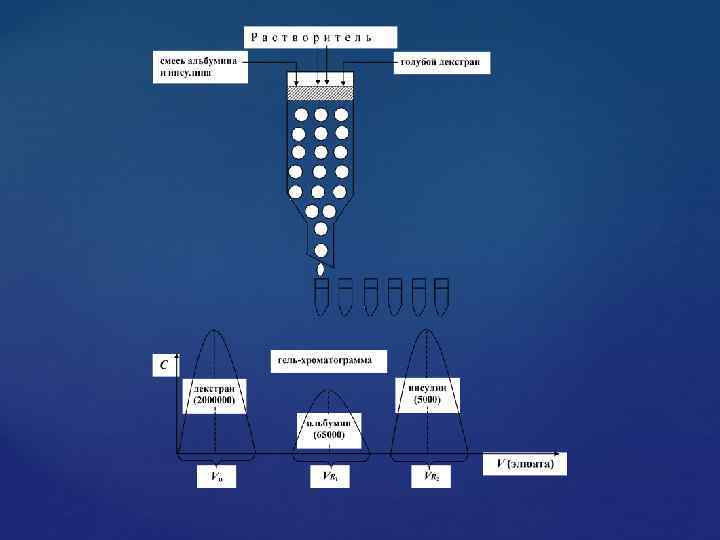
 Из гель хроматограммы видно, что вещества из колонки выйдут в следующем порядке: 1) декстран (Мr=2 000); 2) альбумин (Мr=65 000); 3) инсулин (Мr=5 000). Для определения относительной молекулярной массы исследуемых неизвестных белков по полученной гель хроматограмме находят объемы вышедших компонентов: V 0 – исключающий объем колонки, так как декстран с Мr=2 000 практически не проникает внутрь гранул геля сефадекса G– 100; VR 1 и VR 2 – элюирующие объемы разделяемых веществ (альбумина и инсулина).
Из гель хроматограммы видно, что вещества из колонки выйдут в следующем порядке: 1) декстран (Мr=2 000); 2) альбумин (Мr=65 000); 3) инсулин (Мr=5 000). Для определения относительной молекулярной массы исследуемых неизвестных белков по полученной гель хроматограмме находят объемы вышедших компонентов: V 0 – исключающий объем колонки, так как декстран с Мr=2 000 практически не проникает внутрь гранул геля сефадекса G– 100; VR 1 и VR 2 – элюирующие объемы разделяемых веществ (альбумина и инсулина).
 Затем рассчитывают константу К для каждого белка по формуле: где V – общий объем колонки; V 0 – исключающий объем колонки; VR – элюирующий объем вещества. Обычно строят графическую зависимость рассчитанной константы К от десятичного логарифма известной относительной молекулярной массы маркерных белков (рис. 3).
Затем рассчитывают константу К для каждого белка по формуле: где V – общий объем колонки; V 0 – исключающий объем колонки; VR – элюирующий объем вещества. Обычно строят графическую зависимость рассчитанной константы К от десятичного логарифма известной относительной молекулярной массы маркерных белков (рис. 3).
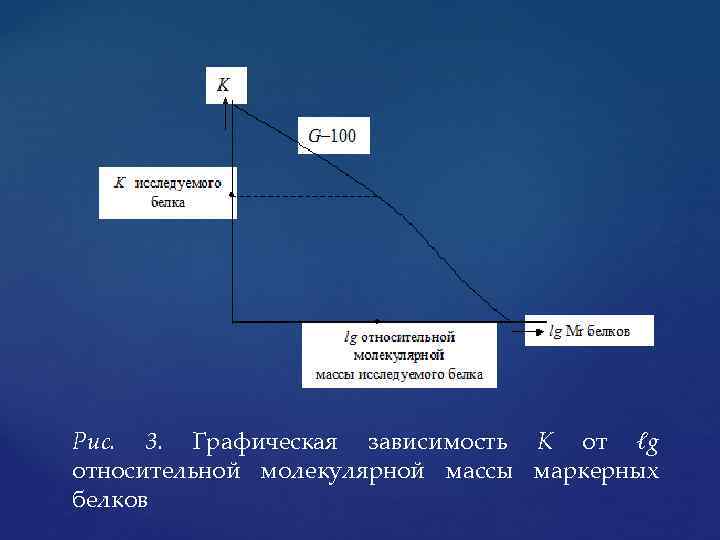 Рис. 3. Графическая зависимость К от ℓg относительной молекулярной массы маркерных белков
Рис. 3. Графическая зависимость К от ℓg относительной молекулярной массы маркерных белков
 Пропустив затем через колонку исследуемый белок и рассчитав по формуле его константу К, по графику можно определить его относительную молекулярную массу. Недостатки эксклюзионной хроматографии состоят в том, что нельзя разделять соединения с молекулами близких размеров и из за наличия границ рабочего интервала каждая колонка применима лишь к нескольким разделяемым компонентам. Этот метод непригоден для разделения изомеров и соединений, различающихся только функциональными группами. Кроме обычного использования эксклюзионной хроматографии для определения распределения полимеров по молекулярным массам, метод пригоден для предварительной оценки размеров молекул неизвестного образца перед его исследованиям.
Пропустив затем через колонку исследуемый белок и рассчитав по формуле его константу К, по графику можно определить его относительную молекулярную массу. Недостатки эксклюзионной хроматографии состоят в том, что нельзя разделять соединения с молекулами близких размеров и из за наличия границ рабочего интервала каждая колонка применима лишь к нескольким разделяемым компонентам. Этот метод непригоден для разделения изомеров и соединений, различающихся только функциональными группами. Кроме обычного использования эксклюзионной хроматографии для определения распределения полимеров по молекулярным массам, метод пригоден для предварительной оценки размеров молекул неизвестного образца перед его исследованиям.
 Эксклюзионная хроматография представляет собой наилучший метод для предварительного исследования образцов неизвестного состава. За короткое время, практически не опасаясь каких либо нежелательных превращений вещества в колонке, можно получить ценную информацию о степени сложности анализируемой смеси и (ориентировочно) о молекулярной массе ее компонентов. Все остальные разновидности ВЭЖХ требуют достаточно больших затрат времени при выборе условий разделения. Результаты предварительного разделения часто облегчают выбор варианта ВЭЖХ, который целесообразно использовать для детального изучения состава образца. Кроме того, эксклюзионная хроматография обычно является первым этапом при исследовании сложных смесей путем сочетания различных вариантов ВЭЖХ, так как позволяет легко выделить из смеси нужную группу веществ.
Эксклюзионная хроматография представляет собой наилучший метод для предварительного исследования образцов неизвестного состава. За короткое время, практически не опасаясь каких либо нежелательных превращений вещества в колонке, можно получить ценную информацию о степени сложности анализируемой смеси и (ориентировочно) о молекулярной массе ее компонентов. Все остальные разновидности ВЭЖХ требуют достаточно больших затрат времени при выборе условий разделения. Результаты предварительного разделения часто облегчают выбор варианта ВЭЖХ, который целесообразно использовать для детального изучения состава образца. Кроме того, эксклюзионная хроматография обычно является первым этапом при исследовании сложных смесей путем сочетания различных вариантов ВЭЖХ, так как позволяет легко выделить из смеси нужную группу веществ.
 Спасибо за внимание
Спасибо за внимание


