1-АХОВ-Зеленая Химия.pptx
- Количество слайдов: 163
 Экозащитные технологии в промышленности Лекции Prezentacii. com
Экозащитные технологии в промышленности Лекции Prezentacii. com
 • В силу используемых технологий и масштабов производства химическая промышленность является одним из крупнейших загрязнителей окружающей среды, но она же и на передовых позициях по развитию и внедрению экозащитных технологий. • По уровню использования водных ресурсов химическая промышленность опережает даже металлургию, уступая лишь электроэнергетике, по сбросу загрязнений в природные водоемы он занимает второе место (правда, по общему объему выбросов вредных веществ в атмосферу – лишь десятое). • На химический комплекс приходится четверть потребляемого российской промышленностью тепла и около 10% энергоресурсов.
• В силу используемых технологий и масштабов производства химическая промышленность является одним из крупнейших загрязнителей окружающей среды, но она же и на передовых позициях по развитию и внедрению экозащитных технологий. • По уровню использования водных ресурсов химическая промышленность опережает даже металлургию, уступая лишь электроэнергетике, по сбросу загрязнений в природные водоемы он занимает второе место (правда, по общему объему выбросов вредных веществ в атмосферу – лишь десятое). • На химический комплекс приходится четверть потребляемого российской промышленностью тепла и около 10% энергоресурсов.
 • В обществе сформировалось отрицательное отношение к химии, как отрасли промышленности, дающей высокий вклад в загрязнение окружающей среды, и представляющей повышенную опасность. • В России насчитывается около 4 тысяч химически опасных объектов, а сто сорок шесть городов с населением более ста тысяч человек расположены в зонах повышенной химической опасности. • Чрезвычайные аварийные ситуации на химических предприятиях могут повлиять на экологию не только локально, но и в международном масштабе.
• В обществе сформировалось отрицательное отношение к химии, как отрасли промышленности, дающей высокий вклад в загрязнение окружающей среды, и представляющей повышенную опасность. • В России насчитывается около 4 тысяч химически опасных объектов, а сто сорок шесть городов с населением более ста тысяч человек расположены в зонах повышенной химической опасности. • Чрезвычайные аварийные ситуации на химических предприятиях могут повлиять на экологию не только локально, но и в международном масштабе.

 № Виды ЧС Доля 1 Аварии в зданиях жилого и социально-бытового назначения 27 % 2 Аварии на промышленных объектах 24 % 3 Крупные автомобильные катастрофы (пострадало более 4 человек) 11 % 4 Аварии в системах жизнеобеспечения 8 % 5 Аварии на магистральных трубопроводах 8 % 6 Химические аварии 8 % 7 Обнаружение взрывчатых веществ (боеприпасов) в населенных пунктах 6 % 8 Авиационные катастрофы 2 % 9 Аварии на грузовых и пассажирских судах 2 % 10 Крушения, аварии и столкновения на ж/д транспорте, в т. ч. на метрополитене 2 % 11 Обнаружение (утрата) радиоактивных источников 2 %
№ Виды ЧС Доля 1 Аварии в зданиях жилого и социально-бытового назначения 27 % 2 Аварии на промышленных объектах 24 % 3 Крупные автомобильные катастрофы (пострадало более 4 человек) 11 % 4 Аварии в системах жизнеобеспечения 8 % 5 Аварии на магистральных трубопроводах 8 % 6 Химические аварии 8 % 7 Обнаружение взрывчатых веществ (боеприпасов) в населенных пунктах 6 % 8 Авиационные катастрофы 2 % 9 Аварии на грузовых и пассажирских судах 2 % 10 Крушения, аварии и столкновения на ж/д транспорте, в т. ч. на метрополитене 2 % 11 Обнаружение (утрата) радиоактивных источников 2 %
 Авария в Китае в 2010 г. • 300 бочек с отходами
Авария в Китае в 2010 г. • 300 бочек с отходами
 • Химические катастрофы относятся к числу так называемых техногенных, т. е. связанных со сложными техническими устройствами и сооружениями. • Поскольку человечество, не удовлетворяясь природными ядами, синтезировало еще 7 миллионов искусственных токсичных веществ и из них 60 -70 тысяч находятся в близком соприкосновении с людьми или недалеко от мест их проживания, опасность аварий и катастроф, связанных с выбросами таких веществ весьма велика. • По расчетам экспертов затраты на предупреждение аварий во много раз меньше по сравнению с величиной ущерба, к которому они приводят в случае возникновения. Поэтому во всем мире вопросам безопасности химических производств придается очень большое значение.
• Химические катастрофы относятся к числу так называемых техногенных, т. е. связанных со сложными техническими устройствами и сооружениями. • Поскольку человечество, не удовлетворяясь природными ядами, синтезировало еще 7 миллионов искусственных токсичных веществ и из них 60 -70 тысяч находятся в близком соприкосновении с людьми или недалеко от мест их проживания, опасность аварий и катастроф, связанных с выбросами таких веществ весьма велика. • По расчетам экспертов затраты на предупреждение аварий во много раз меньше по сравнению с величиной ущерба, к которому они приводят в случае возникновения. Поэтому во всем мире вопросам безопасности химических производств придается очень большое значение.
 • Наибольшее число аварий в мире и в России происходит на предприятиях, производящих или хранящих аммиак, хлор, минеральные удобрения, гербициды, продукты органического и нефтеорганического синтеза.
• Наибольшее число аварий в мире и в России происходит на предприятиях, производящих или хранящих аммиак, хлор, минеральные удобрения, гербициды, продукты органического и нефтеорганического синтеза.

 • В середине 60 -х гг. на ст. Горький произошла утечка хлора, вызвавшая тяжелые последствия для населения и окружающей среды. Это привело к необходимости разработки перечня группы опасных для человека химических веществ. Эти вещества получили название сильно действующие ядовитые вещества (СДЯВ). • СДЯВ – это вещества, при попадании которых в окружающую среду в количествах, превышающих предельно допустимые концентрации (ПДК), на людей, животных и растения оказывается воздействие, вызывающее у них поражения различной степени тяжести, в том числе смертельные. • В 80 -х гг. был разработан перечень СДЯВ из 107 наименований. Однако он оказался мало пригоден – чрезмерно перегружен ядовитыми веществами. Кроме того, отсутствовали токсические характеристики большинства химически опасных веществ. Следовательно, невозможно было делать прогнозы о масштабах зон заражения ими и планировать защитные мероприятия. • Позднее был разработан перечень ядовитых веществ по классам опасности.
• В середине 60 -х гг. на ст. Горький произошла утечка хлора, вызвавшая тяжелые последствия для населения и окружающей среды. Это привело к необходимости разработки перечня группы опасных для человека химических веществ. Эти вещества получили название сильно действующие ядовитые вещества (СДЯВ). • СДЯВ – это вещества, при попадании которых в окружающую среду в количествах, превышающих предельно допустимые концентрации (ПДК), на людей, животных и растения оказывается воздействие, вызывающее у них поражения различной степени тяжести, в том числе смертельные. • В 80 -х гг. был разработан перечень СДЯВ из 107 наименований. Однако он оказался мало пригоден – чрезмерно перегружен ядовитыми веществами. Кроме того, отсутствовали токсические характеристики большинства химически опасных веществ. Следовательно, невозможно было делать прогнозы о масштабах зон заражения ими и планировать защитные мероприятия. • Позднее был разработан перечень ядовитых веществ по классам опасности.
 • Аварии последних лет показали, что ЧС могут возникать в результате не только распространения СДЯВ в атмосфере, но и при попадании в водоемы. Возникла необходимость принять новое определение для опасных химических веществ, которые приводят к ЧС. • В соответствии ГОСТ 22. 9. 05 -95 Российской Федерации СДЯВ переименованы в АХОВ (аварийно химические опасные вещества). • АХОВ – это опасное химическое вещество, применяемое в промышленности и сельском хозяйстве, при аварийном выбросе которого может произойти заражение окружающей среды в поражающих живые организмы концентрациях (токсодозах). • Токсичность – свойства вещества вызывать отравления (интоксикацию) организма; характеризуется дозой вещества, способной вызвать ту или иную степень отравления. • Токсодоза – количественная характеристика токсичности АХОВ, соответствующая определенному уровню поражения при его воздействии на живой организм.
• Аварии последних лет показали, что ЧС могут возникать в результате не только распространения СДЯВ в атмосфере, но и при попадании в водоемы. Возникла необходимость принять новое определение для опасных химических веществ, которые приводят к ЧС. • В соответствии ГОСТ 22. 9. 05 -95 Российской Федерации СДЯВ переименованы в АХОВ (аварийно химические опасные вещества). • АХОВ – это опасное химическое вещество, применяемое в промышленности и сельском хозяйстве, при аварийном выбросе которого может произойти заражение окружающей среды в поражающих живые организмы концентрациях (токсодозах). • Токсичность – свойства вещества вызывать отравления (интоксикацию) организма; характеризуется дозой вещества, способной вызвать ту или иную степень отравления. • Токсодоза – количественная характеристика токсичности АХОВ, соответствующая определенному уровню поражения при его воздействии на живой организм.
 Классификация АХОВ: • 1. По способу действия на организм. - ингаляционного действия (АХОВ ИД) - поступают через органы дыхания; - перорального действия (АХОВ ПД) – поступают через рот; - кожно-резорбтивного воздействуют через кожу. действия (АХОВ КРД) –
Классификация АХОВ: • 1. По способу действия на организм. - ингаляционного действия (АХОВ ИД) - поступают через органы дыхания; - перорального действия (АХОВ ПД) – поступают через рот; - кожно-резорбтивного воздействуют через кожу. действия (АХОВ КРД) –
 2. По степени воздействия на организм человека химические вещества делятся на 4 класса: • • • • 1 -класс. Чрезвычайно опасные: соединения ртути, свинца, кадмия, цинка; цианистый водород, синильная кислота и ее соли, нитриты; соединения фосфора; галогеноводороды: водород хлористый, водород фтористый, водород бромистый; хлориды: этиленхлоргидрин, этилхлоргидрит; некоторые другие соединения: фосген, оксид этилена. 2 класс. Высоко опасные: минеральные и органические кислоты: серная, азотная, соляная; щелочи: аммиак, едкий натрий; серосодержащие соединения: сульфиды, сероуглерод; некоторые спирты и альдегиды кислот: формальдегид, метиловый спирт; органические и неорганические нитро- и аминосоединения: анилин, нитробензол; фенолы, крезолы и их производные. 3 класс. Умеренно опасные. относятся все остальные химические соединения. 4 класс. Малоопасные.
2. По степени воздействия на организм человека химические вещества делятся на 4 класса: • • • • 1 -класс. Чрезвычайно опасные: соединения ртути, свинца, кадмия, цинка; цианистый водород, синильная кислота и ее соли, нитриты; соединения фосфора; галогеноводороды: водород хлористый, водород фтористый, водород бромистый; хлориды: этиленхлоргидрин, этилхлоргидрит; некоторые другие соединения: фосген, оксид этилена. 2 класс. Высоко опасные: минеральные и органические кислоты: серная, азотная, соляная; щелочи: аммиак, едкий натрий; серосодержащие соединения: сульфиды, сероуглерод; некоторые спирты и альдегиды кислот: формальдегид, метиловый спирт; органические и неорганические нитро- и аминосоединения: анилин, нитробензол; фенолы, крезолы и их производные. 3 класс. Умеренно опасные. относятся все остальные химические соединения. 4 класс. Малоопасные.
 3. Классификация АХОВ по основным физикохимическим свойствам и условиям хранения. Группа Характеристики 1 Жидкие летучие, хранимые в емкостях под давлением (сжатые и сжиженные газы) Жидкие летучие, хранимые в емкостях без давления 2 3 Дымящие кислоты 4 Сыпучие и твердые нелетучие при хранении до + 40 градусов С 5 Сыпучие и твердые летучие при хранении до + 40 градусов С Типичные представители Хлор, аммиак, сероводород, фосген Синильная кислота, акрилонитрил, хлорпикрин Серная, азотная, соляная Сулема, фосфор желтый, мышьяковый ангидрид Соли синильной кислоты, меркураны
3. Классификация АХОВ по основным физикохимическим свойствам и условиям хранения. Группа Характеристики 1 Жидкие летучие, хранимые в емкостях под давлением (сжатые и сжиженные газы) Жидкие летучие, хранимые в емкостях без давления 2 3 Дымящие кислоты 4 Сыпучие и твердые нелетучие при хранении до + 40 градусов С 5 Сыпучие и твердые летучие при хранении до + 40 градусов С Типичные представители Хлор, аммиак, сероводород, фосген Синильная кислота, акрилонитрил, хлорпикрин Серная, азотная, соляная Сулема, фосфор желтый, мышьяковый ангидрид Соли синильной кислоты, меркураны
 4. Классификация АХОВ по преимущественному синдрому, складывающему при острой интоксикации: № п/п 1 2 3 4 5 6 Наименование группы Характер действия Наименование АХОВ Вещества Воздействуют на Хлор, фосген, хлорпикрин, преимущественно дыхательные пути человека треххлористый фосфор, удушающего действия хлорокись фосфора Вещества Нарушают энергетический Оксид углерода (11), цианистый преимущественно обмен водород, хлорциан, общеядовитого действия мышьяковистый водород Вещества удушающего и Вызывают отек легких, при Акрилонитрил, азотная кислота, общеядовитого действия ингаляционном воздействии оксиды азота, сернистый и нарушают энергетический ангидрит, фтористый водород, обмен при резорбции сероводород Нейротропные яды Действуют на генерацию, Сероуглерод, проведение и передачу фосфорорганические соединения нервного импульса (ФОС) Вещества удушающего и Вызывают токсический оттек Аммиак нейротропного действия легких, формируют тяжелое поражение нервной системы Метаболические яды Нарушают процессы Оксид этилена, бромистый метил, метаболизма и обмена дихлорэтан, диоксин веществ в организме
4. Классификация АХОВ по преимущественному синдрому, складывающему при острой интоксикации: № п/п 1 2 3 4 5 6 Наименование группы Характер действия Наименование АХОВ Вещества Воздействуют на Хлор, фосген, хлорпикрин, преимущественно дыхательные пути человека треххлористый фосфор, удушающего действия хлорокись фосфора Вещества Нарушают энергетический Оксид углерода (11), цианистый преимущественно обмен водород, хлорциан, общеядовитого действия мышьяковистый водород Вещества удушающего и Вызывают отек легких, при Акрилонитрил, азотная кислота, общеядовитого действия ингаляционном воздействии оксиды азота, сернистый и нарушают энергетический ангидрит, фтористый водород, обмен при резорбции сероводород Нейротропные яды Действуют на генерацию, Сероуглерод, проведение и передачу фосфорорганические соединения нервного импульса (ФОС) Вещества удушающего и Вызывают токсический оттек Аммиак нейротропного действия легких, формируют тяжелое поражение нервной системы Метаболические яды Нарушают процессы Оксид этилена, бромистый метил, метаболизма и обмена дихлорэтан, диоксин веществ в организме
 5. По способности к горению, все АХОВ делятся на: - негорючие (фосген, диоксин); - трудногорючие вещества (сжиженный аммиак, цианистый водород и др. ), способные гореть только в присутствии источника зажигания; - горючие вещества (газообразный аммиак, сероуглерод и др. ), способные к горению даже после удаления источника зажигания.
5. По способности к горению, все АХОВ делятся на: - негорючие (фосген, диоксин); - трудногорючие вещества (сжиженный аммиак, цианистый водород и др. ), способные гореть только в присутствии источника зажигания; - горючие вещества (газообразный аммиак, сероуглерод и др. ), способные к горению даже после удаления источника зажигания.
 • К АХОВ относятся только те вещества, которые могут представлять опасность лишь в аварийных ситуациях. • В настоящее время перечень АХОВ не разработан. Но исходя из оценки масштабов реальной опасности, зависящие от токсичности вещества, величины их запасов и характера распространения в атмосфере, - перечень АХОВ, от воздействия которых необходимо обеспечить защиту, в настоящее время, можно ограничить 9 веществами: хлор, аммиак, фосген, сернистый ангидрид, цианистый водород, сероуглерод, фтористый водород, нитрил акриловой кислоты. • Время воздействий опасных концентраций зависит от типа и количества выброшенного (вылитого) АХОВ, а также метеоусловий в районе аварий (скорости ветра и температуры окружающей среды). Так, например, при выбросе 50 тыс. тонн АХОВ и температуре окружающей среды 20 градусов С время действия хлора, аммиака, фосгена и сероводорода составляет 1, 8; 3, 2; 1, 7 и 6, 7 суток соответственно.
• К АХОВ относятся только те вещества, которые могут представлять опасность лишь в аварийных ситуациях. • В настоящее время перечень АХОВ не разработан. Но исходя из оценки масштабов реальной опасности, зависящие от токсичности вещества, величины их запасов и характера распространения в атмосфере, - перечень АХОВ, от воздействия которых необходимо обеспечить защиту, в настоящее время, можно ограничить 9 веществами: хлор, аммиак, фосген, сернистый ангидрид, цианистый водород, сероуглерод, фтористый водород, нитрил акриловой кислоты. • Время воздействий опасных концентраций зависит от типа и количества выброшенного (вылитого) АХОВ, а также метеоусловий в районе аварий (скорости ветра и температуры окружающей среды). Так, например, при выбросе 50 тыс. тонн АХОВ и температуре окружающей среды 20 градусов С время действия хлора, аммиака, фосгена и сероводорода составляет 1, 8; 3, 2; 1, 7 и 6, 7 суток соответственно.
 • Как правило, в технологических линиях обращается, незначительное количество токсических химических продуктов. Значительно большее количество АХОВ по объему содержится на складах предприятий. Это приводит к тому, что при авариях в цехах предприятий в большинстве случаев имеет место локальное загрязнение воздуха, оборудования цехов, территорий предприятий. При этом поражение в таких случаях может получить в основном производственный персонал. При авариях на складах предприятий, когда разрушаются крупнотоннажные емкости, АХОВ распространяются за пределы предприятия, приводя к массовому поражению не только персонала предприятия, но и населения, живущего вблизи химически опасных предприятий.
• Как правило, в технологических линиях обращается, незначительное количество токсических химических продуктов. Значительно большее количество АХОВ по объему содержится на складах предприятий. Это приводит к тому, что при авариях в цехах предприятий в большинстве случаев имеет место локальное загрязнение воздуха, оборудования цехов, территорий предприятий. При этом поражение в таких случаях может получить в основном производственный персонал. При авариях на складах предприятий, когда разрушаются крупнотоннажные емкости, АХОВ распространяются за пределы предприятия, приводя к массовому поражению не только персонала предприятия, но и населения, живущего вблизи химически опасных предприятий.
 • На производственных площадках или в транспортных средствах АХОВ, как правило, содержатся в стандартных емкостных элементах. Это могут быть алюминиевые, стальные и железобетонные оболочки, в которых поддерживаются условия, соответствующие заданному режиму хранения. Способы хранения выбираются в зависимости от физико-химических свойств АХОВ. • Основная цель – уменьшить объем хранимого вещества, что является весьма важным при промышленных масштабах использования химически опасных веществ. • Основным параметром, влияющим на выбор способа хранения, является температура кипения АХОВ.
• На производственных площадках или в транспортных средствах АХОВ, как правило, содержатся в стандартных емкостных элементах. Это могут быть алюминиевые, стальные и железобетонные оболочки, в которых поддерживаются условия, соответствующие заданному режиму хранения. Способы хранения выбираются в зависимости от физико-химических свойств АХОВ. • Основная цель – уменьшить объем хранимого вещества, что является весьма важным при промышленных масштабах использования химически опасных веществ. • Основным параметром, влияющим на выбор способа хранения, является температура кипения АХОВ.
 • В среднем на предприятиях минимальные (неснижаемые) запасы химических продуктов создаются на трое суток, а для заводов по производству минеральных удобрений на 10 -15 суток работы. • Кроме того по ФЗ № 116 «О промышленной безопасности» даются предельные количества химически опасных веществ, которые можно хранить и использовать на промышленных предприятиях: • Аммиак -500 т; • Нитрат аммония – 2500 т; • Акрилонитрил – 200 т; • Хлор – 25 т; • Оксид этилена – 50 т; • Цианистый водород – 20 т; • Сернистый водород – 50 т; • Диоксид серы – 250 т; • Метилизоцианат – 0, 15 т.
• В среднем на предприятиях минимальные (неснижаемые) запасы химических продуктов создаются на трое суток, а для заводов по производству минеральных удобрений на 10 -15 суток работы. • Кроме того по ФЗ № 116 «О промышленной безопасности» даются предельные количества химически опасных веществ, которые можно хранить и использовать на промышленных предприятиях: • Аммиак -500 т; • Нитрат аммония – 2500 т; • Акрилонитрил – 200 т; • Хлор – 25 т; • Оксид этилена – 50 т; • Цианистый водород – 20 т; • Сернистый водород – 50 т; • Диоксид серы – 250 т; • Метилизоцианат – 0, 15 т.
 Для хранения АХОВ на складах предприятий используются следующие основные способы: • в резервуарах под высоким давлением (в этом случае расчетное давление в резервуаре соответствует давлению паров продукта над жидкостью при абсолютной максимальной температуре окружающей среды – хлор, аммиак и др. ); • в изотермических хранилищах при давлении близком к атмосферному (низкотемпературное хранилище) или до 1 Па (изотермическое хранилище, при этом используются шаровые резервуары большой вместимости от 900 до 2000 т, например, аммиак при t = -33, 4°С); • хранение при температуре окружающей среды в закрытых емкостях (характерно для высококипящих жидкостей – гидразин, тетраэтилсвинец). • Способ хранения АХОВ во многом определяет их поведение при авариях.
Для хранения АХОВ на складах предприятий используются следующие основные способы: • в резервуарах под высоким давлением (в этом случае расчетное давление в резервуаре соответствует давлению паров продукта над жидкостью при абсолютной максимальной температуре окружающей среды – хлор, аммиак и др. ); • в изотермических хранилищах при давлении близком к атмосферному (низкотемпературное хранилище) или до 1 Па (изотермическое хранилище, при этом используются шаровые резервуары большой вместимости от 900 до 2000 т, например, аммиак при t = -33, 4°С); • хранение при температуре окружающей среды в закрытых емкостях (характерно для высококипящих жидкостей – гидразин, тетраэтилсвинец). • Способ хранения АХОВ во многом определяет их поведение при авариях.
 Прогностические оценки на ближайшую перспективу показывают, что тенденция повышение вероятности химических аварий будет сохраняться. Для этого есть целый ряд предпосылок: • • • рост сложных производств с применением новых технологий, которые требуют высокую концентрацию энергии и опасных веществ, крупные структурные изменения в экономике страны, приведшие к остановке ряда производств, нарушению хозяйственных связей и сбоям в технологических цепочках; высокий и все прогрессирующий износ основных производственных фондов, достигающих на ряде предприятий 80 -100%; падение технологической и производственной дисциплины, уровня квалификации технического персонала; накопление отходов производства, опасных для окружающей среды; снижение требовательности и эффективности работы надзорных органов; высокая концентрация населения, проживающего вблизи потенциально опасных промышленных объектов; отсутствие или недостаточный уровень предупреждающих мероприятий, способных уменьшить масштабы последствий химических аварий и снизить риск их возникновения; недостаточная законодательная и нормативная база; неизбежное увеличение объема химического производства, переход к работе с полной нагрузкой крупнейших химических комплексов страны, увеличение объема перевозок и хранения АХОВ; стремление иностранных государств и фирм к инвестированию вредных производств на территории России; -возрастание вероятности терроризма на химически опасных производствах.
Прогностические оценки на ближайшую перспективу показывают, что тенденция повышение вероятности химических аварий будет сохраняться. Для этого есть целый ряд предпосылок: • • • рост сложных производств с применением новых технологий, которые требуют высокую концентрацию энергии и опасных веществ, крупные структурные изменения в экономике страны, приведшие к остановке ряда производств, нарушению хозяйственных связей и сбоям в технологических цепочках; высокий и все прогрессирующий износ основных производственных фондов, достигающих на ряде предприятий 80 -100%; падение технологической и производственной дисциплины, уровня квалификации технического персонала; накопление отходов производства, опасных для окружающей среды; снижение требовательности и эффективности работы надзорных органов; высокая концентрация населения, проживающего вблизи потенциально опасных промышленных объектов; отсутствие или недостаточный уровень предупреждающих мероприятий, способных уменьшить масштабы последствий химических аварий и снизить риск их возникновения; недостаточная законодательная и нормативная база; неизбежное увеличение объема химического производства, переход к работе с полной нагрузкой крупнейших химических комплексов страны, увеличение объема перевозок и хранения АХОВ; стремление иностранных государств и фирм к инвестированию вредных производств на территории России; -возрастание вероятности терроризма на химически опасных производствах.
 Безопасность функционирования химически опасных предприятий зависит от многих факторов : • физико-химические свойства сырья, полуфабрикатов и продуктов, характер технологических процессов; • конструкция и надежность оборудования; • условия хранения и транспортировки АХОВ; • состояние контрольно-измерительных приборов средств автоматизации; • эффективность средств противоаварийной защиты; • уровень организации профилактической работы; • наличие и совершенство диагностических комплексе своевременность и качество планово-предупредительных ремонтных работ; • подготовленность и практические навыки персонала; система надзора за состоянием технических средств противоаварийной защиты.
Безопасность функционирования химически опасных предприятий зависит от многих факторов : • физико-химические свойства сырья, полуфабрикатов и продуктов, характер технологических процессов; • конструкция и надежность оборудования; • условия хранения и транспортировки АХОВ; • состояние контрольно-измерительных приборов средств автоматизации; • эффективность средств противоаварийной защиты; • уровень организации профилактической работы; • наличие и совершенство диагностических комплексе своевременность и качество планово-предупредительных ремонтных работ; • подготовленность и практические навыки персонала; система надзора за состоянием технических средств противоаварийной защиты.

 По определению МЧС РФ, ХИМИЧЕСКАЯ АВАРИЯ • – это нарушение технологических процессов на производстве, повреждение трубопроводов, емкостей, хранилищ, транспортных средств, приводящее к выбросу аварийных химически опасных веществ (АХОВ) в атмосферу в количествах, представляющих опасность для жизни и здоровья людей, функционирования биосферы.
По определению МЧС РФ, ХИМИЧЕСКАЯ АВАРИЯ • – это нарушение технологических процессов на производстве, повреждение трубопроводов, емкостей, хранилищ, транспортных средств, приводящее к выбросу аварийных химически опасных веществ (АХОВ) в атмосферу в количествах, представляющих опасность для жизни и здоровья людей, функционирования биосферы.

 • Крупными запасами АХОВ, главным образом хлора, аммиака, фосгена, синильной кислоты, сернистого ангидрида и других веществ, располагают химические, целлюлозно-бумажные и перерабатывающие комбинаты, заводы минеральных удобрений, черной и цветной металлургии, а также хладокомбинаты, пивзаводы, кондитерские фабрики, овощебазы и водопроводные станции. • Опасность химической аварии для людей и животных заключается в нарушении нормальной жизнедеятельности организма и возможности отдаленных генетических последствий, а при определенных обстоятельствах – в летальном исходе при попадании АХВ в организм через органы дыхания, кожу, слизистые оболочки, раны и вместе с пищей.
• Крупными запасами АХОВ, главным образом хлора, аммиака, фосгена, синильной кислоты, сернистого ангидрида и других веществ, располагают химические, целлюлозно-бумажные и перерабатывающие комбинаты, заводы минеральных удобрений, черной и цветной металлургии, а также хладокомбинаты, пивзаводы, кондитерские фабрики, овощебазы и водопроводные станции. • Опасность химической аварии для людей и животных заключается в нарушении нормальной жизнедеятельности организма и возможности отдаленных генетических последствий, а при определенных обстоятельствах – в летальном исходе при попадании АХВ в организм через органы дыхания, кожу, слизистые оболочки, раны и вместе с пищей.
 ПРЕДУПРЕДИТЕЛЬНЫЕ МЕРОПРИЯТИЯ (рекомендации МЧС) • Уточните, находится ли вблизи места Вашего проживания или работы химически опасный объект. Если да, то ознакомьтесь со свойствами, отличительными признаками и потенциальной опасностью АХОВ, имеющихся на данном объекте. Запомните характерные особенности сигнала оповещения населения об аварии «Внимание всем» по радио (вой сирен и прерывистые гудки предприятий), порядок действий при его получении, правила герметизации помещения, защиты продовольствия и воды. Изготовьте и храните в доступном месте ватно-марлевые повязки для себя и членов семьи, а также памятку по действиям населения при аварии на химически опасном объекте. При возможности приобретите противогазы с коробками, защищающими от соответствующих видов АХОВ.
ПРЕДУПРЕДИТЕЛЬНЫЕ МЕРОПРИЯТИЯ (рекомендации МЧС) • Уточните, находится ли вблизи места Вашего проживания или работы химически опасный объект. Если да, то ознакомьтесь со свойствами, отличительными признаками и потенциальной опасностью АХОВ, имеющихся на данном объекте. Запомните характерные особенности сигнала оповещения населения об аварии «Внимание всем» по радио (вой сирен и прерывистые гудки предприятий), порядок действий при его получении, правила герметизации помещения, защиты продовольствия и воды. Изготовьте и храните в доступном месте ватно-марлевые повязки для себя и членов семьи, а также памятку по действиям населения при аварии на химически опасном объекте. При возможности приобретите противогазы с коробками, защищающими от соответствующих видов АХОВ.
 ДЕЙСТВИЯ ПРИ ХИМИЧЕСКОЙ АВАРИИ • • При сигнале «Внимание всем!» включите радиоприемник и телевизор для получения достоверной информации об аварии и рекомендуемых действиях. Закройте окна, отключите электробытовые приборы и газ. Наденьте резиновые сапоги, плащ, возьмите документы, необходимые теплые вещи, 3 -х суточный запас непортящихся продуктов, оповестите соседей и быстро, но без паники выходите из зоны возможного заражения перпендикулярно направлению ветра, на расстояние не менее 1, 5 км от предыдущего места пребывания. Для защиты органов дыхания используйте противогаз, а при его отсутствии – ватномарлевую повязку или подручные изделия из ткани, смоченные в воде, 2 -5%ном растворе пищевой соды (для защиты от хлора), 2%-ном растворе лимонной или уксусной кислоты (для защиты от аммиака). При невозможности покинуть зону заражения плотно закройте двери, окна, вентиляционные отверстия и дымоходы. Имеющиеся в них щели заклейте бумагой или скотчем. Не укрывайтесь на первых этажах зданий, в подвалах и полуподвалах. При авариях на железнодорожных и автомобильных магистралях, связанных с транспортировкой АХОВ, опасная зона устанавливается в радиусе 200 м от места аварии. Приближаться к этой зоне и входить в нее категорически запрещено.
ДЕЙСТВИЯ ПРИ ХИМИЧЕСКОЙ АВАРИИ • • При сигнале «Внимание всем!» включите радиоприемник и телевизор для получения достоверной информации об аварии и рекомендуемых действиях. Закройте окна, отключите электробытовые приборы и газ. Наденьте резиновые сапоги, плащ, возьмите документы, необходимые теплые вещи, 3 -х суточный запас непортящихся продуктов, оповестите соседей и быстро, но без паники выходите из зоны возможного заражения перпендикулярно направлению ветра, на расстояние не менее 1, 5 км от предыдущего места пребывания. Для защиты органов дыхания используйте противогаз, а при его отсутствии – ватномарлевую повязку или подручные изделия из ткани, смоченные в воде, 2 -5%ном растворе пищевой соды (для защиты от хлора), 2%-ном растворе лимонной или уксусной кислоты (для защиты от аммиака). При невозможности покинуть зону заражения плотно закройте двери, окна, вентиляционные отверстия и дымоходы. Имеющиеся в них щели заклейте бумагой или скотчем. Не укрывайтесь на первых этажах зданий, в подвалах и полуподвалах. При авариях на железнодорожных и автомобильных магистралях, связанных с транспортировкой АХОВ, опасная зона устанавливается в радиусе 200 м от места аварии. Приближаться к этой зоне и входить в нее категорически запрещено.
 ДЕЙСТВИЯ ПОСЛЕ ХИМИЧЕСКОЙ АВАРИИ • При подозрении на поражение АХОВ исключите любые физические нагрузки, примите обильное питье (молоко, чай) и немедленно обратитесь к врачу. Вход в здания разрешается только после контрольной проверки содержания в них АХОВ. Если Вы попали под непосредственное воздействие АХОВ, то при первой возможности примите душ. Зараженную одежду постирайте, а при невозможности стирки – выбросьте. Проведите тщательную влажную уборку помещения. Воздержитесь от употребления водопроводной (тем более колодезной!) воды, фруктов и овощей из огорода, мяса скота и птицы, забитых после аварии, до официального заключения об их безопасности.
ДЕЙСТВИЯ ПОСЛЕ ХИМИЧЕСКОЙ АВАРИИ • При подозрении на поражение АХОВ исключите любые физические нагрузки, примите обильное питье (молоко, чай) и немедленно обратитесь к врачу. Вход в здания разрешается только после контрольной проверки содержания в них АХОВ. Если Вы попали под непосредственное воздействие АХОВ, то при первой возможности примите душ. Зараженную одежду постирайте, а при невозможности стирки – выбросьте. Проведите тщательную влажную уборку помещения. Воздержитесь от употребления водопроводной (тем более колодезной!) воды, фруктов и овощей из огорода, мяса скота и птицы, забитых после аварии, до официального заключения об их безопасности.


 Зеленая химия Prezentacii. com
Зеленая химия Prezentacii. com
 • Химия окружающей среды изучает источники, распространение, устойчивость и воздействие химических загрязнителей. • Химия для окружающей среды обеспечивает химические решения для того, чтобы избавиться от загрязнений. Prezentacii. com
• Химия окружающей среды изучает источники, распространение, устойчивость и воздействие химических загрязнителей. • Химия для окружающей среды обеспечивает химические решения для того, чтобы избавиться от загрязнений. Prezentacii. com
 • При этом существует три возможных пути химических решений: • 1. Уничтожать загрязнители, поступившие в окружающую среду • 2. Ограничивать их распространение, если они локальные • 3. Прекратить их производство (путем замены существующих способов получения химических продуктов на новые). • Третье направление и представляет собой ту область, которой занимается зеленая химия. • Зеленая Химия – это многообещающий путь предотвращения загрязнений, поскольку она применяет новейшие научные решения к реальным экологическим ситуациям.
• При этом существует три возможных пути химических решений: • 1. Уничтожать загрязнители, поступившие в окружающую среду • 2. Ограничивать их распространение, если они локальные • 3. Прекратить их производство (путем замены существующих способов получения химических продуктов на новые). • Третье направление и представляет собой ту область, которой занимается зеленая химия. • Зеленая Химия – это многообещающий путь предотвращения загрязнений, поскольку она применяет новейшие научные решения к реальным экологическим ситуациям.
 «Зеленая химия» • это любое усовершенствование химических процессов, которое положительно влияет на окружающую среду (Анастас и Уорнер). • это разработка химических продуктов и процессов, которая снижает или исключает использование и/или производство опасных веществ» (К. Седдон).
«Зеленая химия» • это любое усовершенствование химических процессов, которое положительно влияет на окружающую среду (Анастас и Уорнер). • это разработка химических продуктов и процессов, которая снижает или исключает использование и/или производство опасных веществ» (К. Седдон).
 • Организация химических процессов в соответствии с принципами зеленой химии предусматривает: • получение необходимых веществ и потребительских товаров; • оценку возможных последствий для здоровья и окружающей среды. • В основе – подход к решению экологических проблем, связанный с использованием чистых и менее загрязняющих окружающую среду промышленных процессов и гарантирующий, что производители берут на себя ответственность за производимые продукты.
• Организация химических процессов в соответствии с принципами зеленой химии предусматривает: • получение необходимых веществ и потребительских товаров; • оценку возможных последствий для здоровья и окружающей среды. • В основе – подход к решению экологических проблем, связанный с использованием чистых и менее загрязняющих окружающую среду промышленных процессов и гарантирующий, что производители берут на себя ответственность за производимые продукты.
 Почему мы нуждаемся в зеленой химии? • 1. Отсутствие полной информации о химических веществах (продуктах) или о возможных негативных последствиях, вызванных этими химическими веществами. • 2. С тысячами химических веществ, которые мы используем сегодня, совершенно невозможно, да и не нужно, разбираться обычным людям. Для этой цели должны существовать подходы, которые действуют еще до того, как продукты попадают к потребителям. Причем, это должно касаться как обычных продуктов питания, так и промышленных производств. • 3. Именно Зеленая химия является долгосрочным рычагом управления охраной окружающей среды, способствует сохранению здоровья людей и помогает сохранить окружающую среду для будущих поколений.
Почему мы нуждаемся в зеленой химии? • 1. Отсутствие полной информации о химических веществах (продуктах) или о возможных негативных последствиях, вызванных этими химическими веществами. • 2. С тысячами химических веществ, которые мы используем сегодня, совершенно невозможно, да и не нужно, разбираться обычным людям. Для этой цели должны существовать подходы, которые действуют еще до того, как продукты попадают к потребителям. Причем, это должно касаться как обычных продуктов питания, так и промышленных производств. • 3. Именно Зеленая химия является долгосрочным рычагом управления охраной окружающей среды, способствует сохранению здоровья людей и помогает сохранить окружающую среду для будущих поколений.
 В чем разница между наукой об окружающей среде и Зеленой химией? • Оба этих направления устремлены на поиски путей, которые сделают мир лучше. Они, безусловно, взаимосвязаны друг с другом. • Наука об охране окружающей среды устанавливает источники, разъясняет механизмы и оценивает проблемы окружающей среды. • Зеленая химия ищет пути решения этих проблем, создавая безопасные альтернативные технологии. • Несмотря на общие глобальные цели, зеленая химия и химия окружающей среды – это разные науки.
В чем разница между наукой об окружающей среде и Зеленой химией? • Оба этих направления устремлены на поиски путей, которые сделают мир лучше. Они, безусловно, взаимосвязаны друг с другом. • Наука об охране окружающей среды устанавливает источники, разъясняет механизмы и оценивает проблемы окружающей среды. • Зеленая химия ищет пути решения этих проблем, создавая безопасные альтернативные технологии. • Несмотря на общие глобальные цели, зеленая химия и химия окружающей среды – это разные науки.
 Цель зеленой химии • предотвращение загрязнения в процессе создания химических продуктов, т. е. предотвращение загрязнения на самых начальных стадиях планирования осуществления химических процессов. и
Цель зеленой химии • предотвращение загрязнения в процессе создания химических продуктов, т. е. предотвращение загрязнения на самых начальных стадиях планирования осуществления химических процессов. и
 12 принципов «Зеленой химии» : Anastas, P. T. ; Warner, J. C. Green Chemistry: Theory and Practice, Oxford University Press: New York, 1998 1. Упреждение. • Лучше не допускать образования отходов, чем заниматься их переработкой или уничтожением. 2. Экономия атомов. • Методы синтеза должны разрабатываться таким образом, чтобы в состав конечного продукта включалось как можно больше атомов реагентов, использованных в ходе синтеза. 3. Снижение опасности процессов и продуктов синтеза. • Во всех практически возможных случаях следует стремиться к использованию или синтезу веществ, не токсичных или мало токсичных для человека и окружающей среды.
12 принципов «Зеленой химии» : Anastas, P. T. ; Warner, J. C. Green Chemistry: Theory and Practice, Oxford University Press: New York, 1998 1. Упреждение. • Лучше не допускать образования отходов, чем заниматься их переработкой или уничтожением. 2. Экономия атомов. • Методы синтеза должны разрабатываться таким образом, чтобы в состав конечного продукта включалось как можно больше атомов реагентов, использованных в ходе синтеза. 3. Снижение опасности процессов и продуктов синтеза. • Во всех практически возможных случаях следует стремиться к использованию или синтезу веществ, не токсичных или мало токсичных для человека и окружающей среды.
 4. Конструирование «зеленых» материалов. • Технологии должны обеспечивать создание новых материалов, обладающих наилучшими функциональными характеристиками и наименьшей токсичностью. 5. Использование менее опасных вспомогательных реагентов. • Использования вспомогательных реагентов (растворителей, экстрагентов и т. д. ) в процессах синтеза следует по возможности избегать. Если это невозможно, ключевым является параметр токсичности.
4. Конструирование «зеленых» материалов. • Технологии должны обеспечивать создание новых материалов, обладающих наилучшими функциональными характеристиками и наименьшей токсичностью. 5. Использование менее опасных вспомогательных реагентов. • Использования вспомогательных реагентов (растворителей, экстрагентов и т. д. ) в процессах синтеза следует по возможности избегать. Если это невозможно, ключевым является параметр токсичности.
 6. Энергосбережение. • Следует отдавать себе отчет в экологических и экономических последствиях, связанных с затратами энергии в химических процессах. Желательно осуществлять процессы синтеза при комнатной температуре и атмосферном давлении. 7. Использование возобновимого сырья. • Во всех случаях, когда это технически возможно и экономически допустимо, следует отдавать предпочтение возобновимому сырью.
6. Энергосбережение. • Следует отдавать себе отчет в экологических и экономических последствиях, связанных с затратами энергии в химических процессах. Желательно осуществлять процессы синтеза при комнатной температуре и атмосферном давлении. 7. Использование возобновимого сырья. • Во всех случаях, когда это технически возможно и экономически допустимо, следует отдавать предпочтение возобновимому сырью.
 8. Уменьшение числа промежуточных стадий. • Следует минимизировать или вообще отказаться от ненужных промежуточных производных (блокирующие группы, протекторы, промежуточные модификаторы физических и химических процессов), поскольку промежуточные стадии сопряжены с генерацией дополнительных отходов и с потреблением реагентов 9. Использование каталитических процессов. • Каталитические процессы (с возможно большей селективностью) предпочтительнее по сравнению со стехиометрическими реакциями. 10. Биоразлагаемость • Химический дизайн продуктов должен обеспечивать их легкую деградацию в конце жизненного цикла, не приводящую к образованию соединений, опасных для окружающей природной среды.
8. Уменьшение числа промежуточных стадий. • Следует минимизировать или вообще отказаться от ненужных промежуточных производных (блокирующие группы, протекторы, промежуточные модификаторы физических и химических процессов), поскольку промежуточные стадии сопряжены с генерацией дополнительных отходов и с потреблением реагентов 9. Использование каталитических процессов. • Каталитические процессы (с возможно большей селективностью) предпочтительнее по сравнению со стехиометрическими реакциями. 10. Биоразлагаемость • Химический дизайн продуктов должен обеспечивать их легкую деградацию в конце жизненного цикла, не приводящую к образованию соединений, опасных для окружающей природной среды.
 11. Обеспечение аналитического контроля в реальном масштабе времени. • Для предотвращения образования опасных отходов следует развивать аналитические методы, обеспечивающие возможности мониторинга и контроля в реальном масштабе времени. 12. Предотвращение возможности аварий. • Химические соединения, используемые в технологических процессах, должны присутствовать в формах, минимизирующих вероятность химических аварий (выбросов сильнодействующих ядовитых веществ, взрывов, пожаров). 13 -й принцип (Е. С. Локтева и В. В. Лунин (МГУ)): Если вы делаете все так, как привыкли, то и получите то, что обычно получаете.
11. Обеспечение аналитического контроля в реальном масштабе времени. • Для предотвращения образования опасных отходов следует развивать аналитические методы, обеспечивающие возможности мониторинга и контроля в реальном масштабе времени. 12. Предотвращение возможности аварий. • Химические соединения, используемые в технологических процессах, должны присутствовать в формах, минимизирующих вероятность химических аварий (выбросов сильнодействующих ядовитых веществ, взрывов, пожаров). 13 -й принцип (Е. С. Локтева и В. В. Лунин (МГУ)): Если вы делаете все так, как привыкли, то и получите то, что обычно получаете.
 • Внедрение принципов зеленой химии – предполагает предварительную оценку и сравнительный анализ не только веществ, материалов, технологий, но и последствий их использования, их потенциал как опасного вещества или загрязнителя. Для этого необходимо привлекать знания по токсикологии, экотоксикологии и др.
• Внедрение принципов зеленой химии – предполагает предварительную оценку и сравнительный анализ не только веществ, материалов, технологий, но и последствий их использования, их потенциал как опасного вещества или загрязнителя. Для этого необходимо привлекать знания по токсикологии, экотоксикологии и др.
 • Проблемы, находящиеся в компетенции «зеленой» химии, можно разделить на два направления: • 1. переработка, утилизация, уничтожение экологически опасных побочных и отработанных продуктов химической и других отраслей промышленности таким образом, чтобы ликвидировать экологическую опасность или хотя бы снизить ее до приемлемых величин. • 2. более перспективное, связано с разработкой новых промышленных процессов, которые бы позволяли обойтись вовсе без экологически опасных продуктов (в том числе побочных) или свести их использование и выделение к минимуму. • Одним из наглядных примеров того, как изменение подхода к производству только одного химического продукта может потянуть за собой целую цепочку положительных экологических последствий, является производство каустической соды.
• Проблемы, находящиеся в компетенции «зеленой» химии, можно разделить на два направления: • 1. переработка, утилизация, уничтожение экологически опасных побочных и отработанных продуктов химической и других отраслей промышленности таким образом, чтобы ликвидировать экологическую опасность или хотя бы снизить ее до приемлемых величин. • 2. более перспективное, связано с разработкой новых промышленных процессов, которые бы позволяли обойтись вовсе без экологически опасных продуктов (в том числе побочных) или свести их использование и выделение к минимуму. • Одним из наглядных примеров того, как изменение подхода к производству только одного химического продукта может потянуть за собой целую цепочку положительных экологических последствий, является производство каустической соды.
 • В настоящее время ее получают электролизом хлорида натрия в водном растворе по реакции Na. Cl + H 2 O + е (С, Hg, Ti) = Na. OH + Cl 2 , где е означает электрод из соответствующего материала. • Щелочи требуется много, а хлор является побочным продуктом этого процесса. Для утилизации этого избыточного хлора учеными были разработаны многие процессы хлорной промышленности, но существуют и бесхлорные методы производства каустика. Их разработка позволит избежать избыточного выделения хлора и начать замену многих получаемых на его основе продуктов другими, более экологичными.
• В настоящее время ее получают электролизом хлорида натрия в водном растворе по реакции Na. Cl + H 2 O + е (С, Hg, Ti) = Na. OH + Cl 2 , где е означает электрод из соответствующего материала. • Щелочи требуется много, а хлор является побочным продуктом этого процесса. Для утилизации этого избыточного хлора учеными были разработаны многие процессы хлорной промышленности, но существуют и бесхлорные методы производства каустика. Их разработка позволит избежать избыточного выделения хлора и начать замену многих получаемых на его основе продуктов другими, более экологичными.
 • К примеру, одним из крупнотоннажных продуктов, производимых в промышленности, является поливинилхлоридный пластик (ПВХ), в настоящее время он активно используется для производства товаров народного потребления (окна, линолеум, игрушки и др. ). ПВХ обладает высокими потребительскими свойствами – прочен, легко формуется, устойчив в условиях температур окружающей среды. • В то же время он потенциально опасен. Ведь в его составе содержится до 50% хлора. Следовательно, процессы его утилизации неизбежно будут сопровождаться выделением диоксинов.
• К примеру, одним из крупнотоннажных продуктов, производимых в промышленности, является поливинилхлоридный пластик (ПВХ), в настоящее время он активно используется для производства товаров народного потребления (окна, линолеум, игрушки и др. ). ПВХ обладает высокими потребительскими свойствами – прочен, легко формуется, устойчив в условиях температур окружающей среды. • В то же время он потенциально опасен. Ведь в его составе содержится до 50% хлора. Следовательно, процессы его утилизации неизбежно будут сопровождаться выделением диоксинов.
 • Повторное использование ПВХ затруднительно и препятствует рециклингу других пластмасс, поскольку ПВХ очень плохо смешивается с ними и не способен размягчаться без разложения. Более того, все три стадии производства ПВХ – хлорирование этилена до дихлорэтана, дегидрохлорирование дихлорэтана до винилхлорида и полимеризация - сопровождаются выбросами диоксинов, причем в нарастающих количествах. Учитывая широчайшее поле применения подобных пластиков, отдаленные последствия могут быть крайне негативными. Недаром страны с более развитой экономикой стремятся перевести такие производства в третьи страны. Вот почему мы видим повсюду рекламу пластиковых окон «из Германии» , которые на самом деле давно уже делаются у нас, в России.
• Повторное использование ПВХ затруднительно и препятствует рециклингу других пластмасс, поскольку ПВХ очень плохо смешивается с ними и не способен размягчаться без разложения. Более того, все три стадии производства ПВХ – хлорирование этилена до дихлорэтана, дегидрохлорирование дихлорэтана до винилхлорида и полимеризация - сопровождаются выбросами диоксинов, причем в нарастающих количествах. Учитывая широчайшее поле применения подобных пластиков, отдаленные последствия могут быть крайне негативными. Недаром страны с более развитой экономикой стремятся перевести такие производства в третьи страны. Вот почему мы видим повсюду рекламу пластиковых окон «из Германии» , которые на самом деле давно уже делаются у нас, в России.
 • В то же время недавно разработаны промышленные способы производства металлоценовых катализаторов получения полиолефинов, которые способны заменить ПВХ практически во всех областях его использования, но при этом не столь опасны с точки зрения экологии. При соответствующих масштабах производства эти полимеры могут стать выгоднее ПВХ, хотя уже сейчас они представляют угрозу для 15% рынка ПВХ.
• В то же время недавно разработаны промышленные способы производства металлоценовых катализаторов получения полиолефинов, которые способны заменить ПВХ практически во всех областях его использования, но при этом не столь опасны с точки зрения экологии. При соответствующих масштабах производства эти полимеры могут стать выгоднее ПВХ, хотя уже сейчас они представляют угрозу для 15% рынка ПВХ.
 • Часто представители промышленности отвергают принципы «зеленой» химии на основании того, что предлагаемое «революционное» изменение производства экономически нецелесообразно. В этом случае оптимальными были бы «эволюционные» изменения промышленных процессов, позволяющие на каждой стадии немного улучшить экологические показатели. Примером может служить эволюционное усовершенствование каждой стадии производства освежителей цвета для стиральных порошков на основе стильбена.
• Часто представители промышленности отвергают принципы «зеленой» химии на основании того, что предлагаемое «революционное» изменение производства экономически нецелесообразно. В этом случае оптимальными были бы «эволюционные» изменения промышленных процессов, позволяющие на каждой стадии немного улучшить экологические показатели. Примером может служить эволюционное усовершенствование каждой стадии производства освежителей цвета для стиральных порошков на основе стильбена.
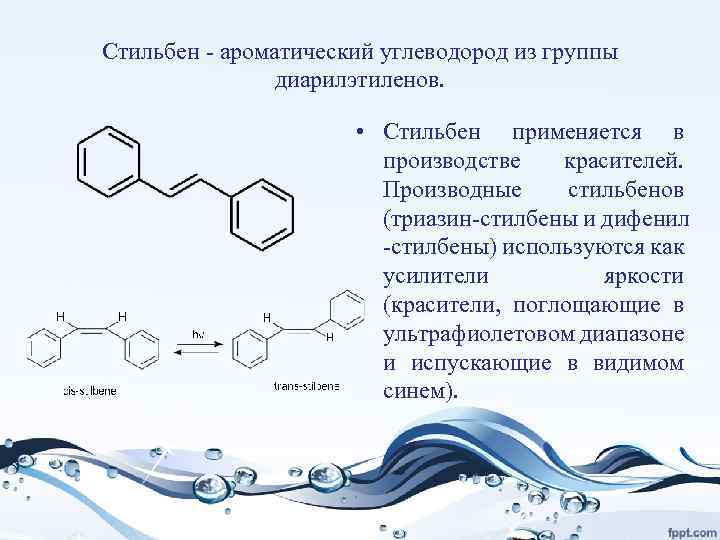 Стильбен - ароматический углеводород из группы диарилэтиленов. • Стильбен применяется в производстве красителей. Производные стильбенов (триазин-стилбены и дифенил -стилбены) используются как усилители яркости (красители, поглощающие в ультрафиолетовом диапазоне и испускающие в видимом синем).
Стильбен - ароматический углеводород из группы диарилэтиленов. • Стильбен применяется в производстве красителей. Производные стильбенов (триазин-стилбены и дифенил -стилбены) используются как усилители яркости (красители, поглощающие в ультрафиолетовом диапазоне и испускающие в видимом синем).
 • Изменение концентрации кислоты, замена органических растворителей водой, изменение конструкции аппаратов и др. позволяют существенно снизить экологический ущерб от всех стадий производства. При этом «эволюционные» изменения осуществляются полностью в русле задач и методов «зеленой» химии, и противопоставляться им не должны. • Особенно следует подчеркнуть, что все проведенные изменения оказались и экономически выгодными.
• Изменение концентрации кислоты, замена органических растворителей водой, изменение конструкции аппаратов и др. позволяют существенно снизить экологический ущерб от всех стадий производства. При этом «эволюционные» изменения осуществляются полностью в русле задач и методов «зеленой» химии, и противопоставляться им не должны. • Особенно следует подчеркнуть, что все проведенные изменения оказались и экономически выгодными.
 Для количественной оценки степени экологичности той или иной реакции/процесса используют два критерия (Роджер Шелдон): • Е-фактор – это отношение массы всех получившихся в реакции побочных продуктов к массе целевого продукта. Естественно, что чем больше Е-фактор, тем менее «зеленой» является реакция или процесс. • Атомная эффективность – отношение молярной массы целевого продукта к сумме молярных масс всех остальных продуктов в стехиометрическом уравнении. Чем ближе атомная эффективность к 100%, тем более зеленой является данная реакция.
Для количественной оценки степени экологичности той или иной реакции/процесса используют два критерия (Роджер Шелдон): • Е-фактор – это отношение массы всех получившихся в реакции побочных продуктов к массе целевого продукта. Естественно, что чем больше Е-фактор, тем менее «зеленой» является реакция или процесс. • Атомная эффективность – отношение молярной массы целевого продукта к сумме молярных масс всех остальных продуктов в стехиометрическом уравнении. Чем ближе атомная эффективность к 100%, тем более зеленой является данная реакция.
 Величины Е-фактора для различных типов химических процессов Е-фактор Химическая продукция 0, 1 Нефтехимические продукты 1 -5 Продукция основного органического и неорганического синтеза 5 -50 Продукция тонкого органического синтеза (парфюмерия и др. ) 25 -100 и более Лекарства • Атомная эффективность будет невысокой в тех реакциях, где используют кислоты, щелочи, растворенные металлы, поскольку во всех этих случаях необходима нейтрализация. Это приводит к образованию солей в качестве побочных продуктов. Этих недостатков лишены каталитические процессы. Катализаторы позволяют проводить реакции с высокими селективностями. Катализ является одним из ключевых направлений зеленой химии.
Величины Е-фактора для различных типов химических процессов Е-фактор Химическая продукция 0, 1 Нефтехимические продукты 1 -5 Продукция основного органического и неорганического синтеза 5 -50 Продукция тонкого органического синтеза (парфюмерия и др. ) 25 -100 и более Лекарства • Атомная эффективность будет невысокой в тех реакциях, где используют кислоты, щелочи, растворенные металлы, поскольку во всех этих случаях необходима нейтрализация. Это приводит к образованию солей в качестве побочных продуктов. Этих недостатков лишены каталитические процессы. Катализаторы позволяют проводить реакции с высокими селективностями. Катализ является одним из ключевых направлений зеленой химии.
 • Известно, что высокой реакционной способностью, как правило, обладают опасные вещества. • Катализаторы - удобные реагенты при создании новых химических продуктов , т. к. не требуют высоких температур, давлений и т. п. , т. е. энергетически выгодны. • Если мы отказываемся от реакционноспособных веществ, а берем за основу менее реакционноспособные, мы увеличиваем энергозатраты, что противоречит 6 -му принципу Зеленой химии – принципу энергетической эффективности. • Есть два пути: • – использование катализатора, который снижает энергетический барьер реакции. • – использование локальных источников энергии для активации молекул (фотохимия, микроволновое излучение).
• Известно, что высокой реакционной способностью, как правило, обладают опасные вещества. • Катализаторы - удобные реагенты при создании новых химических продуктов , т. к. не требуют высоких температур, давлений и т. п. , т. е. энергетически выгодны. • Если мы отказываемся от реакционноспособных веществ, а берем за основу менее реакционноспособные, мы увеличиваем энергозатраты, что противоречит 6 -му принципу Зеленой химии – принципу энергетической эффективности. • Есть два пути: • – использование катализатора, который снижает энергетический барьер реакции. • – использование локальных источников энергии для активации молекул (фотохимия, микроволновое излучение).
 • Разработанные в последнее время каталитические процессы обладают очень высокой атомной эффективностью. • Например, окисление метанола до уксусной кислоты на родиевом катализаторе (100%). Rh CH 3 OH +CO = CH 3 COOH Атомная эффективность 100% (фирма Монсанто)
• Разработанные в последнее время каталитические процессы обладают очень высокой атомной эффективностью. • Например, окисление метанола до уксусной кислоты на родиевом катализаторе (100%). Rh CH 3 OH +CO = CH 3 COOH Атомная эффективность 100% (фирма Монсанто)
 Получение трет-бутиламина Традиционный путь Каталитический путь Н+ цеолит (СН 3)3 СОН + HCN → (СН 3)2 С=СН 2 + NH 3 → Na. OH HCONHC(CH 3)3 → (CH 3)3 CNH 2 + HCOONa 1. 2. Недостатки: Атомная эффективность Участие синильной кислоты. (CH 3) 3 CNH 2 Атомная эффективность 100% (фирма BASF) Применяют в производстве эмульгаторов, экстрагентов, ингибиторов коррозии, лек. в-в, ускорителей вулканизации и антиоксидантов для резин, пестицидов и др.
Получение трет-бутиламина Традиционный путь Каталитический путь Н+ цеолит (СН 3)3 СОН + HCN → (СН 3)2 С=СН 2 + NH 3 → Na. OH HCONHC(CH 3)3 → (CH 3)3 CNH 2 + HCOONa 1. 2. Недостатки: Атомная эффективность Участие синильной кислоты. (CH 3) 3 CNH 2 Атомная эффективность 100% (фирма BASF) Применяют в производстве эмульгаторов, экстрагентов, ингибиторов коррозии, лек. в-в, ускорителей вулканизации и антиоксидантов для резин, пестицидов и др.
 Основные направления развития каталитической науки: • 1. Катализ наночастицами • 2. Цеолиты и мезопористые катализаторы • 3. Закрепление гомогенных катализаторов на носителе • 4. Предотвращение потерь катализатора • 5. Катализ энзимами (ферментами), в том числе закрепленными (гетерогенизированными)
Основные направления развития каталитической науки: • 1. Катализ наночастицами • 2. Цеолиты и мезопористые катализаторы • 3. Закрепление гомогенных катализаторов на носителе • 4. Предотвращение потерь катализатора • 5. Катализ энзимами (ферментами), в том числе закрепленными (гетерогенизированными)
 Особенно активно используются биокатализаторы – ферменты: • 1. пищевая промышленность – гидролиз некрахмальных полисахаридов, уменьшение вязкости растворов, производство пива, спирта, белковых гидролизатов (бета-глюканазы, целлюлазы, протеазы, амилазы, кератиназы); • 2. текстильная промышленность - изменение свойств поверхности текстильных изделий (удаление индиго с джинсовых изделий, биополировка, удаление ворса, предотвращение пиллинга, облагораживание шерсти); • 3. целлюлозно-бумажная промышленность - биоотбеливание пульпы, удаление тонеров и чернил при вторичной переработке бумаги/макулатуры; • 4. производство моющих средств - разрушение загрязнений, придание свежести тканям, предотвращение пиллинга.
Особенно активно используются биокатализаторы – ферменты: • 1. пищевая промышленность – гидролиз некрахмальных полисахаридов, уменьшение вязкости растворов, производство пива, спирта, белковых гидролизатов (бета-глюканазы, целлюлазы, протеазы, амилазы, кератиназы); • 2. текстильная промышленность - изменение свойств поверхности текстильных изделий (удаление индиго с джинсовых изделий, биополировка, удаление ворса, предотвращение пиллинга, облагораживание шерсти); • 3. целлюлозно-бумажная промышленность - биоотбеливание пульпы, удаление тонеров и чернил при вторичной переработке бумаги/макулатуры; • 4. производство моющих средств - разрушение загрязнений, придание свежести тканям, предотвращение пиллинга.
 Классическая проблем в катализе – проблема активации атмосферного азота и кислорода. • Процесс ведут при температуре 400— 600 °C и давлениях 10— 1000 атмосфер. Наибольшее применение получил катализатор на основе металлического железа с примесями оксидов алюминия и калия. • В процессе поиска подходящего катализатора было испробовано около двадцати тысяч различных соединений.
Классическая проблем в катализе – проблема активации атмосферного азота и кислорода. • Процесс ведут при температуре 400— 600 °C и давлениях 10— 1000 атмосфер. Наибольшее применение получил катализатор на основе металлического железа с примесями оксидов алюминия и калия. • В процессе поиска подходящего катализатора было испробовано около двадцати тысяч различных соединений.
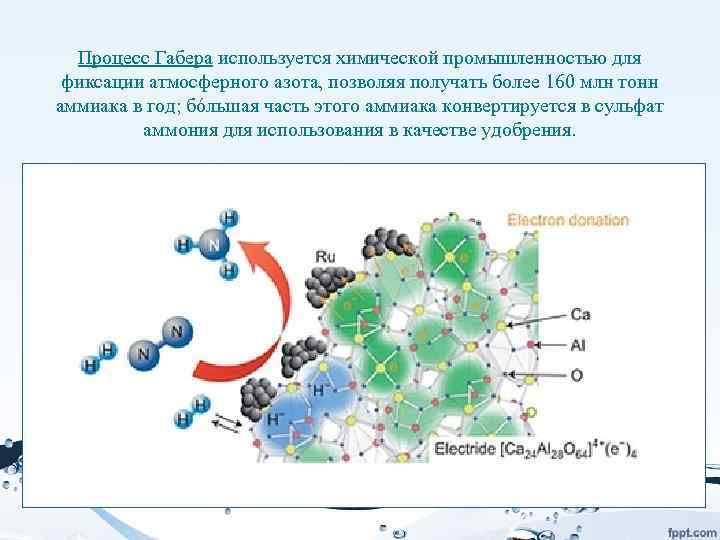 Процесс Габера используется химической промышленностью для фиксации атмосферного азота, позволяя получать более 160 млн тонн аммиака в год; бóльшая часть этого аммиака конвертируется в сульфат аммония для использования в качестве удобрения.
Процесс Габера используется химической промышленностью для фиксации атмосферного азота, позволяя получать более 160 млн тонн аммиака в год; бóльшая часть этого аммиака конвертируется в сульфат аммония для использования в качестве удобрения.
 Биомасса как источник нефтехимических продуктов
Биомасса как источник нефтехимических продуктов
 Это одно из ключевых направлений развития зеленой химии – использование возобновляемого сырья в качестве источника углерода в химической промышленности. • Сейчас основным источником являются ископаемые топлива – нефть, газ, уголь. При этом мы истощаем ресурсы Земли. Это уже привело к тому, что стоимость углеводородов очень сильно выросла. Добыча все больше смещается в труднодоступные районы – север, арктический шельф, море и др.
Это одно из ключевых направлений развития зеленой химии – использование возобновляемого сырья в качестве источника углерода в химической промышленности. • Сейчас основным источником являются ископаемые топлива – нефть, газ, уголь. При этом мы истощаем ресурсы Земли. Это уже привело к тому, что стоимость углеводородов очень сильно выросла. Добыча все больше смещается в труднодоступные районы – север, арктический шельф, море и др.

 Но вторая опасность – возрастающий парниковый эффект, изменения климата Земли за счет техногенного поступления СО 2 в атмосферу.
Но вторая опасность – возрастающий парниковый эффект, изменения климата Земли за счет техногенного поступления СО 2 в атмосферу.

 • Обоих недостатков лишено производство химических продуктов из растительного сырья. • Это возобновляемый ресурс, или даже отходы (сельского хозяйства, бытовой мусор). И, кроме того, сколько СО 2 усвоено растениями, образующими биомассу, столько его и может выделиться при использовании соответствующих химических продуктов, то есть дополнительного поступления СО 2 в атмосферу не происходит.
• Обоих недостатков лишено производство химических продуктов из растительного сырья. • Это возобновляемый ресурс, или даже отходы (сельского хозяйства, бытовой мусор). И, кроме того, сколько СО 2 усвоено растениями, образующими биомассу, столько его и может выделиться при использовании соответствующих химических продуктов, то есть дополнительного поступления СО 2 в атмосферу не происходит.
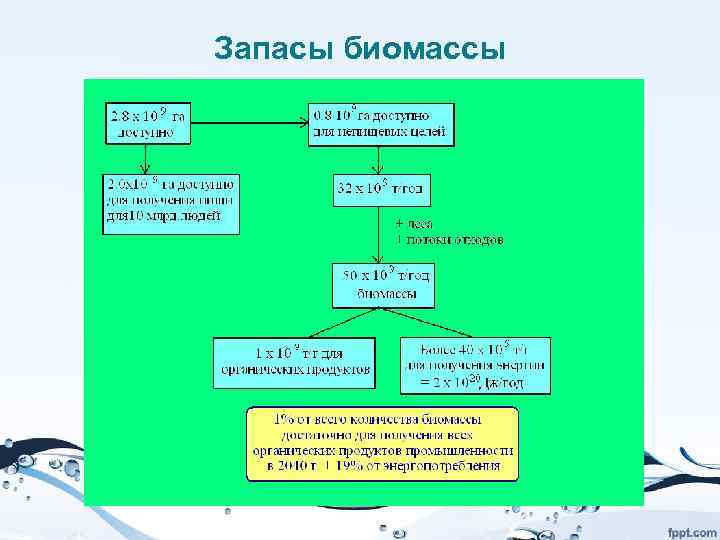 Запасы биомассы
Запасы биомассы


 Непищевые применения биомассы • 1. Традиционное использование в виде лесоматериалов, бумаги, волокон, резины, экстракция химических веществ (отдушки, красители, биоактивные молекулы) • 2. Термическое получение энергии прямом сжигании биомассы или после газификации • 3. Получение топлива для транспорта на основе биомассы, например, получение этанола ферментацией углеводов, или биодизеля методом транс-этерификации растительных масел, или паровым реформингом, методом ФТ, из лигноцеллюлозных материалов, или водорода методом парового реформинга/реакции водяного газа • 4. Получение из биомассы продуктов каталитической конверсией углеводов, триглицеридов и терпенов.
Непищевые применения биомассы • 1. Традиционное использование в виде лесоматериалов, бумаги, волокон, резины, экстракция химических веществ (отдушки, красители, биоактивные молекулы) • 2. Термическое получение энергии прямом сжигании биомассы или после газификации • 3. Получение топлива для транспорта на основе биомассы, например, получение этанола ферментацией углеводов, или биодизеля методом транс-этерификации растительных масел, или паровым реформингом, методом ФТ, из лигноцеллюлозных материалов, или водорода методом парового реформинга/реакции водяного газа • 4. Получение из биомассы продуктов каталитической конверсией углеводов, триглицеридов и терпенов.
 Дальнейшие перспективы: • ферментативный синтез органических кислот (лимонной, молочной, щавелевой и др. ), которые являются сырьем для огромного количества других химических продуктов. Например, полученный на основе молочной кислоты полимер – полилактат – хорошая замена полиэтилена и полипропилена в упаковочных пленках: он нетоксичен.
Дальнейшие перспективы: • ферментативный синтез органических кислот (лимонной, молочной, щавелевой и др. ), которые являются сырьем для огромного количества других химических продуктов. Например, полученный на основе молочной кислоты полимер – полилактат – хорошая замена полиэтилена и полипропилена в упаковочных пленках: он нетоксичен.

 На основе растительного сырья можно получить богатую гамму продуктов. • Например – спирт из зерна. Этот процесс дешевле, чем производство этилового спирта окислением этилена, последний процесс практически нигде в мире не используется. Стоимость зернового спирта примерно 300 долларов за тонну. Если он благодаря усовершенствованию процесса подешевеет в два раза, он станет выгодным сырьем для производства этилена и полиэтиленов. • Такая схема позволяет совершенно отказаться от использования нефти в качестве основного сырья для химической промышленности и перейти к возобновляемым источникам сырья.
На основе растительного сырья можно получить богатую гамму продуктов. • Например – спирт из зерна. Этот процесс дешевле, чем производство этилового спирта окислением этилена, последний процесс практически нигде в мире не используется. Стоимость зернового спирта примерно 300 долларов за тонну. Если он благодаря усовершенствованию процесса подешевеет в два раза, он станет выгодным сырьем для производства этилена и полиэтиленов. • Такая схема позволяет совершенно отказаться от использования нефти в качестве основного сырья для химической промышленности и перейти к возобновляемым источникам сырья.

 • Важным возобновляемым сырьем являются лигноцеллюлоза и крахмал, получаемые из биомассы растений. Превращение их в сахара открывает путь к ферментативной переработке сахара в органические кислоты (молочную, щавелевую, лимонную и др. ), а это путь к огромному числу химических продуктов. Например, дегидратацией молочной кислоты можно получить акриловую, из нее ацетальдегид, этиленгликоль, тетрагидрофуран, пропандиол. Но и сами органические кислоты являются важными продуктами. Например, полилактат – полимер, получаемый на основе молочной кислоты, - это превосходная упаковка для пищевых продуктов, которая за несколько недель разлагается в природе.
• Важным возобновляемым сырьем являются лигноцеллюлоза и крахмал, получаемые из биомассы растений. Превращение их в сахара открывает путь к ферментативной переработке сахара в органические кислоты (молочную, щавелевую, лимонную и др. ), а это путь к огромному числу химических продуктов. Например, дегидратацией молочной кислоты можно получить акриловую, из нее ацетальдегид, этиленгликоль, тетрагидрофуран, пропандиол. Но и сами органические кислоты являются важными продуктами. Например, полилактат – полимер, получаемый на основе молочной кислоты, - это превосходная упаковка для пищевых продуктов, которая за несколько недель разлагается в природе.
 • Развитые в промышленном отношении страны уделяют большое внимание переработке возобновляемого сырья. Например, в США поставлена задача - через 25 лет перевести на растительное сырье до 25% химической промышленности. Для этих разработок выделяется более 500 млн. долларов в год. • У нас в стране сосредоточено около 7% мировых запасов нефти – не так много. В США берегут свою нефть, она является стратегическим запасом. Мы свою нефть тратим и проедаем.
• Развитые в промышленном отношении страны уделяют большое внимание переработке возобновляемого сырья. Например, в США поставлена задача - через 25 лет перевести на растительное сырье до 25% химической промышленности. Для этих разработок выделяется более 500 млн. долларов в год. • У нас в стране сосредоточено около 7% мировых запасов нефти – не так много. В США берегут свою нефть, она является стратегическим запасом. Мы свою нефть тратим и проедаем.

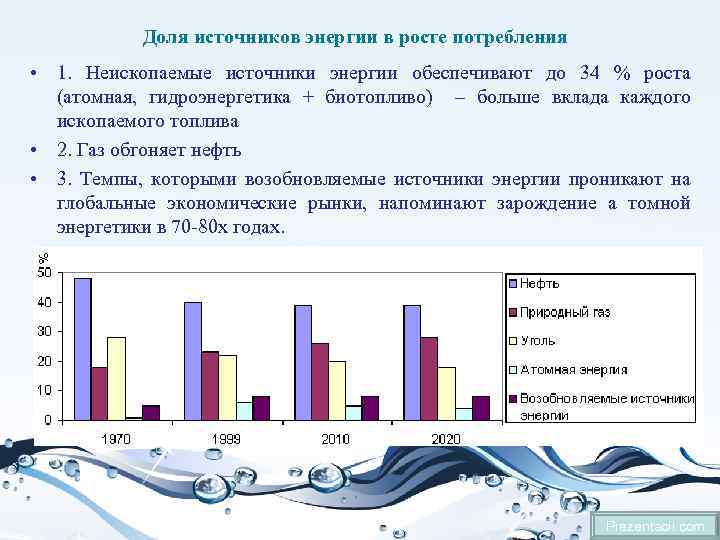 Доля источников энергии в росте потребления • 1. Неископаемые источники энергии обеспечивают до 34 % роста (атомная, гидроэнергетика + биотопливо) – больше вклада каждого ископаемого топлива • 2. Газ обгоняет нефть • 3. Темпы, которыми возобновляемые источники энергии проникают на глобальные экономические рынки, напоминают зарождение а томной энергетики в 70 -80 х годах. Prezentacii. com
Доля источников энергии в росте потребления • 1. Неископаемые источники энергии обеспечивают до 34 % роста (атомная, гидроэнергетика + биотопливо) – больше вклада каждого ископаемого топлива • 2. Газ обгоняет нефть • 3. Темпы, которыми возобновляемые источники энергии проникают на глобальные экономические рынки, напоминают зарождение а томной энергетики в 70 -80 х годах. Prezentacii. com
 • Сырье для химической промышленности: продукты (нефтяной, газовой и угольной промышленности), невостребованные при производстве энергии – первые химические производные: олефины, ароматические соединения, синтез-газ. • Текущая добыча нефти достаточна для покрытия от 60 до 200% увеличения потребности до 2030 г. • По мере исчерпания ресурсов производство нефти будет медленно снижаться, хотя потребности быстрорастущих наций (Китай, Индия) могут ускорить этот процесс. • Сейчас новые месторождения открывают со скоростью в два раза ниже, чем необходимо для потребления в настоящее время. • Необходимы: • Углубление переработки существующего сырья • Переход к новым источникам сырья – газовый конденсат, природный газ, сланцевый газ, возобновляемые источники (биомасса) – и, следовательно, новые процессы для переработки такого сырья.
• Сырье для химической промышленности: продукты (нефтяной, газовой и угольной промышленности), невостребованные при производстве энергии – первые химические производные: олефины, ароматические соединения, синтез-газ. • Текущая добыча нефти достаточна для покрытия от 60 до 200% увеличения потребности до 2030 г. • По мере исчерпания ресурсов производство нефти будет медленно снижаться, хотя потребности быстрорастущих наций (Китай, Индия) могут ускорить этот процесс. • Сейчас новые месторождения открывают со скоростью в два раза ниже, чем необходимо для потребления в настоящее время. • Необходимы: • Углубление переработки существующего сырья • Переход к новым источникам сырья – газовый конденсат, природный газ, сланцевый газ, возобновляемые источники (биомасса) – и, следовательно, новые процессы для переработки такого сырья.
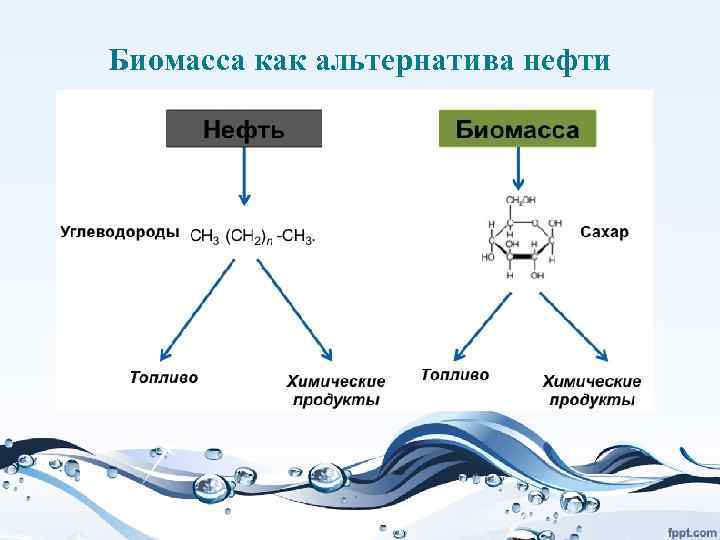 Биомасса как альтернатива нефти
Биомасса как альтернатива нефти
 • Биото пливо — топливо из растительного или животного сырья, из продуктов жизнедеятельности организмов или органических промышленных отходов. • Различается жидкое биотопливо (для двигателей внутреннего сгорания, например, этанол, метанол, биодизель), твёрдое биотопливо (дрова, брикеты, топливные гранулы, щепа, солома, лузга) и газообразное (синтезгаз, биогаз, водород).
• Биото пливо — топливо из растительного или животного сырья, из продуктов жизнедеятельности организмов или органических промышленных отходов. • Различается жидкое биотопливо (для двигателей внутреннего сгорания, например, этанол, метанол, биодизель), твёрдое биотопливо (дрова, брикеты, топливные гранулы, щепа, солома, лузга) и газообразное (синтезгаз, биогаз, водород).
 Сырье Выход, л • Кукуруза (зерно) 470 • Стебли кукурузы 427 • Рисовая солома 415 • Отходы очистки хлопка 215 • Лиственные опилки 381 • Макулатура 439
Сырье Выход, л • Кукуруза (зерно) 470 • Стебли кукурузы 427 • Рисовая солома 415 • Отходы очистки хлопка 215 • Лиственные опилки 381 • Макулатура 439
 Поколения растительного сырья для биотоплива: • 1. Биотоплива первого поколения - из зерна (рапсовое масло, подсолнечное масло и др. ) • Первыми начали использовать традиционные сельскохозяйственные культуры с высоким содержанием Растительные жиры хорошо жиров, крахмала, перерабатываются в сахаров. биодизель. Растительные крахмалы и сахара перерабатываются на этанол. Однако такое сырье оказалось крайне неудобным: помимо затратного землепользования с истощением почв и высокими потребностями в обработке почв, удобрениях и пестицидах его изъятие с рынка прямо влияет на цену пищевых продуктов.
Поколения растительного сырья для биотоплива: • 1. Биотоплива первого поколения - из зерна (рапсовое масло, подсолнечное масло и др. ) • Первыми начали использовать традиционные сельскохозяйственные культуры с высоким содержанием Растительные жиры хорошо жиров, крахмала, перерабатываются в сахаров. биодизель. Растительные крахмалы и сахара перерабатываются на этанол. Однако такое сырье оказалось крайне неудобным: помимо затратного землепользования с истощением почв и высокими потребностями в обработке почв, удобрениях и пестицидах его изъятие с рынка прямо влияет на цену пищевых продуктов.
 2. Биотоплива второго поколения - из растительных и бытовых отходов (непищевые остатки культивируемых растений, травы и древесина). • Его получение гораздо менее затратно, чем у культур первого поколения. Такое сырье содержит целлюлозу и лигнин. Его можно прямо сжигать (как это традиционно делали с дровами), газифицировать (получая горючие газы), осуществлять пиролиз. • Основные недостатки второго поколения сырья — занимаемые земельные ресурсы и относительно невысокая отдача с единицы площади.
2. Биотоплива второго поколения - из растительных и бытовых отходов (непищевые остатки культивируемых растений, травы и древесина). • Его получение гораздо менее затратно, чем у культур первого поколения. Такое сырье содержит целлюлозу и лигнин. Его можно прямо сжигать (как это традиционно делали с дровами), газифицировать (получая горючие газы), осуществлять пиролиз. • Основные недостатки второго поколения сырья — занимаемые земельные ресурсы и относительно невысокая отдача с единицы площади.
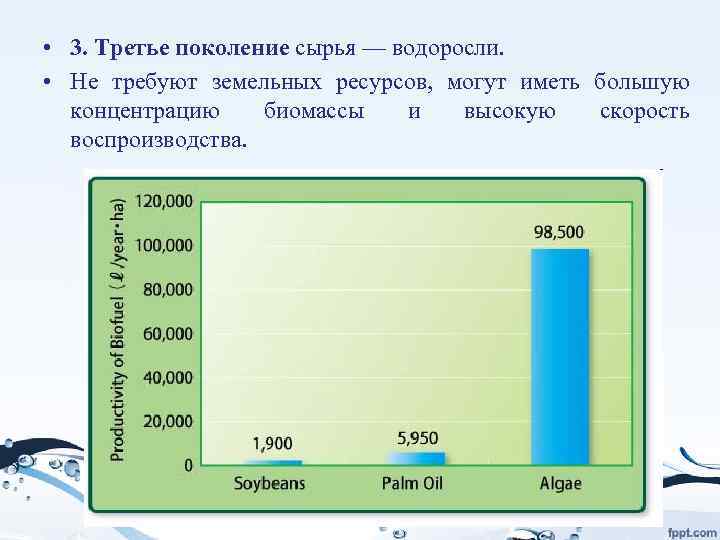 • 3. Третье поколение сырья — водоросли. • Не требуют земельных ресурсов, могут иметь большую концентрацию биомассы и высокую скорость воспроизводства.
• 3. Третье поколение сырья — водоросли. • Не требуют земельных ресурсов, могут иметь большую концентрацию биомассы и высокую скорость воспроизводства.

 Виды биотоплив: твердые, жидкие и газообразные. • Твердые — это традиционные дрова (часто в виде отходов деревообработки) и топливные гранулы (прессованные мелкие остатки деревообработки). • Жидкие топлива — это спирты (метанол, этанол, бутанол), эфиры, биодизель и биомазут. • Газообразные топлива — различные газовые смеси с угарным газом, метаном, водородом получаемые при термическом разложении сырья в присутствии кислорода (газификация), без кислорода (пиролиз) или при сбраживании под воздействием бактерий.
Виды биотоплив: твердые, жидкие и газообразные. • Твердые — это традиционные дрова (часто в виде отходов деревообработки) и топливные гранулы (прессованные мелкие остатки деревообработки). • Жидкие топлива — это спирты (метанол, этанол, бутанол), эфиры, биодизель и биомазут. • Газообразные топлива — различные газовые смеси с угарным газом, метаном, водородом получаемые при термическом разложении сырья в присутствии кислорода (газификация), без кислорода (пиролиз) или при сбраживании под воздействием бактерий.
 Твердое биотопливо • • Дрова — древнейшее топливо, используемое человечеством. В настоящее время в мире для производства дров или биомассы выращивают энергетические леса, состоящие из быстрорастущих пород (тополь, эвкалипт и др. ). В России на дрова и биомассу в основном идет балансовая древесина, не подходящая по качеству для производства пиломатериалов. Топливные гранулы и брикеты — прессованные изделия из древесных отходов (опилок, щепы, коры, тонкомерной и некондиционной древесины, порубочные остатки при лесозаготовках), соломы, отходов сельского хозяйства (лузги подсолнечника, ореховой скорлупы, навоза, куриного помета) и другой биомассы. Древесные топливные гранулы называются пеллеты, они имеют форму цилиндрических или сферических гранул диаметр. В настоящее время в России производство топливных гранул и брикетов экономически выгодно только при больших объемах. Энергоносители биологического происхождения (главным образом, навоз) брикетируются, сушатся и сжигаются в каминах жилых домов и топках тепловых электростанций, вырабатывая дешёвое электричество. Древесная щепа — производится путем измельчения тонкомерной древесины или порубочных остатков при лесозаготовках непосредственно на лесосеке или отходов деревообработки на производстве при помощи мобильных рубительных машин или с помощью стационарных шредеров. В Европе щепу в основном сжигают на крупных теплоэлектростанциях.
Твердое биотопливо • • Дрова — древнейшее топливо, используемое человечеством. В настоящее время в мире для производства дров или биомассы выращивают энергетические леса, состоящие из быстрорастущих пород (тополь, эвкалипт и др. ). В России на дрова и биомассу в основном идет балансовая древесина, не подходящая по качеству для производства пиломатериалов. Топливные гранулы и брикеты — прессованные изделия из древесных отходов (опилок, щепы, коры, тонкомерной и некондиционной древесины, порубочные остатки при лесозаготовках), соломы, отходов сельского хозяйства (лузги подсолнечника, ореховой скорлупы, навоза, куриного помета) и другой биомассы. Древесные топливные гранулы называются пеллеты, они имеют форму цилиндрических или сферических гранул диаметр. В настоящее время в России производство топливных гранул и брикетов экономически выгодно только при больших объемах. Энергоносители биологического происхождения (главным образом, навоз) брикетируются, сушатся и сжигаются в каминах жилых домов и топках тепловых электростанций, вырабатывая дешёвое электричество. Древесная щепа — производится путем измельчения тонкомерной древесины или порубочных остатков при лесозаготовках непосредственно на лесосеке или отходов деревообработки на производстве при помощи мобильных рубительных машин или с помощью стационарных шредеров. В Европе щепу в основном сжигают на крупных теплоэлектростанциях.
 Жидкое биотопливо • 1. Биоэтанол является менее «энергоплотным» источником энергии, чем бензин; пробег машин, работающих на Е 85 (смесь 85 % этанола и 15 % бензина; буква «Е» от английского Ethanol), на единицу объёма топлива составляет примерно 75% от пробега стандартных машин. Обычные машины не могут работать на Е 85, хотя двигатели внутреннего сгорания прекрасно работают на Е 10 или Е 15. На чистом этаноле могут работать только т. н. «Flex-Fuel» машины ( «гибкотопливные» машины). Эти автомобили также могут работать на обычном бензине с небольшой добавкой этанола или на произвольной смеси того и другого. Пользуясь тем, что этанол дешевле бензина, недобросовестные заправщики разбавляют Е 20 азеотропом, так что его концентрация может негласно доходить до 40 %. Переделать обычную машину в «flex-fuel» можно, но экономически нецелесообразно. • Недостаток - при сгорании этанола в выхлопных газах двигателей появляются альдегиды (формальдегид и ацетальдегид), наносящие живым организмам не меньший ущерб, чем ароматические углеводороды от бензина.
Жидкое биотопливо • 1. Биоэтанол является менее «энергоплотным» источником энергии, чем бензин; пробег машин, работающих на Е 85 (смесь 85 % этанола и 15 % бензина; буква «Е» от английского Ethanol), на единицу объёма топлива составляет примерно 75% от пробега стандартных машин. Обычные машины не могут работать на Е 85, хотя двигатели внутреннего сгорания прекрасно работают на Е 10 или Е 15. На чистом этаноле могут работать только т. н. «Flex-Fuel» машины ( «гибкотопливные» машины). Эти автомобили также могут работать на обычном бензине с небольшой добавкой этанола или на произвольной смеси того и другого. Пользуясь тем, что этанол дешевле бензина, недобросовестные заправщики разбавляют Е 20 азеотропом, так что его концентрация может негласно доходить до 40 %. Переделать обычную машину в «flex-fuel» можно, но экономически нецелесообразно. • Недостаток - при сгорании этанола в выхлопных газах двигателей появляются альдегиды (формальдегид и ацетальдегид), наносящие живым организмам не меньший ущерб, чем ароматические углеводороды от бензина.
 2. Биометанол • Промышленное культивирование и биотехнологическая конвер сия морского фитопланктона в искусственных водоемах, создаваемых на морском побережье, рассматривается как одно из наиболее перспективных направлений. • Выращенную биомассу подвергают метановому брожению и последующему гидроксилированию метана с получением метанола. Основные преимущества использования микроводорослей : • высокая продуктивность фитопланктона (до 100 т/га в год); • в производстве не используются ни плодородные почвы, ни пресная вода; • процесс не конкурирует с сельскохозяйственным производством.
2. Биометанол • Промышленное культивирование и биотехнологическая конвер сия морского фитопланктона в искусственных водоемах, создаваемых на морском побережье, рассматривается как одно из наиболее перспективных направлений. • Выращенную биомассу подвергают метановому брожению и последующему гидроксилированию метана с получением метанола. Основные преимущества использования микроводорослей : • высокая продуктивность фитопланктона (до 100 т/га в год); • в производстве не используются ни плодородные почвы, ни пресная вода; • процесс не конкурирует с сельскохозяйственным производством.
 3. Биобутанол • C 4 H 10 O — бутиловый спирт. Бесцветная жидкость с характерным запахом. • Энергия бутанола близка к энергии бензина. Бутанол может использоваться в топливных элементах, и как сырьё для производства водорода. • Сырьём для производства биобутанола могут быть сахарный тростник, свекла, кукуруза, пшеница, маниока, а в будущем и целлюлоза. • Технология производства биобутанола разработана компанией Du. Pont Biofuels.
3. Биобутанол • C 4 H 10 O — бутиловый спирт. Бесцветная жидкость с характерным запахом. • Энергия бутанола близка к энергии бензина. Бутанол может использоваться в топливных элементах, и как сырьё для производства водорода. • Сырьём для производства биобутанола могут быть сахарный тростник, свекла, кукуруза, пшеница, маниока, а в будущем и целлюлоза. • Технология производства биобутанола разработана компанией Du. Pont Biofuels.
 4. Диметиловый эфир (ДМЭ - C 2 H 6 O) • Большое количество диметилового эфира производится из отходов целлюлозо-бумажного производства. Сжижается при небольшом давлении. • Диметиловый эфир — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя. • Автомобили с двигателями, работающими на диметиловом эфире разрабатывают KAMAZ, Volvo, Nissan и китайская компания SAIC Motor.
4. Диметиловый эфир (ДМЭ - C 2 H 6 O) • Большое количество диметилового эфира производится из отходов целлюлозо-бумажного производства. Сжижается при небольшом давлении. • Диметиловый эфир — экологически чистое топливо без содержания серы, содержание оксидов азота в выхлопных газах на 90 % меньше, чем у бензина. Применение диметилового эфира не требует специальных фильтров, но необходима переделка систем питания (установка газобалонного оборудования, корректировка смесеобразования) и зажигания двигателя. • Автомобили с двигателями, работающими на диметиловом эфире разрабатывают KAMAZ, Volvo, Nissan и китайская компания SAIC Motor.
 5. Биодизель — топливо на основе жиров животного, растительного и микробного происхождения, а также продуктов их этерификации. • Для получения биодизельного топлива используются растительные или животные жиры. Сырьём могут быть рапсовое, соевое, пальмовое, кокосовое масло, или любого другого масла-сырца, а также отходы пищевой промышленности. Затем их обрабатывают избытком метанола в течение 1 ч при 60 °С в присутствии катализатора (например, метилата натрия, CH 3 ONa):
5. Биодизель — топливо на основе жиров животного, растительного и микробного происхождения, а также продуктов их этерификации. • Для получения биодизельного топлива используются растительные или животные жиры. Сырьём могут быть рапсовое, соевое, пальмовое, кокосовое масло, или любого другого масла-сырца, а также отходы пищевой промышленности. Затем их обрабатывают избытком метанола в течение 1 ч при 60 °С в присутствии катализатора (например, метилата натрия, CH 3 ONa):
 • • Достоинства: Биодизель, как показали опыты, при попадании в воду не причиняет вреда растениям и животным. Кроме того, он подвергается практически полному биологическому распаду: в почве или в воде микроорганизмы за 28 дней перерабатывают 99 % биодизеля, что позволяет говорить о минимизации загрязнения рек и озёр. Сокращение выбросов СО 2, т. к. при сгорании биодизеля выделяется ровно такое же количество углекислого газа, которое было потреблено из атмосферы растением, являющимся исходным сырьём для производства масла, за весь период его жизни. Качество биотоплива соответствует по нормам токсичности Евро 4.
• • Достоинства: Биодизель, как показали опыты, при попадании в воду не причиняет вреда растениям и животным. Кроме того, он подвергается практически полному биологическому распаду: в почве или в воде микроорганизмы за 28 дней перерабатывают 99 % биодизеля, что позволяет говорить о минимизации загрязнения рек и озёр. Сокращение выбросов СО 2, т. к. при сгорании биодизеля выделяется ровно такое же количество углекислого газа, которое было потреблено из атмосферы растением, являющимся исходным сырьём для производства масла, за весь период его жизни. Качество биотоплива соответствует по нормам токсичности Евро 4.
 Недостатки • В холодное время года необходимо подогревать топливо, идущее из топливного бака в топливный насос, или применять смеси 20 % биодизеля и 80 % солярки марки В 20. • Долго не хранится (около 3 месяцев) • Производство топлива из растений занимает сельскохозяйственные площади. • 1 литр «солнечной» солярки дороже обычной.
Недостатки • В холодное время года необходимо подогревать топливо, идущее из топливного бака в топливный насос, или применять смеси 20 % биодизеля и 80 % солярки марки В 20. • Долго не хранится (около 3 месяцев) • Производство топлива из растений занимает сельскохозяйственные площади. • 1 литр «солнечной» солярки дороже обычной.
 Биодизель в России • В России не существует единой государственной программы развития биодизельного топлива, но создаются региональные программы, например Алтайская краевая целевая программа «Рапс — биодизель» . В Липецкой области создана Ассоциация Производителей Рапсового Масла. • Планируется строительство заводов по производству биодизеля в: Липецкой области, Татарстане, Алтайском крае, Ростовской области, Волгоградской области, Орловской области, Краснодарском крае, Омской области. • ОАО «РЖД» в 2006— 2007 годах провела испытания биодизеля из рапсового масла на тепловозах депо Воронеж-Курский Юго-Восточной железной дороги. Представители РЖД заявили о готовности использовать биодизель в промышленных масштабах на своих тепловозах
Биодизель в России • В России не существует единой государственной программы развития биодизельного топлива, но создаются региональные программы, например Алтайская краевая целевая программа «Рапс — биодизель» . В Липецкой области создана Ассоциация Производителей Рапсового Масла. • Планируется строительство заводов по производству биодизеля в: Липецкой области, Татарстане, Алтайском крае, Ростовской области, Волгоградской области, Орловской области, Краснодарском крае, Омской области. • ОАО «РЖД» в 2006— 2007 годах провела испытания биодизеля из рапсового масла на тепловозах депо Воронеж-Курский Юго-Восточной железной дороги. Представители РЖД заявили о готовности использовать биодизель в промышленных масштабах на своих тепловозах
 Наиболее перспективным источником сырья для производства биодизеля являются водоросли. • По оценкам Департамента Энергетики США с одного акра (4047 м² ~ 0, 4 га) земли можно получить 255 литров соевого масла, или 2400 литров пальмового масла. С такой же площади водной поверхности можно производить до 3570 барреля бионефти (1 баррель = 159 литров). • По оценкам компании Green Star Products с 1 акра земли можно получить 48 галлонов соевого масла, 140 галлонов масла канолы и 10 000 галлонов из водорослей.
Наиболее перспективным источником сырья для производства биодизеля являются водоросли. • По оценкам Департамента Энергетики США с одного акра (4047 м² ~ 0, 4 га) земли можно получить 255 литров соевого масла, или 2400 литров пальмового масла. С такой же площади водной поверхности можно производить до 3570 барреля бионефти (1 баррель = 159 литров). • По оценкам компании Green Star Products с 1 акра земли можно получить 48 галлонов соевого масла, 140 галлонов масла канолы и 10 000 галлонов из водорослей.
 В Японии начали использовать эвгленовые водоросли вместо бензина • Водоросль содержит масляную субстанцию, поэтому и привлекла внимание ученых как возможное сырье для биотоплива. Кроме того, она содержит хлорофилл и способна поглощать углекислый газ. • Первый в мире автобус, работающий на биотопливе с применением зеленых эвгленовых водорослей, начал ездить в японском городе Фудзисава и совершает 22 поездки в день. • Согласно планам к 2018 году компании Isuzu и Euglena рассчитывают создать технологию, позволяющую без дополнительной нагрузки на двигатель использовать биотопливо, которое будет на 100% выработано из зеленых водорослей.
В Японии начали использовать эвгленовые водоросли вместо бензина • Водоросль содержит масляную субстанцию, поэтому и привлекла внимание ученых как возможное сырье для биотоплива. Кроме того, она содержит хлорофилл и способна поглощать углекислый газ. • Первый в мире автобус, работающий на биотопливе с применением зеленых эвгленовых водорослей, начал ездить в японском городе Фудзисава и совершает 22 поездки в день. • Согласно планам к 2018 году компании Isuzu и Euglena рассчитывают создать технологию, позволяющую без дополнительной нагрузки на двигатель использовать биотопливо, которое будет на 100% выработано из зеленых водорослей.
 В конце июня компании Isuzu и Euglena подписали договор о проведении совместных разработок двигателя и топлива из зеленых водорослей - нового поколения биотоплива.
В конце июня компании Isuzu и Euglena подписали договор о проведении совместных разработок двигателя и топлива из зеленых водорослей - нового поколения биотоплива.
 Биогаз • — продукт сбраживания органических отходов (биомассы), представляющий смесь метана и углекислого газа. Разложение биомассы происходит под воздействием бактерий класса метаногенов. • 1. Биоводород — водород, полученный из биомассы термохимическим, биохимическим или другим способом, например водорослями. • 2. Метан синтезируется после очистки от всевозможных примесей так называемого синтетического природного газа из углеродосодержащего твердого топлива, такого как уголь или древесина. Этот экзотермический процесс происходит при температуре от 300 до 450 °C и давлении 1− 5 бар в присутствии катализатора.
Биогаз • — продукт сбраживания органических отходов (биомассы), представляющий смесь метана и углекислого газа. Разложение биомассы происходит под воздействием бактерий класса метаногенов. • 1. Биоводород — водород, полученный из биомассы термохимическим, биохимическим или другим способом, например водорослями. • 2. Метан синтезируется после очистки от всевозможных примесей так называемого синтетического природного газа из углеродосодержащего твердого топлива, такого как уголь или древесина. Этот экзотермический процесс происходит при температуре от 300 до 450 °C и давлении 1− 5 бар в присутствии катализатора.
 Способы переработки биомассы такие же как и нефти: • 1. Каталитический крекинг (расщепление в присутствии Al 2 O 3 и Si. O 2) • 2. Термическая обработка (гидрокрекинг при Т ~ 450 500 ºС)
Способы переработки биомассы такие же как и нефти: • 1. Каталитический крекинг (расщепление в присутствии Al 2 O 3 и Si. O 2) • 2. Термическая обработка (гидрокрекинг при Т ~ 450 500 ºС)

 Три стратегии получения химических продуктов из вторичной биомассы • • • 1. Через разложение до молекул низкой м. м. (газификация в синтез-газ, пиролиз). Затем получение углеводородов и других веществ обычными способами. Недостатки: многостадий, потеря существующих структур. 2. Через базовые молекулы (платформы): концепция biorefinery(бионефтехимия). Часть биомассы превращают в топливо пиролизом или газификацией, другую часть методом ферментации или каталитическими превращают в молекулы-платформы (этанол, органические кислоты и др. ), из них как из строительных блоков собирают другие молекулы. Недостаток: нужны новые пути синтеза (часто связанные с восстановлением и гидрогенолизом, поскольку молекулы-платформы содержат кислород в отличие от ископаемых углеводородов, для которых преимущественно работают окислительные реакции. ) 3. Прямое превращение биомассы в продукты (one-pot synthesis): в состав многих коммерческих продуктов (краски, бумага, косметика, связующие, конструкционные материалы) входят смеси похожих веществ (например, диолов или полиолов) и их можно получать прямо из биомассы методами, часто включающими две или несколько каталитических стадий без выделения промежуточных продуктов. •
Три стратегии получения химических продуктов из вторичной биомассы • • • 1. Через разложение до молекул низкой м. м. (газификация в синтез-газ, пиролиз). Затем получение углеводородов и других веществ обычными способами. Недостатки: многостадий, потеря существующих структур. 2. Через базовые молекулы (платформы): концепция biorefinery(бионефтехимия). Часть биомассы превращают в топливо пиролизом или газификацией, другую часть методом ферментации или каталитическими превращают в молекулы-платформы (этанол, органические кислоты и др. ), из них как из строительных блоков собирают другие молекулы. Недостаток: нужны новые пути синтеза (часто связанные с восстановлением и гидрогенолизом, поскольку молекулы-платформы содержат кислород в отличие от ископаемых углеводородов, для которых преимущественно работают окислительные реакции. ) 3. Прямое превращение биомассы в продукты (one-pot synthesis): в состав многих коммерческих продуктов (краски, бумага, косметика, связующие, конструкционные материалы) входят смеси похожих веществ (например, диолов или полиолов) и их можно получать прямо из биомассы методами, часто включающими две или несколько каталитических стадий без выделения промежуточных продуктов. •

 • Необходима разработка каталитических способов переработки и новых конструкций оборудования. • Катализаторы и оборудование нефтепереработки разрабатывали в течение 120 лет. • Процессы переработки биомассы только начинают разрабатывать. Необходимы: • Новые процессы, адаптированные для переработки кислородсодержащих соединений • Многостадийные процессы( каскадный катализ) • Катализаторы, устойчивые к действию примесей в сырье • Новые процессы активации (ультразвук, микроволны) • Новые реакционные среды (сверхкритические флюиды, ионные жидкости) • Т. е. процессы основанные на принципах зеленой химии
• Необходима разработка каталитических способов переработки и новых конструкций оборудования. • Катализаторы и оборудование нефтепереработки разрабатывали в течение 120 лет. • Процессы переработки биомассы только начинают разрабатывать. Необходимы: • Новые процессы, адаптированные для переработки кислородсодержащих соединений • Многостадийные процессы( каскадный катализ) • Катализаторы, устойчивые к действию примесей в сырье • Новые процессы активации (ультразвук, микроволны) • Новые реакционные среды (сверхкритические флюиды, ионные жидкости) • Т. е. процессы основанные на принципах зеленой химии
 Превращение триглицеридов (молекула- платформа) из растительных масел
Превращение триглицеридов (молекула- платформа) из растительных масел

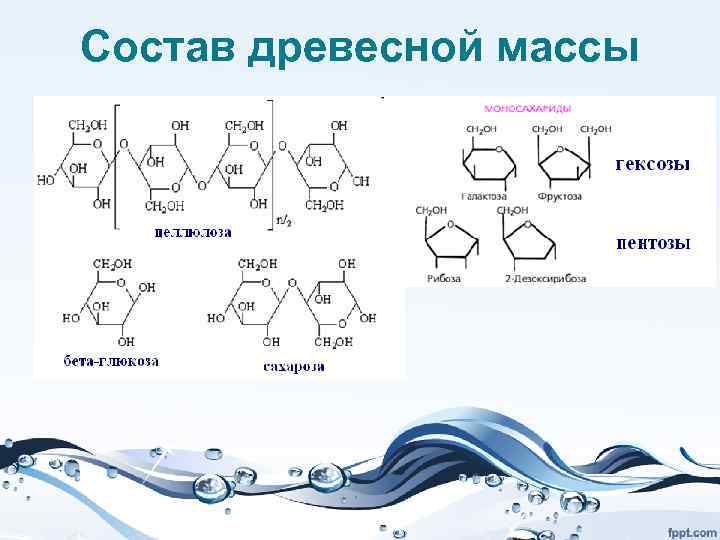 Состав древесной массы
Состав древесной массы

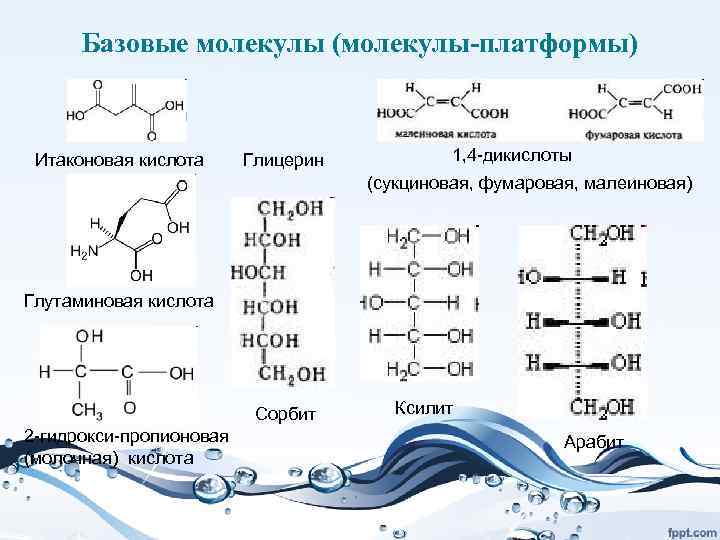 Базовые молекулы (молекулы-платформы) Итаконовая кислота Глицерин 1, 4 -дикислоты (сукциновая, фумаровая, малеиновая) Глутаминовая кислота Сорбит 2 -гидрокси-пропионовая (молочная) кислота Ксилит Арабит
Базовые молекулы (молекулы-платформы) Итаконовая кислота Глицерин 1, 4 -дикислоты (сукциновая, фумаровая, малеиновая) Глутаминовая кислота Сорбит 2 -гидрокси-пропионовая (молочная) кислота Ксилит Арабит
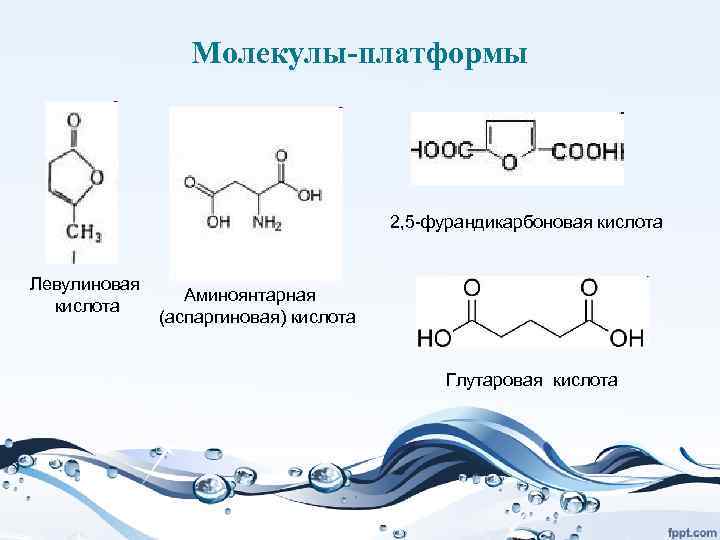 Молекулы-платформы 2, 5 -фурандикарбоновая кислота Левулиновая кислота Аминоянтарная (аспаргиновая) кислота Глутаровая кислота
Молекулы-платформы 2, 5 -фурандикарбоновая кислота Левулиновая кислота Аминоянтарная (аспаргиновая) кислота Глутаровая кислота
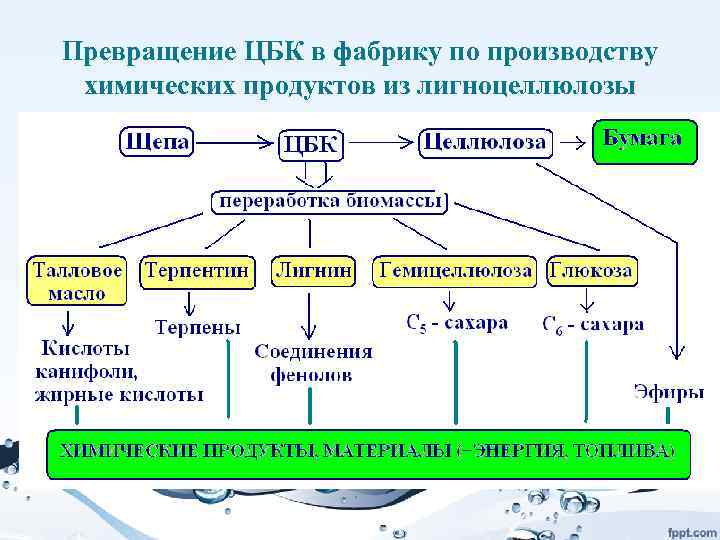 Превращение ЦБК в фабрику по производству химических продуктов из лигноцеллюлозы
Превращение ЦБК в фабрику по производству химических продуктов из лигноцеллюлозы
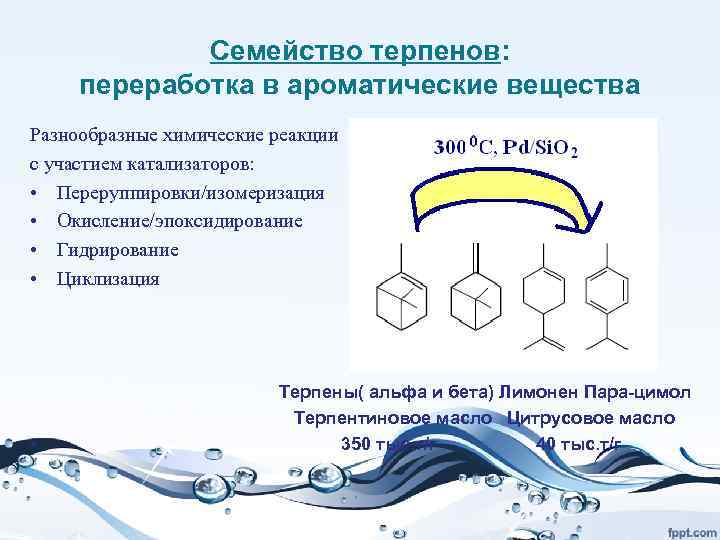 Семейство терпенов: переработка в ароматические вещества Разнообразные химические реакции с участием катализаторов: • Переруппировки/изомеризация • Окисление/эпоксидирование • Гидрирование • Циклизация • Терпены( альфа и бета) Лимонен Пара-цимол Терпентиновое масло Цитрусовое масло 350 тыс. т/г 40 тыс. т/г
Семейство терпенов: переработка в ароматические вещества Разнообразные химические реакции с участием катализаторов: • Переруппировки/изомеризация • Окисление/эпоксидирование • Гидрирование • Циклизация • Терпены( альфа и бета) Лимонен Пара-цимол Терпентиновое масло Цитрусовое масло 350 тыс. т/г 40 тыс. т/г
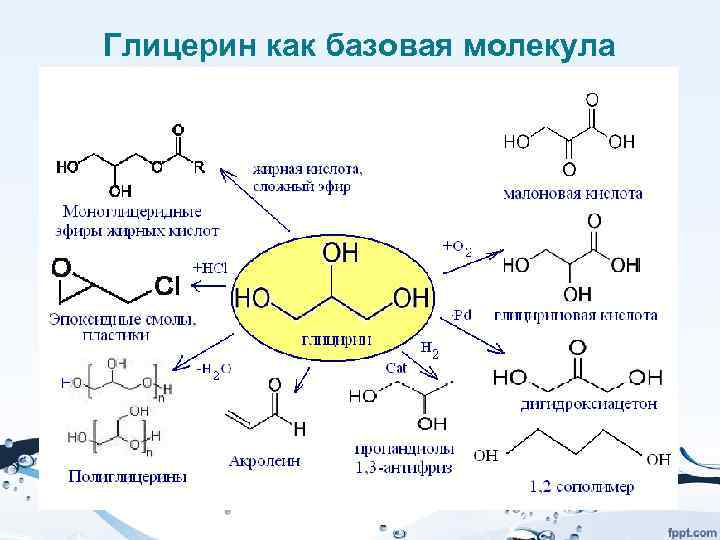 Глицерин как базовая молекула
Глицерин как базовая молекула

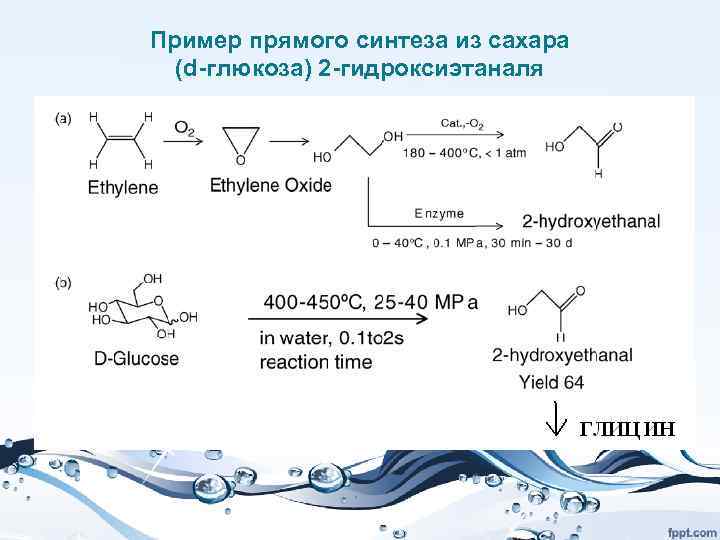 Пример прямого синтеза из сахара (d-глюкоза) 2 -гидроксиэтаналя
Пример прямого синтеза из сахара (d-глюкоза) 2 -гидроксиэтаналя
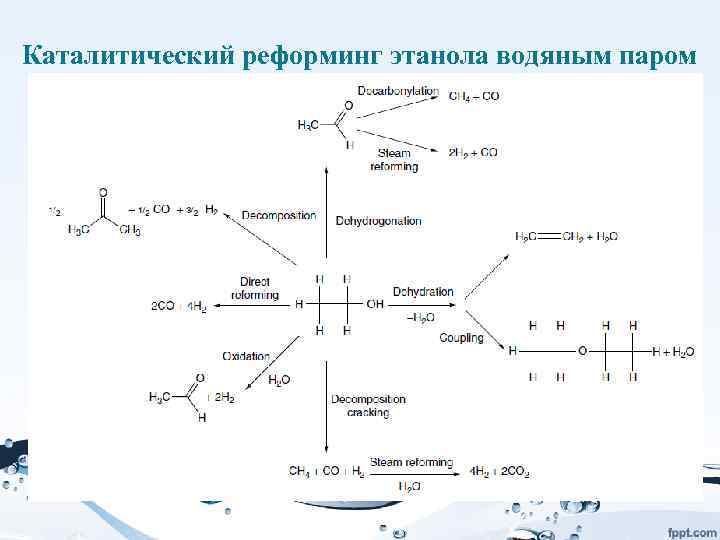 Каталитический реформинг этанола водяным паром
Каталитический реформинг этанола водяным паром
 Биомасса для очистки воды
Биомасса для очистки воды
 Фиторемедиация - технология очистки загрязненных природных и техногенных сред с использованием растений. • Первые простейшие методы очистки сточных вод — поля орошения и поля фильтрации — были основаны на использовании растений. • Первые научные исследования были проведены в 50 -х годах в Израиле, однако активное развитие метод получил только в 80 -х годах XX века.
Фиторемедиация - технология очистки загрязненных природных и техногенных сред с использованием растений. • Первые простейшие методы очистки сточных вод — поля орошения и поля фильтрации — были основаны на использовании растений. • Первые научные исследования были проведены в 50 -х годах в Израиле, однако активное развитие метод получил только в 80 -х годах XX века.
 Поля орошения
Поля орошения
 Поля фильтрации
Поля фильтрации
 схема
схема
 Основные виды воздействия растений на окружающую среду: 1. Очистка от металлов: • ризофильтрация — корни всасывают воду и химические элементы, необходимые для жизнедеятельности растений; • фитоэкстракция — накопление в организме растения опасных загрязнений (например, тяжёлых металлов); • фитоволатилизация — испарение воды и летучих химических элементов (As, Se) листьями растений; 2. Очистка от органики: • фитостабилизация — перевод химических соединений в менее подвижную и активную форму (снижает риск распространения загрязнений); • фитодеградация — деградация растениями и симбиотическими микроорганизмами органической части загрязнений; • фитостимуляция — стимуляция развития симбиотических микроорганизмов, принимающих участие в процессе очистки.
Основные виды воздействия растений на окружающую среду: 1. Очистка от металлов: • ризофильтрация — корни всасывают воду и химические элементы, необходимые для жизнедеятельности растений; • фитоэкстракция — накопление в организме растения опасных загрязнений (например, тяжёлых металлов); • фитоволатилизация — испарение воды и летучих химических элементов (As, Se) листьями растений; 2. Очистка от органики: • фитостабилизация — перевод химических соединений в менее подвижную и активную форму (снижает риск распространения загрязнений); • фитодеградация — деградация растениями и симбиотическими микроорганизмами органической части загрязнений; • фитостимуляция — стимуляция развития симбиотических микроорганизмов, принимающих участие в процессе очистки.
 Используемые виды растений Тростник (Phragmiittes communiis)
Используемые виды растений Тростник (Phragmiittes communiis)
 Ива (Salix cinerea, Salix peuntandra)
Ива (Salix cinerea, Salix peuntandra)
 Ряска (Lemna sp. )
Ряска (Lemna sp. )
 Водяной гиацинт (Eichhornia crassipes)
Водяной гиацинт (Eichhornia crassipes)
 Преимущества • возможность произведения ремедиации in situ; • относительно низкая себестоимость проводимых работ по сравнению с традиционными очистными сооружениями (~ в 2 раза); • безопасность для окружающей среды; • теоретическая возможность экстракции ценных веществ (Ni, Au, Cu) из зеленой массы растений; • возможность мониторинга процесса очистки; • качество очистки не уступает традиционным методам, особенно при небольшом объёме сточных вод (например, в деревнях); • более эстетичный по сравнению с традиционной очисткой; • может быть применен для одновременного выведения нескольких поллютантов.
Преимущества • возможность произведения ремедиации in situ; • относительно низкая себестоимость проводимых работ по сравнению с традиционными очистными сооружениями (~ в 2 раза); • безопасность для окружающей среды; • теоретическая возможность экстракции ценных веществ (Ni, Au, Cu) из зеленой массы растений; • возможность мониторинга процесса очистки; • качество очистки не уступает традиционным методам, особенно при небольшом объёме сточных вод (например, в деревнях); • более эстетичный по сравнению с традиционной очисткой; • может быть применен для одновременного выведения нескольких поллютантов.
 Недостатки • результат зависит от внешних условий (климат, температура, высотность, состав воды и почвы, влажность и др. ); • требует достаточно большого числа операций как при изучении, так и в процессе применения метода; • существует риск возвращения поллютантов в очищаемую среду после отмирания растения (осень); • в ряде случаев на «зеленую очистку» требуется больше времени.
Недостатки • результат зависит от внешних условий (климат, температура, высотность, состав воды и почвы, влажность и др. ); • требует достаточно большого числа операций как при изучении, так и в процессе применения метода; • существует риск возвращения поллютантов в очищаемую среду после отмирания растения (осень); • в ряде случаев на «зеленую очистку» требуется больше времени.
 Фитодобыча - извлечение металлов из нерентабельных рудных тел и других источников путем их концентрирования в тканях растений-гипераккумулянтов. Схема процесса фитодобычи: • 1. Выбор объекта - предварительные исследования: характеристика объекта, выбор растений; • 2. Исследование - достаточно ли металлов для рентабельного урожая, требуется ли удобрение (индуцирование)? • 3. высадка (посев) растений, внесение удобрений, создание условий: р. Н, хелатирование), индуцирование растений; • 4. созревание растений; • 5. сбор «урожая» ; • 6. сжигание биомассы: • 6. 1 выплавка биоруды в металл, • 6. 2 энергия (прибыль)
Фитодобыча - извлечение металлов из нерентабельных рудных тел и других источников путем их концентрирования в тканях растений-гипераккумулянтов. Схема процесса фитодобычи: • 1. Выбор объекта - предварительные исследования: характеристика объекта, выбор растений; • 2. Исследование - достаточно ли металлов для рентабельного урожая, требуется ли удобрение (индуцирование)? • 3. высадка (посев) растений, внесение удобрений, создание условий: р. Н, хелатирование), индуцирование растений; • 4. созревание растений; • 5. сбор «урожая» ; • 6. сжигание биомассы: • 6. 1 выплавка биоруды в металл, • 6. 2 энергия (прибыль)
 Патент Соединенных Штатов. Авторы: Чаней Р. Л. , Англе Дж. С. , Бакер А. Дж. М. и Й-М. Ли. • Название: «Методы фитодобычи никеля, кобальта и других металлов из почвы» • Продолжающая заявка с патентным номером Pat. No. 5944872 от 1999 Содержание патента: - извлечение из почв с повышенным содержанием металлов: кобальта, никеля и металлов группы платины и палладия (палладий, родий, рутений, платина, ирридий, осмий, рений) - извлечение с применением семейства Brassiaceae (Allysum murale, A. pintodasilvae, A. malacitanum, A. lesbiacum, A. fallacinum) - почвообработка для создания условий: • р. Н 4, 5 -6, 2 (сера и аммонийные удобрения) • понижение кальция (сера, серная кислота, вымывание) • добавление азотного удобрения • добавление агентов, хелатирующих никель (ЭДТА, нитрилтриуксусная кислота, N-тетрауксусная кислота) • До 2, 5% Ni в надземной части растений
Патент Соединенных Штатов. Авторы: Чаней Р. Л. , Англе Дж. С. , Бакер А. Дж. М. и Й-М. Ли. • Название: «Методы фитодобычи никеля, кобальта и других металлов из почвы» • Продолжающая заявка с патентным номером Pat. No. 5944872 от 1999 Содержание патента: - извлечение из почв с повышенным содержанием металлов: кобальта, никеля и металлов группы платины и палладия (палладий, родий, рутений, платина, ирридий, осмий, рений) - извлечение с применением семейства Brassiaceae (Allysum murale, A. pintodasilvae, A. malacitanum, A. lesbiacum, A. fallacinum) - почвообработка для создания условий: • р. Н 4, 5 -6, 2 (сера и аммонийные удобрения) • понижение кальция (сера, серная кислота, вымывание) • добавление азотного удобрения • добавление агентов, хелатирующих никель (ЭДТА, нитрилтриуксусная кислота, N-тетрауксусная кислота) • До 2, 5% Ni в надземной части растений
 Преимущества фитодобычи по сравнению с традиционными способами разработки полезных ископаемых • При соблюдении ряда условий чистая прибыль от фитодобычи составляет 513 $/га. • Возможность экономически выгодного извлечения из нерентабельных рудных тел, почв с повышенным содержанием металлов, отвалов и хвостохранилищ промышленных предприятий. • Воздействие на окружающую среду минимально по сравнению с разработкой рудников. • Содержание металлов в золе растений выше, чем в концентрате, получаемом из руды традиционным способом. • За счет низкого содержания серы сжигание биомассы не приводит к появлению кислотных дождей.
Преимущества фитодобычи по сравнению с традиционными способами разработки полезных ископаемых • При соблюдении ряда условий чистая прибыль от фитодобычи составляет 513 $/га. • Возможность экономически выгодного извлечения из нерентабельных рудных тел, почв с повышенным содержанием металлов, отвалов и хвостохранилищ промышленных предприятий. • Воздействие на окружающую среду минимально по сравнению с разработкой рудников. • Содержание металлов в золе растений выше, чем в концентрате, получаемом из руды традиционным способом. • За счет низкого содержания серы сжигание биомассы не приводит к появлению кислотных дождей.
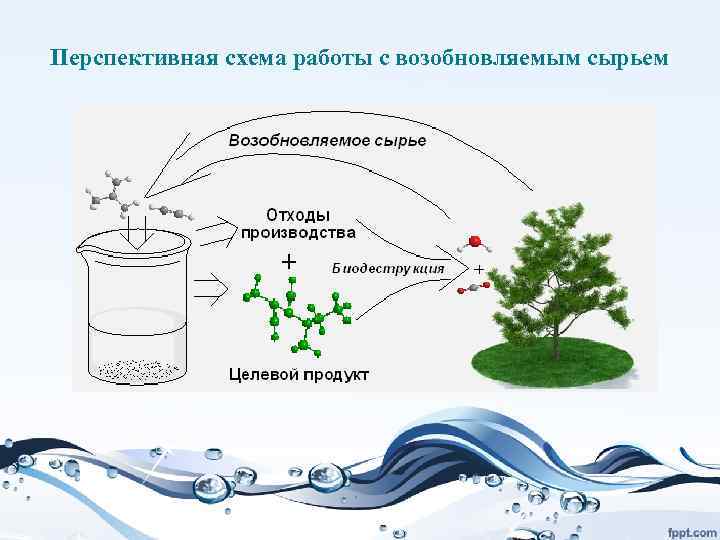 Перспективная схема работы с возобновляемым сырьем
Перспективная схема работы с возобновляемым сырьем
 • Еще одно ключевое направление зеленой химии (принципом 5) – отказ от использования вредных для природы органических растворителей. • Сейчас интенсивно разрабатываются процессы использования в качестве растворителей сверхкритических флюидов, ионных жидкостей, и проведение механохимической активации веществ. • Сверхкритический флюид (СКФ) – это вещество вблизи критической точки на фазовой диаграмме, где его свойства кардинально меняются.
• Еще одно ключевое направление зеленой химии (принципом 5) – отказ от использования вредных для природы органических растворителей. • Сейчас интенсивно разрабатываются процессы использования в качестве растворителей сверхкритических флюидов, ионных жидкостей, и проведение механохимической активации веществ. • Сверхкритический флюид (СКФ) – это вещество вблизи критической точки на фазовой диаграмме, где его свойства кардинально меняются.
 Сверхкритическое - состояние, в котором свойства жидкости и газа перестают различаться (критическая точка на диаграмме состояния вещества). В этом состоянии свойства веществ меняются по сравнению с жидким состоянием. • Например, вода в сверхкритическом состоянии становится неполярной и хорошо растворяет органические соединения, нерастворимые в жидкой воде.
Сверхкритическое - состояние, в котором свойства жидкости и газа перестают различаться (критическая точка на диаграмме состояния вещества). В этом состоянии свойства веществ меняются по сравнению с жидким состоянием. • Например, вода в сверхкритическом состоянии становится неполярной и хорошо растворяет органические соединения, нерастворимые в жидкой воде.
 • Одно из самых распространенных и экологически безвредных веществ — вода, но перевести ее в сверхкритическое состояние достаточно трудно, поскольку параметры критической точки очень велики: tкр — 374° С, ркр — 220 атм. Современные технологии позволяют создавать установки, отвечающие таким требованиям, но работать в этом диапазоне температур и давлений технически сложно. Сверхкритическая вода растворяет практически все органические соединения, которые не разлагаются при высоких температурах. Такая вода, при добавлении в нее кислорода, становится мощной окислительной средой, превращающей за несколько минут любые органические соединения в Н 2 О и СО 2. В настоящее время рассматривают возможность перерабатывать таким способом бытовые отходы, прежде всего пластиковую тару (сжигать такую тару нельзя, т. к. при этом возникают токсичные летучие вещества - диоксины).
• Одно из самых распространенных и экологически безвредных веществ — вода, но перевести ее в сверхкритическое состояние достаточно трудно, поскольку параметры критической точки очень велики: tкр — 374° С, ркр — 220 атм. Современные технологии позволяют создавать установки, отвечающие таким требованиям, но работать в этом диапазоне температур и давлений технически сложно. Сверхкритическая вода растворяет практически все органические соединения, которые не разлагаются при высоких температурах. Такая вода, при добавлении в нее кислорода, становится мощной окислительной средой, превращающей за несколько минут любые органические соединения в Н 2 О и СО 2. В настоящее время рассматривают возможность перерабатывать таким способом бытовые отходы, прежде всего пластиковую тару (сжигать такую тару нельзя, т. к. при этом возникают токсичные летучие вещества - диоксины).
 Сверхкритическое состояние возможно для большинства жидких и газообразных веществ, нужно лишь, чтобы вещество не разлагалось при критической температуре.
Сверхкритическое состояние возможно для большинства жидких и газообразных веществ, нужно лишь, чтобы вещество не разлагалось при критической температуре.
 • Наиболее известные из сверхкритических жидкостей – это вода, углекислый газ, аммиак, пропан, азот. • СО 2 уже сейчас активно используют в качестве растворителя (у него довольно низкая критическая точка). • В фармацевтике с его помощью экстрагируют кофеин из кофейных зерен. • В производстве косметических и парфюмерных препаратов СКФтехнологии используются для извлечения эфирных масел, витаминов, фитонцидов из растительных и животных продуктов. В извлеченных веществах нет следов растворителя, а мягкий способ извлечения позволяет сохранить их биологическую активность. • В Японии он довольно широко используется вместо хлорсодержащих растворителей для устранения загрязнений с одежды (сверхкритическая химчистка), а также для очистки различных электронных схем в процессе их производства. • В сверхкритическом СО 2 можно проводить полимеризацию (он хорошо растворяет, например, фторированные углеводороды); синтез комплексов металлов.
• Наиболее известные из сверхкритических жидкостей – это вода, углекислый газ, аммиак, пропан, азот. • СО 2 уже сейчас активно используют в качестве растворителя (у него довольно низкая критическая точка). • В фармацевтике с его помощью экстрагируют кофеин из кофейных зерен. • В производстве косметических и парфюмерных препаратов СКФтехнологии используются для извлечения эфирных масел, витаминов, фитонцидов из растительных и животных продуктов. В извлеченных веществах нет следов растворителя, а мягкий способ извлечения позволяет сохранить их биологическую активность. • В Японии он довольно широко используется вместо хлорсодержащих растворителей для устранения загрязнений с одежды (сверхкритическая химчистка), а также для очистки различных электронных схем в процессе их производства. • В сверхкритическом СО 2 можно проводить полимеризацию (он хорошо растворяет, например, фторированные углеводороды); синтез комплексов металлов.
 • В пищевой промышленности новая технология позволяет деликатно извлекать из растительного сырья различные вкусовые и ароматические компоненты, добавляемые в пищевую продукцию. • Радиохимия использует новую технологию для решения экологических задач. Многие радиоактивные элементы в сверхкритической среде легко образуют комплексы с добавленными органическими соединениями — лигандами. Образующийся комплекс, в отличие от исходного соединения радиоактивного элемента, растворим во флюиде, и потому легко отделяется от основной массы вещества. Таким способом можно извлекать остатки радиоактивных элементов из отработанных руд, а также проводить дезактивацию почвы, зараженной радиоактивными отходами.
• В пищевой промышленности новая технология позволяет деликатно извлекать из растительного сырья различные вкусовые и ароматические компоненты, добавляемые в пищевую продукцию. • Радиохимия использует новую технологию для решения экологических задач. Многие радиоактивные элементы в сверхкритической среде легко образуют комплексы с добавленными органическими соединениями — лигандами. Образующийся комплекс, в отличие от исходного соединения радиоактивного элемента, растворим во флюиде, и потому легко отделяется от основной массы вещества. Таким способом можно извлекать остатки радиоактивных элементов из отработанных руд, а также проводить дезактивацию почвы, зараженной радиоактивными отходами.
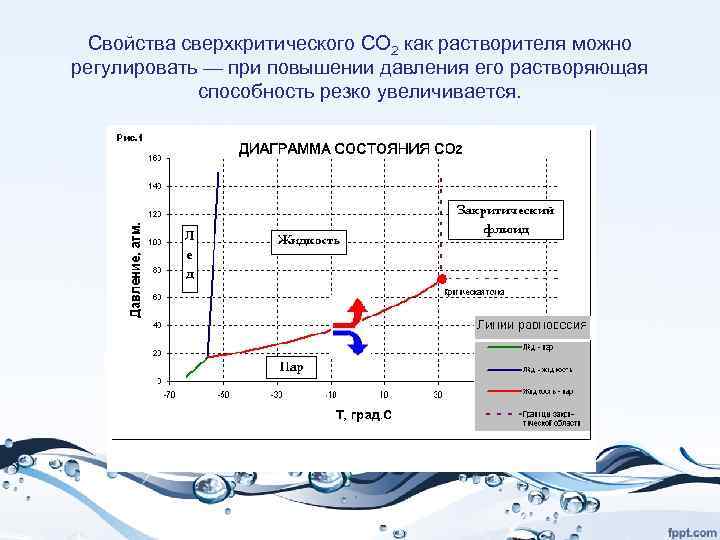 Свойства сверхкритического СО 2 как растворителя можно регулировать — при повышении давления его растворяющая способность резко увеличивается.
Свойства сверхкритического СО 2 как растворителя можно регулировать — при повышении давления его растворяющая способность резко увеличивается.
 Преимущества СКФ-СО 2 • 1. Диоксид углерода - побочный продукт многих химических процессов (снижение выбросов СО 2 в атмосферу). • 2. Замена токсичных органических растворителей. • 3. Снижение энергетических затрат при использовании диоксида углерода в качестве растворителя. Так, если реакция проводится в воде, необходимо затратить большое количество энергии на ее выпаривание, а СО 2 испаряется сам при снятии давления с системы.
Преимущества СКФ-СО 2 • 1. Диоксид углерода - побочный продукт многих химических процессов (снижение выбросов СО 2 в атмосферу). • 2. Замена токсичных органических растворителей. • 3. Снижение энергетических затрат при использовании диоксида углерода в качестве растворителя. Так, если реакция проводится в воде, необходимо затратить большое количество энергии на ее выпаривание, а СО 2 испаряется сам при снятии давления с системы.
 Основной недостаток сверхкритических растворителей • состоит в том, что емкости, заполненные СКФ, работают в режиме периодического процесса: загрузка сырья в аппарат — выгрузка готовой продукции — загрузка свежей порции сырья. Не всегда можно повысить производительность установки, увеличивая объем аппаратов, поскольку создание больших емкостей, выдерживающих давление, близкое к 10 МПа, — трудная техническая задача.
Основной недостаток сверхкритических растворителей • состоит в том, что емкости, заполненные СКФ, работают в режиме периодического процесса: загрузка сырья в аппарат — выгрузка готовой продукции — загрузка свежей порции сырья. Не всегда можно повысить производительность установки, увеличивая объем аппаратов, поскольку создание больших емкостей, выдерживающих давление, близкое к 10 МПа, — трудная техническая задача.
 • В Великобритании уже запущен промышленный процесс селективного гидрирования изофорона (используется для производства отвердителей для систем без растворителя, отверждевающихся при комнатной температуре и как отвердитель в эпоксидах горячего отверждения) в триметилциклогексанон на палладиевом катализаторе производительностью до 1000 тонн в год; в качестве растворителя используется сверхкритический СО 2. • Недавно описано использование сверхкритических углеводородов для проведения важных нефтехимических процессов. Например, каталитическая изомеризация н-бутана в изо-бутан эффективно протекает в сверхкритическом н-бутане; при этом стабильность работы катализатора и срок службы существенно возрастает, потому что сверхкритический растворитель эффективно очищает поверхность катализатора от образующейся сажи.
• В Великобритании уже запущен промышленный процесс селективного гидрирования изофорона (используется для производства отвердителей для систем без растворителя, отверждевающихся при комнатной температуре и как отвердитель в эпоксидах горячего отверждения) в триметилциклогексанон на палладиевом катализаторе производительностью до 1000 тонн в год; в качестве растворителя используется сверхкритический СО 2. • Недавно описано использование сверхкритических углеводородов для проведения важных нефтехимических процессов. Например, каталитическая изомеризация н-бутана в изо-бутан эффективно протекает в сверхкритическом н-бутане; при этом стабильность работы катализатора и срок службы существенно возрастает, потому что сверхкритический растворитель эффективно очищает поверхность катализатора от образующейся сажи.
 Реакции в сверхкритическом СО 2 можно проводить в автоклавах простого устройства, загружая туда сухой лед и реагенты. СО 2 сам при испарении создаст нужные условия.
Реакции в сверхкритическом СО 2 можно проводить в автоклавах простого устройства, загружая туда сухой лед и реагенты. СО 2 сам при испарении создаст нужные условия.
 Ио нная жи дкость • — жидкость, содержащая только ионы. • В широком смысле этого понятия ионные жидкости — это любые расплавленные соли, например, расплавленный хлорид натрия при температуре выше 800 градусов Цельсия. • В настоящее время под термином «ионные жидкости» чаще всего подразумевают соли, температура плавления которых ниже температуры кипения воды, то есть ниже 100 градусов Цельсия. • В частности, соли, которые плавятся при комнатной температуре, называются «RTIL» или «Room-Temperature Ionic Liquids» .
Ио нная жи дкость • — жидкость, содержащая только ионы. • В широком смысле этого понятия ионные жидкости — это любые расплавленные соли, например, расплавленный хлорид натрия при температуре выше 800 градусов Цельсия. • В настоящее время под термином «ионные жидкости» чаще всего подразумевают соли, температура плавления которых ниже температуры кипения воды, то есть ниже 100 градусов Цельсия. • В частности, соли, которые плавятся при комнатной температуре, называются «RTIL» или «Room-Temperature Ionic Liquids» .
 • Основные области применения: прикладная наука, биотехнологии, энергетика, химия. • Ионные жидкости относятся к так называемым «зелёным растворителям» , которые соответствуют принципам зелёной химии. • Некоторые ионные жидкости, например, 1 -бутил-3 метилимидазолий хлорид, являются относительно эффективными растворителями для целлюлозы. В классических растворителях этот процесс происходит только в очень жёстких условиях
• Основные области применения: прикладная наука, биотехнологии, энергетика, химия. • Ионные жидкости относятся к так называемым «зелёным растворителям» , которые соответствуют принципам зелёной химии. • Некоторые ионные жидкости, например, 1 -бутил-3 метилимидазолий хлорид, являются относительно эффективными растворителями для целлюлозы. В классических растворителях этот процесс происходит только в очень жёстких условиях
 Ионные жидкости • это жидкие при нормальных температуре и давлении соли неорганических и органических кислот с объемными органическими основаниями. • Обычно они нелетучи, негорючи, стабильны, обладают хорошими растворяющими свойствами и способны к регенерации. Подбором подходящих катионов и анионов можно регулировать селективность и глубину протекания целевой реакции. В ионных жидкостях проводят алкилирование, хромирование, дехлорирование, получение биологически активных веществ.
Ионные жидкости • это жидкие при нормальных температуре и давлении соли неорганических и органических кислот с объемными органическими основаниями. • Обычно они нелетучи, негорючи, стабильны, обладают хорошими растворяющими свойствами и способны к регенерации. Подбором подходящих катионов и анионов можно регулировать селективность и глубину протекания целевой реакции. В ионных жидкостях проводят алкилирование, хромирование, дехлорирование, получение биологически активных веществ.
 Физические свойства • Ионные жидкости в твёрдом состоянии представляют собой порошки либо воскообразные субстанции белого, либо желтоватого цвета. • В жидком состоянии бесцветны, либо с желтоватым оттенком, который обусловлен небольшим количеством примесей. • Одно из характерных свойств ионных жидкостей это их высокая вязкость, которая затрудняет работу с ними. Имеют низкую температуру плавления, которая обусловлена стерической затрудненностью структуры, которая усложнят кристаллизацию Пример Поваренная соль Na. Cl и ионная жидкость [bmim]NTf 2 (1 -бутил-3 -метилимидазолий гексафторфосфата ) при температуре в 27 °C. .
Физические свойства • Ионные жидкости в твёрдом состоянии представляют собой порошки либо воскообразные субстанции белого, либо желтоватого цвета. • В жидком состоянии бесцветны, либо с желтоватым оттенком, который обусловлен небольшим количеством примесей. • Одно из характерных свойств ионных жидкостей это их высокая вязкость, которая затрудняет работу с ними. Имеют низкую температуру плавления, которая обусловлена стерической затрудненностью структуры, которая усложнят кристаллизацию Пример Поваренная соль Na. Cl и ионная жидкость [bmim]NTf 2 (1 -бутил-3 -метилимидазолий гексафторфосфата ) при температуре в 27 °C. .
 Классификация ИЖ: • Состоящие из органического катиона и неорганического аниона • Состоящие из неорганического катиона и органического аниона • Полностью органические ионные жидкости • Хиральные ионные жидкости (Хиральность — свойство молекулы не совмещаться в пространстве со своим зеркальным отражением).
Классификация ИЖ: • Состоящие из органического катиона и неорганического аниона • Состоящие из неорганического катиона и органического аниона • Полностью органические ионные жидкости • Хиральные ионные жидкости (Хиральность — свойство молекулы не совмещаться в пространстве со своим зеркальным отражением).
 Получение в промышленности • Несмотря на легкость получения ионных жидкостей в лабораторных условиях, не все методы применимы в промышленных масштабах из-за своей дороговизны. Ионные жидкости позиционируются как «зеленые растворители» , но при их производстве зачастую используются большие количества органических растворителей, зачастую для очистки ионных жидкостей от галогенов. Все эти недостатки должны быть устранены при переходе к многотоннажым синтезам. Например, фирма Solvent Innovation предложила, запатентовала и производит тонновыми количествами ионную жидкость, которая получила торговое название ECOENG 212. Она соответствует всем требованиям зеленой химии: она не токсична, способна разлагаться, попав в окружающую среду, не содержит примесей галогенов, при её производстве не применяются растворители, а единственным побочным продуктом является этиловый спирт.
Получение в промышленности • Несмотря на легкость получения ионных жидкостей в лабораторных условиях, не все методы применимы в промышленных масштабах из-за своей дороговизны. Ионные жидкости позиционируются как «зеленые растворители» , но при их производстве зачастую используются большие количества органических растворителей, зачастую для очистки ионных жидкостей от галогенов. Все эти недостатки должны быть устранены при переходе к многотоннажым синтезам. Например, фирма Solvent Innovation предложила, запатентовала и производит тонновыми количествами ионную жидкость, которая получила торговое название ECOENG 212. Она соответствует всем требованиям зеленой химии: она не токсична, способна разлагаться, попав в окружающую среду, не содержит примесей галогенов, при её производстве не применяются растворители, а единственным побочным продуктом является этиловый спирт.
 Механохимические способы активации • В Красноярске из возобновляемого сырья с использованием механохимии активируют растительное сырье (кора березы, древесина лиственницы), что позволяет повысить эффективность получения ценных химических продуктов из него. • Механохимия — раздел химии, изучающий изменение свойств веществ и их смесей, а также физико-химические превращения при механических воздействиях (в мельницах, дезинтеграторах, на вальцах, экструдерах и т. п. ), при деформировании, трении, ударном сжатии.
Механохимические способы активации • В Красноярске из возобновляемого сырья с использованием механохимии активируют растительное сырье (кора березы, древесина лиственницы), что позволяет повысить эффективность получения ценных химических продуктов из него. • Механохимия — раздел химии, изучающий изменение свойств веществ и их смесей, а также физико-химические превращения при механических воздействиях (в мельницах, дезинтеграторах, на вальцах, экструдерах и т. п. ), при деформировании, трении, ударном сжатии.
 • Пластическая деформация твердого тела обычно приводит не только к изменению формы твердого тела, но и к накоплению в нем дефектов, изменяющих физикохимические свойства, в том числе реакционную способность. Накопление дефектов используют в химии для ускорения реакций с участием твердых веществ, снижения температуры процессов и других путей интенсификации химических реакций в твердой фазе. • Механохимическим методом производят деструкцию полимеров, синтез интерметаллидов и ферритов, получают аморфные сплавы, активируют порошковые материалы.
• Пластическая деформация твердого тела обычно приводит не только к изменению формы твердого тела, но и к накоплению в нем дефектов, изменяющих физикохимические свойства, в том числе реакционную способность. Накопление дефектов используют в химии для ускорения реакций с участием твердых веществ, снижения температуры процессов и других путей интенсификации химических реакций в твердой фазе. • Механохимическим методом производят деструкцию полимеров, синтез интерметаллидов и ферритов, получают аморфные сплавы, активируют порошковые материалы.
 • Еще одно важнейшее направление зеленой химии связано с разработкой новых промышленных процессов, позволяющих снизить экологические риски производстве важных химических продуктов. • Например, известно, что введение функциональных групп в органические соединения часто проводят в две стадии: сначала замещают водород на хлор или другой галоген, а затем уже галоген замещают на другую функциональную группу.
• Еще одно важнейшее направление зеленой химии связано с разработкой новых промышленных процессов, позволяющих снизить экологические риски производстве важных химических продуктов. • Например, известно, что введение функциональных групп в органические соединения часто проводят в две стадии: сначала замещают водород на хлор или другой галоген, а затем уже галоген замещают на другую функциональную группу.
 • В соответствии с принципом 8, введения галогена следует избегать; все хлорсодержащие отходы вредны для окружающей среды. • Альтернативный путь – это так называемые реакции нуклеофильного ароматического замещения водорода. Для того, чтобы облегчить уход гидрид-иона, можно использовать, например, кислород воздуха. • Нобелевская премия по химии в 2005 году была присуждена за работу в области зеленой химии – разработку реакции метатезиса олефинов (Француз Ив Шовен (74 года) и американцы Роберт Граббс (63 года) и Ричард Шрок (60 лет)).
• В соответствии с принципом 8, введения галогена следует избегать; все хлорсодержащие отходы вредны для окружающей среды. • Альтернативный путь – это так называемые реакции нуклеофильного ароматического замещения водорода. Для того, чтобы облегчить уход гидрид-иона, можно использовать, например, кислород воздуха. • Нобелевская премия по химии в 2005 году была присуждена за работу в области зеленой химии – разработку реакции метатезиса олефинов (Француз Ив Шовен (74 года) и американцы Роберт Граббс (63 года) и Ричард Шрок (60 лет)).
 • Метатезис - это реакция, в которой происходит разрыв связи между атомами углерода и некоторая группа атомов занимает другое место в молекуле. Это специальные катализаторы ускорители реакций. рутениевый катализатор R 1 -C=C + C=C-R 2 → R 1 -C=C-R 2 + C=C
• Метатезис - это реакция, в которой происходит разрыв связи между атомами углерода и некоторая группа атомов занимает другое место в молекуле. Это специальные катализаторы ускорители реакций. рутениевый катализатор R 1 -C=C + C=C-R 2 → R 1 -C=C-R 2 + C=C
 • В настоящее время метатезис широко используется при производстве фармацевтических препаратов и полимеров. Благодаря исследованиям лауреатов Нобелевской премии эти процессы становятся более эффективными, уменьшается количество вредных отходов, не требуется использования высоких температур, давления и опасных для окружающей среды реагентов. • Хотелось бы подчеркнуть, что особенно важным в Зеленом подходе является, то что он тесно связан с технологией. То есть при планировании усовершенствований нужно химическую реакцию, а промышленный процесс. рассматривать не
• В настоящее время метатезис широко используется при производстве фармацевтических препаратов и полимеров. Благодаря исследованиям лауреатов Нобелевской премии эти процессы становятся более эффективными, уменьшается количество вредных отходов, не требуется использования высоких температур, давления и опасных для окружающей среды реагентов. • Хотелось бы подчеркнуть, что особенно важным в Зеленом подходе является, то что он тесно связан с технологией. То есть при планировании усовершенствований нужно химическую реакцию, а промышленный процесс. рассматривать не
 • Пример. Для окисления органических соединений в промышленности используют оксид хрома и перманганат калия. При этом образуются ядовитые отходы – оксиды хрома и марганца. Кажется очевидным, что использование вместо соединений переходных металлов таких окислителей, как перекись водорода, кислород или озон, имеет очевидные преимущества, ведь побочными продуктами в этом случае будут вода и кислород. Однако следует учесть, что производство перекиси водорода и озона – это чрезвычайно затратные по энергии процессы. Например, синтез озона требует постоянной работы в барьерном разряде, причем по термодинамическим причинам выход озона не может превышать 30%. И если учесть энергетические затраты (Принцип 6) и связанные с производством энергии экологические риски, вовсе не обязательно этот процесс окажется более экологически выгодным.
• Пример. Для окисления органических соединений в промышленности используют оксид хрома и перманганат калия. При этом образуются ядовитые отходы – оксиды хрома и марганца. Кажется очевидным, что использование вместо соединений переходных металлов таких окислителей, как перекись водорода, кислород или озон, имеет очевидные преимущества, ведь побочными продуктами в этом случае будут вода и кислород. Однако следует учесть, что производство перекиси водорода и озона – это чрезвычайно затратные по энергии процессы. Например, синтез озона требует постоянной работы в барьерном разряде, причем по термодинамическим причинам выход озона не может превышать 30%. И если учесть энергетические затраты (Принцип 6) и связанные с производством энергии экологические риски, вовсе не обязательно этот процесс окажется более экологически выгодным.
 • Кроме энергетических затрат, важно оценивать атомную эффективность, то есть эффективность использования атомов, входящих в исходные материалы, для получения конечных продуктов. Например, побочным продуктом производства оксида пропилена является трет-бутанол. В настоящее время его используют в производстве метилтретбутилового эфира. Если допустить, что потребность в МТБЭ исчезла, встает вопрос, что делать с избыточным трет-бутанолом. Для окисления циклогексана до адипиновой кислоты используют азотную кислоту, побочно образующуюся закись азота выбрасывают в атмосферу. При этом не только теряются для производства атомы азота, но и происходит выброс парниковых газов. Хотя в работах Г. И. Панова из Новосибирска разработаны методы каталитического окисления, например, бензола в фенол, с использованием в качестве окислителя закиси азота. Сочетание этих двух процессов могло бы привести к улучшению их экологической приемлемости.
• Кроме энергетических затрат, важно оценивать атомную эффективность, то есть эффективность использования атомов, входящих в исходные материалы, для получения конечных продуктов. Например, побочным продуктом производства оксида пропилена является трет-бутанол. В настоящее время его используют в производстве метилтретбутилового эфира. Если допустить, что потребность в МТБЭ исчезла, встает вопрос, что делать с избыточным трет-бутанолом. Для окисления циклогексана до адипиновой кислоты используют азотную кислоту, побочно образующуюся закись азота выбрасывают в атмосферу. При этом не только теряются для производства атомы азота, но и происходит выброс парниковых газов. Хотя в работах Г. И. Панова из Новосибирска разработаны методы каталитического окисления, например, бензола в фенол, с использованием в качестве окислителя закиси азота. Сочетание этих двух процессов могло бы привести к улучшению их экологической приемлемости.
 Заключение • Зеленый подход по своей природе и сути является более выгодным, чем традиционный. Поэтому компания, которая достаточно умна, чтобы развивать новые процессы и продукты, оказывающие минимальное воздействие на природу, будет иметь лидирующие позиции на рынке. • Руководствуясь зеленым подхом необходимо рассматривать затраты энергии на альтернативные процессы, включая все стадии: подготовку сырья, проведение процесса, очистку, выделение, рецикл продуктов, очистку стоков. • Учитывая энергетическую и атомную эффективность, ликвидацию потерь, такой подход дает максимально выгодные не только экологически, но и экономически процессы .
Заключение • Зеленый подход по своей природе и сути является более выгодным, чем традиционный. Поэтому компания, которая достаточно умна, чтобы развивать новые процессы и продукты, оказывающие минимальное воздействие на природу, будет иметь лидирующие позиции на рынке. • Руководствуясь зеленым подхом необходимо рассматривать затраты энергии на альтернативные процессы, включая все стадии: подготовку сырья, проведение процесса, очистку, выделение, рецикл продуктов, очистку стоков. • Учитывая энергетическую и атомную эффективность, ликвидацию потерь, такой подход дает максимально выгодные не только экологически, но и экономически процессы .



