12_Классификация неорганических веществ.pptx
- Количество слайдов: 108
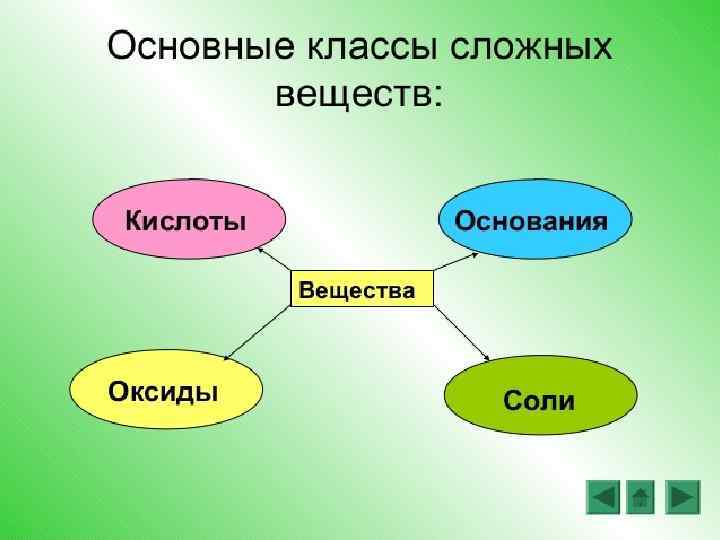
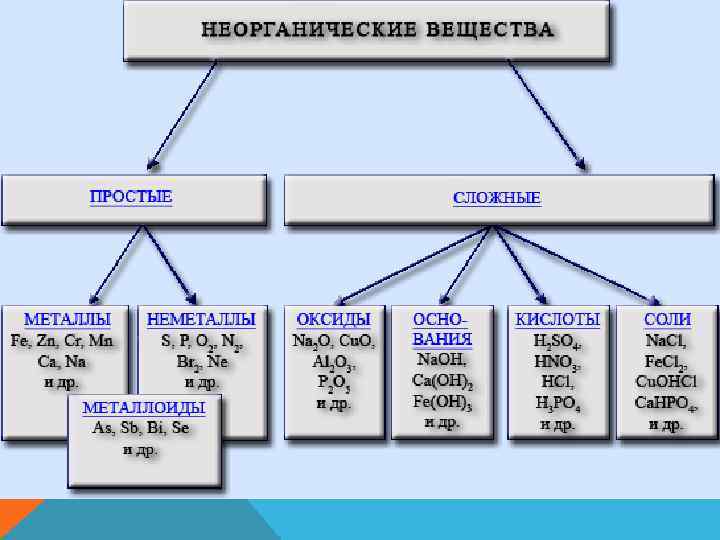
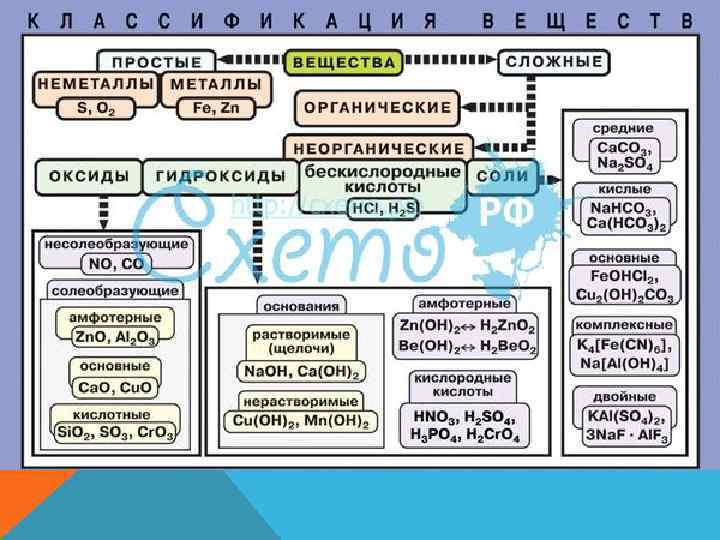
 Е ТВ С ИЯ Х Ц И КА СК И Е Ф Ч СИ НИ АС РГА 2 КЛ ЕО И Я 1 Н КЦ Л Е ЕЩ В
Е ТВ С ИЯ Х Ц И КА СК И Е Ф Ч СИ НИ АС РГА 2 КЛ ЕО И Я 1 Н КЦ Л Е ЕЩ В

 ПРИМЕРЫ ПРОСТЫХ ВЕЩЕСТВ
ПРИМЕРЫ ПРОСТЫХ ВЕЩЕСТВ



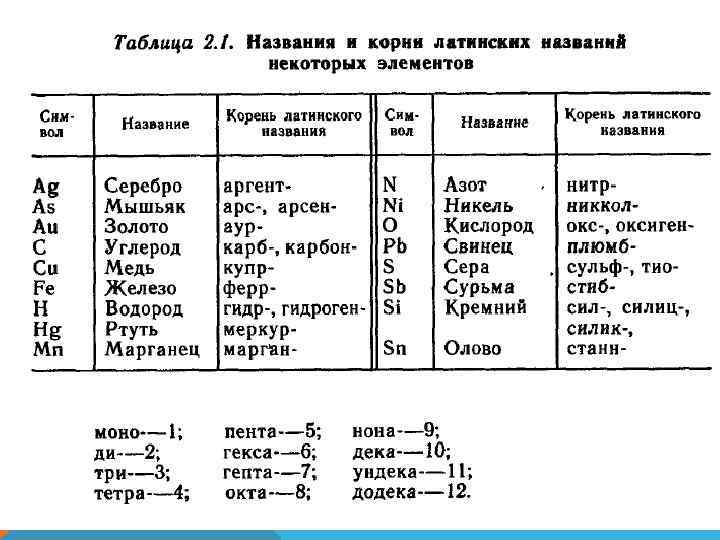
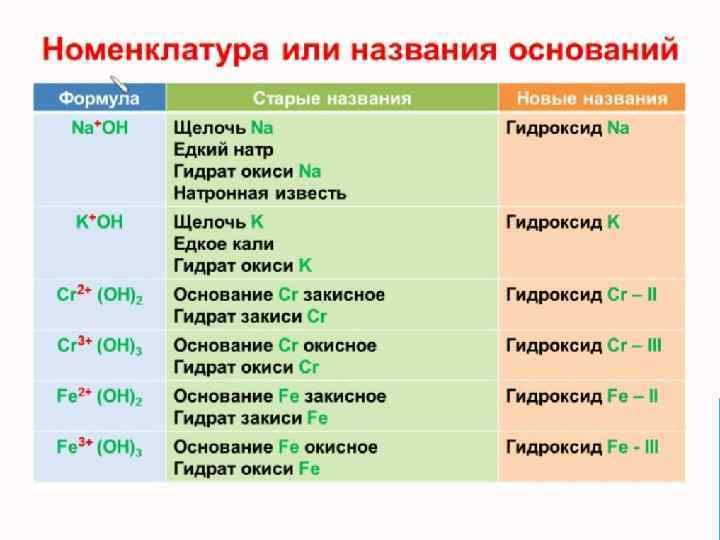
 НАЗВАНИЯ ВЕЩЕСТВ В ХИМИИ Систематическое – по правилам номенклатуры IUPAC (полностью отражает состав вещества: SO 3 – оксид серы (VI), триоксид серы Cu 2 Se – селенид меди (I), селенид димеди Традиционные – используются наряду с систематическими для ряда веществ: H 2 SO 4 – серная кислота (тетраоксосульфат (VI) водорода) KNO 3 – нитрат калия (триоксонитрат (V) калия) Специальные: вода, аммиак, аммоний, гидразин. Тривиальные: соляная кислота, сода, гашеная известь, едкий натр. Минералогические: рутил (Ti. O 2), молибденит (Mo. S 2), малахит (Cu. CO 3·Cu(OH)2).
НАЗВАНИЯ ВЕЩЕСТВ В ХИМИИ Систематическое – по правилам номенклатуры IUPAC (полностью отражает состав вещества: SO 3 – оксид серы (VI), триоксид серы Cu 2 Se – селенид меди (I), селенид димеди Традиционные – используются наряду с систематическими для ряда веществ: H 2 SO 4 – серная кислота (тетраоксосульфат (VI) водорода) KNO 3 – нитрат калия (триоксонитрат (V) калия) Специальные: вода, аммиак, аммоний, гидразин. Тривиальные: соляная кислота, сода, гашеная известь, едкий натр. Минералогические: рутил (Ti. O 2), молибденит (Mo. S 2), малахит (Cu. CO 3·Cu(OH)2).


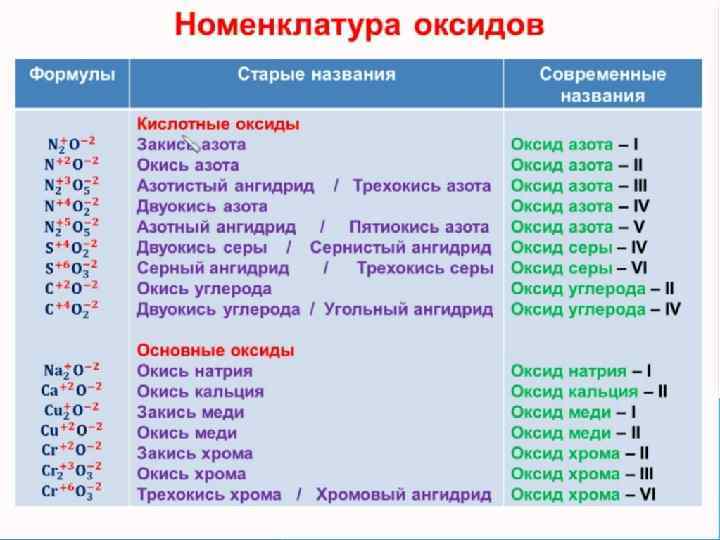



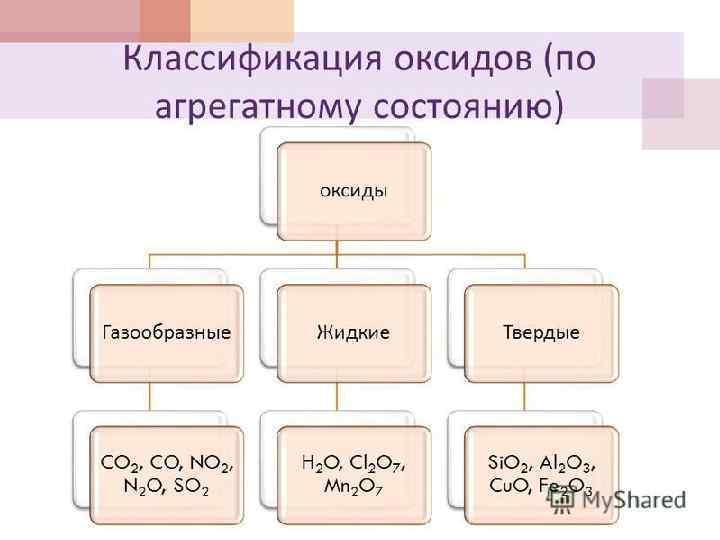
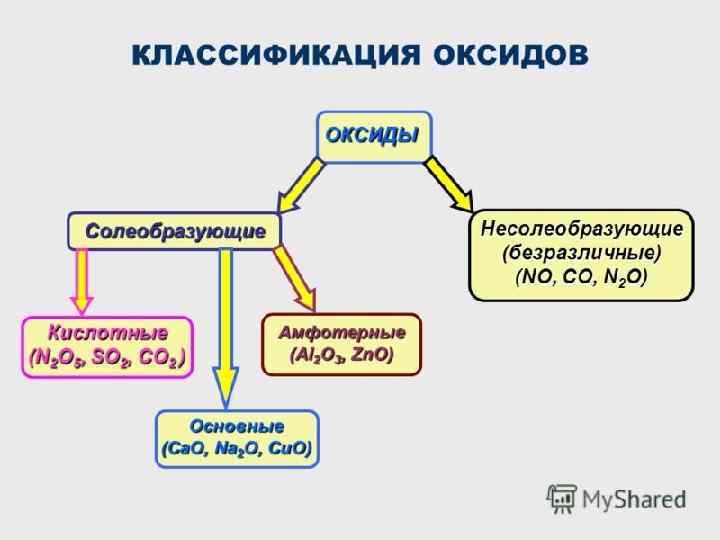
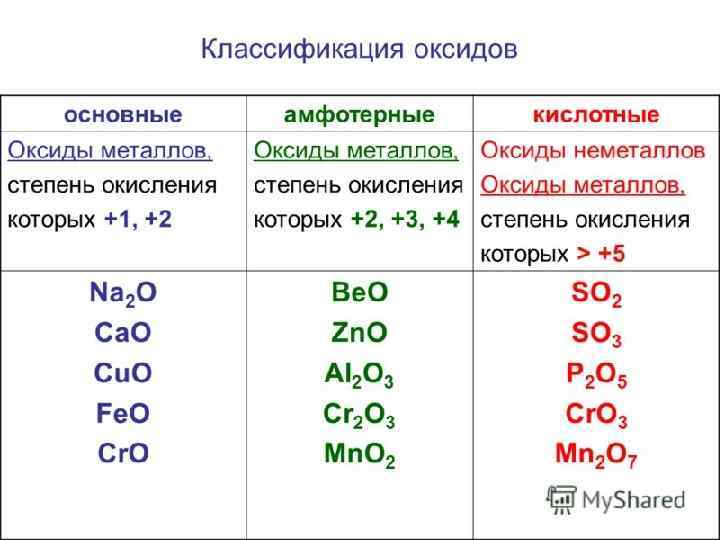
 ПРИМЕРЫ ОКСИДОВ
ПРИМЕРЫ ОКСИДОВ



 ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 5. Кислотные оксиды могут вступать в окислительно-восстановительные реакции: - взаимодействуют с восстановителями t С 02 + С = 2 СО S 02 + 2 H 2 S = 3 S + 2 H 20 - взаимодействуют с окислителями t 2 S 02 + 02 = 2 S 03 6. Малолетучие оксиды вытесняют летучие оксиды из солей: Na 2 C 03 + Si 02 = Na 2 Si 03 + C 02↑
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТНЫХ ОКСИДОВ 5. Кислотные оксиды могут вступать в окислительно-восстановительные реакции: - взаимодействуют с восстановителями t С 02 + С = 2 СО S 02 + 2 H 2 S = 3 S + 2 H 20 - взаимодействуют с окислителями t 2 S 02 + 02 = 2 S 03 6. Малолетучие оксиды вытесняют летучие оксиды из солей: Na 2 C 03 + Si 02 = Na 2 Si 03 + C 02↑

 ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 6. При нагревании основные оксиды не разлагаются, за исключением оксидов ртути и благородных металлов: t 2 Hg. O = 2 Hg + 02 t 2 Ag 20 = 4 Ag + 02 7. Некоторые основные оксиды взаимодействуют с окислителями: t 4 Fe. O + 02 = 2 Fe 203.
ХИМИЧЕСКИЕ СВОЙСТВА ОСНОВНЫХ ОКСИДОВ 6. При нагревании основные оксиды не разлагаются, за исключением оксидов ртути и благородных металлов: t 2 Hg. O = 2 Hg + 02 t 2 Ag 20 = 4 Ag + 02 7. Некоторые основные оксиды взаимодействуют с окислителями: t 4 Fe. O + 02 = 2 Fe 203.

 ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ 5. Амфотерные оксиды могут реагировать друг с другом в случае преобладания у одного из них основных свойств (Аl 203), а у другого кислотных (As 203) с образованием соли: Аl 203 + As 203 = 2 Al. As 03 6. Амфотерные оксиды способны вытеснять летучие оксиды из солей: К 2 С 03 + Zn. O = K 2 Zn 02 + C 02↑
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ 5. Амфотерные оксиды могут реагировать друг с другом в случае преобладания у одного из них основных свойств (Аl 203), а у другого кислотных (As 203) с образованием соли: Аl 203 + As 203 = 2 Al. As 03 6. Амфотерные оксиды способны вытеснять летучие оксиды из солей: К 2 С 03 + Zn. O = K 2 Zn 02 + C 02↑
 ПОЛУЧЕНИЕ ОКСИДОВ ОКИСЛЕНИЕМ 1. Во многих случаях оксиды можно получить реакцией соединения простого вещества с кислородом, протекающей, как правило, при нагревании: С + 02 = С 02 (кислотный оксид) 2 Mg + 02 = 2 Mg. O (основный оксид) 4 Li + 02 = 2 Li 20 (основный оксид) Этот метод практически неприменим для щелочных металлов, кроме Li, которые при окислении обычно дают пероксиды (Na 202, К 202). Непосредственно с кислородом не соединяются металлы - Au, Pl, Ag, неметаллы - F 2, Cl 2, Br 2, I 2.
ПОЛУЧЕНИЕ ОКСИДОВ ОКИСЛЕНИЕМ 1. Во многих случаях оксиды можно получить реакцией соединения простого вещества с кислородом, протекающей, как правило, при нагревании: С + 02 = С 02 (кислотный оксид) 2 Mg + 02 = 2 Mg. O (основный оксид) 4 Li + 02 = 2 Li 20 (основный оксид) Этот метод практически неприменим для щелочных металлов, кроме Li, которые при окислении обычно дают пероксиды (Na 202, К 202). Непосредственно с кислородом не соединяются металлы - Au, Pl, Ag, неметаллы - F 2, Cl 2, Br 2, I 2.
 ПОЛУЧЕНИЕ ОКСИДОВ ОКИСЛЕНИЕМ 2, В некоторых случаях оксиды образуются при окислении кислородом сложных веществ: СН 4 + 202 = С 02 + 2 Н 20 4 Fe. S 2 + 11 O 2 = 2 Fe 203 + 8 S 02 2 Zn. S + 302 = 2 Zn. O + 2 S 02 Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов, и сульфидов серебра и ртути, образующих при этом свободные металлы.
ПОЛУЧЕНИЕ ОКСИДОВ ОКИСЛЕНИЕМ 2, В некоторых случаях оксиды образуются при окислении кислородом сложных веществ: СН 4 + 202 = С 02 + 2 Н 20 4 Fe. S 2 + 11 O 2 = 2 Fe 203 + 8 S 02 2 Zn. S + 302 = 2 Zn. O + 2 S 02 Метод неприменим для сульфидов активных металлов, окисляющихся до сульфатов, и сульфидов серебра и ртути, образующих при этом свободные металлы.
 ПОЛУЧЕНИЕ ОКСИДОВ РАЗЛОЖЕНИЕМ 3. Многие оксиды можно получить термическим разложением: а) нерастворимых в воде оснований или амфотерных гидроксидов: t Мn(ОН)2 = Мn. О + Н 20 t Cu(OH)2 = Cu. O + Н 20 t 2 Аl(ОН)3 = Аl 203 + ЗН 20 б) некоторых кислородсодержащих кислот: t H 2 S 03 = S 02+H 20 t H 2 Si 03 = Si 02 + H 20 t 2 H 3 B 03 = B 203 + 3 H 20
ПОЛУЧЕНИЕ ОКСИДОВ РАЗЛОЖЕНИЕМ 3. Многие оксиды можно получить термическим разложением: а) нерастворимых в воде оснований или амфотерных гидроксидов: t Мn(ОН)2 = Мn. О + Н 20 t Cu(OH)2 = Cu. O + Н 20 t 2 Аl(ОН)3 = Аl 203 + ЗН 20 б) некоторых кислородсодержащих кислот: t H 2 S 03 = S 02+H 20 t H 2 Si 03 = Si 02 + H 20 t 2 H 3 B 03 = B 203 + 3 H 20
 ПОЛУЧЕНИЕ ОКСИДОВ РАЗЛОЖЕНИЕМ в) солей кислородсодержащих кислот: - сульфатов t 4 Fe. S 04 = 2 Fe 203 + 4 S 02 + 02 - карбонатов t Ca. C 03 = Са. О + C 02 t (Zn. OH)2 C 03 = 2 Zn. O + C 02 + H 20 Карбонаты щелочных металлов (за исключением карбоната лития) плавятся без разложения. - нитратов металлов, расположенных в ряду стандартных электродных потенциалов от Mg до Hg: t 2 Pb(N 03)2 = 2 Pb. O + 4 N 02 + 02 t 2 Cu(N 03)2 = 2 Cu. O + 4 N 02 + 02 При разложении солей могут меняться степени окисления элементов, например: t 4 Fe(N 03)2 = 2 Fe 203 + 8 N 02 + 02 t 2 Fe. S 04 = Fe 203 + S 02 + S 03
ПОЛУЧЕНИЕ ОКСИДОВ РАЗЛОЖЕНИЕМ в) солей кислородсодержащих кислот: - сульфатов t 4 Fe. S 04 = 2 Fe 203 + 4 S 02 + 02 - карбонатов t Ca. C 03 = Са. О + C 02 t (Zn. OH)2 C 03 = 2 Zn. O + C 02 + H 20 Карбонаты щелочных металлов (за исключением карбоната лития) плавятся без разложения. - нитратов металлов, расположенных в ряду стандартных электродных потенциалов от Mg до Hg: t 2 Pb(N 03)2 = 2 Pb. O + 4 N 02 + 02 t 2 Cu(N 03)2 = 2 Cu. O + 4 N 02 + 02 При разложении солей могут меняться степени окисления элементов, например: t 4 Fe(N 03)2 = 2 Fe 203 + 8 N 02 + 02 t 2 Fe. S 04 = Fe 203 + S 02 + S 03
 ПОЛУЧЕНИЕ ОКСИДОВ ИЗ ОКСИДОВ 4. Если химический элемент в своих соединениях проявляет различные степени окисления и образует несколько оксидов, то: а) при окислении низших оксидов можно получить оксиды, в которых соответствующий элемент находится в более высокой степени окисления: 4 Fe. O + 02 = 2 Fe 203 2 NO + 02 = 2 N 02 t 2 S 02 + 02 = 2 S 03 б) аналогично при восстановлении высших оксидов можно получить низшие оксиды: t Fe 203 + СО = 2 Fe. O + С 02
ПОЛУЧЕНИЕ ОКСИДОВ ИЗ ОКСИДОВ 4. Если химический элемент в своих соединениях проявляет различные степени окисления и образует несколько оксидов, то: а) при окислении низших оксидов можно получить оксиды, в которых соответствующий элемент находится в более высокой степени окисления: 4 Fe. O + 02 = 2 Fe 203 2 NO + 02 = 2 N 02 t 2 S 02 + 02 = 2 S 03 б) аналогично при восстановлении высших оксидов можно получить низшие оксиды: t Fe 203 + СО = 2 Fe. O + С 02
 ПОЛУЧЕНИЕ ОКСИДОВ ИЗ СОЛЕЙ 5. Если кислотному оксиду (ангидриду) соответствует неустойчивая кислота, а основному оксиду - неустойчивое основание, то можно получить оксид действием кислоты или щелочи на соответствующую соль. Na 2 C 03 + 2 НСl = 2 Na. Cl + Н 2 О + С 02↑ (кислотный оксид) 2 Ag. N 03 + 2 Na. OH = 2 Na. N 03 + H 2 O + Ag 20↓ (основный оксид) 6. При нагревании солей с кислотными оксидами менее летучий оксид вытесняет более летучий оксид из соли: t Na 2 C 03 + Si 02 = Na 2 Si 03 + C 02↑ t 2 Ca 3(P 04)2 + 6 Si 02 = 6 Ca. Si 03 + P 4 O 10
ПОЛУЧЕНИЕ ОКСИДОВ ИЗ СОЛЕЙ 5. Если кислотному оксиду (ангидриду) соответствует неустойчивая кислота, а основному оксиду - неустойчивое основание, то можно получить оксид действием кислоты или щелочи на соответствующую соль. Na 2 C 03 + 2 НСl = 2 Na. Cl + Н 2 О + С 02↑ (кислотный оксид) 2 Ag. N 03 + 2 Na. OH = 2 Na. N 03 + H 2 O + Ag 20↓ (основный оксид) 6. При нагревании солей с кислотными оксидами менее летучий оксид вытесняет более летучий оксид из соли: t Na 2 C 03 + Si 02 = Na 2 Si 03 + C 02↑ t 2 Ca 3(P 04)2 + 6 Si 02 = 6 Ca. Si 03 + P 4 O 10
 ПОЛУЧЕНИЕ ОКСИДОВ ИЗ СОЛЕЙ И КИСЛОТ 7. При действии водоотнимающих веществ на кислоты или соли: 4 HN 03 + Р 4 О 10 = (НР 03)4 + 2 N 205 2 КМn 04 + H 2 S 04 (конц. ) = K 2 S 04 + Mn 207 + Н 20 2 КСl 04 + H 2 S 04 (конц. ) = K 2 S 04 + Сl 207 + Н 20
ПОЛУЧЕНИЕ ОКСИДОВ ИЗ СОЛЕЙ И КИСЛОТ 7. При действии водоотнимающих веществ на кислоты или соли: 4 HN 03 + Р 4 О 10 = (НР 03)4 + 2 N 205 2 КМn 04 + H 2 S 04 (конц. ) = K 2 S 04 + Mn 207 + Н 20 2 КСl 04 + H 2 S 04 (конц. ) = K 2 S 04 + Сl 207 + Н 20




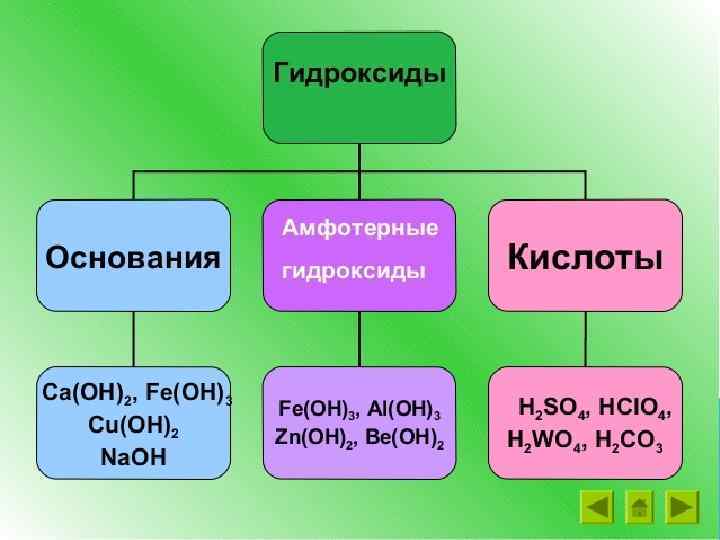

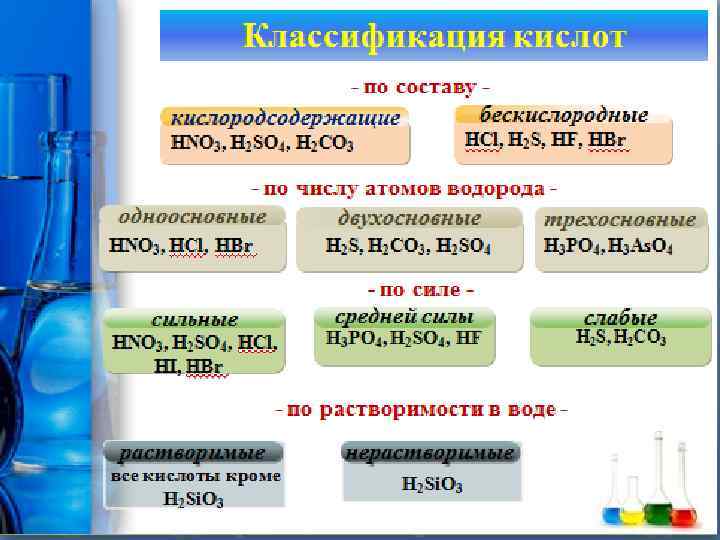



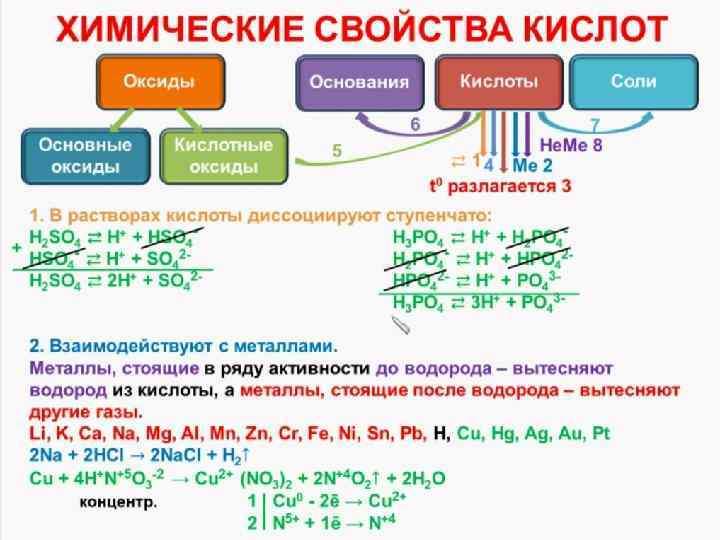
 ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ 3. Взаимодействие кислот с основаниями (нейтрализация). кислота основание соль вода H 2 SO 4 + Ca(OH)2 = Ca. SO 4 + 2 H 2 O H 3 PO 4 + Fe(OH)3 = Fe. PO 4 + 3 H 2 O 2 H 3 PO 4 + 3 Ca(OH)2 = Ca 3(PO 4)2 + 6 H 2 O Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. H 2 Si. O 3 + 2 Na. OH = Na 2 Si. O 3 + 2 H 2 O
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ 3. Взаимодействие кислот с основаниями (нейтрализация). кислота основание соль вода H 2 SO 4 + Ca(OH)2 = Ca. SO 4 + 2 H 2 O H 3 PO 4 + Fe(OH)3 = Fe. PO 4 + 3 H 2 O 2 H 3 PO 4 + 3 Ca(OH)2 = Ca 3(PO 4)2 + 6 H 2 O Для реакций нейтрализации достаточно, чтобы хотя бы одно из реагирующих веществ было растворимо в воде. H 2 Si. O 3 + 2 Na. OH = Na 2 Si. O 3 + 2 H 2 O
 ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ 4. Кислоты взаимодействуют с основными и амфотерными оксидами: H 2 S 04 + Mg. O = Mg. S 04 + Н 20 6 НСl + Аl 203 = 2 Аl. Сl 3 + ЗН 20 2 Н 3 Р 04 + Fe 203 = 2 Fe. P 04 + 3 H 20 5. Более сильные кислоты вытесняют в процессе взаимодействия с солями более слабые кислоты : 3 H 2 S 04 + 2 Na 3 P 04 = 3 Na 2 S 04 + 2 Н 3 Р 04 Реакция также возможна, если в результате образуется осадок или выделяется газ: Са. С 03 + 2 HN 03 = Ca(N 03)2 + С 02↑ + Н 20 Fe. S + 2 НСl = Fe. Cl 2 + H 2 S↑ K 2 Si 03 + 2 HCl = 2 KCl + H 2 Si 03↓ Летучие кислоты могут быть вытеснены из солей менее летучими кислотами: Na. Cl (тв) + H 2 S 04 (конц. ) = Na. HS 04 + HCl↑
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ 4. Кислоты взаимодействуют с основными и амфотерными оксидами: H 2 S 04 + Mg. O = Mg. S 04 + Н 20 6 НСl + Аl 203 = 2 Аl. Сl 3 + ЗН 20 2 Н 3 Р 04 + Fe 203 = 2 Fe. P 04 + 3 H 20 5. Более сильные кислоты вытесняют в процессе взаимодействия с солями более слабые кислоты : 3 H 2 S 04 + 2 Na 3 P 04 = 3 Na 2 S 04 + 2 Н 3 Р 04 Реакция также возможна, если в результате образуется осадок или выделяется газ: Са. С 03 + 2 HN 03 = Ca(N 03)2 + С 02↑ + Н 20 Fe. S + 2 НСl = Fe. Cl 2 + H 2 S↑ K 2 Si 03 + 2 HCl = 2 KCl + H 2 Si 03↓ Летучие кислоты могут быть вытеснены из солей менее летучими кислотами: Na. Cl (тв) + H 2 S 04 (конц. ) = Na. HS 04 + HCl↑
 ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ 5. Кислоты могут реагировать с основными, а иногда и кислыми солями: Co. OHCl + HCl = Со. Сl 2 + Н 20 (Сu. ОН)2 С 03 + 4 НВг = 2 Cu. Br 2 + C 02↑ + ЗН 20 Mg(HC 03)2 + 2 НСl = Mg. Cl 2 + 2 C 02↑ + 2 Н 20 2 KHS 03 + H 2 S 04 = K 2 S 04 + 2 S 02↑ + 2 H 20
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ 5. Кислоты могут реагировать с основными, а иногда и кислыми солями: Co. OHCl + HCl = Со. Сl 2 + Н 20 (Сu. ОН)2 С 03 + 4 НВг = 2 Cu. Br 2 + C 02↑ + ЗН 20 Mg(HC 03)2 + 2 НСl = Mg. Cl 2 + 2 C 02↑ + 2 Н 20 2 KHS 03 + H 2 S 04 = K 2 S 04 + 2 S 02↑ + 2 H 20
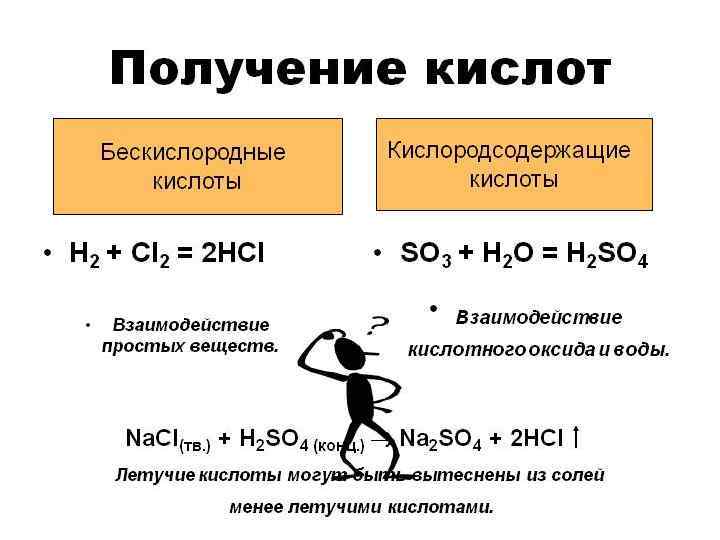


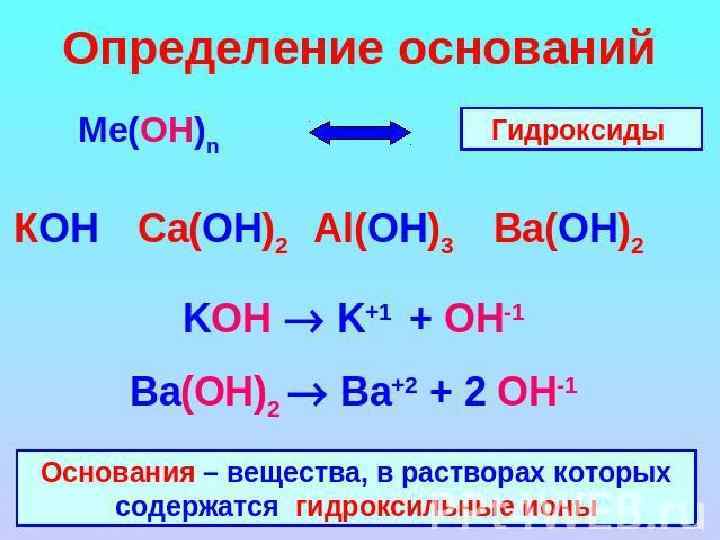
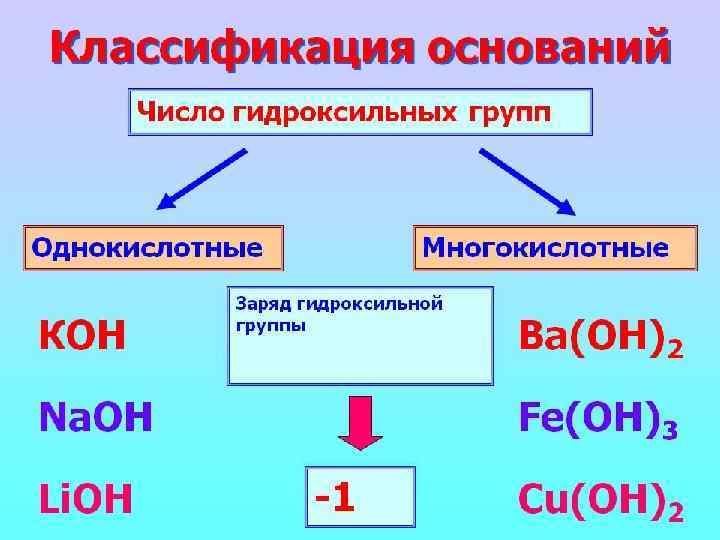



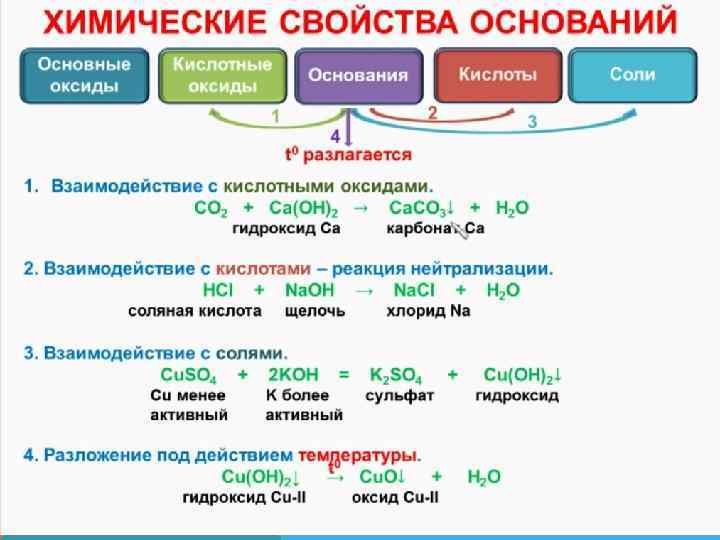
 ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ 5. Взаимодействие с амфотерными оксидами. При сплавлении щелочей с амфотерными оксидами образуются средние соли: t Аl 203 + 2 Na. OH (тв. ) = 2 Na. Al 02 + Н 20 t Zn. O + 2 КОН (тв. ) = K 2 Zn 02 + Н 20 а в растворах - комплексные соли: Аl 203 + 2 Na. OH + ЗН 20 = 2 Na[Al(OH)4] Zn. O + 2 Na. OH + Н 20 = Na 2[Zn(OH)4]
ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ 5. Взаимодействие с амфотерными оксидами. При сплавлении щелочей с амфотерными оксидами образуются средние соли: t Аl 203 + 2 Na. OH (тв. ) = 2 Na. Al 02 + Н 20 t Zn. O + 2 КОН (тв. ) = K 2 Zn 02 + Н 20 а в растворах - комплексные соли: Аl 203 + 2 Na. OH + ЗН 20 = 2 Na[Al(OH)4] Zn. O + 2 Na. OH + Н 20 = Na 2[Zn(OH)4]
 ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ 6. Щелочи взаимодействуют с амфотерными металлами: 2 Na. OH + 2 Н 20 + Zn = Na 2[Zn(OH)4] + 2 H 2↑ и с некоторыми неметаллами: 2 Na. OH + Сl 2 = Na. Cl + Na. OCl + H 20 t 6 KOH +3 Cl 2 = 5 KCl+ KCl 03 + 3 H 20 6 KOH + 3 S = K 2 S 03 + 2 K 2 S + 3 H 2 O 3 KOH + 4 Р(белый) + 3 H 20 = PH 3↑+ 3 KH 2 P 02
ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ 6. Щелочи взаимодействуют с амфотерными металлами: 2 Na. OH + 2 Н 20 + Zn = Na 2[Zn(OH)4] + 2 H 2↑ и с некоторыми неметаллами: 2 Na. OH + Сl 2 = Na. Cl + Na. OCl + H 20 t 6 KOH +3 Cl 2 = 5 KCl+ KCl 03 + 3 H 20 6 KOH + 3 S = K 2 S 03 + 2 K 2 S + 3 H 2 O 3 KOH + 4 Р(белый) + 3 H 20 = PH 3↑+ 3 KH 2 P 02
 ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ 7. Щелочи взаимодействуют с кислыми солями с образованием средних солей: 2 КОН + 2 Na. HS 03 = Na 2 S 03 + K 2 S 03 + 2 Н 20 Ва(ОН)2 + Са(НС 03)2 =Ва. С 03↓ + Са. С 03↓ + 2 Н 20 2 Na. HS 04 + Са(ОН)2 = Ca. S 04 + Na 2 S 04 + 2 H 2Ö
ХИМИЧЕСКИЕ СВОЙСТВА ЩЕЛОЧЕЙ 7. Щелочи взаимодействуют с кислыми солями с образованием средних солей: 2 КОН + 2 Na. HS 03 = Na 2 S 03 + K 2 S 03 + 2 Н 20 Ва(ОН)2 + Са(НС 03)2 =Ва. С 03↓ + Са. С 03↓ + 2 Н 20 2 Na. HS 04 + Са(ОН)2 = Ca. S 04 + Na 2 S 04 + 2 H 2Ö
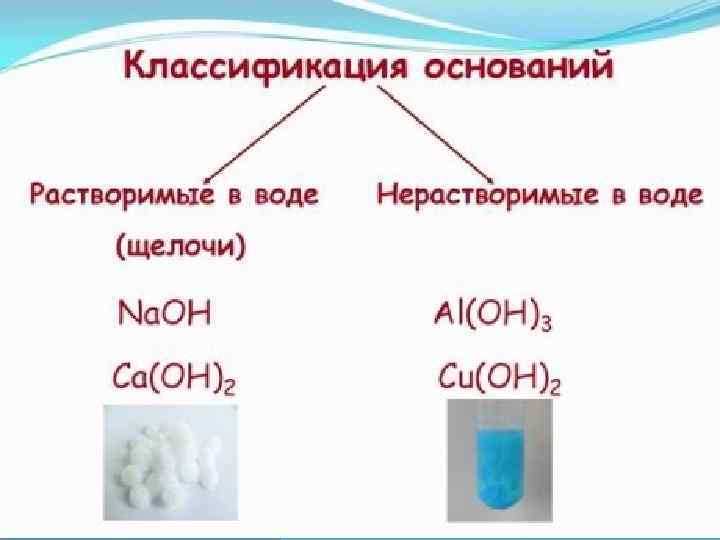
 ХИМИЧЕСКИЕ СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ Некоторые нерастворимые основания взаимодействуют с различными веществами с образованием комплексных соединений: а) катионного типа Cu(OH)2 + 4 NH 4 OH = [Cu(NH 3)4](OH)2 + 4 Н 20 б) анионного типа Cu(OH)2 + 4 HCN = H 2[Cu(CN)4] + 2 Н 20
ХИМИЧЕСКИЕ СВОЙСТВА НЕРАСТВОРИМЫХ ОСНОВАНИЙ Некоторые нерастворимые основания взаимодействуют с различными веществами с образованием комплексных соединений: а) катионного типа Cu(OH)2 + 4 NH 4 OH = [Cu(NH 3)4](OH)2 + 4 Н 20 б) анионного типа Cu(OH)2 + 4 HCN = H 2[Cu(CN)4] + 2 Н 20

 ПОЛУЧЕНИЕ ОСНОВАНИЙ РАСТВОРИМЫХ 3. Щелочи можно получить взаимодействием пероксидов щелочных и щелочноземельных металлов с водой: Na 202 + 2 Н 20 = 2 Na. OH + Н 202 4. Щелочи можно получить электролизом водных растворов солей щелочных металлов (чаще всего - хлоридов): 2 Na. Cl + 2 Н 20 = 2 Na. OH + Н 2 + Сl 2 НЕРАСТВОРИМЫХ 2. Нерастворимые основания можно получить гидролизом солей, у которых он протекает до конца: Al 2 S 3 + 6 Н 20 = 2 Аl(ОН)3↓ + 3 H 2 S↑ или смешиванием водных растворов солей, взаимно усиливающих гидролиз: 2 Аl. Сl 3 + 3 Na 2 C 03 + ЗН 20 = 2 Аl(ОН)3↓ + 6 Na. Cl + 3 C 02↑
ПОЛУЧЕНИЕ ОСНОВАНИЙ РАСТВОРИМЫХ 3. Щелочи можно получить взаимодействием пероксидов щелочных и щелочноземельных металлов с водой: Na 202 + 2 Н 20 = 2 Na. OH + Н 202 4. Щелочи можно получить электролизом водных растворов солей щелочных металлов (чаще всего - хлоридов): 2 Na. Cl + 2 Н 20 = 2 Na. OH + Н 2 + Сl 2 НЕРАСТВОРИМЫХ 2. Нерастворимые основания можно получить гидролизом солей, у которых он протекает до конца: Al 2 S 3 + 6 Н 20 = 2 Аl(ОН)3↓ + 3 H 2 S↑ или смешиванием водных растворов солей, взаимно усиливающих гидролиз: 2 Аl. Сl 3 + 3 Na 2 C 03 + ЗН 20 = 2 Аl(ОН)3↓ + 6 Na. Cl + 3 C 02↑
 ПОЛУЧЕНИЕ ОСНОВАНИЙ 5. И растворимые, и нерастворимые основания можно получить разложением некоторых бинарных соединений водой: Li 3 N + ЗН 20 = 3 Li. OH + NH 3↑ Na. H + Н 20 = Na. OH + H 2↑ Ca 3 P 2 + 6 H 20 = 3 Ca(OH)2 + 2 PH 3↑ Mg 2 Si + 4 H 20 = 2 Mg(OH)2↓ + Si. H 4↑
ПОЛУЧЕНИЕ ОСНОВАНИЙ 5. И растворимые, и нерастворимые основания можно получить разложением некоторых бинарных соединений водой: Li 3 N + ЗН 20 = 3 Li. OH + NH 3↑ Na. H + Н 20 = Na. OH + H 2↑ Ca 3 P 2 + 6 H 20 = 3 Ca(OH)2 + 2 PH 3↑ Mg 2 Si + 4 H 20 = 2 Mg(OH)2↓ + Si. H 4↑





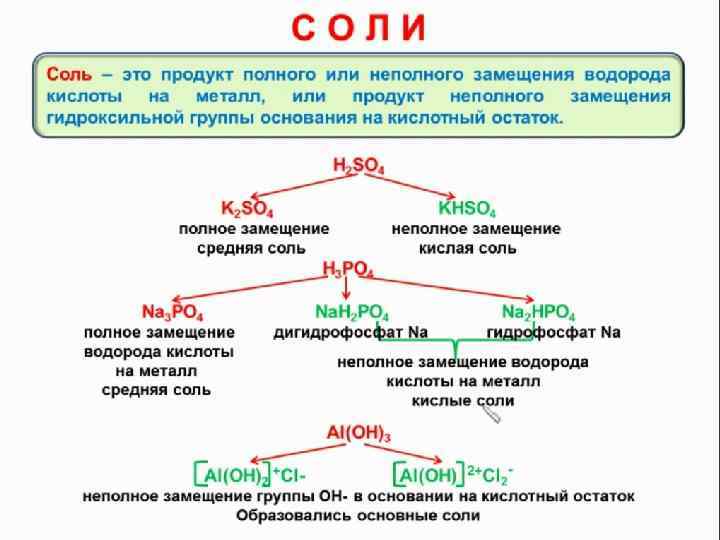



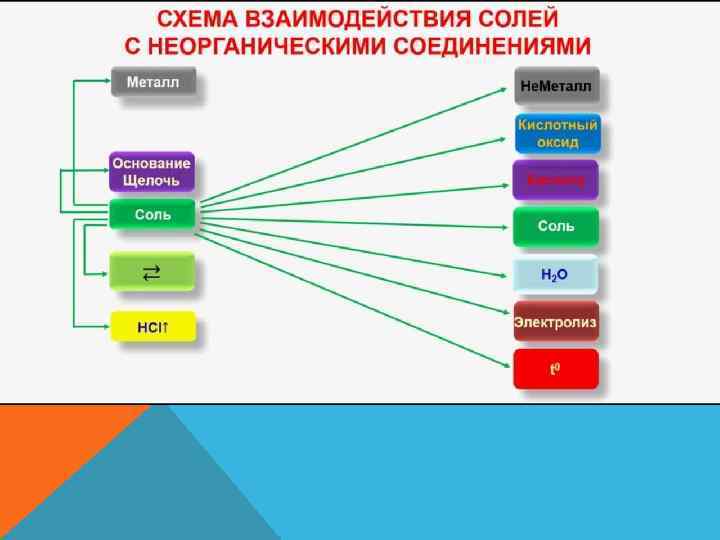
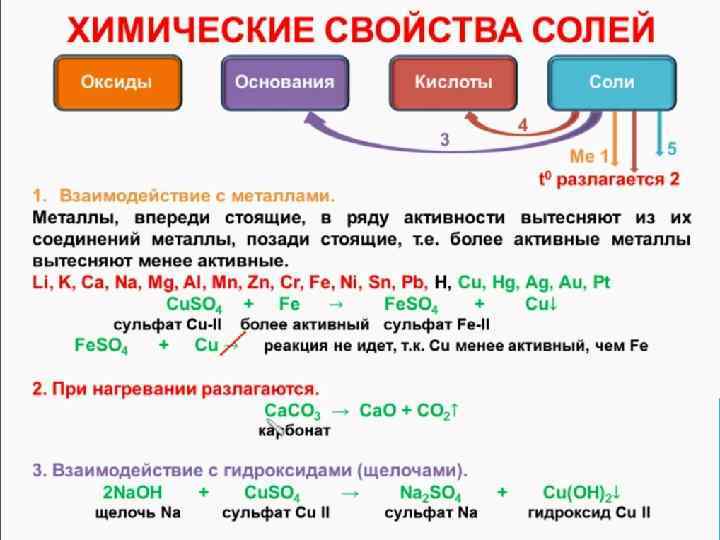
 ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ 4. Почти все соли являются ионными соединениями, поэтому в расплаве и в водном растворе диссоциируют на ионы. При пропускании тока через растворы или расплавы солей идет процесс электролиза. 5. Взаимодействие солей с кислотами возможно в случае образования: а) более слабой кислоты; б) труднорастворимой соли; в) газа. При этом в зависимости от соотношения компонентов возможно образование, как кислоты, так и кислых солей. Например: a) Na 2 S + 2 НСl = 2 Na. Cl + H 2 S b) Na 3 P 04 + 3 HCl = H 3 P 04 + 3 Na. Cl c) Na 3 P 04 + 2 HCl = Na. H 2 P 04 + 2 Na. Cl d) Cu. S 04 + H 2 S = Cu. S↓ + H 2 S 04 е) Ag. N 03 + HCl = Ag. Cl↓ + HN 03 f) Na 2 S(тв. ) + 2 НСl(конц. ) = H 2 S↑ + 2 Na. Cl
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ 4. Почти все соли являются ионными соединениями, поэтому в расплаве и в водном растворе диссоциируют на ионы. При пропускании тока через растворы или расплавы солей идет процесс электролиза. 5. Взаимодействие солей с кислотами возможно в случае образования: а) более слабой кислоты; б) труднорастворимой соли; в) газа. При этом в зависимости от соотношения компонентов возможно образование, как кислоты, так и кислых солей. Например: a) Na 2 S + 2 НСl = 2 Na. Cl + H 2 S b) Na 3 P 04 + 3 HCl = H 3 P 04 + 3 Na. Cl c) Na 3 P 04 + 2 HCl = Na. H 2 P 04 + 2 Na. Cl d) Cu. S 04 + H 2 S = Cu. S↓ + H 2 S 04 е) Ag. N 03 + HCl = Ag. Cl↓ + HN 03 f) Na 2 S(тв. ) + 2 НСl(конц. ) = H 2 S↑ + 2 Na. Cl
 ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ 6. Две растворимые соли вступают в реакцию обмена, если одна из образующихся солей выпадает в осадок: Na. Cl + Ag. N 03 = Ag. Cl↓+ Na. N 03 Cu. Cl 2 + Na 2 C 03 = Ca. C 03↓+ 2 Na. Cl Cu. S 04 + Na 2 S = Cu. S↓ + Na 2 S 04 7. Растворимые соли бескислородных кислот взаимодействуют с некоторыми металлами. Более активный металл вытесняет менее активный из его соли: Na 2 S + Br 2 = 2 Na. Br+ S↓ 8. Соли взаимодействуют с водой - реакция гидролиза: 2 Cu. SO 4 + 2 Н 20 = (Cu. OH)2 S 04 + H 2 S 04
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ 6. Две растворимые соли вступают в реакцию обмена, если одна из образующихся солей выпадает в осадок: Na. Cl + Ag. N 03 = Ag. Cl↓+ Na. N 03 Cu. Cl 2 + Na 2 C 03 = Ca. C 03↓+ 2 Na. Cl Cu. S 04 + Na 2 S = Cu. S↓ + Na 2 S 04 7. Растворимые соли бескислородных кислот взаимодействуют с некоторыми металлами. Более активный металл вытесняет менее активный из его соли: Na 2 S + Br 2 = 2 Na. Br+ S↓ 8. Соли взаимодействуют с водой - реакция гидролиза: 2 Cu. SO 4 + 2 Н 20 = (Cu. OH)2 S 04 + H 2 S 04
 ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ 9. Некоторые соли при нагревании реагируют с нелетучими кислотными или амфотерными оксидами: Nа 2 С 03(тв) + Fe 203 = 2 Na. Fe 02 + C 02↑ Mg. S 03(тв) + Si 02 = Mg. Si 03 + S 02↑ 10. Соли могут вступать в окислительно-восстановительные реакции как по катиону: 2 Fe. Cl 2 + Сl 2 = 2 Fe. Cl 3 так и по аниону: 2 KN 03(тв) + С = 2 KN 02 + C 02↑
ХИМИЧЕСКИЕ СВОЙСТВА СРЕДНИХ СОЛЕЙ 9. Некоторые соли при нагревании реагируют с нелетучими кислотными или амфотерными оксидами: Nа 2 С 03(тв) + Fe 203 = 2 Na. Fe 02 + C 02↑ Mg. S 03(тв) + Si 02 = Mg. Si 03 + S 02↑ 10. Соли могут вступать в окислительно-восстановительные реакции как по катиону: 2 Fe. Cl 2 + Сl 2 = 2 Fe. Cl 3 так и по аниону: 2 KN 03(тв) + С = 2 KN 02 + C 02↑
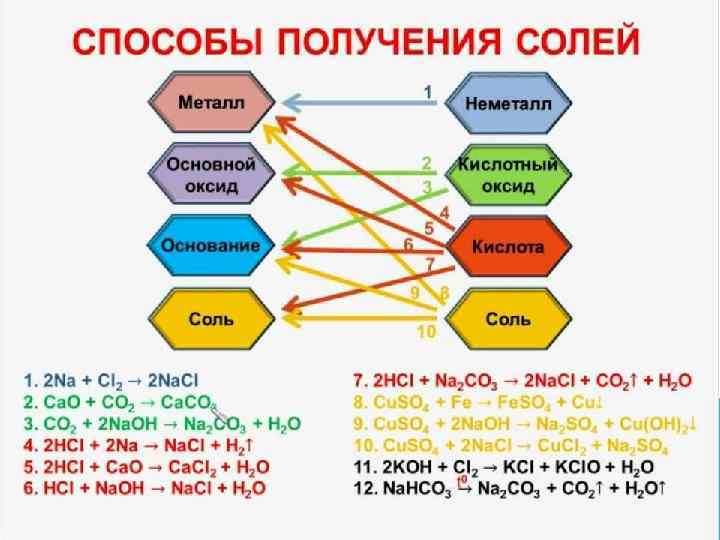
 ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ 13. Взаимодействие амфотерных металлов со щелочами: 2 Al + 2 Na. OH + 6 H 20 = 2 Na[Al(OH)4] + 3 H 2 Zn + 2 Na. OH = Na 2 Zn 02 + H 2 14. Взаимодействие кислоты с амфотерными оксидами: 2 НСl + Zn. O = Zn. Cl 2 + Н 20 15. Взаимодействие щелочей с амфотерными оксидами: 2 Na. OH (тв) + Zn. O = Na 2 Zn 02 + Н 20 16. Взаимодействие активного неметалла с солями менее активных неметаллов: Сl 2 + 2 Na. Br = 2 Na. Cl + Br 2
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ 13. Взаимодействие амфотерных металлов со щелочами: 2 Al + 2 Na. OH + 6 H 20 = 2 Na[Al(OH)4] + 3 H 2 Zn + 2 Na. OH = Na 2 Zn 02 + H 2 14. Взаимодействие кислоты с амфотерными оксидами: 2 НСl + Zn. O = Zn. Cl 2 + Н 20 15. Взаимодействие щелочей с амфотерными оксидами: 2 Na. OH (тв) + Zn. O = Na 2 Zn 02 + Н 20 16. Взаимодействие активного неметалла с солями менее активных неметаллов: Сl 2 + 2 Na. Br = 2 Na. Cl + Br 2
 ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ 17. Взаимодействие пероксидов и надпероксидов с кислотными оксидами: 2 Na 202 + 2 С 02 = 2 Na 2 C 03 + 02↑ 4 К 02 + 2 С 02 = 2 К 2 С 03 + 302↑ 18. Окисление или восстановление кислотообразующего элемента, входящего в состав аниона соли: Na 2 S 03 + Н 202 = Na 2 S 04 + Н 20 Na 2 S 04 + 4 С = Na 2 S + 4 СО 19. Сплавление соли с кислотным оксидом (кислотный оксид должен быть менее летуч, чем образующийся после реакции): Ca. S 03 + Si 02 = Ca. Si 03 + S 02↑
ПОЛУЧЕНИЕ СРЕДНИХ СОЛЕЙ 17. Взаимодействие пероксидов и надпероксидов с кислотными оксидами: 2 Na 202 + 2 С 02 = 2 Na 2 C 03 + 02↑ 4 К 02 + 2 С 02 = 2 К 2 С 03 + 302↑ 18. Окисление или восстановление кислотообразующего элемента, входящего в состав аниона соли: Na 2 S 03 + Н 202 = Na 2 S 04 + Н 20 Na 2 S 04 + 4 С = Na 2 S + 4 СО 19. Сплавление соли с кислотным оксидом (кислотный оксид должен быть менее летуч, чем образующийся после реакции): Ca. S 03 + Si 02 = Ca. Si 03 + S 02↑



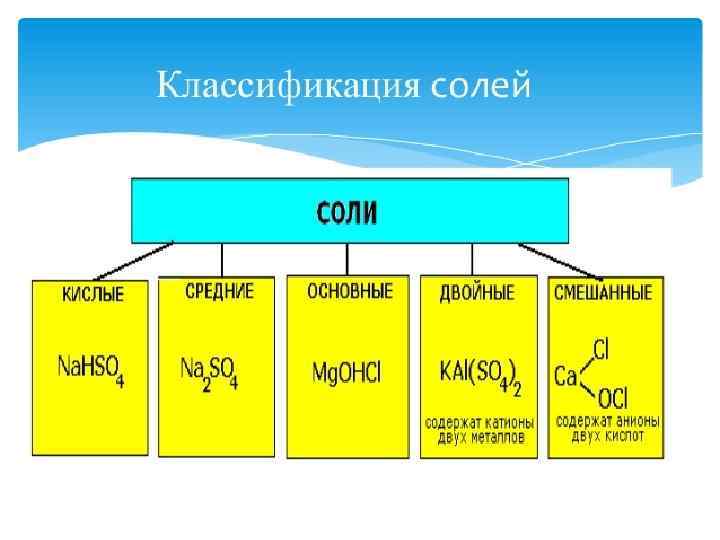
 СВОЙСТВА КИСЛЫХ СОЛЕЙ 1. Кислые соли могут взаимодействовать с растворимыми основаниями, превращаясь в средние или кислые соли с меньшим числом атомов водорода: Na. HC 03 + Na. OH = Na 2 C 03 + Н 20 Na. H 2 P 04 + Na. OH = Na 2 HP 04 + H 20 Na 2 HP 04 + Na. OH = Na 3 P 04 + H 20 2. Кислые соли вступают в реакции обмена со средними солями: Са(НС 03)2 + Na 2 C 03 = Са. С 03↓ + 2 Na. HC 03 Na. HS 04 + Na. Cl = Na 2 S 04 + HCl↑
СВОЙСТВА КИСЛЫХ СОЛЕЙ 1. Кислые соли могут взаимодействовать с растворимыми основаниями, превращаясь в средние или кислые соли с меньшим числом атомов водорода: Na. HC 03 + Na. OH = Na 2 C 03 + Н 20 Na. H 2 P 04 + Na. OH = Na 2 HP 04 + H 20 Na 2 HP 04 + Na. OH = Na 3 P 04 + H 20 2. Кислые соли вступают в реакции обмена со средними солями: Са(НС 03)2 + Na 2 C 03 = Са. С 03↓ + 2 Na. HC 03 Na. HS 04 + Na. Cl = Na 2 S 04 + HCl↑
 СВОЙСТВА КИСЛЫХ СОЛЕЙ 3. Кислые соли обычно термически неустойчивы. При нагревании отщепляют воду и превращаются в средние соли той же кислоты или в средние соли кислоты с большим содержанием ангидрида: Са(НС 03)2 = Са. СОз + С 02 + Н 20 2 Na 2 HP 04 = Na 4 P 207 + Н 20 4. Кислые соли взаимодействуют с металлами: а) расположенными в ряду стандартных электродных потенциалов до водорода, но правее по отношению к металлу соли: Mg(HS 04)2 + Fe = Mg. S 04 + Fe. S 04 + H 2 б) расположенными в ряду стандартных электродных потенциалов до водорода и левее по отношению к металлу соли. В этом случае реакция протекает как по катиону металла, так и по катиону водорода: Fe(HS 04)2 + 2 Mg = 2 Mg. S 04 + Fe + H 2
СВОЙСТВА КИСЛЫХ СОЛЕЙ 3. Кислые соли обычно термически неустойчивы. При нагревании отщепляют воду и превращаются в средние соли той же кислоты или в средние соли кислоты с большим содержанием ангидрида: Са(НС 03)2 = Са. СОз + С 02 + Н 20 2 Na 2 HP 04 = Na 4 P 207 + Н 20 4. Кислые соли взаимодействуют с металлами: а) расположенными в ряду стандартных электродных потенциалов до водорода, но правее по отношению к металлу соли: Mg(HS 04)2 + Fe = Mg. S 04 + Fe. S 04 + H 2 б) расположенными в ряду стандартных электродных потенциалов до водорода и левее по отношению к металлу соли. В этом случае реакция протекает как по катиону металла, так и по катиону водорода: Fe(HS 04)2 + 2 Mg = 2 Mg. S 04 + Fe + H 2


 СВОЙСТВА ОСНОВНЫХ СОЛЕЙ 1. Основные соли могут реагировать с кислотами, превращаясь в средние соли или основные соли с меньшим числом гидроксогрупп: Cu. OHCl + HCl = Cu. Cl 2 + Н 20 Al(OH)2 N 03 + HN 03 = Al 0 H(N 03)2 + H 20 Al 0 H(N 03)2 + HNO 3 = Al(N 03)3 + H 20 2 Zn. OHNO 3 + H 2 S 04 = Zn(N 03)2 + Zn. S 04 + 2 H 20 2. Основные соли реагируют со щелочами: Co. OHNO 3 + Na. OH = Co(OH)2↓+ Na. N 03 3. При нагревании некоторые основные соли разлагаются: (Zn. OH)2 C 03 = 2 Zn. O + С 02↑ + Н 20
СВОЙСТВА ОСНОВНЫХ СОЛЕЙ 1. Основные соли могут реагировать с кислотами, превращаясь в средние соли или основные соли с меньшим числом гидроксогрупп: Cu. OHCl + HCl = Cu. Cl 2 + Н 20 Al(OH)2 N 03 + HN 03 = Al 0 H(N 03)2 + H 20 Al 0 H(N 03)2 + HNO 3 = Al(N 03)3 + H 20 2 Zn. OHNO 3 + H 2 S 04 = Zn(N 03)2 + Zn. S 04 + 2 H 20 2. Основные соли реагируют со щелочами: Co. OHNO 3 + Na. OH = Co(OH)2↓+ Na. N 03 3. При нагревании некоторые основные соли разлагаются: (Zn. OH)2 C 03 = 2 Zn. O + С 02↑ + Н 20
 ОКСОСОЛИ Основные соли могут отщеплять воду, образуя оксосоли: 2 Zn. OHCl = Zn 2 OCl 2 + Н 20 оксохлорид цинка Bi(OH)2 Cl = Bi. OCl + Н 20 оксохлорид висмута (хлорид висмутила) Образующиеся оксосоли не содержат в своем составе гидроксильных групп, но сохраняют свойства основных солей и могут взаимодействовать с кислотами с образованием средних солей: Zn 2 OCl 2 + 2 НСl = 2 Zn. Cl 2 + Н 20 Bi. OCl + 2 НСl = Вi. Сl+ Н 20
ОКСОСОЛИ Основные соли могут отщеплять воду, образуя оксосоли: 2 Zn. OHCl = Zn 2 OCl 2 + Н 20 оксохлорид цинка Bi(OH)2 Cl = Bi. OCl + Н 20 оксохлорид висмута (хлорид висмутила) Образующиеся оксосоли не содержат в своем составе гидроксильных групп, но сохраняют свойства основных солей и могут взаимодействовать с кислотами с образованием средних солей: Zn 2 OCl 2 + 2 НСl = 2 Zn. Cl 2 + Н 20 Bi. OCl + 2 НСl = Вi. Сl+ Н 20




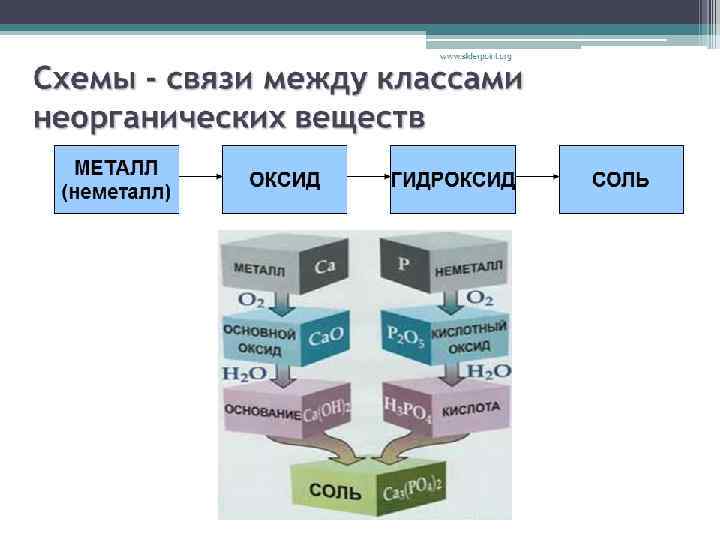
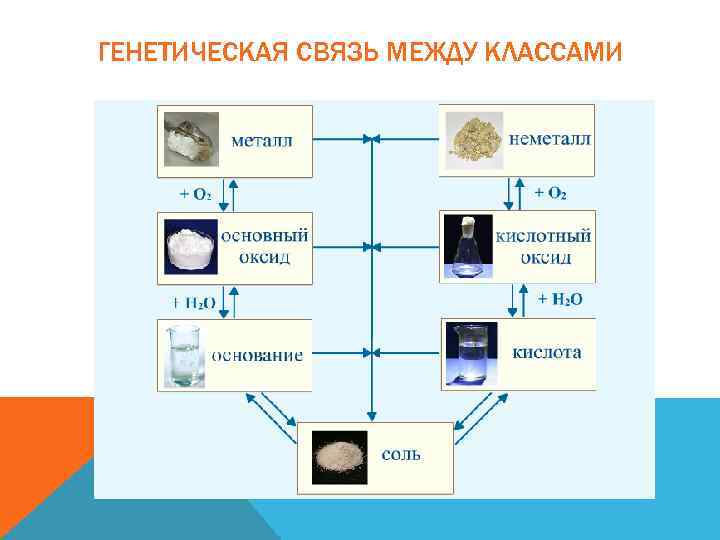 ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ
ГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ КЛАССАМИ

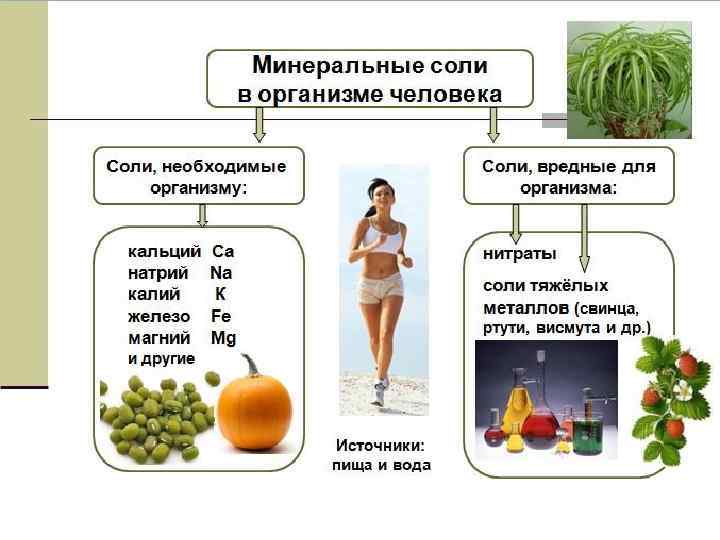
 НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА ЖИВОЙ ПРИРОДЫ
НЕОРГАНИЧЕСКИЕ ВЕЩЕСТВА ЖИВОЙ ПРИРОДЫ
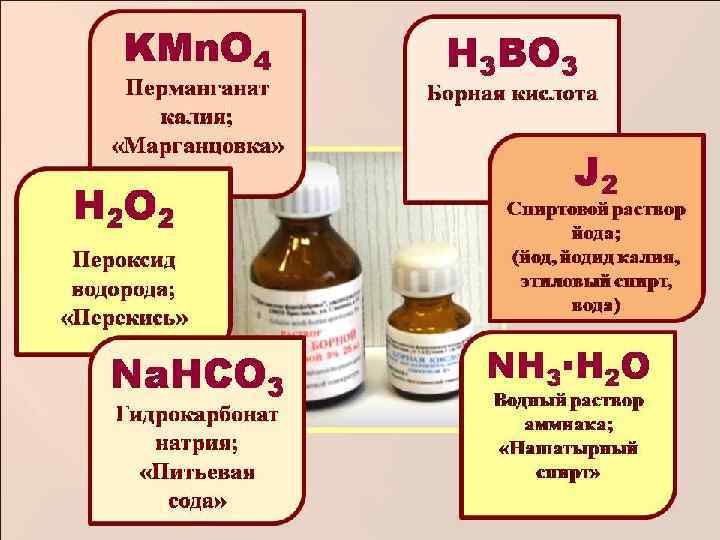
 А! К ТИ К А ЕП Т РЬ Е РА П
А! К ТИ К А ЕП Т РЬ Е РА П


