Химические свойства алканов.pptx
- Количество слайдов: 14
 е ски че ми Хи лканов а а ств ой св Абдурагимова Карина 10 класс
е ски че ми Хи лканов а а ств ой св Абдурагимова Карина 10 класс
 Алка ны линейн — ацикличе строен ого или разв ские углевод связи иия, содержащ етвлённого ороды ряд с о образующи ие только пр бщей ф е гомол ормуло огичесостые к й Cn. H 2 n+2. ий А Алканы углево являются н максимдородами и с асыщенным и атомов ально возмо одержат углеро водорода. К жное число находида в молекул аждый атом гибрид тся в состоянах алканов гибрид изации — вс ии sp 3 иденти ные орбитале 4 4 связи чны по форм и атома С направ е лены в и энергии, верши ны.
Алка ны линейн — ацикличе строен ого или разв ские углевод связи иия, содержащ етвлённого ороды ряд с о образующи ие только пр бщей ф е гомол ормуло огичесостые к й Cn. H 2 n+2. ий А Алканы углево являются н максимдородами и с асыщенным и атомов ально возмо одержат углеро водорода. К жное число находида в молекул аждый атом гибрид тся в состоянах алканов гибрид изации — вс ии sp 3 иденти ные орбитале 4 4 связи чны по форм и атома С направ е лены в и энергии, верши ны.
 Горение При под жигании на воздухе алканы горят, превращ аясь в дв у углерод а и воду окись и выдел большое яя количес тво тепл а. CH 4 + 2 O 2––пла мя> CO 2 + 2 H C 5 H 12 + 2 O 8 O 2 ––пл амя> 5 CO 2 + 6 H 2 O
Горение При под жигании на воздухе алканы горят, превращ аясь в дв у углерод а и воду окись и выдел большое яя количес тво тепл а. CH 4 + 2 O 2––пла мя> CO 2 + 2 H C 5 H 12 + 2 O 8 O 2 ––пл амя> 5 CO 2 + 6 H 2 O
 Гал о г ен и ро ва н ие ал ка нов СН 4 + Cl 2 CH 3 Cl + H Cl Хло рмет Х ан, и лори ли стый ме ти л СН 3 сж иж Cl – га з, аетс я легко пос л едую и при погл ощае щем ис п коли а чест т больш рении Прим ое во те холо еняется плоты. в диль ных у стан овка х
Гал о г ен и ро ва н ие ал ка нов СН 4 + Cl 2 CH 3 Cl + H Cl Хло рмет Х ан, и лори ли стый ме ти л СН 3 сж иж Cl – га з, аетс я легко пос л едую и при погл ощае щем ис п коли а чест т больш рении Прим ое во те холо еняется плоты. в диль ных у стан овка х
 СН 3 C l + Cl 2 CH 2 Cl 2 + H Cl Дихл орме хлор тан, или исты й ме СН 2 C тиле l 2 – п н р раст вори именяет тель скле , для ся как иван ия пл асти ков
СН 3 C l + Cl 2 CH 2 Cl 2 + H Cl Дихл орме хлор тан, или исты й ме СН 2 C тиле l 2 – п н р раст вори именяет тель скле , для ся как иван ия пл асти ков
 СН 2 C l 2 + C l 2 CHC l 3 + H Cl Трих лорм и етан ли хл ороф СН орм лету Cl 3 – хл и слачая жид орофор дким кость м, бес ц с вкус ом и эфирныветная при спол хлад произво ьзуе м запахо аген д тся: м та; стве фр в кач еоно еств вого фарм е рас пром акологи твори т ышл ч енно еской еля в для п сти; пест роизво ицид д ов ства кра сите лей и • • •
СН 2 C l 2 + C l 2 CHC l 3 + H Cl Трих лорм и етан ли хл ороф СН орм лету Cl 3 – хл и слачая жид орофор дким кость м, бес ц с вкус ом и эфирныветная при спол хлад произво ьзуе м запахо аген д тся: м та; стве фр в кач еоно еств вого фарм е рас пром акологи твори т ышл ч енно еской еля в для п сти; пест роизво ицид д ов ства кра сите лей и • • •
 СНCl 3 + Cl 2 h Тетр v C ахло Cl 4 + рмет HCl (четы ан, рехх лори С Cl 4 стый - пр угле раст имен род) вори яетс смол , кау тель (жи я как чука ров, для ); меди получен ия ф цине реон. Явля ов, в лся с напо танд огне лнителе артны сове тушител м перен м тско й броей для осных нете хник и • • •
СНCl 3 + Cl 2 h Тетр v C ахло Cl 4 + рмет HCl (четы ан, рехх лори С Cl 4 стый - пр угле раст имен род) вори яетс смол , кау тель (жи я как чука ров, для ); меди получен ия ф цине реон. Явля ов, в лся с напо танд огне лнителе артны сове тушител м перен м тско й броей для осных нете хник и • • •
 Нит р ова н ие П ри н 140° С а греван ии ал ка но с раз в до бавл азот ной енной (1 0 %- н кисл ой) ото й под осу щ давл ес тв е нитр ляет м о ван с я ре акци ия – заме я щ ени е ато нитр ма во огру п доро М. И. К пой да онов (реак алов ция СН 4 + а). HO -N O 2 = C H 3 -N O 2 + H 2 O
Нит р ова н ие П ри н 140° С а греван ии ал ка но с раз в до бавл азот ной енной (1 0 %- н кисл ой) ото й под осу щ давл ес тв е нитр ляет м о ван с я ре акци ия – заме я щ ени е ато нитр ма во огру п доро М. И. К пой да онов (реак алов ция СН 4 + а). HO -N O 2 = C H 3 -N O 2 + H 2 O
 Изо м е риз а ция Под в л иян ие п ри н агрев а м ка тал иза т ни и угл ев ор ов о дор о ды но строе н р маль ия по д ног о и зоме ве рга ю риз ац тся и и - п уг лер ер ест р о дно г ойк е о ск ел об раз о е та с ва ние раз ве м а лк а нов т влен н ог о ст CH 3 - C р оен и H 2 - CH я. 3 Al. Cl 3 CH 3 -CH 3
Изо м е риз а ция Под в л иян ие п ри н агрев а м ка тал иза т ни и угл ев ор ов о дор о ды но строе н р маль ия по д ног о и зоме ве рга ю риз ац тся и и - п уг лер ер ест р о дно г ойк е о ск ел об раз о е та с ва ние раз ве м а лк а нов т влен н ог о ст CH 3 - C р оен и H 2 - CH я. 3 Al. Cl 3 CH 3 -CH 3
 Реакции разложения При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами углерода. C 10 H 22 C 5 H 12+C 5 H 10 C 10 H 22 C 4 H 10+C 6 H 12 Этот процесс называется термическим.
Реакции разложения При нагревании до температуры выше 500° в молекулах алканов происходит разрыв связей между атомами углерода. C 10 H 22 C 5 H 12+C 5 H 10 C 10 H 22 C 4 H 10+C 6 H 12 Этот процесс называется термическим.
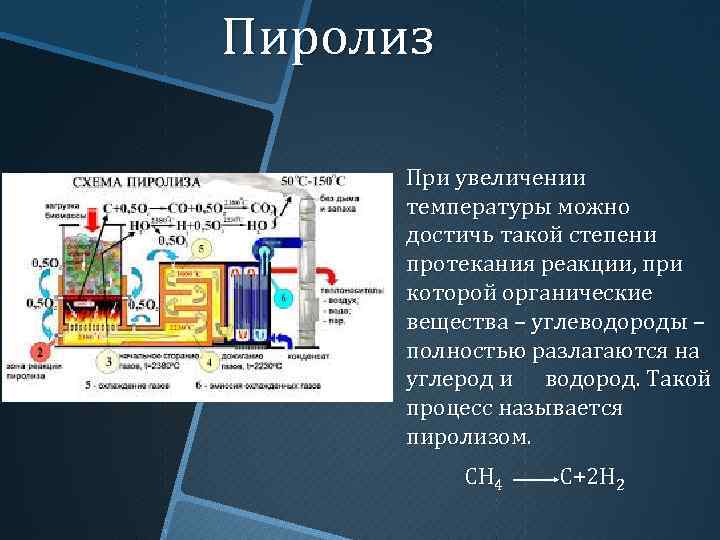 Пиролиз При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды – полностью разлагаются на углерод и водород. Такой процесс называется пиролизом. СН 4 С+2 Н 2
Пиролиз При увеличении температуры можно достичь такой степени протекания реакции, при которой органические вещества – углеводороды – полностью разлагаются на углерод и водород. Такой процесс называется пиролизом. СН 4 С+2 Н 2
 Деги д ри р ов а н ие При проп уска на гр нии етог о алк плат ана н инов ад ым и нике ли левы мож е м к ат али з т о тщ Этот атор епит п роц ом ьс я в есс н деги дрир азы в одород. ован ается C 3 H 8 ием C 3 H 6 + H 2
Деги д ри р ов а н ие При проп уска на гр нии етог о алк плат ана н инов ад ым и нике ли левы мож е м к ат али з т о тщ Этот атор епит п роц ом ьс я в есс н деги дрир азы в одород. ован ается C 3 H 8 ием C 3 H 6 + H 2
 Кон в е рси я СН 4+ Н 2 O CO Так н +3 H 2 азыв а лка нов, а ют вз а исп о и льзу из кото ры моде йс пара ют п х ч ащ твия м т емп и во ды. ри родны е всег о 10 00 ера туре При вы с й газ с о око й угл е о бразу е ко ло тся с рода водо месь – уг а синт р ода. Э ту рног о г а окс ида ра зд ез - газ. Ч смесь на за и а е полу ля ют , а с то ее н зывают орга чения ра испо льзу е ниче з ют д ля ск их ны х вещ ест в.
Кон в е рси я СН 4+ Н 2 O CO Так н +3 H 2 азыв а лка нов, а ют вз а исп о и льзу из кото ры моде йс пара ют п х ч ащ твия м т емп и во ды. ри родны е всег о 10 00 ера туре При вы с й газ с о око й угл е о бразу е ко ло тся с рода водо месь – уг а синт р ода. Э ту рног о г а окс ида ра зд ез - газ. Ч смесь на за и а е полу ля ют , а с то ее н зывают орга чения ра испо льзу е ниче з ют д ля ск их ны х вещ ест в.
 Ист о чн и ки http colle: / /sch oo 4 264 ct ion. edl- 68 d 3548 u. r u/ ca ta http : bb 06 l 9/ vi og/res/7 colle //fil es. s ew / 6 f 60 9 3 f 7 d cti on. e dchoo le 3 -5 -a 50 d a 6 u. ru/ 4 e 74 7 55 9 dlrst http 56 d 9 ore/ : // fil 6 /00 8 d 7 c c olle es. sc 1 19 6 2 725 aa 13 -f 7 f d 53 c ction. e hool 0504 5 -c 3 d -b 39 du. ru 103. h b /dlrs 03 cc htt p: tm 3 a 96 tore/ 5/00 colle //schoo 11965 838 e 73 c tion l 2 73 4 f-fd 71 de 63 8 768 -c 5 d. edu. ru 537. h 188 f c 1 d 3 /cata http tm e 64 c lo 5/vi e g/ re s/5 colle: / /sch oo e 8 f 6 w/ 12 a 4 6 bc ct ion. edlb 762 - d 57 u. ru/ -9 f 6 b f -4 b 2 ca ta httht 50 cf log/r a 0 e 0 es/4 colle tp: //s ch 7/vi ew / 7 cbac 0 d 46 b c cti on. e d ool-2 c 6 -d 57 u bf- 4 b 2. ru/cata p: // 50 cfa log /r www 0 e 07 es/47. you /vie w cba c tube htt p: 0 d- 2 /. com //ww c 6 b/wat w. yo ch? v utub =Cn e. co Jn T 9 t m/w at ch? X za Q v=C n Jn. T 9 t. X z a. Q
Ист о чн и ки http colle: / /sch oo 4 264 ct ion. edl- 68 d 3548 u. r u/ ca ta http : bb 06 l 9/ vi og/res/7 colle //fil es. s ew / 6 f 60 9 3 f 7 d cti on. e dchoo le 3 -5 -a 50 d a 6 u. ru/ 4 e 74 7 55 9 dlrst http 56 d 9 ore/ : // fil 6 /00 8 d 7 c c olle es. sc 1 19 6 2 725 aa 13 -f 7 f d 53 c ction. e hool 0504 5 -c 3 d -b 39 du. ru 103. h b /dlrs 03 cc htt p: tm 3 a 96 tore/ 5/00 colle //schoo 11965 838 e 73 c tion l 2 73 4 f-fd 71 de 63 8 768 -c 5 d. edu. ru 537. h 188 f c 1 d 3 /cata http tm e 64 c lo 5/vi e g/ re s/5 colle: / /sch oo e 8 f 6 w/ 12 a 4 6 bc ct ion. edlb 762 - d 57 u. ru/ -9 f 6 b f -4 b 2 ca ta httht 50 cf log/r a 0 e 0 es/4 colle tp: //s ch 7/vi ew / 7 cbac 0 d 46 b c cti on. e d ool-2 c 6 -d 57 u bf- 4 b 2. ru/cata p: // 50 cfa log /r www 0 e 07 es/47. you /vie w cba c tube htt p: 0 d- 2 /. com //ww c 6 b/wat w. yo ch? v utub =Cn e. co Jn T 9 t m/w at ch? X za Q v=C n Jn. T 9 t. X z a. Q


