Dikarbonovi-kislot-101.ppt
- Количество слайдов: 12

Двохосновні насичені карбонові кислоти можна розглядати як похідні насичених вуглеводнів, у молекулах яких два атоми Гідрогену заміщені на карбоксильні групи. Їх загальна формула Cn. H 2 n(COOH)2. Номенклатура. За номенклатурою IUPAC назви двохосновних кислот утворюють від назв відповідних вуглеводнів, додаючи закінчення діова кислота, наприклад: НООС–СООН – етандіова кислота. Але більш вживаними є тривіальні назви. Найважливішими представниками двохосновних насичених кислот є такі: НООС–СООН – щавлева кислота; НООС–СН 2–СООН –малонова кислота; НООС–(СН 2)2–СООН – Ізомерія. Для дикарбонових кислот характерна структурна їзомерія (карбонового скелета, конформаційна, міжкласова), а якщо молекула має асиметричний атом карбону – то ї оптичну ізомерію. Наприклад, ізомерія карбонового скелету: Міжкласова ізомерія:
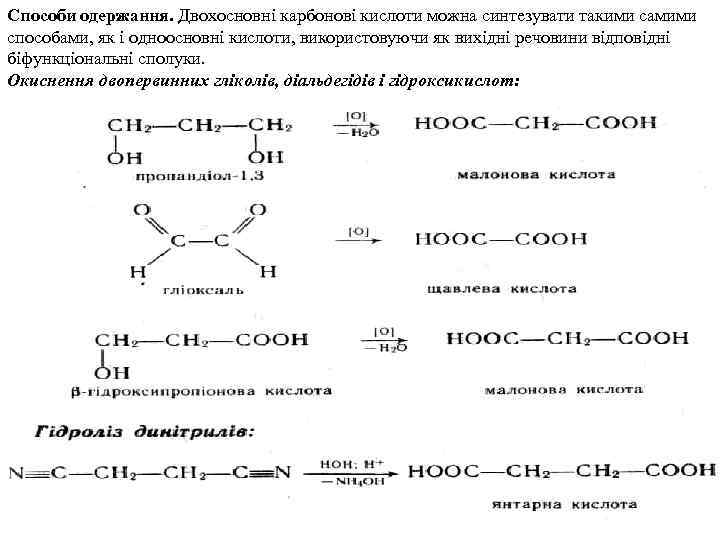
Способи одержання. Двохосновні карбонові кислоти можна синтезувати такими самими способами, як і одноосновні кислоти, використовуючи як вихідні речовини відповідні біфункціональні сполуки. Окиснення двопервинних гліколів, діальдегідів і гідроксикислот:
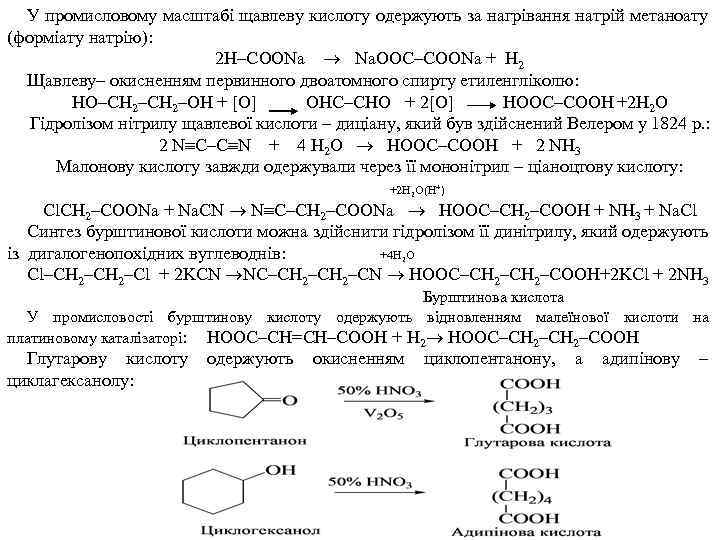
У промисловому масштабі щавлеву кислоту одержують за нагрівання натрій метаноату (форміату натрію): 2 Н–СООNa Na. ООС–СООNa + Н 2 Щавлеву– окисненням первинного двоатомного спирту етиленгліколю: НО–СН 2–ОН + [O] ОНС–СНО + 2[O] HOOC–COOH +2 Н 2 О Гідролізом нітрилу щавлевої кислоти – диціану, який був здійснений Велером у 1824 р. : 2 N С–С N + 4 Н 2 О НООС–СООН + 2 NН 3 Малонову кислоту завжди одержували через її мононітрил – ціаноцтову кислоту: +2 Н 2 О(Н+) Cl. СН 2–СООNa + Na. CN N С–СН 2–СООNa НООС–СН 2–СООН + NН 3 + Na. Cl Синтез бурштинової кислоти можна здійснити гідролізом її динітрилу, який одержують із дигалогенопохідних вуглеводнів: +4 H 2 O Cl–СН 2–Cl + 2 KCN NC–CH 2–CN HOOC–CH 2–COOH+2 KCl + 2 NH 3 Бурштинова кислота У промисловості бурштинову кислоту одержують відновленням малеїнової кислоти на платиновому каталізаторі: HOOC–CH=CH–COOH + Н 2 HOOC–CH 2–COOH Глутарову кислоту циклагексанолу: одержують окисненням циклопентанону, а адипінову –

Фізичні властивості. Дикарбонові кислоти — білі кристалічні речовини, добре розчинні у воді. Температури плавлення кислот з парним числом атомів Карбону вище температур плавлення найближчих гомологічних кислот з непарним числом атомів Карбону. Хімічні властивості. Дикарбонові кислоти завдяки наявності двох карбоксильних груп дисоціюють ступінчато, утворюючи аніон (р. Ка 1) і діаніон (р. Ка 2): За пepшим ступенем дикарбонові кислоти виявляють сильніші кислотні властивості, ніж монокарбонові кислоти з тим самим числом атомів Карбону. Двохосновні кислоти вступають у такі самі реакції, як і одноосновні. Дикарбонові кислоти можуть утворювати два ряди похідних: солей, естерів, амідів. Утворення кислих і середніх солей: +Na. OH НООС–СООН +Na. OH НООС–СООNa Na. ООС–СООNa + H 2 O Утворення естерів: Реакції, характерні для двохосновних кислот. Декарбоксилування за нагрівання: Аналогічно ведуть себе при нагріванні моно та діалкілзаміщені малонові кислоти:
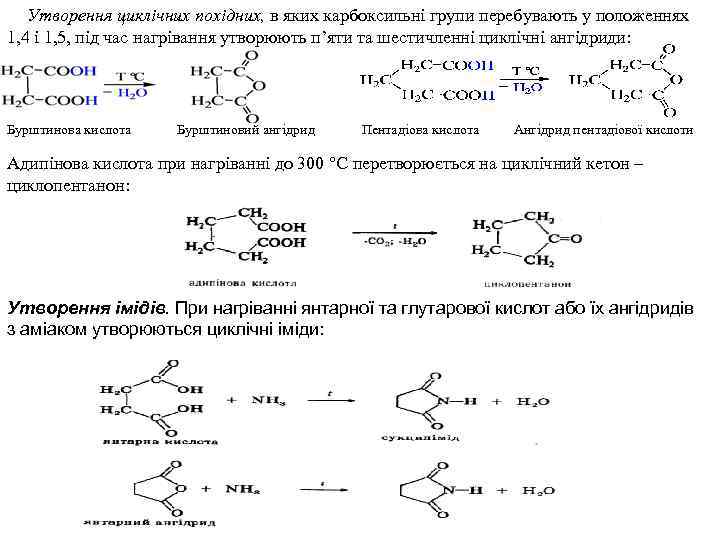
Утворення циклічних похідних, в яких карбоксильні групи перебувають у положеннях 1, 4 і 1, 5, під час нагрівання утворюють п’яти та шестичленні циклічні ангідриди: Бурштинова кислота Бурштиновий ангідрид Пентадіова кислота Ангідрид пентадіової кислоти Адипінова кислота при нагріванні до 300 °С перетворюється на циклічний кетон – циклопентанон: Утворення імідів. При нагріванні янтарної та глутарової кислот або їх ангідридів з аміаком утворюються циклічні іміди:

Оксалатна (щавлева) кислота НООС—СООН. Біла кристалічна речовина (Тпл. = 189 °С), легко розчиняється у воді та спиртах. Міститься у вигляді солей в багатьох рослинах (щавель, ревінь та ін. ). Солі щавлевої кислоти називають оксалатами. Кристали оксалату кальцію дуже важко розчиняються у воді та можуть відкладатися при патологічних станах в нирках у вигляді каміння (нирково кам’яна хвороба). Специфічними реакціями щавлевої кислоти є розкладання концентрованою сульфатною кислотою та окислення. При нагріванні з концентрованою сульфатною кислотою щавлева кислота розкладається з утворенням карбон(II) оксиду, карбон(IV) оксиду та води: При окисненні утворює карбон(IV) оксид і воду: Ця реакція використовується в аналітичній практиці для встановлення титру КМn. O 4: Якісною реакцією для виявлення щавлевої кислоти та її розчинних солей є утворення нерозчинної солі кальцій оксалату : Цю реакцію застосовують в аналітичній практиці також для виявлення іонів Са 2+. Застосовується щавлева кислота також для очистки металів від іржі та накипу, для фарбування тканин, для обробки горіхового та червоного дерев, а як протрава – у шкіряному виробництві.

Малонова кислота НООС–СН 2–СООН. Біла кристалічна речовина (Тпл. = 135 °С), розчинна у воді, етанолі, діетиловому етері. Міститься в соці цукрових буряків. Вперше її було одержано при окиснювальному декарбоксилуванні яблучної кислоти: За участю метиленової групи малонова кислота в присутності основ вступає в реакцію конденсації з альдегідами та кетонами, які не містять атома Гідрогену при Карбоні в α положенні (конденсація Кневенагеля). В результаті реакції утворюються ненасичені монокарбонові кислоти, наприклад: Велике практичне значення має похідна малонової кислоти – діетиловий естер малонової кислоти, який використовується в синтезі одно та багатоосновних карбонових кислот.
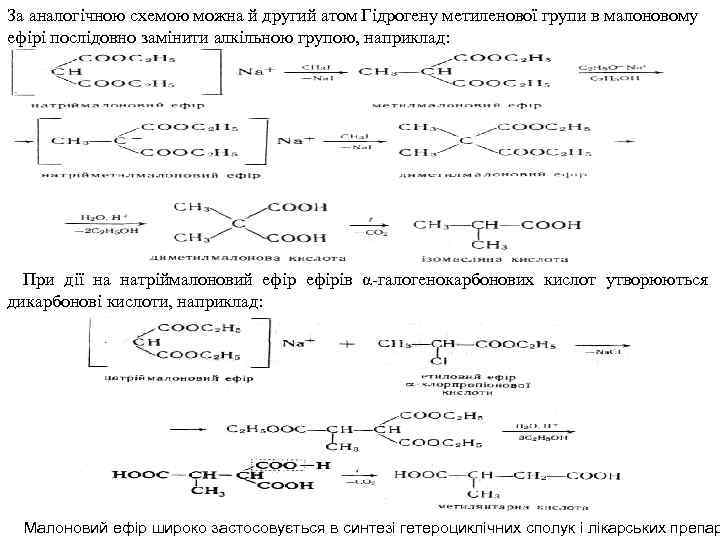
За аналогічною схемою можна й другий атом Гідрогену метиленової групи в малоновому ефірі послідовно замінити алкільною групою, наприклад: При дії на натріймалоновий ефірів α галогенокарбонових кислот утворюються дикарбонові кислоти, наприклад: Малоновий ефір широко застосовується в синтезі гетероциклічних сполук і лікарських препар
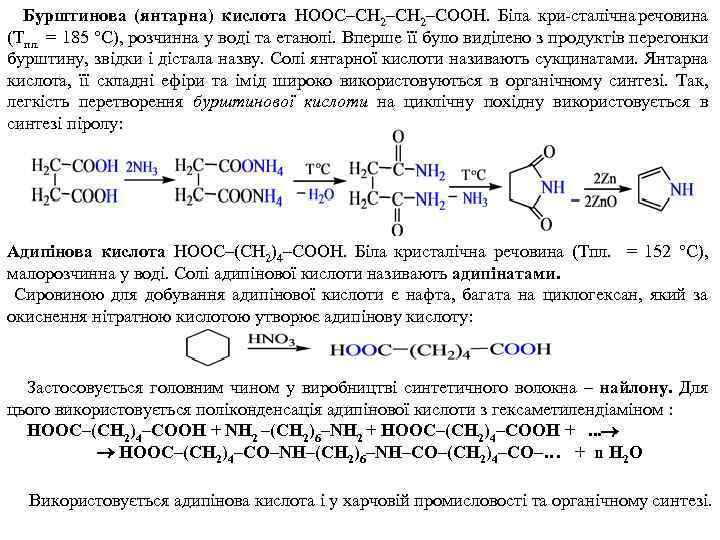
Бурштинова (янтарна) кислота НООС–СН 2–СООН. Біла кри сталічна речовина (Тпл. = 185 °С), розчинна у воді та етанолі. Вперше її було виділено з продуктів перегонки бурштину, звідки і дістала назву. Солі янтарної кислоти називають сукцинатами. Янтарна кислота, її складні ефіри та імід широко використовуються в органічному синтезі. Так, легкість перетворення бурштинової кислоти на циклічну похідну використовується в синтезі піролу: Адипінова кислота НООС–(СН 2)4–СООН. Біла кристалічна речовина (Тпл. = 152 °С), малорозчинна у воді. Солі адипінової кислоти називають адипінатами. Сировиною для добування адипінової кислоти є нафта, багата на циклогексан, який за окиснення нітратною кислотою утворює адипінову кислоту: Застосовується головним чином у виробництві синтетичного волокна – найлону. Для цього використовується поліконденсація адипінової кислоти з гексаметилендіаміном : НООС–(СН 2)4–СООН + NН 2 –(СН 2)6–NН 2 + НООС–(СН 2)4–СООН +. . . НООС–(СН 2)4–СО–NН–(СН 2)6–NН–СО–(СН 2)4–СО–… + n Н 2 О Використовується адипінова кислота і у харчовій промисловості та органічному синтезі.
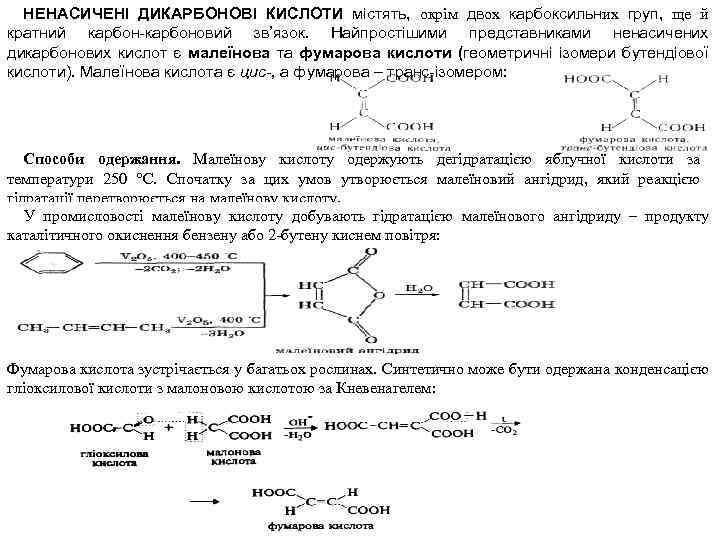
НЕНАСИЧЕНІ ДИКАРБОНОВІ КИСЛОТИ містять, окрім двох карбоксильних груп, ще й кратний карбон-карбоновий зв’язок. Найпростішими представниками ненасичених дикарбонових кислот є малеїнова та фумарова кислоти (геометричні ізомери бутендіової кислоти). Малеїнова кислота є цис-, а фумарова – транс-ізомером: Способи одержання. Малеїнову кислоту одержують дегідратацією яблучної кислоти за температури 250 °С. Спочатку за цих умов утворюється малеїновий ангідрид, який реакцією гідратації перетворюється на малеїнову кислоту. У промисловості малеїнову кислоту добувають гідратацією малеїнового ангідриду – продукту каталітичного окиснення бензену або 2 бутену киснем повітря: Фумарова кислота зустрічається у багатьох рослинах. Синтетично може бути одержана конденсацією гліоксилової кислоти з малоновою кислотою за Кневенагелем:

У промисловості фумарову кислоту добувають термічною ізомеризацією малеїнової кислоти: Фізичні властивості. Малеїнова кислота являє собою білу кристалічну речовину (Тпл. = 131 °С), легко розчиняється у воді та спиртах. Сублімується, в запаяному капілярі Т = 287 °С. На відміну від малеїнової, вонаважкорозчинна у воді. Хімічні властивості. Ненасичені дикарбонові кислоти мають більш виявлені кислотні властивості порівняно з насиченими, оскільки взаємний вплив двох карбоксильних груп передається по спряженій системі π зв’язків сильніше. При цьому малеїнова кислота значно сильніша фумарової. Підвищену кислотність малеїнової кислоти за першим ступенем та низьку кислотність за другим зумовлено внутрішньомолекулярною взаємодією іонізованої та неіонізованої карбоксильних груп (утворення внутрішньомолекулярного водневого зв'язку): За рахунок утворення водневого зв'язку, з одного боку, підвищується стійкість аніона, а з іншого – утруднюється відщеплення протона від другої карбоксильної групи. Реакційна здатність ненасичених дикарбонових кислот зумовлена наявністю в їх структурі двох карбоксильних груп і кратного зв'язку. За участю кратного зв’язку йдуть реакції приєднання. Так, при гідруванні малеїнової та фумарової кислот утворюється янтарна кислота, при галогенуванні – дигалогенянтарна кислота, приєднання галогеноводнів приводить до утворення моногалогенянтарних кислот, приєднання води в присутності мінеральних кислот дає гідроксіянтарну (яблучну) кислоту. При окисленні перманганатом калію утворюється виноградна (мезовинна) кислота:
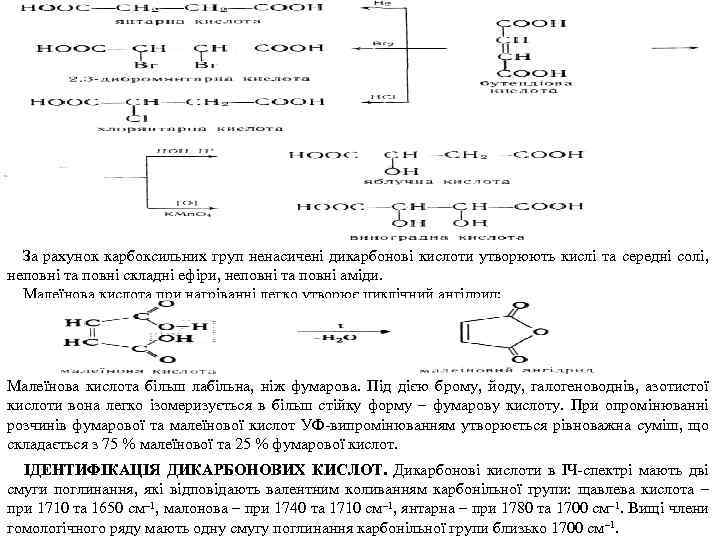
За рахунок карбоксильних груп ненасичені дикарбонові кислоти утворюють кислі та середні солі, неповні та повні складні ефіри, неповні та повні аміди. Малеїнова кислота при нагріванні легко утворює циклічний ангідрид: Малеїнова кислота більш лабільна, ніж фумарова. Під дією брому, йоду, галогеноводнів, азотистої кислоти вона легко ізомеризується в більш стійку форму – фумарову кислоту. При опромінюванні розчинів фумарової та малеїнової кислот УФ випромінюванням утворюється рівноважна суміш, що складається з 75 % малеїнової та 25 % фумарової кислот. ІДЕНТИФІКАЦІЯ ДИКАРБОНОВИХ КИСЛОТ. Дикарбонові кислоти в ІЧ спектрі мають дві смуги поглинання, які відповідають валентним коливанням карбонільної групи: щавлева кислота – при 1710 та 1650 см– 1, малонова – при 1740 та 1710 см– 1, янтарна – при 1780 та 1700 см– 1. Вищі члени гомологічного ряду мають одну смугу поглинання карбонільної групи близько 1700 см– 1.
Dikarbonovi-kislot-101.ppt