Лекция 11-12. Строение ДЭС.pptx
- Количество слайдов: 18
 ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
ДВОЙНОЙ ЭЛЕКТРИЧЕСКИЙ СЛОЙ
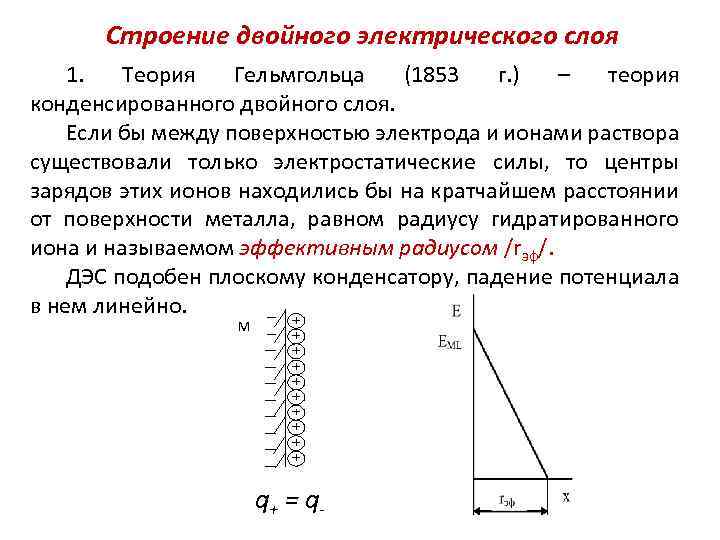 Строение двойного электрического слоя 1. Теория Гельмгольца (1853 г. ) – теория конденсированного двойного слоя. Если бы между поверхностью электрода и ионами раствора существовали только электростатические силы, то центры зарядов этих ионов находились бы на кратчайшем расстоянии от поверхности металла, равном радиусу гидратированного иона и называемом эффективным радиусом /rэф/. ДЭС подобен плоскому конденсатору, падение потенциала в нем линейно. М q+ = q-
Строение двойного электрического слоя 1. Теория Гельмгольца (1853 г. ) – теория конденсированного двойного слоя. Если бы между поверхностью электрода и ионами раствора существовали только электростатические силы, то центры зарядов этих ионов находились бы на кратчайшем расстоянии от поверхности металла, равном радиусу гидратированного иона и называемом эффективным радиусом /rэф/. ДЭС подобен плоскому конденсатору, падение потенциала в нем линейно. М q+ = q-
 Для плоского конденсатора соотношение между разностью потенциалов на обкладках и зарядом описывается уравнением q = E. C где С – емкость конденсатора; q – заряд. Емкость конденсатора равна где – относительная диэлектрическая проницаемость раствора, между обкладками конденсатора; 0 – абсолютная диэлектрическая проницаемость; d – расстояние между обкладками. По аналогии с физическим конденсатором применительно к ДЭС величина С называется емкостью ДЭС, а расстояние между обкладками равно эффективному радиусу иона (d = rэф).
Для плоского конденсатора соотношение между разностью потенциалов на обкладках и зарядом описывается уравнением q = E. C где С – емкость конденсатора; q – заряд. Емкость конденсатора равна где – относительная диэлектрическая проницаемость раствора, между обкладками конденсатора; 0 – абсолютная диэлектрическая проницаемость; d – расстояние между обкладками. По аналогии с физическим конденсатором применительно к ДЭС величина С называется емкостью ДЭС, а расстояние между обкладками равно эффективному радиусу иона (d = rэф).
 В отличие от физического конденсатора емкость ДЭС не является постоянной величиной, так как при изменении потенциала изменяются электростатические силы, действующие на ион и он деформирует свою гидратную оболочку, т. е. изменяется расстояние между обкладками конденсатора. Кривые зависимости емкости ДЭС от потенциала металла
В отличие от физического конденсатора емкость ДЭС не является постоянной величиной, так как при изменении потенциала изменяются электростатические силы, действующие на ион и он деформирует свою гидратную оболочку, т. е. изменяется расстояние между обкладками конденсатора. Кривые зависимости емкости ДЭС от потенциала металла
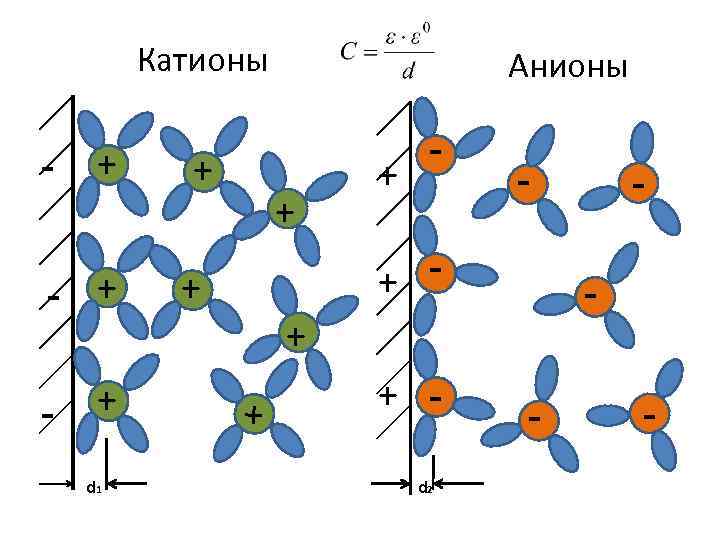 Катионы - + - + d 1 + Анионы + + - - + - + + + d 2 - - -
Катионы - + - + d 1 + Анионы + + - - + - + + + d 2 - - -
 Модель строения ДЭС по Гельмгольцу имеет место в растворах с ионной силой выше 1 М, не содержащих ПАВ. Весьма часто двойной слой имеет более сложное строение. Тепловое движение стремится распределить ионы равномерно в объеме раствора. В результате ионы, компенсирующие заряд поверхности, сосредотачиваются в некотором объеме электролита и концентрация их по мере удаления от поверхности уменьшается. 2. Теория диффузного строения двойного слоя разработана Гуи (1910) и Чапменом (1913 г. )
Модель строения ДЭС по Гельмгольцу имеет место в растворах с ионной силой выше 1 М, не содержащих ПАВ. Весьма часто двойной слой имеет более сложное строение. Тепловое движение стремится распределить ионы равномерно в объеме раствора. В результате ионы, компенсирующие заряд поверхности, сосредотачиваются в некотором объеме электролита и концентрация их по мере удаления от поверхности уменьшается. 2. Теория диффузного строения двойного слоя разработана Гуи (1910) и Чапменом (1913 г. )
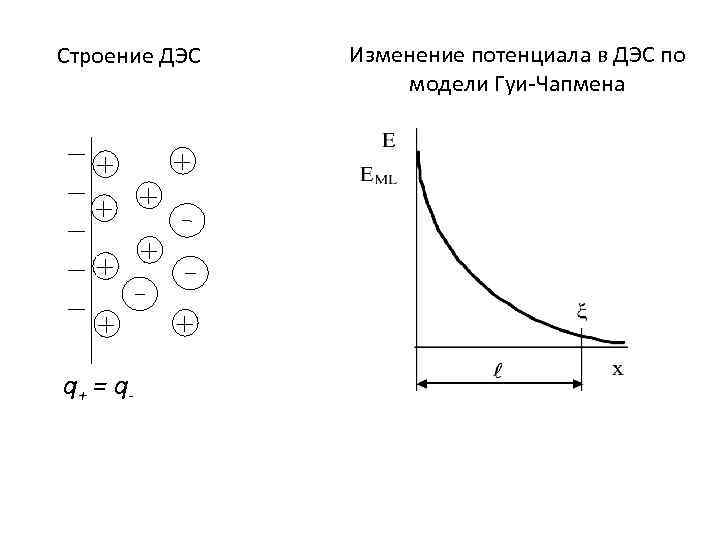 Изменение потенциала в ДЭС по модели Гуи-Чапмена Строение ДЭС q+ = q-
Изменение потенциала в ДЭС по модели Гуи-Чапмена Строение ДЭС q+ = q-
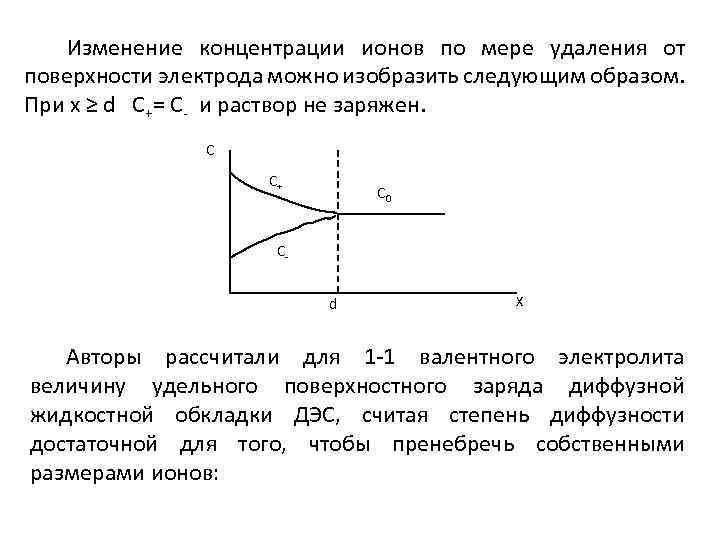 Изменение концентрации ионов по мере удаления от поверхности электрода можно изобразить следующим образом. При х ≥ d С+= С- и раствор не заряжен. С С+ С 0 Сd Х Авторы рассчитали для 1 -1 валентного электролита величину удельного поверхностного заряда диффузной жидкостной обкладки ДЭС, считая степень диффузности достаточной для того, чтобы пренебречь собственными размерами ионов:
Изменение концентрации ионов по мере удаления от поверхности электрода можно изобразить следующим образом. При х ≥ d С+= С- и раствор не заряжен. С С+ С 0 Сd Х Авторы рассчитали для 1 -1 валентного электролита величину удельного поверхностного заряда диффузной жидкостной обкладки ДЭС, считая степень диффузности достаточной для того, чтобы пренебречь собственными размерами ионов:
 где – относительная диэлектрическая проницаемость р-ра; 0 – абсолютная диэлектрическая проницаемость; R – универсальная газовая постоянная; T – температура, К; c – объемная концентрация электролита; E – потенциал электрода. На некотором расстоянии ионы не связаны с поверхностью электрода при относительном движении твердой и жидкой фаз. Потенциал на таком расстоянии является электрокинетическим или ξ- потенциалом. С увеличением концентрации раствора уменьшается степень диффузности и величина ξ- потенциала, что согласуется с опытными данными.
где – относительная диэлектрическая проницаемость р-ра; 0 – абсолютная диэлектрическая проницаемость; R – универсальная газовая постоянная; T – температура, К; c – объемная концентрация электролита; E – потенциал электрода. На некотором расстоянии ионы не связаны с поверхностью электрода при относительном движении твердой и жидкой фаз. Потенциал на таком расстоянии является электрокинетическим или ξ- потенциалом. С увеличением концентрации раствора уменьшается степень диффузности и величина ξ- потенциала, что согласуется с опытными данными.
 Теория Гуи – Чапмена не объясняет изменение знака ξпотенциала, т. е. перезарядку поверхности, возникающую при специфической адсорбции ионов. Эти недостатки вызвали необходимость создания новой теории ДЭС, учитывающей как собственные размеры ионов, так и возможность их специфической адсорбции. 3. Теория Штерна (1924 г. ) – адсорбционная теория двойного слоя. Штерн полагал, что определенная часть ионов удерживается вблизи поверхности раздела металл – раствор, образуя гельмгольцевскую обкладку двойного слоя с толщиной d = rэф. Остальные ионы образуют диффузный слой с падением потенциала Ψ΄. ξ - потенциал является частью Ψ' – потенциала.
Теория Гуи – Чапмена не объясняет изменение знака ξпотенциала, т. е. перезарядку поверхности, возникающую при специфической адсорбции ионов. Эти недостатки вызвали необходимость создания новой теории ДЭС, учитывающей как собственные размеры ионов, так и возможность их специфической адсорбции. 3. Теория Штерна (1924 г. ) – адсорбционная теория двойного слоя. Штерн полагал, что определенная часть ионов удерживается вблизи поверхности раздела металл – раствор, образуя гельмгольцевскую обкладку двойного слоя с толщиной d = rэф. Остальные ионы образуют диффузный слой с падением потенциала Ψ΄. ξ - потенциал является частью Ψ' – потенциала.
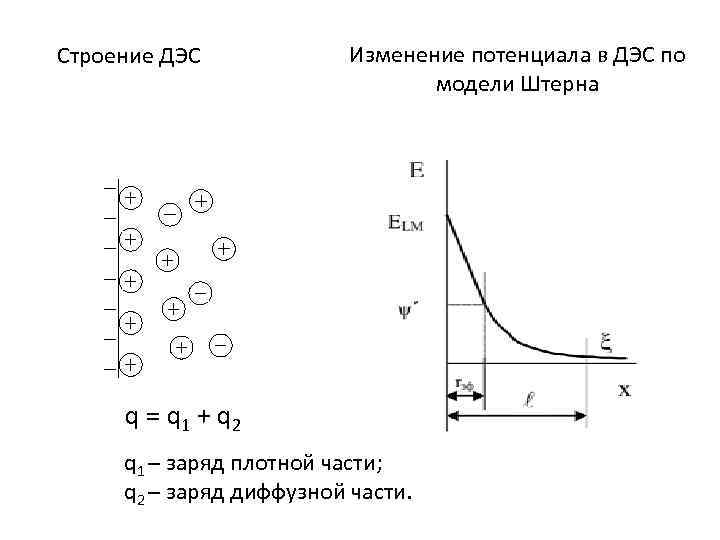 Строение ДЭС Изменение потенциала в ДЭС по модели Штерна q = q 1 + q 2 q 1 – заряд плотной части; q 2 – заряд диффузной части.
Строение ДЭС Изменение потенциала в ДЭС по модели Штерна q = q 1 + q 2 q 1 – заряд плотной части; q 2 – заряд диффузной части.
 При наличии специфической адсорбции: Ф+, Ф- – энергии адсорбции катионов и анионов; Г – поверхностная концентрация ионов в ДЭС; Ψ΄ – потенциал диффузной части ДЭС; с – концентрация в объеме электролита. Заряд диффузной части может быть описан уравнением Гуи:
При наличии специфической адсорбции: Ф+, Ф- – энергии адсорбции катионов и анионов; Г – поверхностная концентрация ионов в ДЭС; Ψ΄ – потенциал диффузной части ДЭС; с – концентрация в объеме электролита. Заряд диффузной части может быть описан уравнением Гуи:
 Тогда При небольших концентрациях единицей в знаменателях первого слагаемого можно пренебречь, тогда + Это уравнение Штерна для плотности заряда ДЭС. Концентрация электролита входит в выражение для q 1 в первой степени, а для q 2 – в степени ½. Поэтому при увеличении концентрации электролита увеличение q 1 происходит быстрее, чем q 2, т. е. q → q 1 и диффузность ДЭС уменьшается.
Тогда При небольших концентрациях единицей в знаменателях первого слагаемого можно пренебречь, тогда + Это уравнение Штерна для плотности заряда ДЭС. Концентрация электролита входит в выражение для q 1 в первой степени, а для q 2 – в степени ½. Поэтому при увеличении концентрации электролита увеличение q 1 происходит быстрее, чем q 2, т. е. q → q 1 и диффузность ДЭС уменьшается.
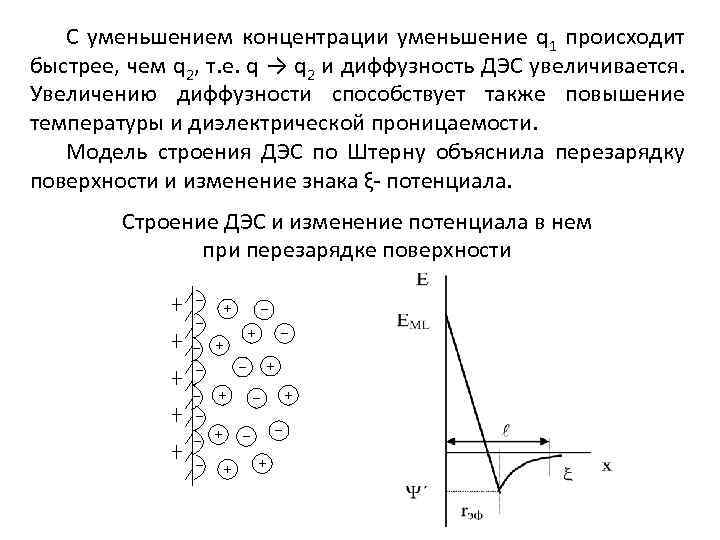 С уменьшением концентрации уменьшение q 1 происходит быстрее, чем q 2, т. е. q → q 2 и диффузность ДЭС увеличивается. Увеличению диффузности способствует также повышение температуры и диэлектрической проницаемости. Модель строения ДЭС по Штерну объяснила перезарядку поверхности и изменение знака ξ- потенциала. Строение ДЭС и изменение потенциала в нем при перезарядке поверхности
С уменьшением концентрации уменьшение q 1 происходит быстрее, чем q 2, т. е. q → q 2 и диффузность ДЭС увеличивается. Увеличению диффузности способствует также повышение температуры и диэлектрической проницаемости. Модель строения ДЭС по Штерну объяснила перезарядку поверхности и изменение знака ξ- потенциала. Строение ДЭС и изменение потенциала в нем при перезарядке поверхности
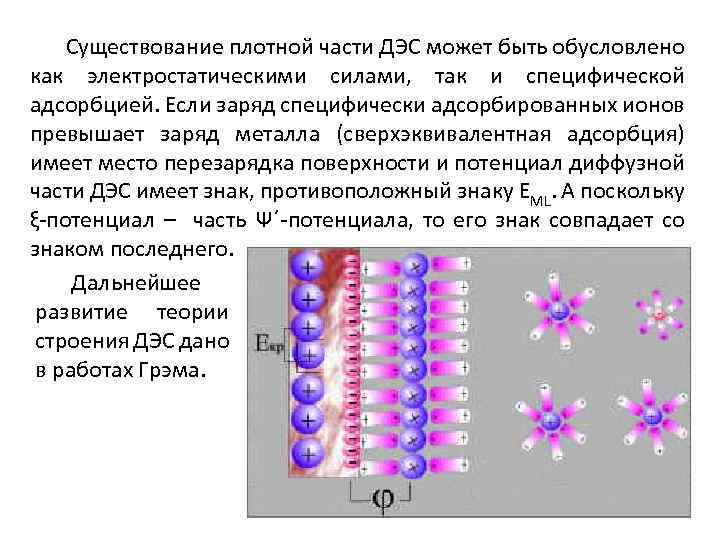 Существование плотной части ДЭС может быть обусловлено как электростатическими силами, так и специфической адсорбцией. Если заряд специфически адсорбированных ионов превышает заряд металла (сверхэквивалентная адсорбция) имеет место перезарядка поверхности и потенциал диффузной части ДЭС имеет знак, противоположный знаку EML. А поскольку ξ-потенциал – часть Ψ΄-потенциала, то его знак совпадает со знаком последнего. Дальнейшее развитие теории строения ДЭС дано в работах Грэма.
Существование плотной части ДЭС может быть обусловлено как электростатическими силами, так и специфической адсорбцией. Если заряд специфически адсорбированных ионов превышает заряд металла (сверхэквивалентная адсорбция) имеет место перезарядка поверхности и потенциал диффузной части ДЭС имеет знак, противоположный знаку EML. А поскольку ξ-потенциал – часть Ψ΄-потенциала, то его знак совпадает со знаком последнего. Дальнейшее развитие теории строения ДЭС дано в работах Грэма.
 Электрокапиллярные кривые. Уравнения Липпмана Первые данные о строении ДЭС получены из анализа электрокапиллярных кривых, которые выражают связь между поверхностным натяжением и скачком потенциала на границе фаз. Граница раздела двух фаз обладает избыточной свободной энергией вследствие отличия энергии частиц на поверхности раздела фаз от энергии частиц в объеме фазы. Избыточная свободная энергия вызывает межфазное (поверхностное) натяжение (σ), которое определяют как работу образования единицы поверхности (Дж/м 2 или Н/м). Поверхностное натяжение характеризует избыток сил притяжения над силами отталкивания. [Н]=[кг·м/с2 ] [Н/м]=[кг/с2]. Для снятия электрокапиллярных кривых Гуи предложил установку – капиллярный электрометр.
Электрокапиллярные кривые. Уравнения Липпмана Первые данные о строении ДЭС получены из анализа электрокапиллярных кривых, которые выражают связь между поверхностным натяжением и скачком потенциала на границе фаз. Граница раздела двух фаз обладает избыточной свободной энергией вследствие отличия энергии частиц на поверхности раздела фаз от энергии частиц в объеме фазы. Избыточная свободная энергия вызывает межфазное (поверхностное) натяжение (σ), которое определяют как работу образования единицы поверхности (Дж/м 2 или Н/м). Поверхностное натяжение характеризует избыток сил притяжения над силами отталкивания. [Н]=[кг·м/с2 ] [Н/м]=[кг/с2]. Для снятия электрокапиллярных кривых Гуи предложил установку – капиллярный электрометр.
 Капиллярный электрометр состоит из измерительной бюретки 1, емкости для ртути 2, конического капилляра 3, погруженного в исследуемый раствор, и платинового контакта 4, являющегося токоподводом к ртути 5. Положение мениска ртути в капилляре определяется, с одной стороны, высотой столба ртути в измерительной бюретке электрометра h, с другой стороны – поверхностным натяжением на границе ртуть-раствор: πr²hρq = 2πrσ. Отсюда следует где ρ - плотность ртути; q - ускорение свободного падения; r - радиус капилляра; h - высота столба ртути
Капиллярный электрометр состоит из измерительной бюретки 1, емкости для ртути 2, конического капилляра 3, погруженного в исследуемый раствор, и платинового контакта 4, являющегося токоподводом к ртути 5. Положение мениска ртути в капилляре определяется, с одной стороны, высотой столба ртути в измерительной бюретке электрометра h, с другой стороны – поверхностным натяжением на границе ртуть-раствор: πr²hρq = 2πrσ. Отсюда следует где ρ - плотность ртути; q - ускорение свободного падения; r - радиус капилляра; h - высота столба ртути
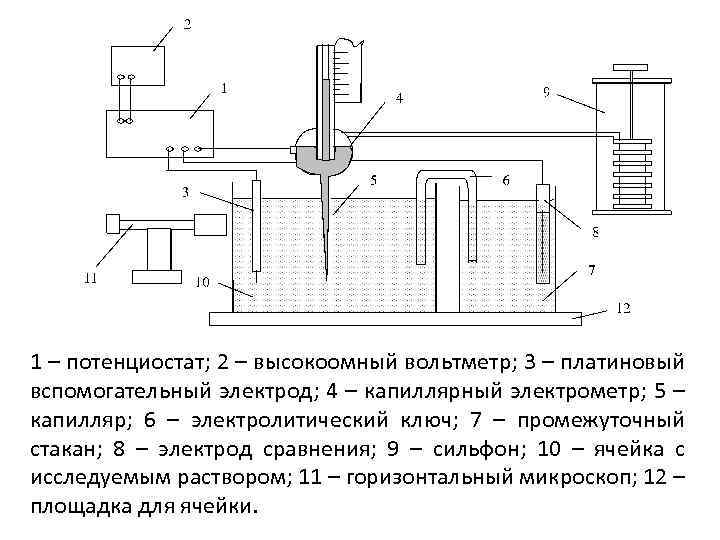 1 – потенциостат; 2 – высокоомный вольтметр; 3 – платиновый вспомогательный электрод; 4 – капиллярный электрометр; 5 – капилляр; 6 – электролитический ключ; 7 – промежуточный стакан; 8 – электрод сравнения; 9 – сильфон; 10 – ячейка с исследуемым раствором; 11 – горизонтальный микроскоп; 12 – площадка для ячейки.
1 – потенциостат; 2 – высокоомный вольтметр; 3 – платиновый вспомогательный электрод; 4 – капиллярный электрометр; 5 – капилляр; 6 – электролитический ключ; 7 – промежуточный стакан; 8 – электрод сравнения; 9 – сильфон; 10 – ячейка с исследуемым раствором; 11 – горизонтальный микроскоп; 12 – площадка для ячейки.


