1Лекция 1.1 - Справочные данные.ppt
- Количество слайдов: 13
 Дударев Владимир Иванович доктор технических наук, профессор ИРГТУ, корпус К, кабинет К-120 Е-mail: vdudarev@istu. edu Кафедра общеобразовательных дисциплин Корпус Ж, кабинет Ж-200 Корпус К, кабинет К-120 Е-mail: ооd@istu. edu
Дударев Владимир Иванович доктор технических наук, профессор ИРГТУ, корпус К, кабинет К-120 Е-mail: vdudarev@istu. edu Кафедра общеобразовательных дисциплин Корпус Ж, кабинет Ж-200 Корпус К, кабинет К-120 Е-mail: ооd@istu. edu
 1. Коровин Н. В. Общая химия. – М. : Высш. шк. , 2008. – 558 с. 2. Глинка Н. Л. Общая химия. - М. : Юрайт, 2010. - 885 с. : a-ил. 3. Глинка Н. Л. Задачи и упражнения по общей химии. - М. : КНОРУС, 2012. - 240 с. : a-ил 4. Ахметов Н. С. Общая и неорганическая химия. - Изд. 7 -е, стер. - М. : Высш. шк. , 2008. - 742 с. : a-ил 5. Краткий справочник физико-химических величин / сост. Н. М. Барон [и др. ]. - Изд. 12 -е. - М. : Арис, 2010. - 237 с. : z-табл. 6. Артеменко А. И. Органическая химия. – М. : Высш. шк. , 2003. – 605 с. 7. Васильев В. П. Аналитическая химия. В 2 ч. - М. : Высш. шк. , 2004. - 743 с. ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА 8. Будяк Е. В. Общая химия. –СПб. : Изд-во Лань, 2011. -384 с. 9. Топшиноева З. Н. , Зуева В. П. , Волков А. Н. , Лебедева О. В. Химия. Методические указания к выполнению лабораторных работ. - Иркутск: Ир. ГТУ, 2005. - 32 с. 10. Пожидаев Ю. Н. , Зуева В. П. , Лебедева О. В. , Топшиноева З. Н. Химия. Задачи по общей химии. − Иркутск. Изд-во Ир. ГТУ, 2008. − 120 с. 4. Кузнецова О. В. , Зуева В. П. , Топшиноева З. Н. , Лебедева О. В. Химия. Тестовые задания: методические указания для СРС. − Иркутск. Изд-во Ир. ГТУ, 2010. − 68 с.
1. Коровин Н. В. Общая химия. – М. : Высш. шк. , 2008. – 558 с. 2. Глинка Н. Л. Общая химия. - М. : Юрайт, 2010. - 885 с. : a-ил. 3. Глинка Н. Л. Задачи и упражнения по общей химии. - М. : КНОРУС, 2012. - 240 с. : a-ил 4. Ахметов Н. С. Общая и неорганическая химия. - Изд. 7 -е, стер. - М. : Высш. шк. , 2008. - 742 с. : a-ил 5. Краткий справочник физико-химических величин / сост. Н. М. Барон [и др. ]. - Изд. 12 -е. - М. : Арис, 2010. - 237 с. : z-табл. 6. Артеменко А. И. Органическая химия. – М. : Высш. шк. , 2003. – 605 с. 7. Васильев В. П. Аналитическая химия. В 2 ч. - М. : Высш. шк. , 2004. - 743 с. ДОПОЛНИТЕЛЬНАЯ ЛИТЕРАТУРА 8. Будяк Е. В. Общая химия. –СПб. : Изд-во Лань, 2011. -384 с. 9. Топшиноева З. Н. , Зуева В. П. , Волков А. Н. , Лебедева О. В. Химия. Методические указания к выполнению лабораторных работ. - Иркутск: Ир. ГТУ, 2005. - 32 с. 10. Пожидаев Ю. Н. , Зуева В. П. , Лебедева О. В. , Топшиноева З. Н. Химия. Задачи по общей химии. − Иркутск. Изд-во Ир. ГТУ, 2008. − 120 с. 4. Кузнецова О. В. , Зуева В. П. , Топшиноева З. Н. , Лебедева О. В. Химия. Тестовые задания: методические указания для СРС. − Иркутск. Изд-во Ир. ГТУ, 2010. − 68 с.
 Всё, что требуется для выполнения КОНТРОЛЬНЫХ работ и самостоятельного освоения дисциплины: http: // www. istu. edu/ Образование/ Заочно-вечерний факультет/Кафедра общеобразовательных дисциплин/Студентузаочнику/Учебные документы студенту-заочнику/Химия Ресурсы сети Интернет http: //library. istu. edu Библиотека Ир. ГТУ http: //www. studentlibrary. ru Консультант Студента http: //www. Himhelp. ru В помощь изучающим Химию http: //www. chem. msu. su/rus/ Ресурсы Хим. Фака МГУ http: //www. sci-lib. com Книги в свободном доступе http: //www. rushim. ru Все о Химии http: //chemicsoft. chat. ru/ Программное обеспечение Химия
Всё, что требуется для выполнения КОНТРОЛЬНЫХ работ и самостоятельного освоения дисциплины: http: // www. istu. edu/ Образование/ Заочно-вечерний факультет/Кафедра общеобразовательных дисциплин/Студентузаочнику/Учебные документы студенту-заочнику/Химия Ресурсы сети Интернет http: //library. istu. edu Библиотека Ир. ГТУ http: //www. studentlibrary. ru Консультант Студента http: //www. Himhelp. ru В помощь изучающим Химию http: //www. chem. msu. su/rus/ Ресурсы Хим. Фака МГУ http: //www. sci-lib. com Книги в свободном доступе http: //www. rushim. ru Все о Химии http: //chemicsoft. chat. ru/ Программное обеспечение Химия
 Химия – наука о веществах и законах их превращений, сопровождающихся изменением состава и свойств. Основу химии составляют: атомно-молекулярная теория, теория строения атомов и молекул, закон сохранения массы и энергии и ряд других основных законов химии. Объектом изучения химии являются химические элементы и их соединения. Химический элемент – совокупность атомов с одинаковым зарядом ядра. Атом – наименьшая частица химического элемента, сохраняющая все присущие ему свойства. Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами и состоящая из одинаковых или различных атомов.
Химия – наука о веществах и законах их превращений, сопровождающихся изменением состава и свойств. Основу химии составляют: атомно-молекулярная теория, теория строения атомов и молекул, закон сохранения массы и энергии и ряд других основных законов химии. Объектом изучения химии являются химические элементы и их соединения. Химический элемент – совокупность атомов с одинаковым зарядом ядра. Атом – наименьшая частица химического элемента, сохраняющая все присущие ему свойства. Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию, обладающая его основными химическими свойствами и состоящая из одинаковых или различных атомов.
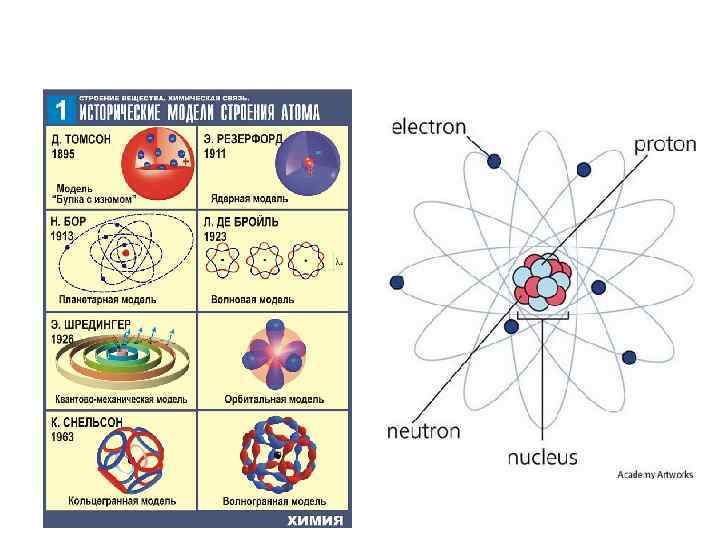
 Электрон, подобно кванту света, обладает двойственными корпускулярно волновыми свойствами, т. е. проявляет одновременно свойства частицы и волны. Невозможно в один и тот же момент точно определить местонахождение электрона в пространстве и его скорость или импульс. Состояние каждого электрона в атоме описывается некоторой функцией , которая может быть получена путем решения уравнения Э. Шредингера.
Электрон, подобно кванту света, обладает двойственными корпускулярно волновыми свойствами, т. е. проявляет одновременно свойства частицы и волны. Невозможно в один и тот же момент точно определить местонахождение электрона в пространстве и его скорость или импульс. Состояние каждого электрона в атоме описывается некоторой функцией , которая может быть получена путем решения уравнения Э. Шредингера.
 Вероятность положения электрона в атоме описывается волновой функцией или орбиталью - , которая характеризует амплитуду волны как функцию координат электрона (плотность электронного облака пропорциональна квадрату волновой функции - 2). Атомная орбиталь (АО) – область пространства, в которой вероятность нахождения электрона максимальна (95%). Для характеристики размера, формы и ориентации в пространстве АО введены квантовые числа – главное, орбитальное, магнитное и спиновое.
Вероятность положения электрона в атоме описывается волновой функцией или орбиталью - , которая характеризует амплитуду волны как функцию координат электрона (плотность электронного облака пропорциональна квадрату волновой функции - 2). Атомная орбиталь (АО) – область пространства, в которой вероятность нахождения электрона максимальна (95%). Для характеристики размера, формы и ориентации в пространстве АО введены квантовые числа – главное, орбитальное, магнитное и спиновое.
 Главное квантовое число (n) характеризует энергию электрона в атоме, энергетический уровень и размеры атомных орбиталей. Принимает целочисленные значения 1, 2, 3, 4, 5 … Чем больше значение n, тем выше энергия электрона. Уровни имеют буквенные обозначения: K (n=1), L (n=2), M (n=3), N (n=4), О (n=5). Орбитальное квантовое число (l) определяет пространственную форму атомной орбитали и энергетический подуровень, на котором располагается электрон. Принимает значения от 0 до (n 1).
Главное квантовое число (n) характеризует энергию электрона в атоме, энергетический уровень и размеры атомных орбиталей. Принимает целочисленные значения 1, 2, 3, 4, 5 … Чем больше значение n, тем выше энергия электрона. Уровни имеют буквенные обозначения: K (n=1), L (n=2), M (n=3), N (n=4), О (n=5). Орбитальное квантовое число (l) определяет пространственную форму атомной орбитали и энергетический подуровень, на котором располагается электрон. Принимает значения от 0 до (n 1).
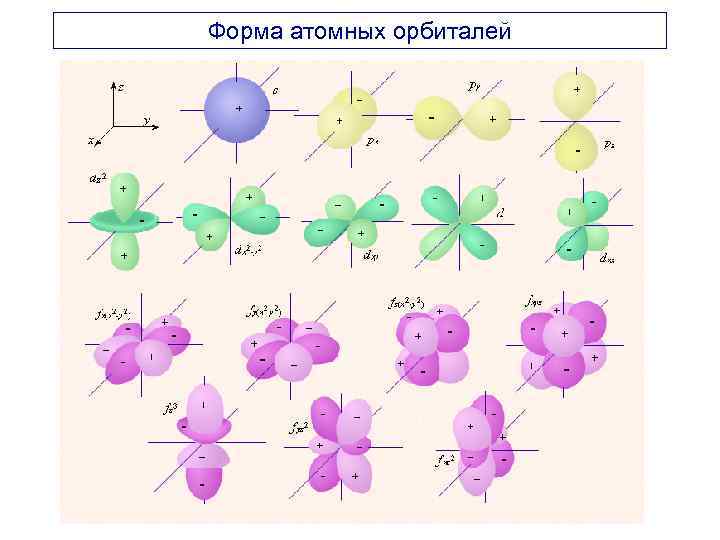 Форма атомных орбиталей
Форма атомных орбиталей
 Магнитное квантовое число (ml ) характеризует ориентацию орбитали в пространстве. Число значений магнитного квантового числа зависит от орбитального квантового числа равняется (2 l+1). Принимает значения от +l до -l. На одном энергетическом уровне может быть одна s-орбиталь (ml =0), три р-орбитали (ml = -1, 0, +1), пять d-орбиталей (ml = -2, -1, 0, +1, +2) и семь f-орбиталей (ml = -3, -2, -1, 0, +1, +2, +3). Спиновое (ms) квантовое число отражает наличие у электрона собственного момента движения т. е. способности вращаться вокруг своей оси в двух различных направлениях. Поэтому спиновое квантовое число может принимать лишь два значения - +½ и –½.
Магнитное квантовое число (ml ) характеризует ориентацию орбитали в пространстве. Число значений магнитного квантового числа зависит от орбитального квантового числа равняется (2 l+1). Принимает значения от +l до -l. На одном энергетическом уровне может быть одна s-орбиталь (ml =0), три р-орбитали (ml = -1, 0, +1), пять d-орбиталей (ml = -2, -1, 0, +1, +2) и семь f-орбиталей (ml = -3, -2, -1, 0, +1, +2, +3). Спиновое (ms) квантовое число отражает наличие у электрона собственного момента движения т. е. способности вращаться вокруг своей оси в двух различных направлениях. Поэтому спиновое квантовое число может принимать лишь два значения - +½ и –½.
 Электроны в атоме распределены по уровням, подуровням и атомным орбиталям. Запись такого распределения электронов получила название электронной конфигурации элемента (атома, иона). В записи электронной конфигурации цифрами обозначают номер уровня (значение главного квантового числа), буквами подуровня (значение орбитального квантового числа), количество электронов на подуровне обозначается верхним индексом. Максимальное число электронов на одном уровне составляет 2 n 2. Принцип минимальной энергии – электрон в основном состоянии в первую очередь располагается в пределах электронного уровня с наименьшей энергией. Это отражает общее правило – максимум устойчивости системы соответствует минимуму энергии. Правила Клечковского – 1) электрон обладает наименьшей энергией на том электронном подуровне, где сумма главного и орбитального квантовых чисел минимальна; 2) при равных значениях суммы главного и орбитального квантовых чисел идет заполнение подуровня с наименьшим значением главного квантового числа. Принцип Паули – в атоме не может быть двух электронов, имеющих одинаковый набор всех квантовых чисел. На одном уровне могут находиться только два электрона. Если два электрона расположены на одной атомной орбитали одного подуровня и одного уровня, они должны иметь разные значения спинового числа.
Электроны в атоме распределены по уровням, подуровням и атомным орбиталям. Запись такого распределения электронов получила название электронной конфигурации элемента (атома, иона). В записи электронной конфигурации цифрами обозначают номер уровня (значение главного квантового числа), буквами подуровня (значение орбитального квантового числа), количество электронов на подуровне обозначается верхним индексом. Максимальное число электронов на одном уровне составляет 2 n 2. Принцип минимальной энергии – электрон в основном состоянии в первую очередь располагается в пределах электронного уровня с наименьшей энергией. Это отражает общее правило – максимум устойчивости системы соответствует минимуму энергии. Правила Клечковского – 1) электрон обладает наименьшей энергией на том электронном подуровне, где сумма главного и орбитального квантовых чисел минимальна; 2) при равных значениях суммы главного и орбитального квантовых чисел идет заполнение подуровня с наименьшим значением главного квантового числа. Принцип Паули – в атоме не может быть двух электронов, имеющих одинаковый набор всех квантовых чисел. На одном уровне могут находиться только два электрона. Если два электрона расположены на одной атомной орбитали одного подуровня и одного уровня, они должны иметь разные значения спинового числа.
 Правило Гунда – заполнение одного подуровня в основном состоянии атома начинается электронами с одинаковыми значениями спинового числа. Суммарное спиновое число электронов данного подуровня должно быть максимальным. Это означает, что энергетически выгодно, когда на орбитали находится один электрон. Орбитали сначала заполняются по одному электрону, затем по второму электрону. Электрон, который последним заполняет орбитали атома элемента, называется формирующим электроном. Элемент относится к группе, называемой по формирующему элементу. Для ряда элементов периодической системы наблюдается отклонение от правила Клечковского. Для этих элементов при незаполненной 4 s-подуровня идет заполнение 3 d-подуровня, так называемый «проскок» электронов. Такое явление характерно для 10 d-элементов периодической системы. Это связано с более устойчивой конфигурацией атома при наполовину или полностью заполненной d-подуровня предвнешнего уровня.
Правило Гунда – заполнение одного подуровня в основном состоянии атома начинается электронами с одинаковыми значениями спинового числа. Суммарное спиновое число электронов данного подуровня должно быть максимальным. Это означает, что энергетически выгодно, когда на орбитали находится один электрон. Орбитали сначала заполняются по одному электрону, затем по второму электрону. Электрон, который последним заполняет орбитали атома элемента, называется формирующим электроном. Элемент относится к группе, называемой по формирующему элементу. Для ряда элементов периодической системы наблюдается отклонение от правила Клечковского. Для этих элементов при незаполненной 4 s-подуровня идет заполнение 3 d-подуровня, так называемый «проскок» электронов. Такое явление характерно для 10 d-элементов периодической системы. Это связано с более устойчивой конфигурацией атома при наполовину или полностью заполненной d-подуровня предвнешнего уровня.



