Дробный анализ [Автосохраненный].pptx
- Количество слайдов: 34
Дробный анализ. Капельный анализ, как его разновидность
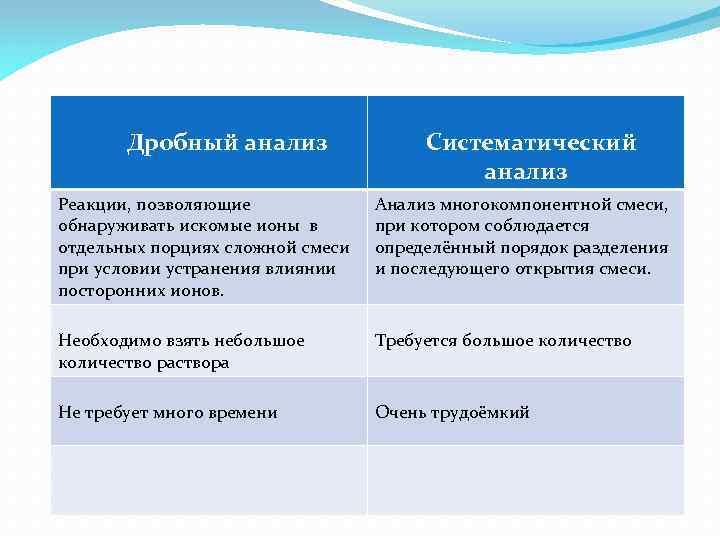
Дробный анализ Систематический анализ Реакции, позволяющие обнаруживать искомые ионы в отдельных порциях сложной смеси при условии устранения влиянии посторонних ионов. Анализ многокомпонентной смеси, при котором соблюдается определённый порядок разделения и последующего открытия смеси. Необходимо взять небольшое количество раствора Требуется большое количество Не требует много времени Очень трудоёмкий

Методы качественного анализа 1. 2. 3. 4. 5. Анализ мокрым путём. Бесстружковый метод анализа Тананаева. Микрокристаллоскопический метод. Анализ сухим путём Метод растирания порошков . . .

Капельный метод анализа Н. А. Тананаев Проводят на: -фарфоровых , стеклянных пластинах. -фильтровальной бумаге

Катионы Hg 2 2+ 1. Hg 2(NO 3)2 + Sn. Cl 2= Hg 2 O + Sn(NO 3)2 Hg 2 Cl 2 + Sn. Cl 2 = 2 Hg + Sn. Cl 4

Ag + С амидопирином Ag+ + R = R+ +Ag (выделение металлического серебра)

2+ Pb Реакция золотого дождя Pb(NO 3)2+ 2 KI= Pb. I 2 +2 KNO 3 Pb. I 2 + 2 KI= K 2[Pb. I 4]
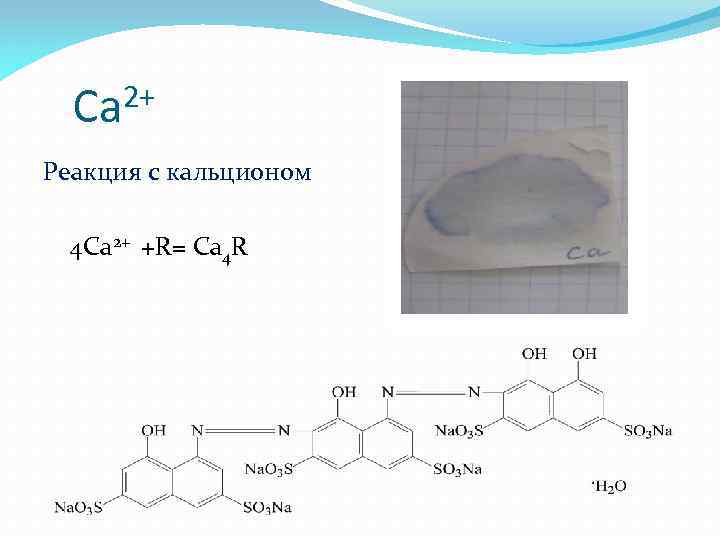
2+ Ca Реакция с кальционом 4 Ca 2+ +R= Ca 4 R
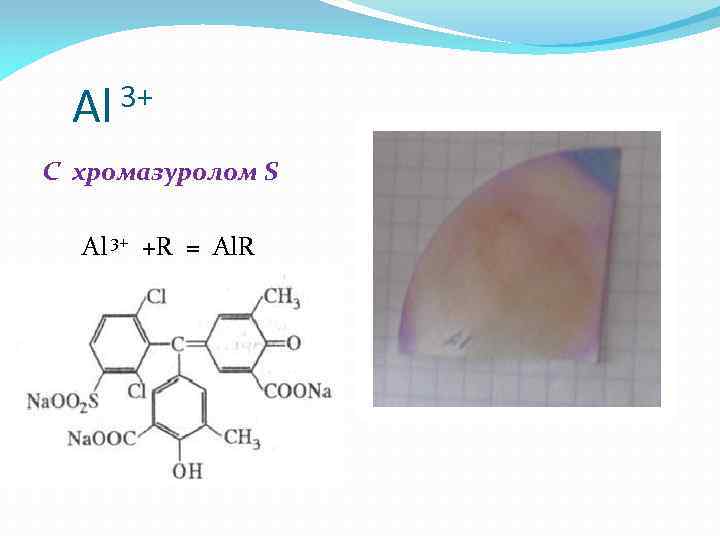
3+ Al С хромазуролом S Al 3+ +R = Al. R

Zn 2+ C сульфарсазеном
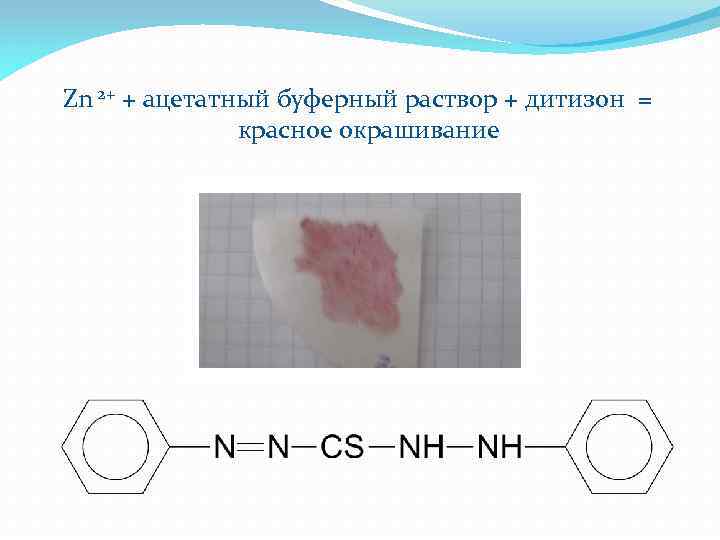
Zn 2+ + ацетатный буферный раствор + дитизон = красное окрашивание

Cr 3+ + ЭДТА = фиолетовое окрашивание
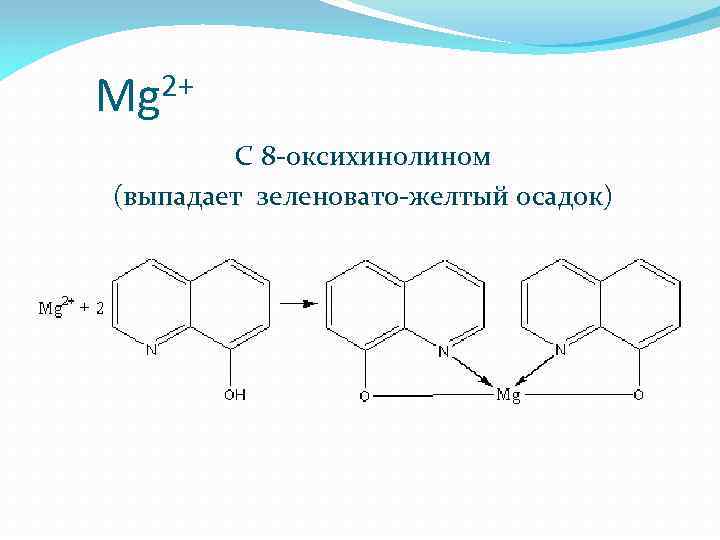
2+ Mg С 8 -оксихинолином (выпадает зеленовато-желтый осадок)
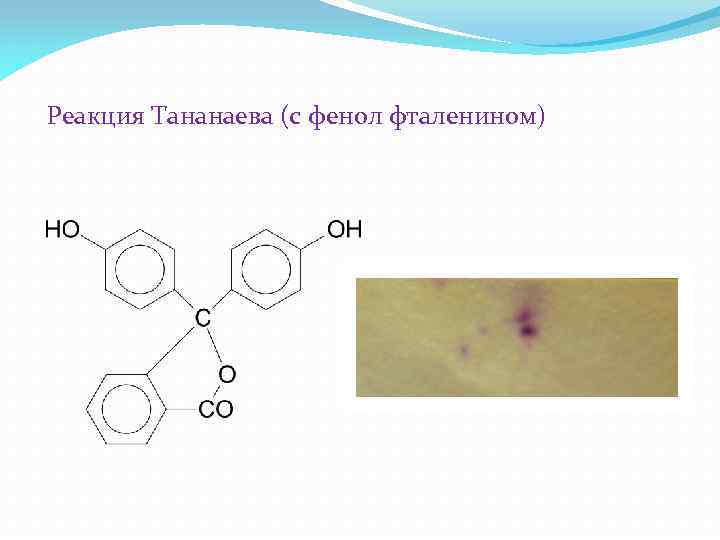
Реакция Тананаева (с фенол фталенином)

2+ Mn 2 Mn(NO 3)2+ 5 Na. Bi. O 3+16 HNO 3 = 5 Bi(NO 3)3 + 5 Na. NO 3 +2 HMn. O 4 +7 H 2 O
![2+ Fe 3 Fe. Cl 2 +2 K 3[Fe(CN)6]= Fe 3 [Fe(CN)6]2 +6 KCl 2+ Fe 3 Fe. Cl 2 +2 K 3[Fe(CN)6]= Fe 3 [Fe(CN)6]2 +6 KCl](https://present5.com/presentation/18930887_142987930/image-16.jpg)
2+ Fe 3 Fe. Cl 2 +2 K 3[Fe(CN)6]= Fe 3 [Fe(CN)6]2 +6 KCl
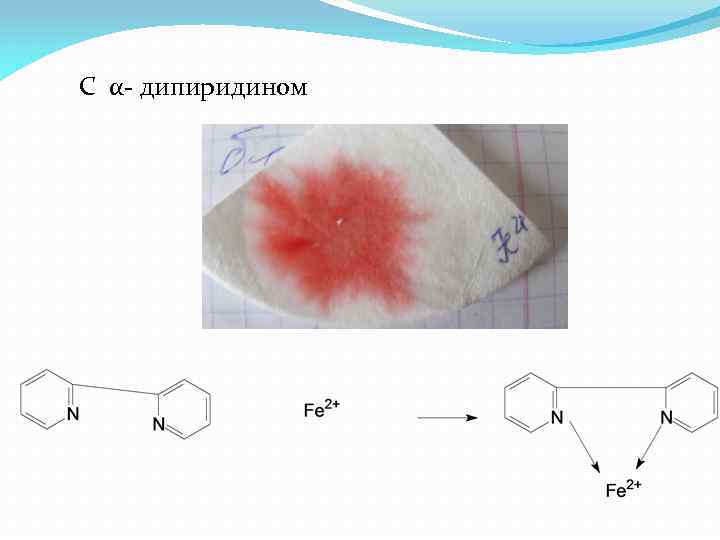
С α- дипиридином
![3+ Fe 1. 4 Fe. Cl 3 +3 K 3[Fe(CN)6]= Fe 4 [Fe(CN)6]3 +12 3+ Fe 1. 4 Fe. Cl 3 +3 K 3[Fe(CN)6]= Fe 4 [Fe(CN)6]3 +12](https://present5.com/presentation/18930887_142987930/image-18.jpg)
3+ Fe 1. 4 Fe. Cl 3 +3 K 3[Fe(CN)6]= Fe 4 [Fe(CN)6]3 +12 KCl 2. Железо +сульфосалициловая к-та

2+ Cu С глицином

2+ Cd Cd 2+ + KBr + ДАМ= белый осадок
![2+ Co Co. Cl 2 + 4 NH 4 SCN=(NH 4)2[Co(SCN)4]+2 NH 4 Cl 2+ Co Co. Cl 2 + 4 NH 4 SCN=(NH 4)2[Co(SCN)4]+2 NH 4 Cl](https://present5.com/presentation/18930887_142987930/image-21.jpg)
2+ Co Co. Cl 2 + 4 NH 4 SCN=(NH 4)2[Co(SCN)4]+2 NH 4 Cl

2+ Ni Реакция Чугаева

NH 4 + С реактивом Несслера
![Ti 4+ Реакция с диантипирилметаном (ДАМ) Ti 4+ + 3 ДАМ = [Ti(ДАМ)3]4+ Ti 4+ Реакция с диантипирилметаном (ДАМ) Ti 4+ + 3 ДАМ = [Ti(ДАМ)3]4+](https://present5.com/presentation/18930887_142987930/image-24.jpg)
Ti 4+ Реакция с диантипирилметаном (ДАМ) Ti 4+ + 3 ДАМ = [Ti(ДАМ)3]4+

Реакция с H 2 O 2 Ti(SO 4)2 + H 2 O = H 4 Ti. O 5 + 2 H 2 SO 4 надтитановая кислота
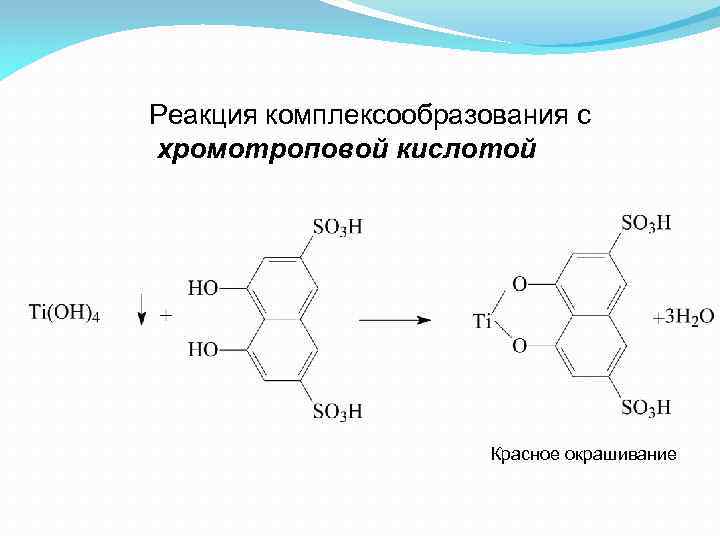
Реакция комплексообразования с хромотроповой кислотой Красное окрашивание
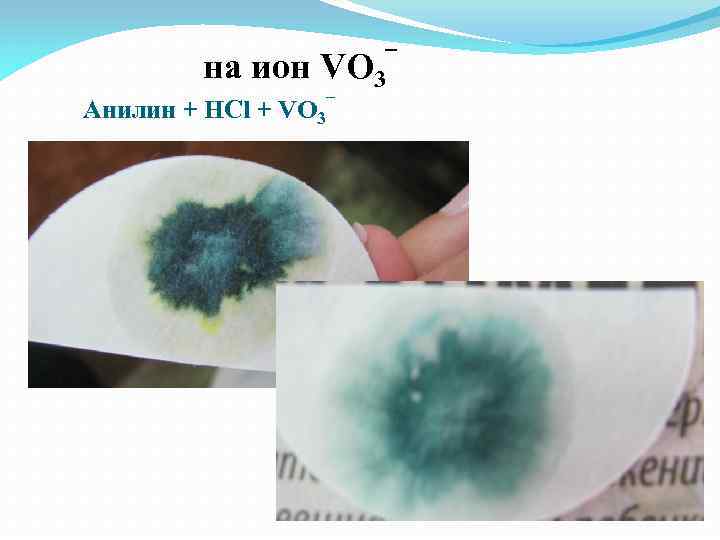
на ион VO 3¯ Анилин + HCl + VO 3¯

Образование надванадиевой кислоты HVO 4 Na. VO 3 + H 2 O 2 + HCl = HVO 4 + Na. Cl + H 2 O

Восстановление Мо 6+ 2(NH 4)2 Mo. O 4 + 3 Zn + 16 HCl = 2 Mo. Cl 3 + 3 Zn. Cl 2 + 4 NH 4 Cl + 8 H 2 O 2(NH 4)2 Mo. O 4 + 3 Sn. Cl 2 + 16 HCl = 2 Mo. Cl 3 + 3 Sn. Cl 4 + 4 NH 4 Cl + 8 H 2 O

Открытие Мо капельным методом 2(NH 4)2 Mo. O 4 + 12 HCl + Sn. Cl 2 + 10 NH 4 SCN = 2(NH 4)2[Mo. O(SCN)5] + Sn. Cl 4 + 6 H 2 O + 10 NH 4 Cl

Анионы BO 2 с образованием борнометиловым эфиром H 3 BO 3+ 3 CH 3 OH = B(OCH 3)3 +3 H 2 O
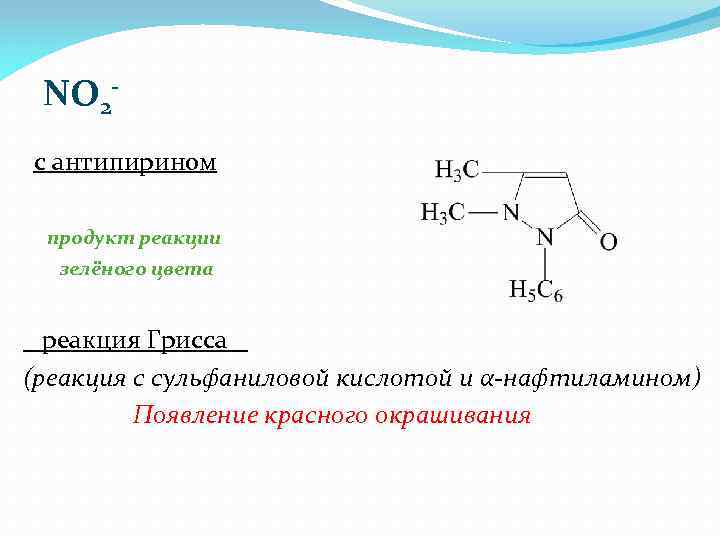
NO 2 с антипирином продукт реакции зелёного цвета реакция Грисса (реакция с сульфаниловой кислотой и α-нафтиламином) Появление красного окрашивания
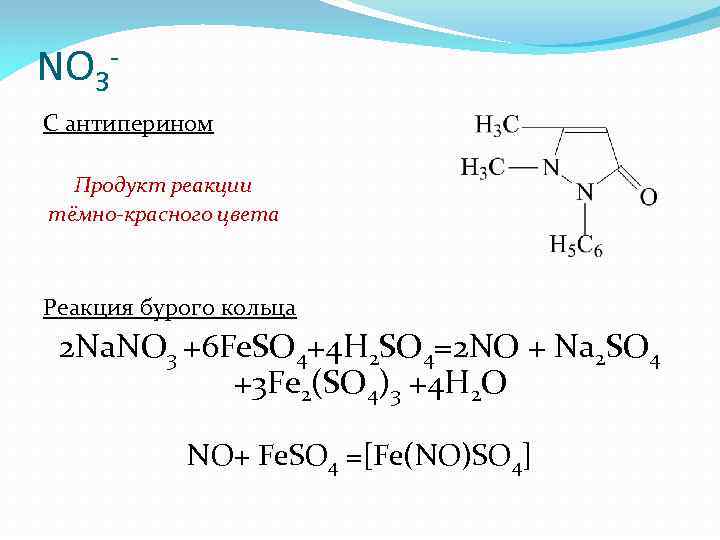
NO 3 С антиперином Продукт реакции тёмно-красного цвета Реакция бурого кольца 2 Na. NO 3 +6 Fe. SO 4+4 H 2 SO 4=2 NO + Na 2 SO 4 +3 Fe 2(SO 4)3 +4 H 2 O NO+ Fe. SO 4 =[Fe(NO)SO 4]

Спасибо за внимание !
Дробный анализ [Автосохраненный].pptx