фхма.доп.ppt
- Количество слайдов: 16
 Дополнительные главы аналитической химии Доцент, к. х. н. Нина Михайловна Якимова 1
Дополнительные главы аналитической химии Доцент, к. х. н. Нина Михайловна Якимова 1
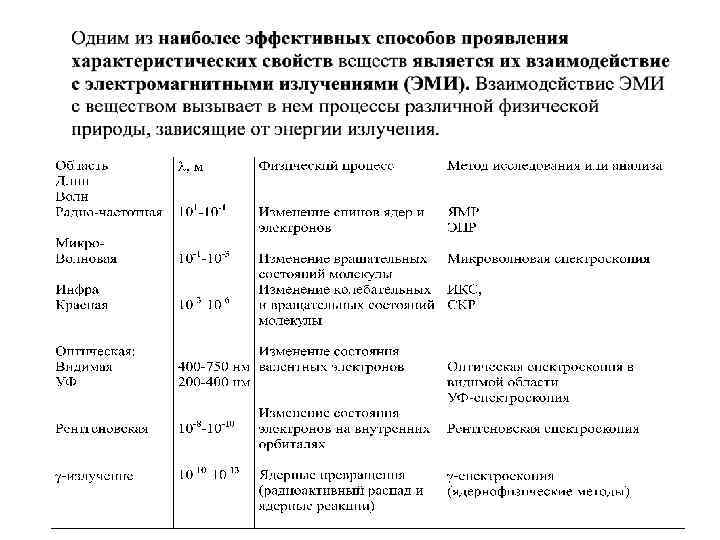
 Методы атомного спектрального анализа • Атомно-эмиссионный спектральный анализ • Атомно-абсорбционный спектральный анализ 3
Методы атомного спектрального анализа • Атомно-эмиссионный спектральный анализ • Атомно-абсорбционный спектральный анализ 3
 Переходы атома из одного энергетического состояния в другое при излучении или поглощении им кванта света. Ek Излучение Ei Nk Поглощение Ni ki = (Ek – Ei)/h ; ki = c/ Iem = Nk Aki h ki , где Aki - вероятность перехода с уровня k на уровень i С учетом влияния температуры: Закон Больцмана – закон распределения атомов по энергетическим уровням, т. е. по энергиям возбуждения: Nk = No gk/go. e-(Ek – Ei)/k. БT Iki = No. Aki. h ki gk/go. e-(Ek – Ei)/k. БT = acb Абсорбция –переход с i на k Iabs = Ni Bik h ik 4
Переходы атома из одного энергетического состояния в другое при излучении или поглощении им кванта света. Ek Излучение Ei Nk Поглощение Ni ki = (Ek – Ei)/h ; ki = c/ Iem = Nk Aki h ki , где Aki - вероятность перехода с уровня k на уровень i С учетом влияния температуры: Закон Больцмана – закон распределения атомов по энергетическим уровням, т. е. по энергиям возбуждения: Nk = No gk/go. e-(Ek – Ei)/k. БT Iki = No. Aki. h ki gk/go. e-(Ek – Ei)/k. БT = acb Абсорбция –переход с i на k Iabs = Ni Bik h ik 4
 Атомно-эмиссионная спектрометрия. Рассмотрим на примере эмиссионного спектра атомов натрия. После атомизации при сравнительно не высоких температурах все атомы в парах находятся на 3 S-уровне. При высокотемпературном возбуждении подвод избыточной энергии оказывается достаточным для перевода валентных электронов на любой из возбужденных уровней. Энергетические уровни валентных электронов атомов натрия 5 p 4 p 3 p 3 s 285, 90 330, 30 589, 59 285, 28 330, 28 589, 00 Простейший случай – перевод на два очень близких, различающихся только спинами 3 Р-уровня, с которых возбужденный электрон возвращается в свое нормальное состояние 3 s с испусканием (эмиссией) квантов ЭМИ соответствующих 589, 59 и 589, 00 нм. Испускаемое излучение и обеспечивает характеристический желтый цвет натриевого пламени.
Атомно-эмиссионная спектрометрия. Рассмотрим на примере эмиссионного спектра атомов натрия. После атомизации при сравнительно не высоких температурах все атомы в парах находятся на 3 S-уровне. При высокотемпературном возбуждении подвод избыточной энергии оказывается достаточным для перевода валентных электронов на любой из возбужденных уровней. Энергетические уровни валентных электронов атомов натрия 5 p 4 p 3 p 3 s 285, 90 330, 30 589, 59 285, 28 330, 28 589, 00 Простейший случай – перевод на два очень близких, различающихся только спинами 3 Р-уровня, с которых возбужденный электрон возвращается в свое нормальное состояние 3 s с испусканием (эмиссией) квантов ЭМИ соответствующих 589, 59 и 589, 00 нм. Испускаемое излучение и обеспечивает характеристический желтый цвет натриевого пламени.
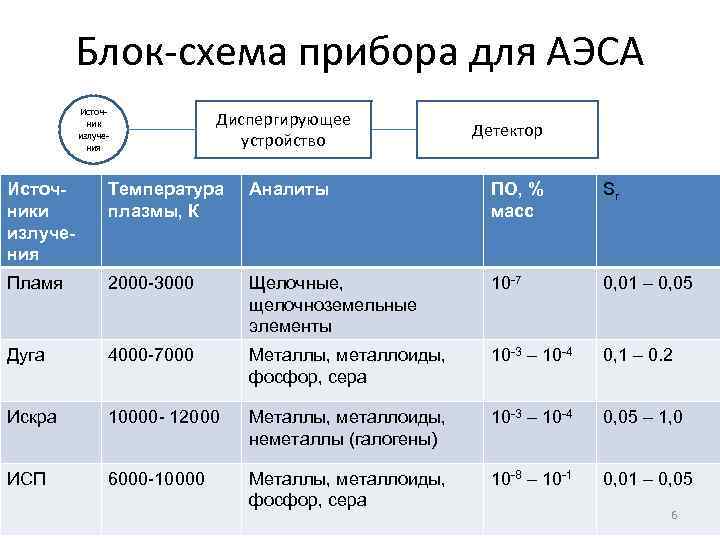 Блок-схема прибора для АЭСА Источник излучения Диспергирующее устройство Детектор Источники излучения Температура плазмы, К Аналиты ПО, % масс Sr Пламя 2000 -3000 Щелочные, щелочноземельные элементы 10 -7 0, 01 – 0, 05 Дуга 4000 -7000 Металлы, металлоиды, фосфор, сера 10 -3 – 10 -4 0, 1 – 0. 2 Искра 10000 - 12000 Металлы, металлоиды, неметаллы (галогены) 10 -3 – 10 -4 0, 05 – 1, 0 ИСП 6000 -10000 Металлы, металлоиды, фосфор, сера 10 -8 – 10 -1 0, 01 – 0, 05 6
Блок-схема прибора для АЭСА Источник излучения Диспергирующее устройство Детектор Источники излучения Температура плазмы, К Аналиты ПО, % масс Sr Пламя 2000 -3000 Щелочные, щелочноземельные элементы 10 -7 0, 01 – 0, 05 Дуга 4000 -7000 Металлы, металлоиды, фосфор, сера 10 -3 – 10 -4 0, 1 – 0. 2 Искра 10000 - 12000 Металлы, металлоиды, неметаллы (галогены) 10 -3 – 10 -4 0, 05 – 1, 0 ИСП 6000 -10000 Металлы, металлоиды, фосфор, сера 10 -8 – 10 -1 0, 01 – 0, 05 6
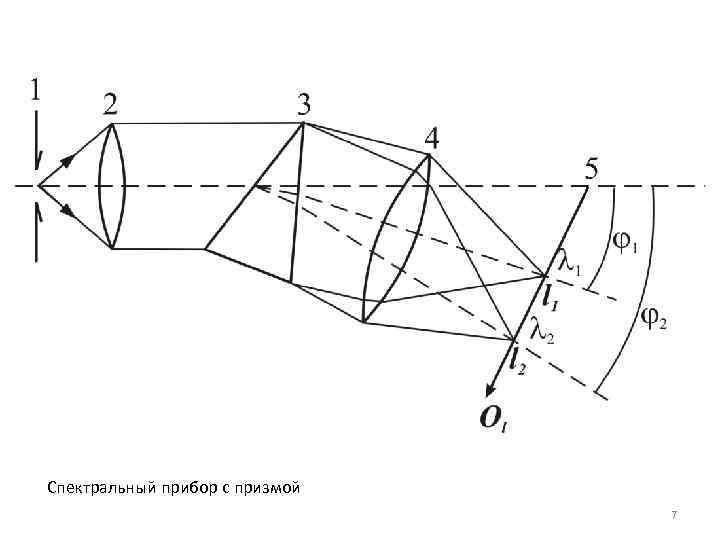 Спектральный прибор с призмой 7
Спектральный прибор с призмой 7
 Дифракция и интерференция параллельного пучка лучей на отражательной решетке: 1, 2, 3 - падающие лучи; 1 , 2 , 3 - дифрагированные лучи; - угол дифракции, - разность хода интерферирующих лучей в направлении . Принцип действия дифракционной решетки с профилированными штрихами. 8
Дифракция и интерференция параллельного пучка лучей на отражательной решетке: 1, 2, 3 - падающие лучи; 1 , 2 , 3 - дифрагированные лучи; - угол дифракции, - разность хода интерферирующих лучей в направлении . Принцип действия дифракционной решетки с профилированными штрихами. 8
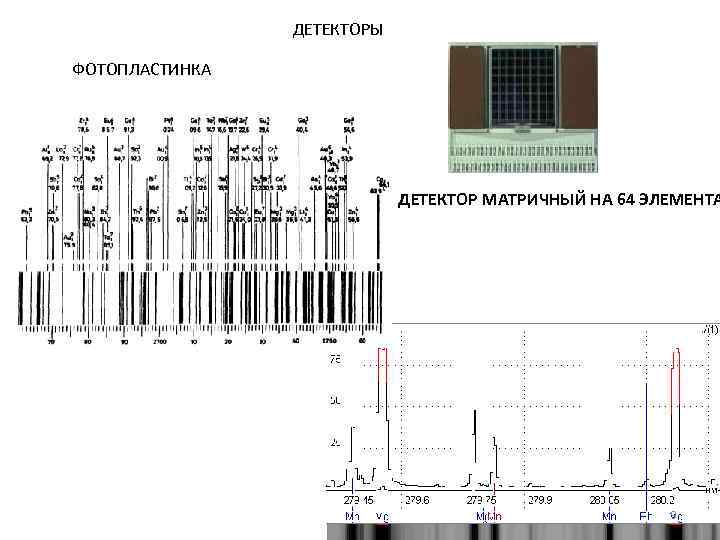 ДЕТЕКТОРЫ ФОТОПЛАСТИНКА ДЕТЕКТОР МАТРИЧНЫЙ НА 64 ЭЛЕМЕНТА 9
ДЕТЕКТОРЫ ФОТОПЛАСТИНКА ДЕТЕКТОР МАТРИЧНЫЙ НА 64 ЭЛЕМЕНТА 9
 Аналитическое применение АЭС: 1. Качественный анализ проб неизвестного состава 2. Полуколичественный анализ проб неизвестного состава 3. Количественный анализ Объекты анализа АЭСА • Твердые образцы: почвы, горные породы, промышленные материалы, пищевые продукты • Жидкие: природные, сточные воды, биологические жидкости, пищевые продукты • Газообразные: аэрозоли. 10
Аналитическое применение АЭС: 1. Качественный анализ проб неизвестного состава 2. Полуколичественный анализ проб неизвестного состава 3. Количественный анализ Объекты анализа АЭСА • Твердые образцы: почвы, горные породы, промышленные материалы, пищевые продукты • Жидкие: природные, сточные воды, биологические жидкости, пищевые продукты • Газообразные: аэрозоли. 10
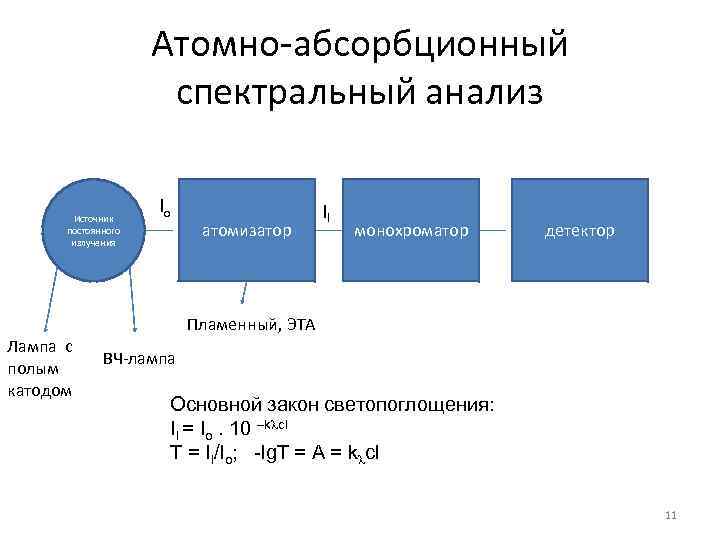 Атомно-абсорбционный спектральный анализ Источник постоянного излучения Io атомизатор Il монохроматор детектор Пламенный, ЭТА Лампа с полым катодом ВЧ-лампа Основной закон светопоглощения: Il = Io. 10 –k cl T = Il/Io; -lg. T = A = k cl 11
Атомно-абсорбционный спектральный анализ Источник постоянного излучения Io атомизатор Il монохроматор детектор Пламенный, ЭТА Лампа с полым катодом ВЧ-лампа Основной закон светопоглощения: Il = Io. 10 –k cl T = Il/Io; -lg. T = A = k cl 11
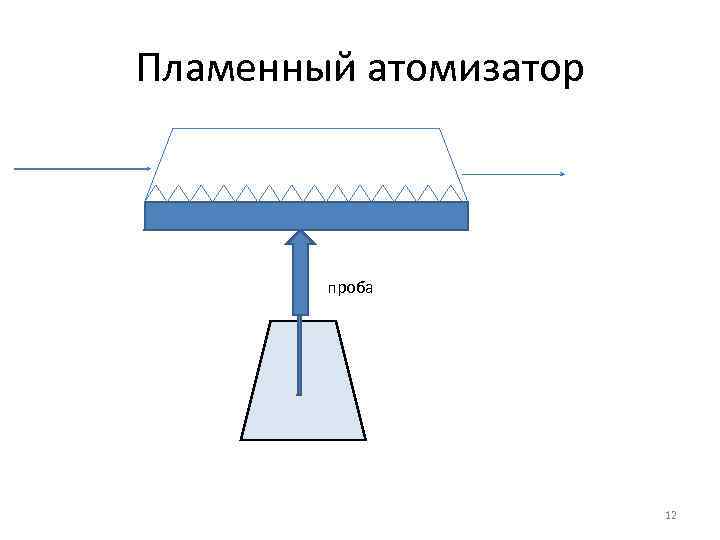 Пламенный атомизатор проба 12
Пламенный атомизатор проба 12
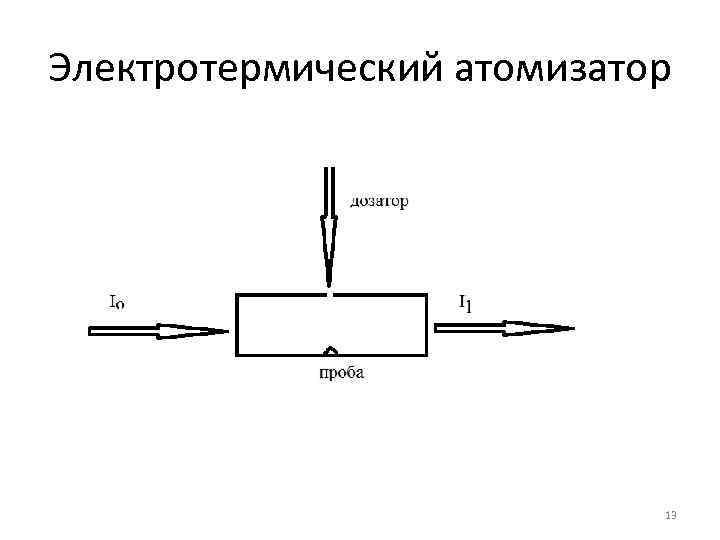 Электротермический атомизатор 13
Электротермический атомизатор 13
 Аналиты и объекты анализа • Пламенный атомизатор, ПО до 10 -7 г/л. Металлы в жидких образцах • ЭТА , ПО 10 -10 г/л. Металлы и металлоиды в жидких и твердых образцах. Объекты анализа: природные воды, биологические материалы, пищевые продукты 14
Аналиты и объекты анализа • Пламенный атомизатор, ПО до 10 -7 г/л. Металлы в жидких образцах • ЭТА , ПО 10 -10 г/л. Металлы и металлоиды в жидких и твердых образцах. Объекты анализа: природные воды, биологические материалы, пищевые продукты 14
 АТОМНО-ФЛУОРЕСЦЕНТНАЯ СПЕКТРОМЕТРИЯ (АФС) Следующий вариант метода атомной спектрометрии, основанный на излучательных переходах электронов на внешних орбиталях – АФС. Различия АЭС и АФС проявляются в способе перевода атомов в возбужденное состояние. В АЭС возбуждение атомов осуществляется за счет тепловой энергии. В АФС возбуждение производится от внешнего источника ЭМИ. Соответственно доля возбужденных атомов, определяющих величину аналитического сигнала, является функцией не температуры, как в АЭС, а интенсивности ЭМИ от внешнего источника.
АТОМНО-ФЛУОРЕСЦЕНТНАЯ СПЕКТРОМЕТРИЯ (АФС) Следующий вариант метода атомной спектрометрии, основанный на излучательных переходах электронов на внешних орбиталях – АФС. Различия АЭС и АФС проявляются в способе перевода атомов в возбужденное состояние. В АЭС возбуждение атомов осуществляется за счет тепловой энергии. В АФС возбуждение производится от внешнего источника ЭМИ. Соответственно доля возбужденных атомов, определяющих величину аналитического сигнала, является функцией не температуры, как в АЭС, а интенсивности ЭМИ от внешнего источника.
 АТОМНО-ФЛУОРЕСЦЕНТНАЯ СПЕКТРОМЕТРИЯ (АФС) Индуцируемое ЭМИ является люминесцентным. его интенсивность: I = 2, 3 Io fklc, где Io – интенсивность излучения внешнего источника; f – квантовый выход люминесценции, k – коэффициент поглощения, l – длина оптического пути, проходимого поглощаемым излучением в образце, С – концентрация излучающих частиц. Величины f, как правило, невелики и чтобы обеспечить достаточную чувствительность метода, необходимы источники излучения с максимальной Io. Поэтому метод оказывается конкурентноспособным только при лазерном возбуждении. В этом случае ПО АФС оказываются рекордными. Но главное достоинство АФС – высокая селективность. Самая высокаясреди методов атомной спектрометрии.
АТОМНО-ФЛУОРЕСЦЕНТНАЯ СПЕКТРОМЕТРИЯ (АФС) Индуцируемое ЭМИ является люминесцентным. его интенсивность: I = 2, 3 Io fklc, где Io – интенсивность излучения внешнего источника; f – квантовый выход люминесценции, k – коэффициент поглощения, l – длина оптического пути, проходимого поглощаемым излучением в образце, С – концентрация излучающих частиц. Величины f, как правило, невелики и чтобы обеспечить достаточную чувствительность метода, необходимы источники излучения с максимальной Io. Поэтому метод оказывается конкурентноспособным только при лазерном возбуждении. В этом случае ПО АФС оказываются рекордными. Но главное достоинство АФС – высокая селективность. Самая высокаясреди методов атомной спектрометрии.


