ДОНСКОЙ ГОСУДАРСТВЕННЫЙ













































Лекция 7. Общие и ЭХ свойства металлов.ppt
- Количество слайдов: 58
 ДОНСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКОЙ УНИВЕРСИТЕТ КАФЕДРА «ХИМИЯ» ЛЕКЦИЯ № 7 ПО КУРСУ «ХИМИЯ» ОБЩИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ. КОРРОЗИЯ. МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ 1
ДОНСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКОЙ УНИВЕРСИТЕТ КАФЕДРА «ХИМИЯ» ЛЕКЦИЯ № 7 ПО КУРСУ «ХИМИЯ» ОБЩИЕ И ЭЛЕКТРОХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ. КОРРОЗИЯ. МЕТОДЫ ЗАЩИТЫ МЕТАЛЛОВ ОТ КОРРОЗИИ 1
 2
2
 3
3
 4
4
 5
5
 6
6
 7
7
 8
8
 9
9
 10
10
 11
11
 12
12
 13
13
 14
14
 15
15
 16
16
 17
17
 ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li K Ba Sr Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb (H 2) Cu Hg Ag Pt Au Вывод: 1. Уменьшается восстановительные свойства металлов при реакциях в водных растворах в стандартных условиях (250 С, 1 атм. ); 2. Металл, стоящий левее, вытесняет металл, стоящий правее, из их солей в растворе; 3. Металлы, стоящие до водорода, вытесняют его из кислот в растворе (исключение HNO 3, Н 2 SO 4 конц. ); 4. Ме (до Al) + Н 2 О щелочь + Н 2 Ме (до Н 2) + Н 2 О оксид + Н 2 (жесткие условия) 18 Ме (после Н 2) + Н 2 О не реагируют
ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ МЕТАЛЛОВ Li K Ba Sr Ca Na Mg Al Zn Cr Fe Cd Co Ni Sn Pb (H 2) Cu Hg Ag Pt Au Вывод: 1. Уменьшается восстановительные свойства металлов при реакциях в водных растворах в стандартных условиях (250 С, 1 атм. ); 2. Металл, стоящий левее, вытесняет металл, стоящий правее, из их солей в растворе; 3. Металлы, стоящие до водорода, вытесняют его из кислот в растворе (исключение HNO 3, Н 2 SO 4 конц. ); 4. Ме (до Al) + Н 2 О щелочь + Н 2 Ме (до Н 2) + Н 2 О оксид + Н 2 (жесткие условия) 18 Ме (после Н 2) + Н 2 О не реагируют
 Взаимодействие металлов с кислотами l Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы «металл - ион металла» . Исходя из этого, все металлы удобно разделить на три условные группы: 19
Взаимодействие металлов с кислотами l Взаимодействие с металлами различных кислот протекает согласно положению металлов в ряду напряжений, который характеризует окислительно-восстановительную способность электрохимической системы «металл - ион металла» . Исходя из этого, все металлы удобно разделить на три условные группы: 19
 Взаимодействие металлов с кислотами-неокислителями Zn + H 2 SO 4 → Zn. SO 4 + H 2 Zn +2 HCI → Zn. CI 2 + H 2 Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют: Cu + HCl ¹ 20
Взаимодействие металлов с кислотами-неокислителями Zn + H 2 SO 4 → Zn. SO 4 + H 2 Zn +2 HCI → Zn. CI 2 + H 2 Малоактивные металлы, расположенные в ряду напряжений правее водорода, из разбавленного раствора кислоты его не вытесняют: Cu + HCl ¹ 20
 Взаимодействие металлов с концентрированной серной кислотой В результате взаимодействия образуются сульфат металла, вода и один из продуктов восстановления кислотного остатка: Zn + 2 H 2 SO 4(К) → Zn. SO 4 + SO 2 + 2 H 2 O, 4 Zn + 5 H 2 SO 4(К) → 4 Zn. SO 4 + H 2 S + 4 H 2 O, 3 Zn + 4 H 2 SO 4(К) → 3 Zn. SO 4 + S + 4 H 2 O, Сu + 2 H 2 SO 4(к) → Сu SO 4 + SO 2 + 2 H 2 O. Холодная концентрированная серная кислота пассивирует Al , Fe ; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой 21 протекает интенсивно.
Взаимодействие металлов с концентрированной серной кислотой В результате взаимодействия образуются сульфат металла, вода и один из продуктов восстановления кислотного остатка: Zn + 2 H 2 SO 4(К) → Zn. SO 4 + SO 2 + 2 H 2 O, 4 Zn + 5 H 2 SO 4(К) → 4 Zn. SO 4 + H 2 S + 4 H 2 O, 3 Zn + 4 H 2 SO 4(К) → 3 Zn. SO 4 + S + 4 H 2 O, Сu + 2 H 2 SO 4(к) → Сu SO 4 + SO 2 + 2 H 2 O. Холодная концентрированная серная кислота пассивирует Al , Fe ; при нагревании пассивирующие пленки растворяются, и взаимодействие с кислотой 21 протекает интенсивно.
 22
22
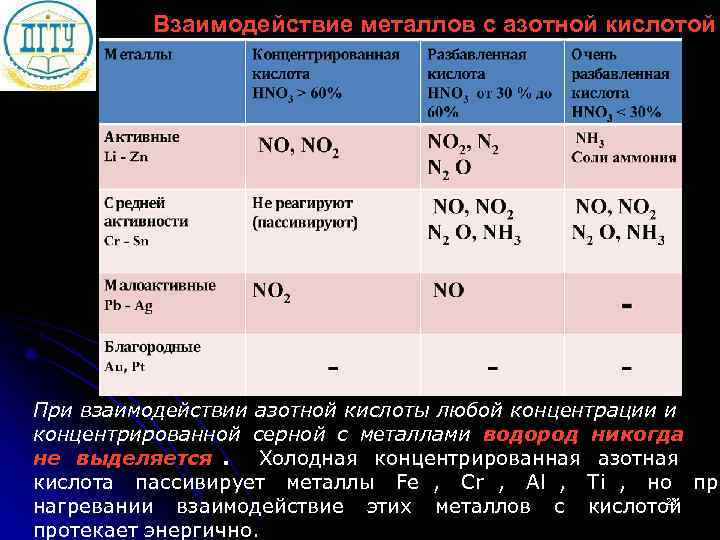
 Взаимодействие металлов с азотной кислотой При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется. Холодная концентрированная азотная кислота пассивирует металлы Fe , Cr , Al , Ti , но при нагревании взаимодействие этих металлов с кислотой 23 протекает энергично.
Взаимодействие металлов с азотной кислотой При взаимодействии азотной кислоты любой концентрации и концентрированной серной с металлами водород никогда не выделяется. Холодная концентрированная азотная кислота пассивирует металлы Fe , Cr , Al , Ti , но при нагревании взаимодействие этих металлов с кислотой 23 протекает энергично.
 24
24
 25
25
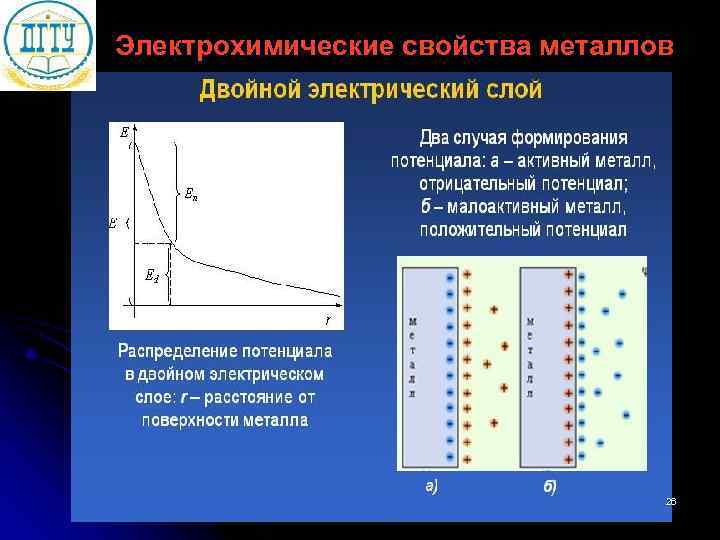
 Электрохимические свойства металлов 26
Электрохимические свойства металлов 26
 27
27
 l Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста: 28
l Перейдя от натуральных логарифмов к десятичным и подставив численные значения F, R и T = 298 K, получим удобную для расчетов форму уравнения Нернста: 28
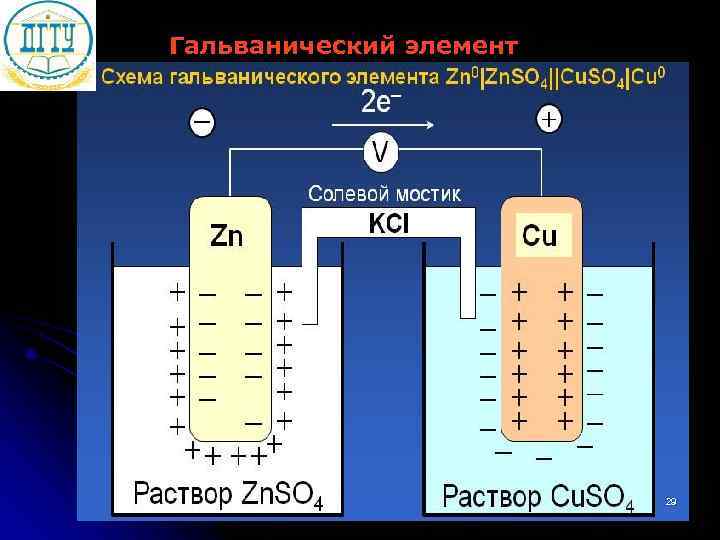
 Гальванический элемент 29
Гальванический элемент 29
 30
30
 31
31
 32
32
 33
33
 Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne 34
Растворимый анод (Cu, Ag, Ni, Cd) подвергается окислению Me =>Men+ +ne 34
 35
35
 36
36
 37
37
 Коррозия металлов l Коррозия - это процесс самопроизвольного разрушения металлов и сплавов под влиянием внешней среды (от лат. corrosio разъедание). 38
Коррозия металлов l Коррозия - это процесс самопроизвольного разрушения металлов и сплавов под влиянием внешней среды (от лат. corrosio разъедание). 38
 39
39
 40
40
 41
41
 42
42
 43
43
 44
44
 45
45
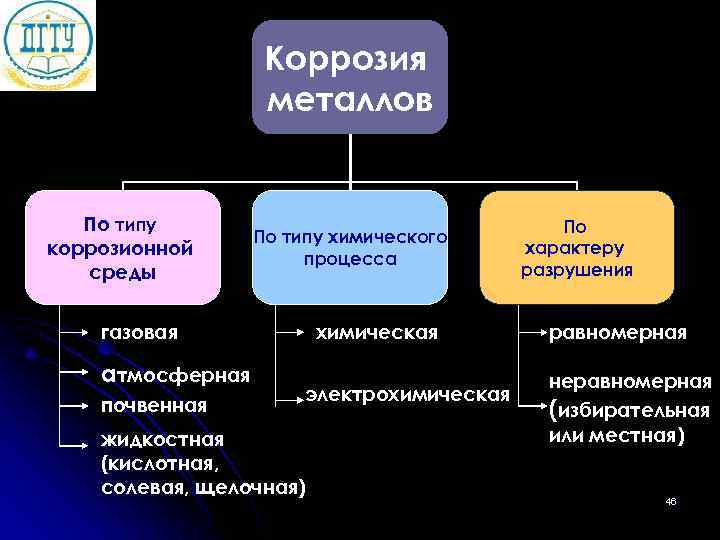
 Коррозия металлов По типу По типу химического коррозионной характеру процесса среды разрушения газовая химическая равномерная атмосферная неравномерная электрохимическая почвенная (избирательная жидкостная или местная) (кислотная, солевая, щелочная) 46
Коррозия металлов По типу По типу химического коррозионной характеру процесса среды разрушения газовая химическая равномерная атмосферная неравномерная электрохимическая почвенная (избирательная жидкостная или местная) (кислотная, солевая, щелочная) 46
 Химическая коррозия l Этот вид коррозии наблюдается в процессе обработки металлов при высоких температурах. l Протекают окислительно- восстановительные химические реакции. l Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные плёнки. Если плёнки прочные, плотные и хорошо связаны с металлом, то они защищают металл от дальнейшего разрушения ( у Zn, Al, Cr, Ni, Sn, Pb и др. ). Если плёнка рыхлая ( как у Fe), то она не защищает металл от дальнейшего разрушения. 47
Химическая коррозия l Этот вид коррозии наблюдается в процессе обработки металлов при высоких температурах. l Протекают окислительно- восстановительные химические реакции. l Большинство металлов окисляется кислородом воздуха, образуя на поверхности оксидные плёнки. Если плёнки прочные, плотные и хорошо связаны с металлом, то они защищают металл от дальнейшего разрушения ( у Zn, Al, Cr, Ni, Sn, Pb и др. ). Если плёнка рыхлая ( как у Fe), то она не защищает металл от дальнейшего разрушения. 47
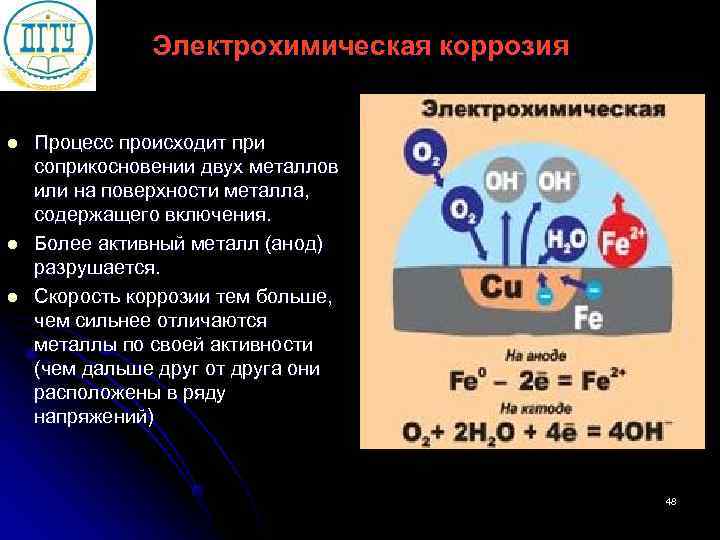
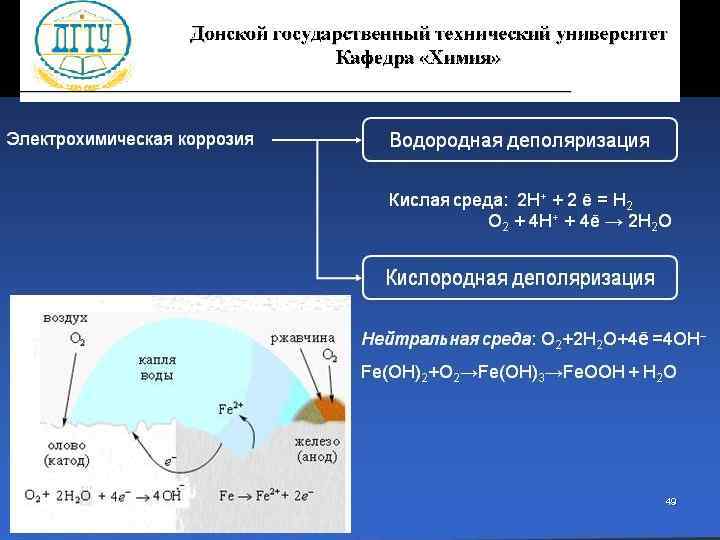
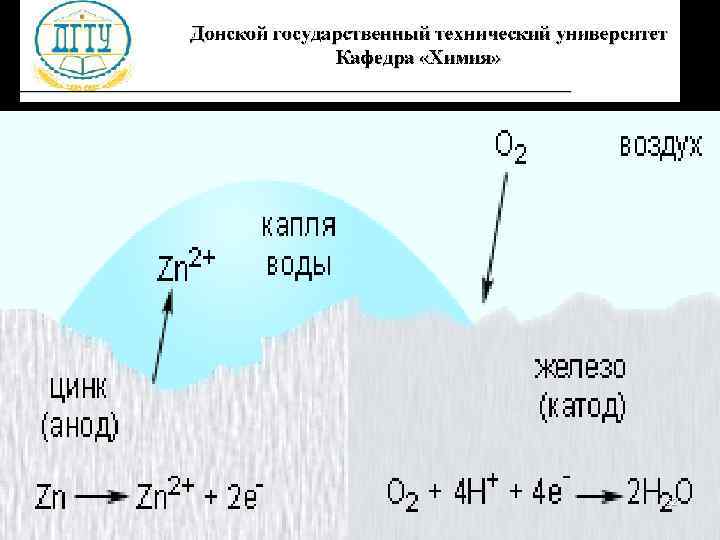
 Электрохимическая коррозия l Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения. l Более активный металл (анод) разрушается. l Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности (чем дальше друг от друга они расположены в ряду напряжений) 48
Электрохимическая коррозия l Процесс происходит при соприкосновении двух металлов или на поверхности металла, содержащего включения. l Более активный металл (анод) разрушается. l Скорость коррозии тем больше, чем сильнее отличаются металлы по своей активности (чем дальше друг от друга они расположены в ряду напряжений) 48
 49
49
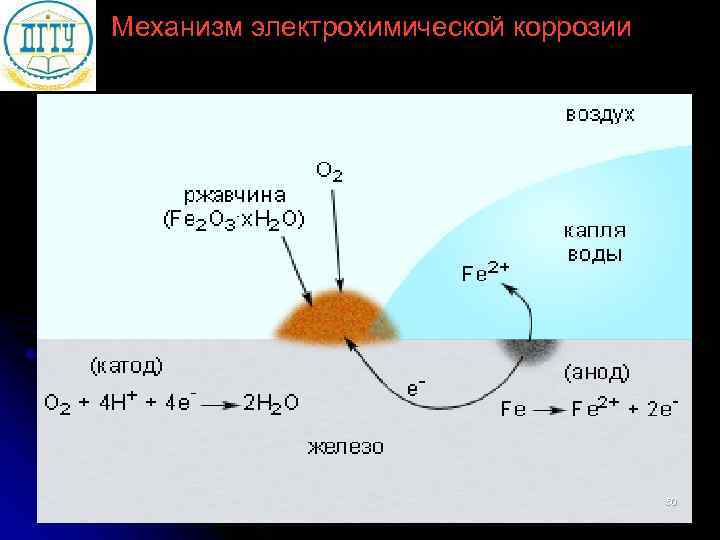
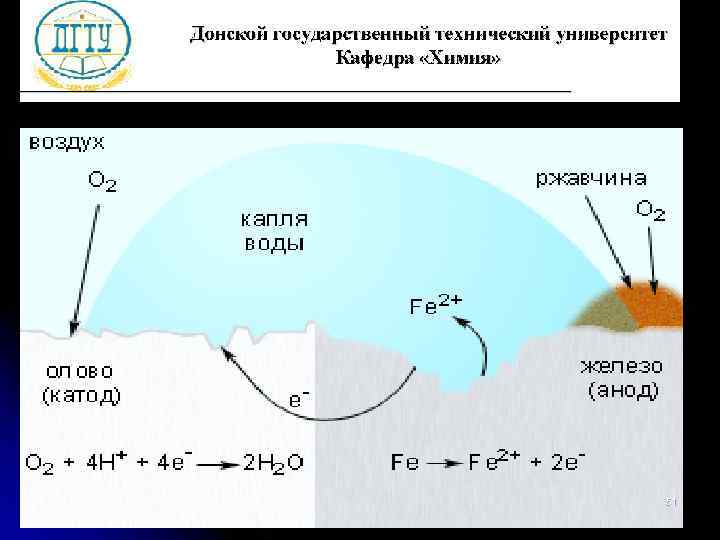
 Механизм электрохимической коррозии 50
Механизм электрохимической коррозии 50
 51
51
 52
52
 53
53
 54
54
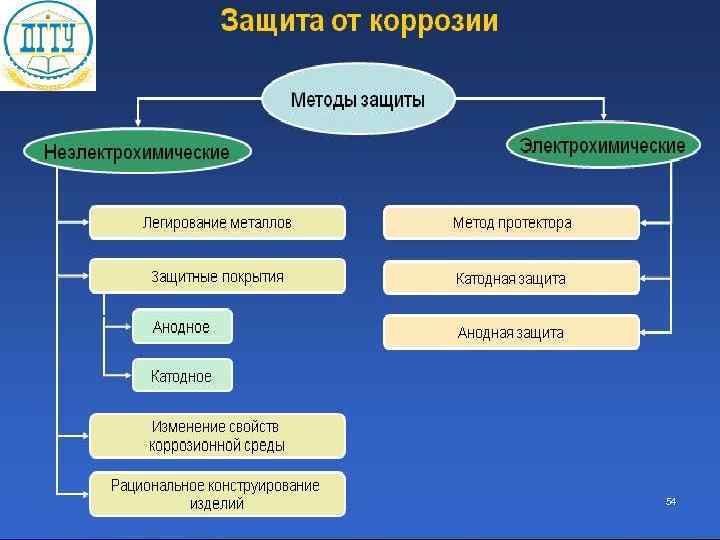
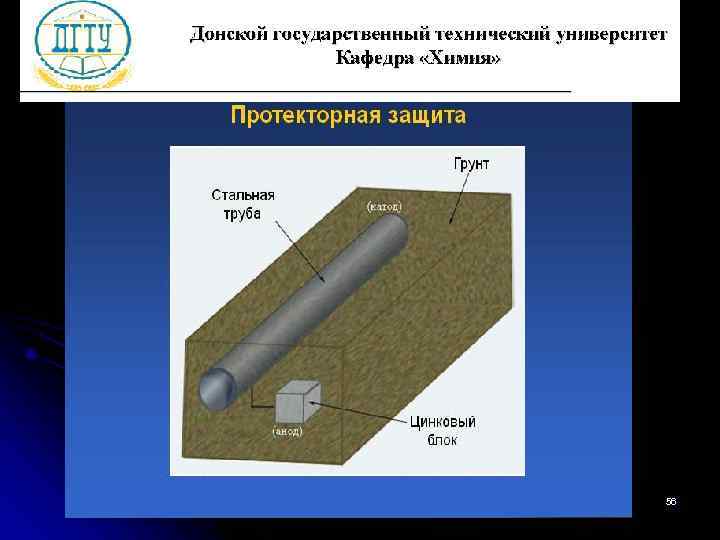
 Электрохимические методы защиты Катодная защита Металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность её анодного разрушения. Протекторная защита К защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита 55
Электрохимические методы защиты Катодная защита Металлоконструкцию подсоединяют к катоду внешнего источника тока, что исключает возможность её анодного разрушения. Протекторная защита К защищаемой металлической конструкции присоединяют кусок более активного металла (протектор), который служит анодом и разрушается в присутствии электролита 55
 56
56
 57
57
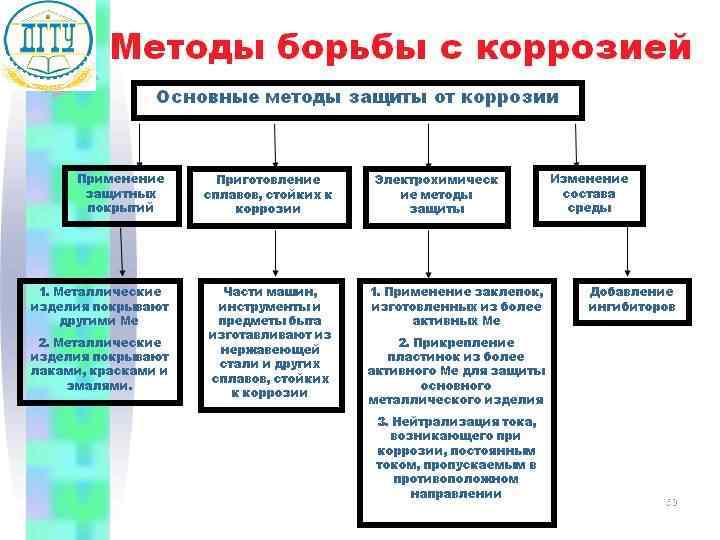
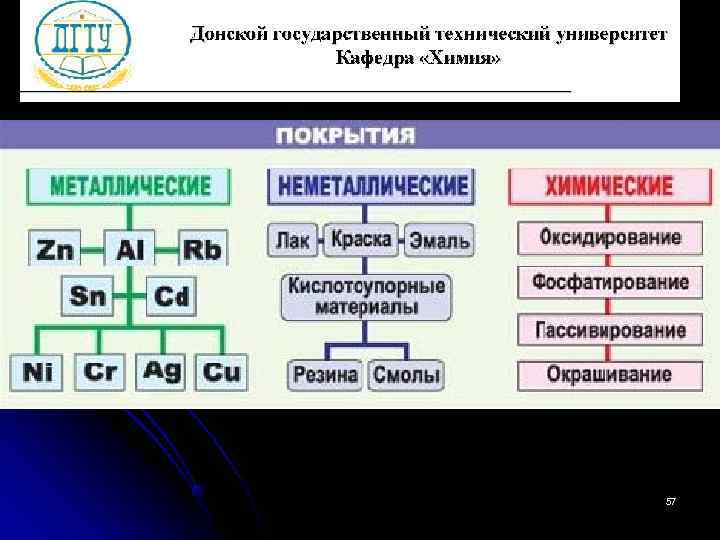
 Шлифование поверхностей изделия Поверхности шлифуют, чтобы на них не задерживалась влага. Применение легированных сплавов Они содержат специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой. Известны легированные стали – «нержавейки» , из которых Специальная обработка изготавливают предметы электролита или другой домашнего среды обихода, детали машин, Введение веществ ингибиторов, инструменты. замедляющих коррозию. 58
Шлифование поверхностей изделия Поверхности шлифуют, чтобы на них не задерживалась влага. Применение легированных сплавов Они содержат специальные добавки: хром, никель, которые при высокой температуре на поверхности металла образуют устойчивый оксидный слой. Известны легированные стали – «нержавейки» , из которых Специальная обработка изготавливают предметы электролита или другой домашнего среды обихода, детали машин, Введение веществ ингибиторов, инструменты. замедляющих коррозию. 58

