lecture_2_Domen.pptx
- Количество слайдов: 35
 Доменна організація ферментів Поняття про активний центр
Доменна організація ферментів Поняття про активний центр
 Доменна організація ферменту • Уперше були виділені Д. Філліпсом в 1936 р. при описі структури лізоциму у вигляді декількох компактних глобулярних блоків. • Подібні, але більш відособлені друг від друга структурні утворення були відзначені в імуноглобулінах Б. Каннінгхемом і співр. в 1971 р. Для характеристики тривимірних структур білків цієї групи ними була сформульована гіпотеза доменів у припущенні про незалежність генетичного контролю кожної структурно автономної області. • Доменна організація тривимірної структури була відзначена в 1972 р. Дж. Бірктофтом і Д. Блоу в α-хімотрипсину. Нативна конформація цього білка включає 2 домени, кожний з яких має циліндричну форму, утворену шестиланцюговою антипаралельною βструктурою. Такою ж топологією мають тривимірні структури еластази й трипсину, а також структури аспартатних протеїназ (пепсину).
Доменна організація ферменту • Уперше були виділені Д. Філліпсом в 1936 р. при описі структури лізоциму у вигляді декількох компактних глобулярних блоків. • Подібні, але більш відособлені друг від друга структурні утворення були відзначені в імуноглобулінах Б. Каннінгхемом і співр. в 1971 р. Для характеристики тривимірних структур білків цієї групи ними була сформульована гіпотеза доменів у припущенні про незалежність генетичного контролю кожної структурно автономної області. • Доменна організація тривимірної структури була відзначена в 1972 р. Дж. Бірктофтом і Д. Блоу в α-хімотрипсину. Нативна конформація цього білка включає 2 домени, кожний з яких має циліндричну форму, утворену шестиланцюговою антипаралельною βструктурою. Такою ж топологією мають тривимірні структури еластази й трипсину, а також структури аспартатних протеїназ (пепсину).
 Доменна організація ферменту • Це області в третинній структурі білка з певною структурною автономією; • Як правило, домени можуть незалежно від інших частин білкової молекули підтримувати й навіть формувати просторову структуру; • Вдається виділити домени за допомогою обмеженого протеолізу.
Доменна організація ферменту • Це області в третинній структурі білка з певною структурною автономією; • Як правило, домени можуть незалежно від інших частин білкової молекули підтримувати й навіть формувати просторову структуру; • Вдається виділити домени за допомогою обмеженого протеолізу.
 Доменна організація ферменту • Д. Уетлауфер пояснює існування доменів специфікою механізму мимовільного складання амінокислотної послідовності в нативну конформацію. • Він розрізняє 2 види доменів: з безперервним і з переривчастим поліпептидним ланцюгом. • Елементом, що цементує структуру домену, вважається ядро (нуклеація) з 8 - 18 залишків. Ядро служить матрицею для укладання поліпептидного ланцюга домену розміром в 40 - 150 амінокислотних залишків. Така організація домену забезпечує швидке спонтанне складання всієї структури білка.
Доменна організація ферменту • Д. Уетлауфер пояснює існування доменів специфікою механізму мимовільного складання амінокислотної послідовності в нативну конформацію. • Він розрізняє 2 види доменів: з безперервним і з переривчастим поліпептидним ланцюгом. • Елементом, що цементує структуру домену, вважається ядро (нуклеація) з 8 - 18 залишків. Ядро служить матрицею для укладання поліпептидного ланцюга домену розміром в 40 - 150 амінокислотних залишків. Така організація домену забезпечує швидке спонтанне складання всієї структури білка.
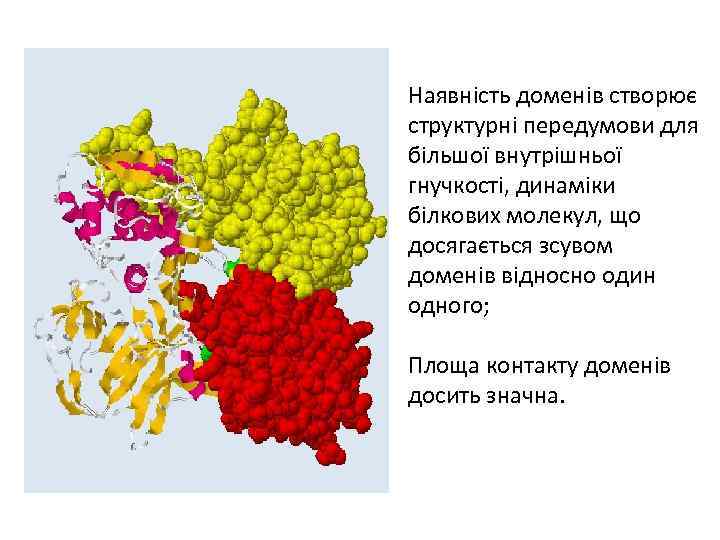 Наявність доменів створює структурні передумови для більшої внутрішньої гнучкості, динаміки білкових молекул, що досягається зсувом доменів відносно один одного; Площа контакту доменів досить значна.
Наявність доменів створює структурні передумови для більшої внутрішньої гнучкості, динаміки білкових молекул, що досягається зсувом доменів відносно один одного; Площа контакту доменів досить значна.
 Класифікація доменів За функціями - мінімальна частина поліпептидного ланцюга, яка: • достатня в експерименті для збереження однієї з активностей цілого білка • може автономно згорнутися в правильну, нативну структуру
Класифікація доменів За функціями - мінімальна частина поліпептидного ланцюга, яка: • достатня в експерименті для збереження однієї з активностей цілого білка • може автономно згорнутися в правильну, нативну структуру
 Derbyshire et al. , PNAS, 94, 1146611471(1997)“Genetic definition of a protein-splicing domain: Functional mini-inteins support structure predictions and a model for intein evolution” Рекомбіназа A з Mycobacterium tuberculosis (790 а. о. ) містить інтеїн (440 а. о. ) – мобільний елемент, що володіє здатністю автономно вирізатися з поліпептидного ланцюга (явище білкового сплайсинга) Інтеїн володіє також ендонуклеазною активністю
Derbyshire et al. , PNAS, 94, 1146611471(1997)“Genetic definition of a protein-splicing domain: Functional mini-inteins support structure predictions and a model for intein evolution” Рекомбіназа A з Mycobacterium tuberculosis (790 а. о. ) містить інтеїн (440 а. о. ) – мобільний елемент, що володіє здатністю автономно вирізатися з поліпептидного ланцюга (явище білкового сплайсинга) Інтеїн володіє також ендонуклеазною активністю
 Структура гомологічного білка Pi-scei – хомінг ендонуклеази із дріжджів (PDB код 1 VDE) Ендонуклеаза 186 -405 ІнтеЇн 1 -181, 416 -454
Структура гомологічного білка Pi-scei – хомінг ендонуклеази із дріжджів (PDB код 1 VDE) Ендонуклеаза 186 -405 ІнтеЇн 1 -181, 416 -454
 Класифікація доменів • За структурою Відособлена в просторі частина білка, його структурна одиниця, що має: • порівняно мало контактів з іншими частинами білка • власне гідрофобне ядро
Класифікація доменів • За структурою Відособлена в просторі частина білка, його структурна одиниця, що має: • порівняно мало контактів з іншими частинами білка • власне гідрофобне ядро
 У полімеразах звичайно визначають три домени: fingers, palm, thumb Product RNA Fingers Template RNA Thumb NTP Palm
У полімеразах звичайно визначають три домени: fingers, palm, thumb Product RNA Fingers Template RNA Thumb NTP Palm
 На чому базуються методи виокремлення доменів • Домен має власне гідрофобне ядро (приклад: алгоритм DETECTIVE Swindells, 1995) • Домен – це частина білка, усередині якої багато контактів амінокислотних залишків, а між доменами – мало контактів (приклад: алгоритм DOMAK, Siddiqui&Barton, 1995)
На чому базуються методи виокремлення доменів • Домен має власне гідрофобне ядро (приклад: алгоритм DETECTIVE Swindells, 1995) • Домен – це частина білка, усередині якої багато контактів амінокислотних залишків, а між доменами – мало контактів (приклад: алгоритм DOMAK, Siddiqui&Barton, 1995)
 Доменна організація ферменту Домени у структурі ферменту можуть бути однакової чи різної будови Н. : хімотрипсин – однакова структура доменів; папаїн - домени мають різну структуру: один містить тільки αспіралі, а інший - переважно βструктури. Однак у доменізації папаїну вторинні структури не відіграють істотної ролі, оскільки вміст α-спіралей (дуже неправильних) у білку не перевищує 20%, а β-структур - не набагато більше 10%.
Доменна організація ферменту Домени у структурі ферменту можуть бути однакової чи різної будови Н. : хімотрипсин – однакова структура доменів; папаїн - домени мають різну структуру: один містить тільки αспіралі, а інший - переважно βструктури. Однак у доменізації папаїну вторинні структури не відіграють істотної ролі, оскільки вміст α-спіралей (дуже неправильних) у білку не перевищує 20%, а β-структур - не набагато більше 10%.
 Доменна організація ферменту Окремі домени складних білків кодуються різними екзонами. Н. : у складі гена трьохдоменної піруваткінази є ділянка, що відповідає довготривалій паузі в трансляції амінокислотної послідовності. Припускають, що подібні паузи необхідні для забезпечення правильного складання мультидоменних білків.
Доменна організація ферменту Окремі домени складних білків кодуються різними екзонами. Н. : у складі гена трьохдоменної піруваткінази є ділянка, що відповідає довготривалій паузі в трансляції амінокислотної послідовності. Припускають, що подібні паузи необхідні для забезпечення правильного складання мультидоменних білків.
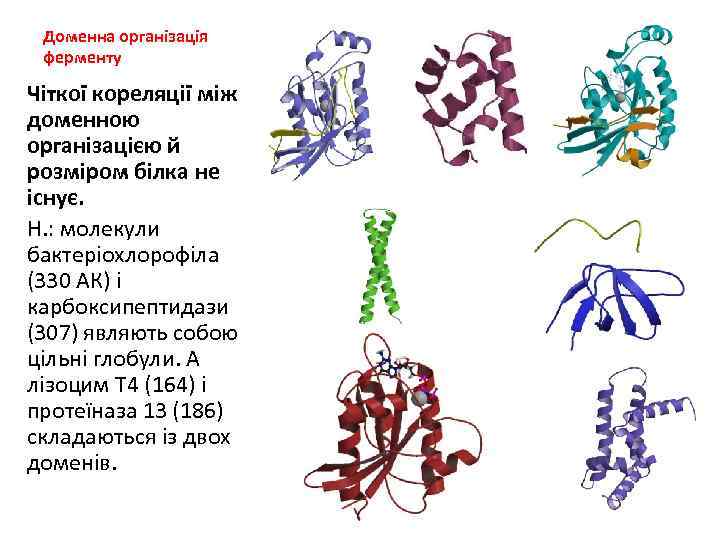 Доменна організація ферменту Чіткої кореляції між доменною організацією й розміром білка не існує. Н. : молекули бактеріохлорофіла (330 АК) і карбоксипептидази (307) являють собою цільні глобули. А лізоцим Т 4 (164) і протеїназа 13 (186) складаються із двох доменів.
Доменна організація ферменту Чіткої кореляції між доменною організацією й розміром білка не існує. Н. : молекули бактеріохлорофіла (330 АК) і карбоксипептидази (307) являють собою цільні глобули. А лізоцим Т 4 (164) і протеїназа 13 (186) складаються із двох доменів.
 Доменна організація ферменту Відсутній який-небудь зв'язок між доменною організацією й вмістом у білку вторинних структур. Н. : Відомі домени, у яких альфа-спіралі й бетаструктури складають близько 50% (термолізин), і домени, у яких вони взагалі відсутні (центральний домен з 200 залишків тирозинт. РНК-синтетази).
Доменна організація ферменту Відсутній який-небудь зв'язок між доменною організацією й вмістом у білку вторинних структур. Н. : Відомі домени, у яких альфа-спіралі й бетаструктури складають близько 50% (термолізин), і домени, у яких вони взагалі відсутні (центральний домен з 200 залишків тирозинт. РНК-синтетази).
 Доменна організація ферменту Часто структурна автономія доповнюється функціональною. Н. : нуклеотид-зв’язуючий домен дегідрогеназ, що має незалежно від конкретної функції того або іншого ферменту однаковий спосіб укладання поліпептидного ланцюга, відповідає за взаємодію з одним із субстратів реакції - коферментом NAD або NADH. Амінокінцеві домени (крингли) ферментів системи згортання крові забезпечують зв'язування з ліпідами мембран і іншими білками. Амінокінцеві домени імуноглобулінів формують центр Третинна структура одного з доменів зв'язування антигену. протромбіну. При активації цей домен - перший крингл (залишки 66 -144) - забезпечує зв'язування протромбіну з фосфоліпідом.
Доменна організація ферменту Часто структурна автономія доповнюється функціональною. Н. : нуклеотид-зв’язуючий домен дегідрогеназ, що має незалежно від конкретної функції того або іншого ферменту однаковий спосіб укладання поліпептидного ланцюга, відповідає за взаємодію з одним із субстратів реакції - коферментом NAD або NADH. Амінокінцеві домени (крингли) ферментів системи згортання крові забезпечують зв'язування з ліпідами мембран і іншими білками. Амінокінцеві домени імуноглобулінів формують центр Третинна структура одного з доменів зв'язування антигену. протромбіну. При активації цей домен - перший крингл (залишки 66 -144) - забезпечує зв'язування протромбіну з фосфоліпідом.
 Доменна організація ферменту У ряді випадків для доменів не можна вказати окремої функціональної ролі Н. : у структурі папаїну добре помітно два домени. У западині, що розділяє домени, розташований каталітичний центр, причому утворюючі його функціональні групи розміщені в обох доменах (cys-25, his-159, asn-175). Домени в структурі папаїну. Переривчастими лініями намічений напрямок западини між двома доменами, у якій зв'язується субстрат і розміщений каталітичний центр. Дисульфідні зв'язки заштриховані
Доменна організація ферменту У ряді випадків для доменів не можна вказати окремої функціональної ролі Н. : у структурі папаїну добре помітно два домени. У западині, що розділяє домени, розташований каталітичний центр, причому утворюючі його функціональні групи розміщені в обох доменах (cys-25, his-159, asn-175). Домени в структурі папаїну. Переривчастими лініями намічений напрямок западини між двома доменами, у якій зв'язується субстрат і розміщений каталітичний центр. Дисульфідні зв'язки заштриховані
 Доменна організація білка Припускають, що домени відповідають ранньому етапу еволюції просторової структури багатьох білків, що утворювалися із глобул суттєво меншого розміру. Н. : незвичайно маленька протеїназа вірусу імунодефіциту людину (ВІЛ), пептидний ланцюг якої складається всього лише з 99 АК, по способу згортання схожа на домени пепсину - протеїнази, що діє по подібному механізму. Оскільки протеїназа ВІЛ активна тільки як димер, можна припускати, що вона еволюційно споріднена якомусь прадавньому попередникові доменів пепсину.
Доменна організація білка Припускають, що домени відповідають ранньому етапу еволюції просторової структури багатьох білків, що утворювалися із глобул суттєво меншого розміру. Н. : незвичайно маленька протеїназа вірусу імунодефіциту людину (ВІЛ), пептидний ланцюг якої складається всього лише з 99 АК, по способу згортання схожа на домени пепсину - протеїнази, що діє по подібному механізму. Оскільки протеїназа ВІЛ активна тільки як димер, можна припускати, що вона еволюційно споріднена якомусь прадавньому попередникові доменів пепсину.
 Спільна топологія у двох доменів характеризується Вирівнюванням елементів вторинної структури при якому: • зіставлені елементи вторинної структури однаково контактують у просторі між собою • є схожим взаємне розташування елементів вторинної структури.
Спільна топологія у двох доменів характеризується Вирівнюванням елементів вторинної структури при якому: • зіставлені елементи вторинної структури однаково контактують у просторі між собою • є схожим взаємне розташування елементів вторинної структури.
 Каталаза (C-кінцевий домен) Флаводоксин Загальне укладання (фолд). Гарне суміщення поліпептидних ланцюгів неможливо, але щось спільне в розташуванні елементів вторинної структури прослідковується… Говорять: “спільна топологія”
Каталаза (C-кінцевий домен) Флаводоксин Загальне укладання (фолд). Гарне суміщення поліпептидних ланцюгів неможливо, але щось спільне в розташуванні елементів вторинної структури прослідковується… Говорять: “спільна топологія”
 Вторинна структура C-кінцевого домена Каталази 1 CFG Вторинна структура флаводоксина 1 AG 9
Вторинна структура C-кінцевого домена Каталази 1 CFG Вторинна структура флаводоксина 1 AG 9
 Активний центр • Це частина білкової молекули, що сполучається з субстратом чи кофактором, від якої залежать ферментативні властивості (специфічність, каталітична активність) • Концепція численної спорідненості – в активному центрі міститься кілька активних зон
Активний центр • Це частина білкової молекули, що сполучається з субстратом чи кофактором, від якої залежать ферментативні властивості (специфічність, каталітична активність) • Концепція численної спорідненості – в активному центрі міститься кілька активних зон
 Активний центр • Містить не менше 2 -х ділянок Каталітично активний центр – функціональні групи, що безпосередньо беруть участь у каталізі Контактна (якірна, адсорбційна) ділянка – забезпечує певне стеричне розміщення субстрату відносно активного центру – визначає специфічність ферменту
Активний центр • Містить не менше 2 -х ділянок Каталітично активний центр – функціональні групи, що безпосередньо беруть участь у каталізі Контактна (якірна, адсорбційна) ділянка – забезпечує певне стеричне розміщення субстрату відносно активного центру – визначає специфічність ферменту
 Активний центр Додатково виділяють: • Допоміжні групи – функціональні групи, які зближені з активним центром і безпосередньо впливають на реакційну здатність функціональних груп ферменту • Сприяючі групи – знаходяться далеко від активного центру, відповідають за нативну конформацію ферменту
Активний центр Додатково виділяють: • Допоміжні групи – функціональні групи, які зближені з активним центром і безпосередньо впливають на реакційну здатність функціональних груп ферменту • Сприяючі групи – знаходяться далеко від активного центру, відповідають за нативну конформацію ферменту
 Місцезнаходження активного центру Стандартні впадини в архітектурах білкових глобул часто визначають місцеположення (не функцію!) активного центру. Ліворуч: активний центр (active site) у впадині при верхівці b/ aбочки з паралельним bциліндром; Праворуч: активний центр у щілині (crevice), що утворюється в укладці Россманна в місці розходження правих b-a-b суперспіралей, що йдуть у різні сторони (у суперспіралі b 1 -a-b 2 ланцюг іде від нас, у суперспіралі b 4 -a-b 5 — до нас).
Місцезнаходження активного центру Стандартні впадини в архітектурах білкових глобул часто визначають місцеположення (не функцію!) активного центру. Ліворуч: активний центр (active site) у впадині при верхівці b/ aбочки з паралельним bциліндром; Праворуч: активний центр у щілині (crevice), що утворюється в укладці Россманна в місці розходження правих b-a-b суперспіралей, що йдуть у різні сторони (у суперспіралі b 1 -a-b 2 ланцюг іде від нас, у суперспіралі b 4 -a-b 5 — до нас).
 Місцезнаходження активного центру Також звичайним місцем активного центру є місце стику доменів. Н. : положення активного центру в серинових протеазах типу трипсину. Показані частини активного центру: каталітичного центру, де виділені бічні групи "тріади переносу заряду" — Ser 195 (жовтогарячий), His 57 (синій) і Asp 102 (малиновий), і якірної ділянки, де зеленим зображені Nh-Групи, що утворюють оксианіонну діру, блакитним — неспецифічна субстрат-з’єднуючий майданчик, і жовтим - групи, що вистилають специфічний субстратз’єднуючу кишеню.
Місцезнаходження активного центру Також звичайним місцем активного центру є місце стику доменів. Н. : положення активного центру в серинових протеазах типу трипсину. Показані частини активного центру: каталітичного центру, де виділені бічні групи "тріади переносу заряду" — Ser 195 (жовтогарячий), His 57 (синій) і Asp 102 (малиновий), і якірної ділянки, де зеленим зображені Nh-Групи, що утворюють оксианіонну діру, блакитним — неспецифічна субстрат-з’єднуючий майданчик, і жовтим - групи, що вистилають специфічний субстратз’єднуючу кишеню.
 Активний центр 1. У структуру активного центру входять групи, що знаходяться віддалено у поліпептидному ланцюзі. Додатково може містити іони металів, молекули води, тощо Н. : хімотрипсин – 195, 57, 102 2. Характеризується щілинною будовою, як правило, між доменами 3. Щілинна будова забезпечує поєднання гідрофільних та гідрофобних груп в межах однієї структури
Активний центр 1. У структуру активного центру входять групи, що знаходяться віддалено у поліпептидному ланцюзі. Додатково може містити іони металів, молекули води, тощо Н. : хімотрипсин – 195, 57, 102 2. Характеризується щілинною будовою, як правило, між доменами 3. Щілинна будова забезпечує поєднання гідрофільних та гідрофобних груп в межах однієї структури
 Активний центр 4. Щілинна будова дозволяє регулювати активність ферментів зміною конформації 5. Є закритим від зовнішього впливу завдяки мікросфері. Особливості мікросфери: Мікрогетерогенність активного центру пов’язана з тим, що поверхня білкової молекули не повністю гідрофільна Н. : хімотрипсин – у поверхневому шарі 10 Ley, 10 Val, 10 Ile, 6 Phe Тому можлива взаємодія між субстратом і активним центром
Активний центр 4. Щілинна будова дозволяє регулювати активність ферментів зміною конформації 5. Є закритим від зовнішього впливу завдяки мікросфері. Особливості мікросфери: Мікрогетерогенність активного центру пов’язана з тим, що поверхня білкової молекули не повністю гідрофільна Н. : хімотрипсин – у поверхневому шарі 10 Ley, 10 Val, 10 Ile, 6 Phe Тому можлива взаємодія між субстратом і активним центром
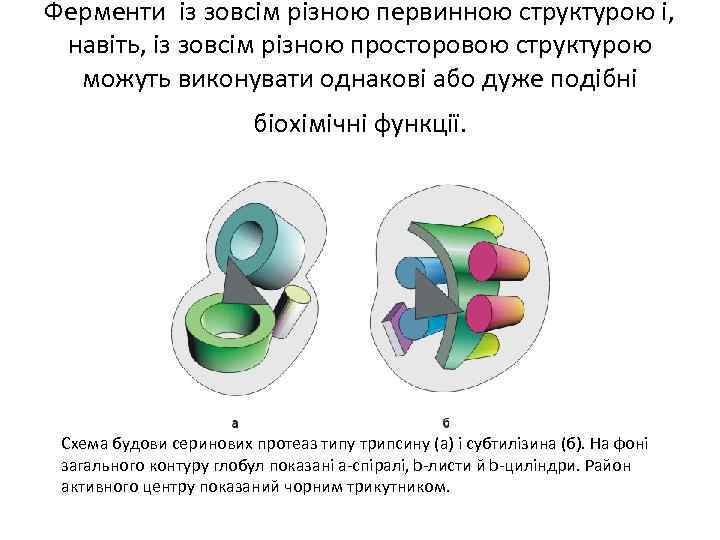 Ферменти із зовсім різною первинною структурою і, навіть, із зовсім різною просторовою структурою можуть виконувати однакові або дуже подібні біохімічні функції. Схема будови серинових протеаз типу трипсину (а) і субтилізина (б). На фоні загального контуру глобул показані a-спіралі, b-листи й b-циліндри. Район активного центру показаний чорним трикутником.
Ферменти із зовсім різною первинною структурою і, навіть, із зовсім різною просторовою структурою можуть виконувати однакові або дуже подібні біохімічні функції. Схема будови серинових протеаз типу трипсину (а) і субтилізина (б). На фоні загального контуру глобул показані a-спіралі, b-листи й b-циліндри. Район активного центру показаний чорним трикутником.
 Схема будови каталітичних центрів серинових протеаз типу трипсину (а) і субтилізина (б). Чорним виділені фрагменти головного ланцюга; напрямок ходу ланцюга в цих фрагментах показаний стрілками. Кружком показане місце оксианіонової діри. Видно, що тільки розташування кінців бічних груп каталітичної тріади переносу заряду (Ser, His, Asp) і — з натяжкою — положення оксианіонової діри інваріантне в цих двох класах серинових протеаз, у той час як кардинальні відмінності спостерігаються навіть у ході головного ланцюга в ключових каталітичних залишків His і Asp.
Схема будови каталітичних центрів серинових протеаз типу трипсину (а) і субтилізина (б). Чорним виділені фрагменти головного ланцюга; напрямок ходу ланцюга в цих фрагментах показаний стрілками. Кружком показане місце оксианіонової діри. Видно, що тільки розташування кінців бічних груп каталітичної тріади переносу заряду (Ser, His, Asp) і — з натяжкою — положення оксианіонової діри інваріантне в цих двох класах серинових протеаз, у той час як кардинальні відмінності спостерігаються навіть у ході головного ланцюга в ключових каталітичних залишків His і Asp.
 Классы Основные • Альфа-спиральные домены (202 фолда) • Бета-структурные домены (141) • Альфа/бета структурные домены (a/b) (бета-альфа-бета структурные единицы) (130) • Альфа+бета домены (a+b) (260) (разделенные альфа спиральные и бета-структурные области)
Классы Основные • Альфа-спиральные домены (202 фолда) • Бета-структурные домены (141) • Альфа/бета структурные домены (a/b) (бета-альфа-бета структурные единицы) (130) • Альфа+бета домены (a+b) (260) (разделенные альфа спиральные и бета-структурные области)
 Специфические • Многодоменные белки (сложные домены) (40) • Мембранные (кроме белков иммунной системы) (42) • Маленькие (72) Формально собранные классы Спирализованные спирали (6) Низкое разрешение (22) Пептиды, фрагменты (111) Искусственные белки (41)
Специфические • Многодоменные белки (сложные домены) (40) • Мембранные (кроме белков иммунной системы) (42) • Маленькие (72) Формально собранные классы Спирализованные спирали (6) Низкое разрешение (22) Пептиды, фрагменты (111) Искусственные белки (41)
 Специфические • Многодоменные белки (сложные домены) (40) • Мембранные (кроме белков иммунной системы) (42) • Маленькие (72) Формально собранные классы Спирализованные спирали (6) Низкое разрешение (22) Пептиды, фрагменты (111) Искусственные белки (41)
Специфические • Многодоменные белки (сложные домены) (40) • Мембранные (кроме белков иммунной системы) (42) • Маленькие (72) Формально собранные классы Спирализованные спирали (6) Низкое разрешение (22) Пептиды, фрагменты (111) Искусственные белки (41)
 Разница между a/b и a+b a/b: - Спирали и тяжи вместе образуют глобулу -Часто спираль соединяет два тяжа как показано на рис. ниже 1 TPH Triosephosphate isomerase from Chicken (Gallus gallus) 1 TPH
Разница между a/b и a+b a/b: - Спирали и тяжи вместе образуют глобулу -Часто спираль соединяет два тяжа как показано на рис. ниже 1 TPH Triosephosphate isomerase from Chicken (Gallus gallus) 1 TPH
 Разница между a+b и a/b a+b: - Спирали и тяжи более или менее разобщены - Часто спирали образуют свое маленькое ядро - Мотивы - - как на предыдущем слайде встречаются редко 2 ACT. ACTINIDIN (SULFHYDRYL PROTEINASE)
Разница между a+b и a/b a+b: - Спирали и тяжи более или менее разобщены - Часто спирали образуют свое маленькое ядро - Мотивы - - как на предыдущем слайде встречаются редко 2 ACT. ACTINIDIN (SULFHYDRYL PROTEINASE)


