 Домашнее задание В 5
Домашнее задание В 5
 Вариант № 3
Вариант № 3
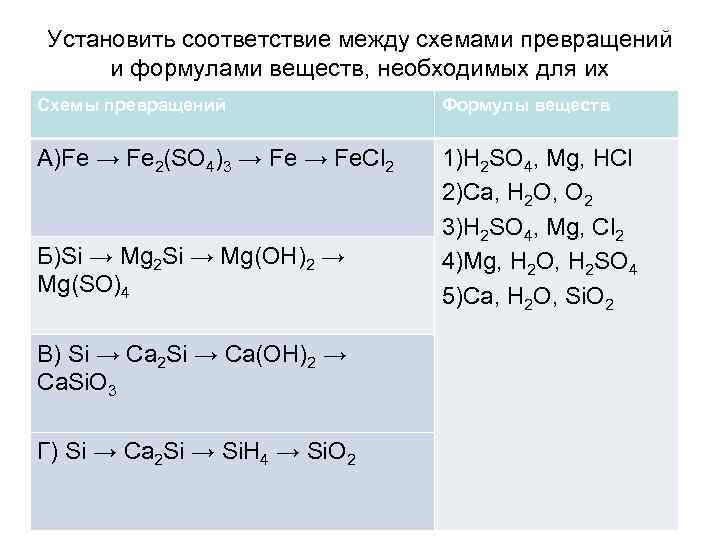 Установить соответствие между схемами превращений и формулами веществ, необходимых для их последовательного осуществления Схемы превращений Формулы веществ А)Fe → Fe 2(SO 4)3 → Fe. Cl 2 Б)Si → Mg 2 Si → Mg(OH)2 → Mg(SO)4 В) Si → Ca 2 Si → Ca(OH)2 → Ca. Si. O 3 Г) Si → Ca 2 Si → Si. H 4 → Si. O 2 1)H 2 SO 4, Mg, HCl 2)Ca, H 2 O, O 2 3)H 2 SO 4, Mg, Cl 2 4)Mg, H 2 O, H 2 SO 4 5)Ca, H 2 O, Si. O 2
Установить соответствие между схемами превращений и формулами веществ, необходимых для их последовательного осуществления Схемы превращений Формулы веществ А)Fe → Fe 2(SO 4)3 → Fe. Cl 2 Б)Si → Mg 2 Si → Mg(OH)2 → Mg(SO)4 В) Si → Ca 2 Si → Ca(OH)2 → Ca. Si. O 3 Г) Si → Ca 2 Si → Si. H 4 → Si. O 2 1)H 2 SO 4, Mg, HCl 2)Ca, H 2 O, O 2 3)H 2 SO 4, Mg, Cl 2 4)Mg, H 2 O, H 2 SO 4 5)Ca, H 2 O, Si. O 2
 А)Fe → Fe 2(SO 4)3 → Fe. Cl 2 Реакция Катализатор 2 Fe+6 H 2 SO 4(конц. )→Fe 2(SO 4)3+ 3 SO 2↑+6 H 2 O ― Fe 2(SO 4)3+3 Mg→ 3 Mg. SO 4+2 Fe ― Fe+2 HCl(разб. )→Fe. Cl 2+H 2↑ Без O 2
А)Fe → Fe 2(SO 4)3 → Fe. Cl 2 Реакция Катализатор 2 Fe+6 H 2 SO 4(конц. )→Fe 2(SO 4)3+ 3 SO 2↑+6 H 2 O ― Fe 2(SO 4)3+3 Mg→ 3 Mg. SO 4+2 Fe ― Fe+2 HCl(разб. )→Fe. Cl 2+H 2↑ Без O 2
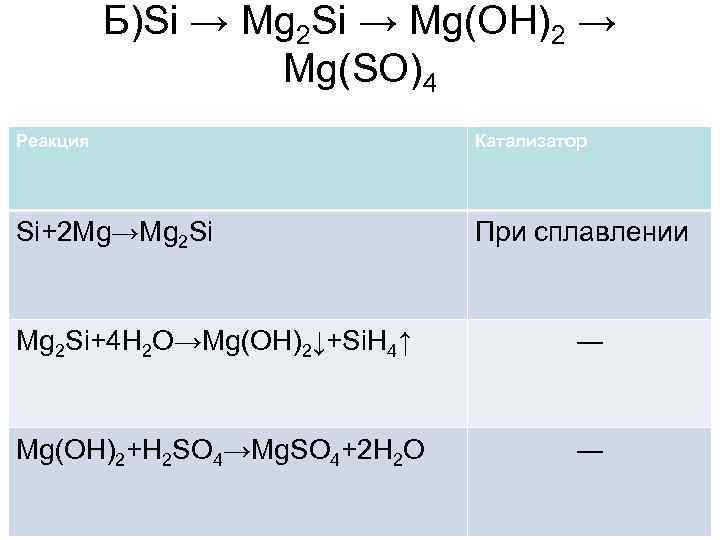 Б)Si → Mg 2 Si → Mg(OH)2 → Mg(SO)4 Реакция Катализатор Si+2 Mg→Mg 2 Si При сплавлении Mg 2 Si+4 H 2 O→Mg(OH)2↓+Si. H 4↑ ― Mg(OH)2+H 2 SO 4→Mg. SO 4+2 H 2 O ―
Б)Si → Mg 2 Si → Mg(OH)2 → Mg(SO)4 Реакция Катализатор Si+2 Mg→Mg 2 Si При сплавлении Mg 2 Si+4 H 2 O→Mg(OH)2↓+Si. H 4↑ ― Mg(OH)2+H 2 SO 4→Mg. SO 4+2 H 2 O ―
 В) Si → Ca 2 Si → Ca(OH)2 → Ca. Si. O 3 Реакция Катализатор Si+2 Ca→Ca 2 Si При сплавлении Ca 2 Si+4 H 2 O→Ca(OH)2 ↓+Si. H 4 ― Ca(OH)2+Si. O 2→Ca. Si. O 3+H 2 O ―
В) Si → Ca 2 Si → Ca(OH)2 → Ca. Si. O 3 Реакция Катализатор Si+2 Ca→Ca 2 Si При сплавлении Ca 2 Si+4 H 2 O→Ca(OH)2 ↓+Si. H 4 ― Ca(OH)2+Si. O 2→Ca. Si. O 3+H 2 O ―
 Г) Si → Ca 2 Si → Si. H 4 → Si. O 2 Реакция Катализатор Si+2 Ca→Ca 2 Si При сплавлении Ca 2 Si+4 H 2 O→Ca(OH)2 ↓+Si. H 4 ― Si. H 4+2 O 2→Si. O 2+2 H 2 O ―
Г) Si → Ca 2 Si → Si. H 4 → Si. O 2 Реакция Катализатор Si+2 Ca→Ca 2 Si При сплавлении Ca 2 Si+4 H 2 O→Ca(OH)2 ↓+Si. H 4 ― Si. H 4+2 O 2→Si. O 2+2 H 2 O ―
 Вариант № 4
Вариант № 4
 Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид кремния(IV) 1)Al, HNO 3, CO 2)Fe. O, CO 2, H 2 O 3)C, KOH, Ca. CO 3 4)Na. OH, H 2 O, Ca. O 5)H 2 O, SO 3, H 3 PO 4 6)H 2 O, HNO 3, Ca(OH)2 Оксид азота(IV) Оксид бария Оксид железа(III)
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид кремния(IV) 1)Al, HNO 3, CO 2)Fe. O, CO 2, H 2 O 3)C, KOH, Ca. CO 3 4)Na. OH, H 2 O, Ca. O 5)H 2 O, SO 3, H 3 PO 4 6)H 2 O, HNO 3, Ca(OH)2 Оксид азота(IV) Оксид бария Оксид железа(III)
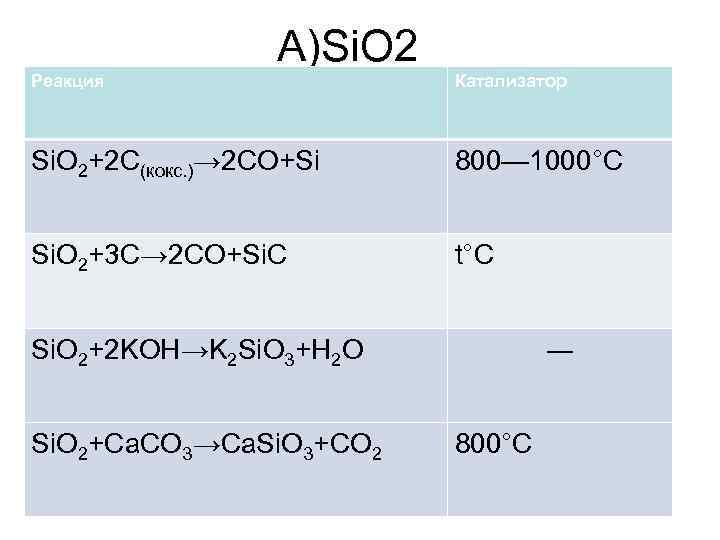 А)Si. O 2 Реакция Катализатор Si. O 2+2 C(кокс. )→ 2 CO+Si 800— 1000°C Si. O 2+3 C→ 2 CO+Si. C t°C Si. O 2+2 KOH→K 2 Si. O 3+H 2 O Si. O 2+Ca. CO 3→Ca. Si. O 3+CO 2 ― 800°C
А)Si. O 2 Реакция Катализатор Si. O 2+2 C(кокс. )→ 2 CO+Si 800— 1000°C Si. O 2+3 C→ 2 CO+Si. C t°C Si. O 2+2 KOH→K 2 Si. O 3+H 2 O Si. O 2+Ca. CO 3→Ca. Si. O 3+CO 2 ― 800°C
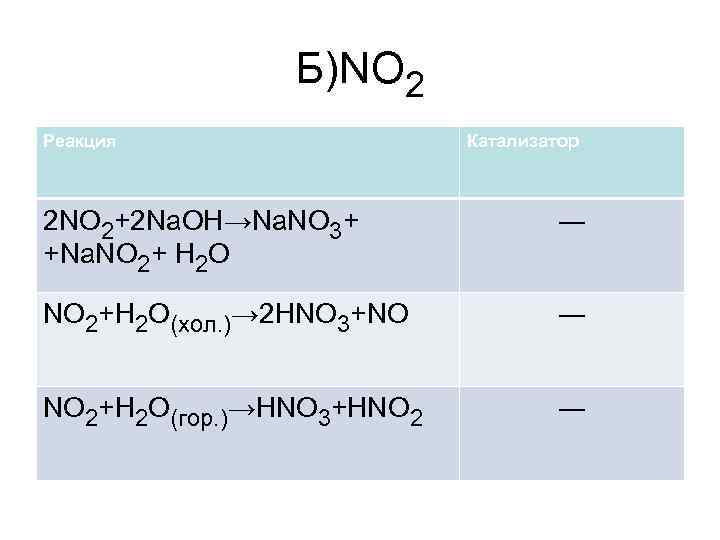 Б)NO 2 Реакция Катализатор 2 NO 2+2 Na. OH→Na. NO 3+ +Na. NO 2+ H 2 O ― NO 2+H 2 O(хол. )→ 2 HNO 3+NO ― NO 2+H 2 O(гор. )→HNO 3+HNO 2 ―
Б)NO 2 Реакция Катализатор 2 NO 2+2 Na. OH→Na. NO 3+ +Na. NO 2+ H 2 O ― NO 2+H 2 O(хол. )→ 2 HNO 3+NO ― NO 2+H 2 O(гор. )→HNO 3+HNO 2 ―
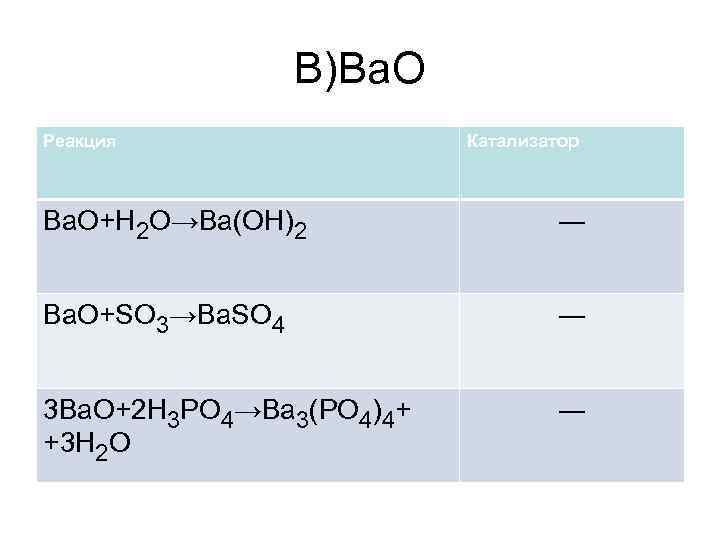 В)Ba. O Реакция Катализатор Ba. O+H 2 O→Ba(OH)2 ― Ba. O+SO 3→Ba. SO 4 ― 3 Ba. O+2 H 3 PO 4→Ba 3(PO 4)4+ +3 H 2 O ―
В)Ba. O Реакция Катализатор Ba. O+H 2 O→Ba(OH)2 ― Ba. O+SO 3→Ba. SO 4 ― 3 Ba. O+2 H 3 PO 4→Ba 3(PO 4)4+ +3 H 2 O ―
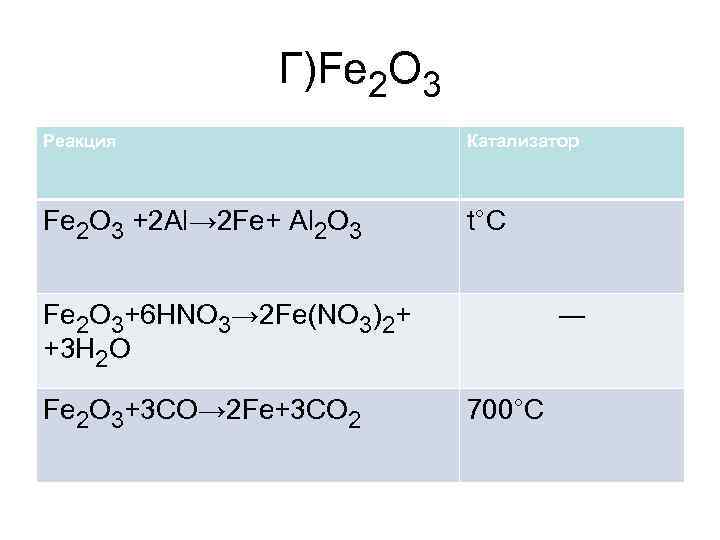 Г)Fe 2 O 3 Реакция Катализатор Fe 2 O 3 +2 Al→ 2 Fe+ Al 2 O 3 t°C Fe 2 O 3+6 HNO 3→ 2 Fe(NO 3)2+ +3 H 2 O Fe 2 O 3+3 CO→ 2 Fe+3 CO 2 ― 700°C
Г)Fe 2 O 3 Реакция Катализатор Fe 2 O 3 +2 Al→ 2 Fe+ Al 2 O 3 t°C Fe 2 O 3+6 HNO 3→ 2 Fe(NO 3)2+ +3 H 2 O Fe 2 O 3+3 CO→ 2 Fe+3 CO 2 ― 700°C
 Вариант 7
Вариант 7
 Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид азота(IV) 1)Na. OH, P 2 O 5, HCl 2)Na. OH, O 3, H 2 O 3)Na. OH, H 2 O, H 2 Si. O 3 4)CO 2, H 2 S, H 2 O 5)N 2, Ca(OH)2, O 2 6)HNO 3, O 2, Br 2 Оксид бария Оксид цинка Оксид хрома(II)
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид азота(IV) 1)Na. OH, P 2 O 5, HCl 2)Na. OH, O 3, H 2 O 3)Na. OH, H 2 O, H 2 Si. O 3 4)CO 2, H 2 S, H 2 O 5)N 2, Ca(OH)2, O 2 6)HNO 3, O 2, Br 2 Оксид бария Оксид цинка Оксид хрома(II)
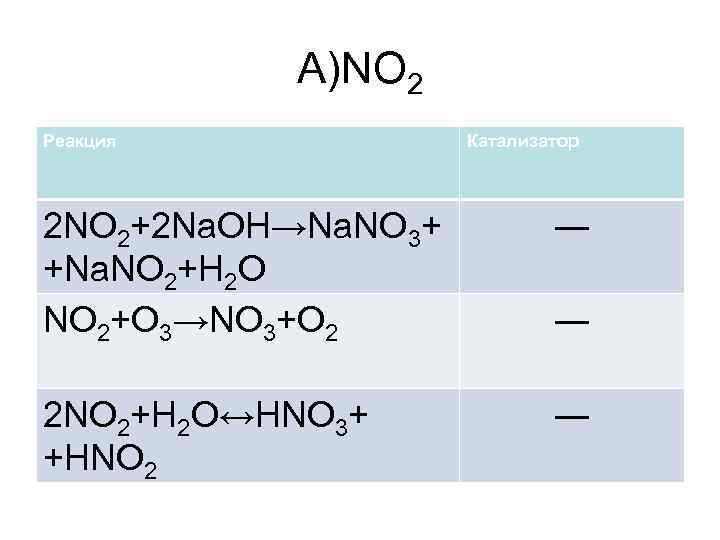 А)NO 2 Реакция Катализатор 2 NO 2+2 Na. OH→Na. NO 3+ +Na. NO 2+H 2 O NO 2+O 3→NO 3+O 2 ― 2 NO 2+H 2 O↔HNO 3+ +HNO 2 ― ―
А)NO 2 Реакция Катализатор 2 NO 2+2 Na. OH→Na. NO 3+ +Na. NO 2+H 2 O NO 2+O 3→NO 3+O 2 ― 2 NO 2+H 2 O↔HNO 3+ +HNO 2 ― ―
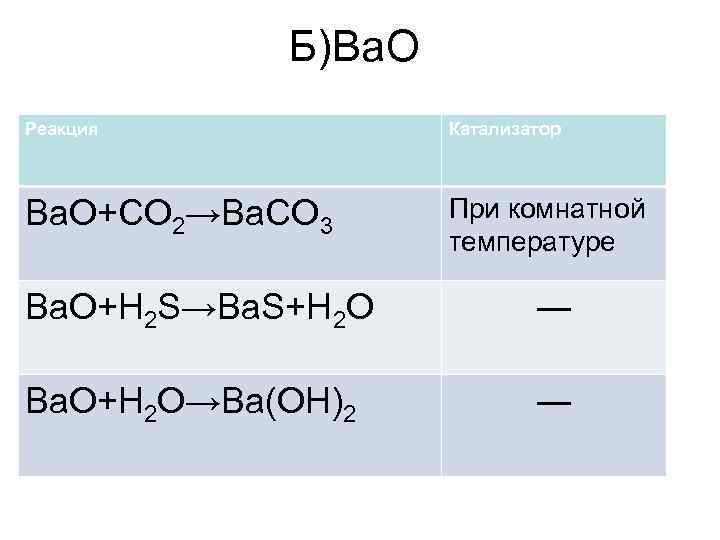 Б)Ba. O Реакция Катализатор Ba. O+CO 2→Ba. CO 3 При комнатной температуре Ba. O+H 2 S→Ba. S+H 2 O ― Ba. O+H 2 O→Ba(OH)2 ―
Б)Ba. O Реакция Катализатор Ba. O+CO 2→Ba. CO 3 При комнатной температуре Ba. O+H 2 S→Ba. S+H 2 O ― Ba. O+H 2 O→Ba(OH)2 ―
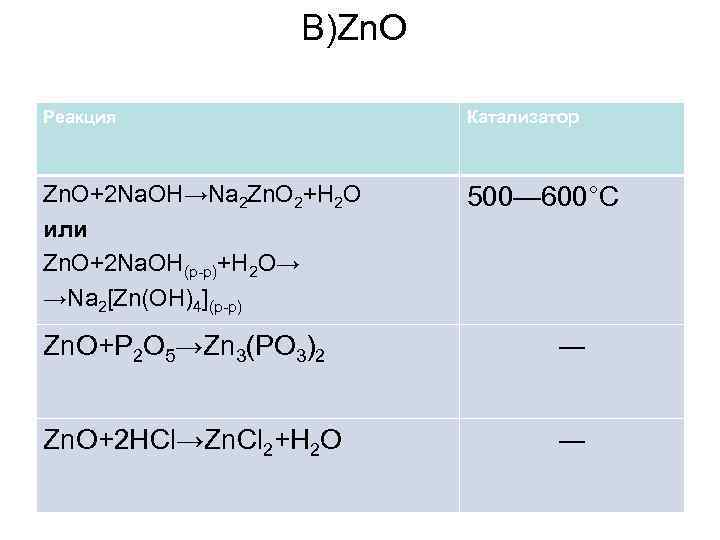 В)Zn. O Реакция Катализатор Zn. O+2 Na. OH→Na 2 Zn. O 2+H 2 O или Zn. O+2 Na. OH(р-р)+H 2 O→ →Na 2[Zn(OH)4](р-р) 500— 600°C Zn. O+P 2 O 5→Zn 3(PO 3)2 ― Zn. O+2 HCl→Zn. Cl 2+H 2 O ―
В)Zn. O Реакция Катализатор Zn. O+2 Na. OH→Na 2 Zn. O 2+H 2 O или Zn. O+2 Na. OH(р-р)+H 2 O→ →Na 2[Zn(OH)4](р-р) 500— 600°C Zn. O+P 2 O 5→Zn 3(PO 3)2 ― Zn. O+2 HCl→Zn. Cl 2+H 2 O ―
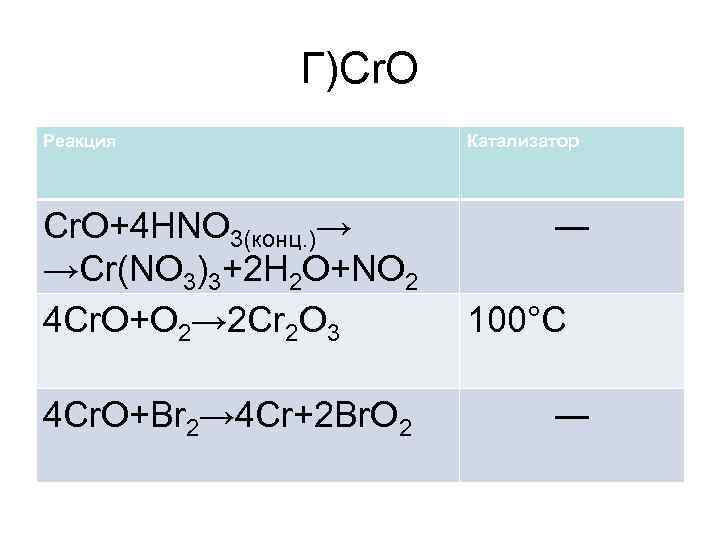 Г)Cr. O Реакция Cr. O+4 HNO 3(конц. )→ →Cr(NO 3)3+2 H 2 O+NO 2 4 Cr. O+O 2→ 2 Cr 2 O 3 4 Cr. O+Br 2→ 4 Cr+2 Br. O 2 Катализатор ― 100°C ―
Г)Cr. O Реакция Cr. O+4 HNO 3(конц. )→ →Cr(NO 3)3+2 H 2 O+NO 2 4 Cr. O+O 2→ 2 Cr 2 O 3 4 Cr. O+Br 2→ 4 Cr+2 Br. O 2 Катализатор ― 100°C ―
 Вариант № 12
Вариант № 12
 Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид углерода(IV) 1)C, HNO 3, H 2 2)Al, Fe 2 O 3, H 2 O 3)Mg, Ca(OH)2, H 2 O 4)Na. OH, Cl 2, O 2 5)Fe. O, CO 2, H 2 O 6)H 2 O, Si. O 2, H 2 SO 4 Оксид меди(II) Оксид кальция Оксид углерода(II)
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид углерода(IV) 1)C, HNO 3, H 2 2)Al, Fe 2 O 3, H 2 O 3)Mg, Ca(OH)2, H 2 O 4)Na. OH, Cl 2, O 2 5)Fe. O, CO 2, H 2 O 6)H 2 O, Si. O 2, H 2 SO 4 Оксид меди(II) Оксид кальция Оксид углерода(II)
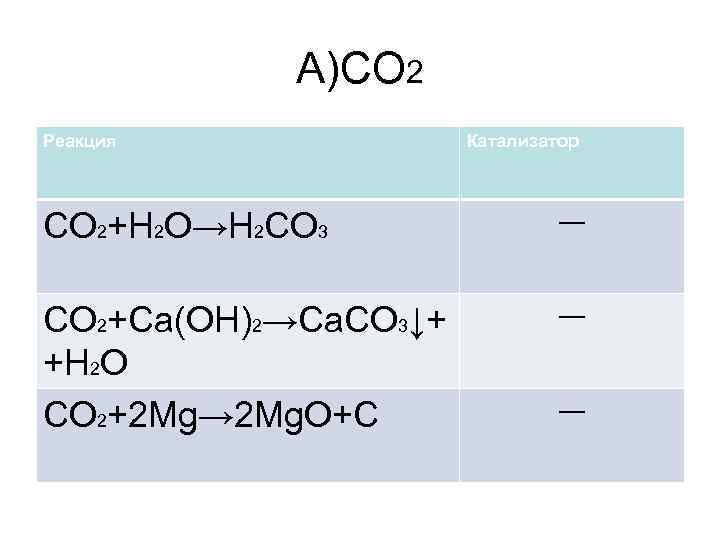 А)CO 2 Реакция Катализатор CO 2+H 2 O→H 2 CO 3 ― CO 2+Ca(OH)2→Ca. CO 3↓+ +H 2 O CO 2+2 Mg→ 2 Mg. O+C ― ―
А)CO 2 Реакция Катализатор CO 2+H 2 O→H 2 CO 3 ― CO 2+Ca(OH)2→Ca. CO 3↓+ +H 2 O CO 2+2 Mg→ 2 Mg. O+C ― ―
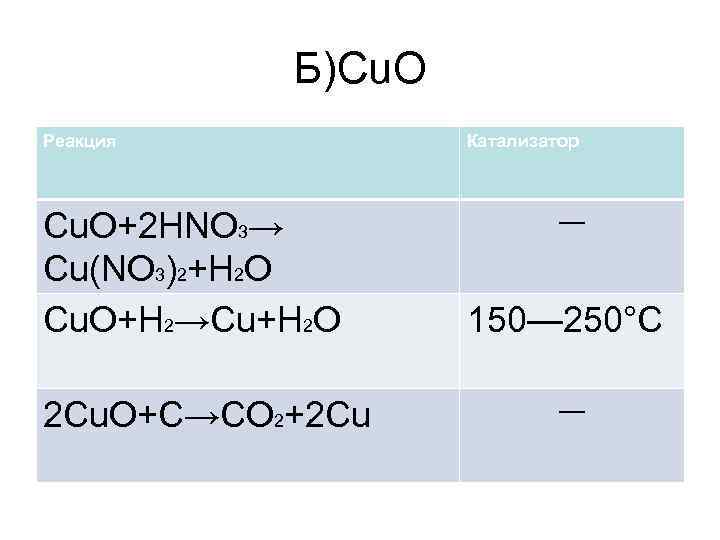 Б)Cu. O Реакция Cu. O+2 HNO 3→ Cu(NO 3)2+H 2 O Cu. O+H 2→Cu+H 2 O 2 Cu. O+C→CO 2+2 Cu Катализатор ― 150— 250°C ―
Б)Cu. O Реакция Cu. O+2 HNO 3→ Cu(NO 3)2+H 2 O Cu. O+H 2→Cu+H 2 O 2 Cu. O+C→CO 2+2 Cu Катализатор ― 150— 250°C ―
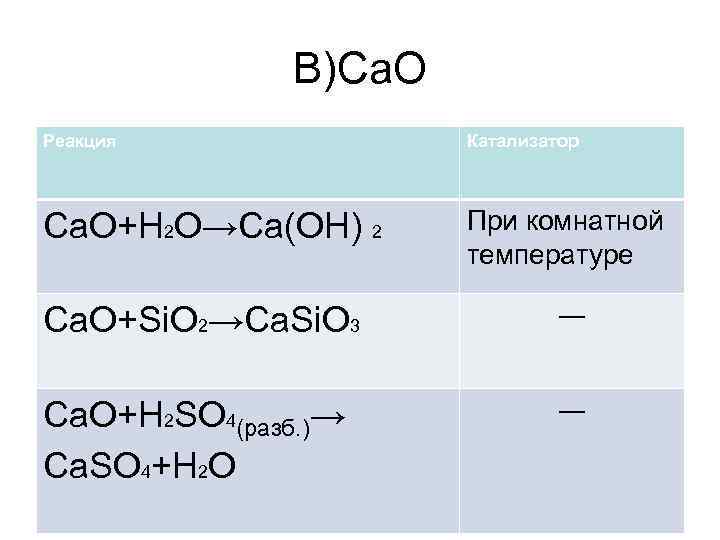 В)Ca. O Реакция Катализатор Ca. O+H 2 O→Ca(OH) 2 При комнатной температуре Са. О+Si. O 2→Са. Si. O 3 ― Ca. O+H 2 SO 4(разб. )→ Ca. SO 4+H 2 O ―
В)Ca. O Реакция Катализатор Ca. O+H 2 O→Ca(OH) 2 При комнатной температуре Са. О+Si. O 2→Са. Si. O 3 ― Ca. O+H 2 SO 4(разб. )→ Ca. SO 4+H 2 O ―
 Г)CO Реакция Катализатор 2 CO+O 2→ 2 CO 2+577 к. Дж ― CO+Cl 2→COCl 2 ― CO+Na. OH→HCOONa ―
Г)CO Реакция Катализатор 2 CO+O 2→ 2 CO 2+577 к. Дж ― CO+Cl 2→COCl 2 ― CO+Na. OH→HCOONa ―
 Вариант 13
Вариант 13
 Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид калия 1)H 2 O, Mg. O, Li. OH 2)Fe 3 O 4, H 2 O, Si 3)H 2, Fe 3 O 4, O 2 4)H 2 O, N 2 O 5, H 3 PO 4 5)H 2 SO 4, Na. OH, Al 6)Al, N 2 O 5, H 2 O Оксид углерода(II) Оксид хрома(III) Оксид фосфора(V)
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название оксида Вещества Оксид калия 1)H 2 O, Mg. O, Li. OH 2)Fe 3 O 4, H 2 O, Si 3)H 2, Fe 3 O 4, O 2 4)H 2 O, N 2 O 5, H 3 PO 4 5)H 2 SO 4, Na. OH, Al 6)Al, N 2 O 5, H 2 O Оксид углерода(II) Оксид хрома(III) Оксид фосфора(V)
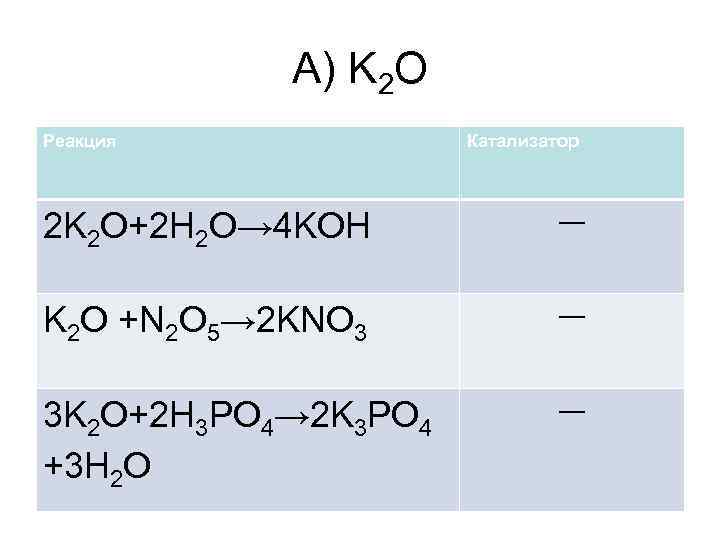 А) K 2 O Реакция Катализатор 2 K 2 O+2 H 2 O→ 4 KOH ― K 2 O +N 2 O 5→ 2 KNO 3 ― 3 K 2 O+2 H 3 PO 4→ 2 K 3 PO 4 +3 H 2 O ―
А) K 2 O Реакция Катализатор 2 K 2 O+2 H 2 O→ 4 KOH ― K 2 O +N 2 O 5→ 2 KNO 3 ― 3 K 2 O+2 H 3 PO 4→ 2 K 3 PO 4 +3 H 2 O ―
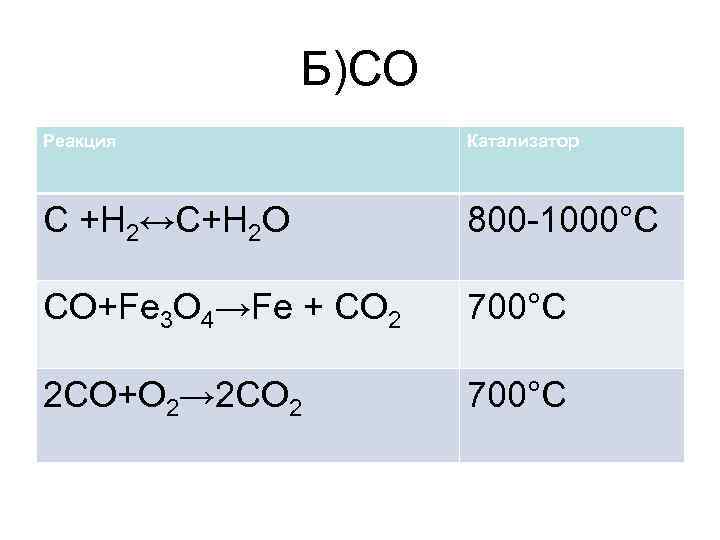 Б)CO Реакция Катализатор C +H 2↔C+H 2 O 800 -1000°C CO+Fe 3 O 4→Fe + CO 2 700°C 2 CO+O 2→ 2 CO 2 700°C
Б)CO Реакция Катализатор C +H 2↔C+H 2 O 800 -1000°C CO+Fe 3 O 4→Fe + CO 2 700°C 2 CO+O 2→ 2 CO 2 700°C
 В)Cr 2 O 3 Реакция Cr 2 O 3+3 H 2 SO 4→ →Cr 2(SO 4)3+3 H 2 O Cr 2 O 3+2 Na. OH→ → 2 Na. Cr. O 2+H 2 O Cr 2 O 3 +Al→Al 2 O 3+2 Cr Катализатор ― При сплавлении 800°C
В)Cr 2 O 3 Реакция Cr 2 O 3+3 H 2 SO 4→ →Cr 2(SO 4)3+3 H 2 O Cr 2 O 3+2 Na. OH→ → 2 Na. Cr. O 2+H 2 O Cr 2 O 3 +Al→Al 2 O 3+2 Cr Катализатор ― При сплавлении 800°C
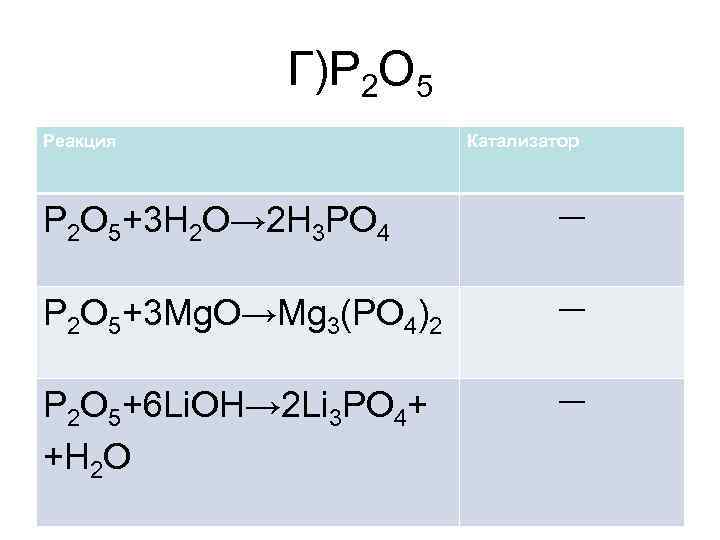 Г)P 2 O 5 Реакция Катализатор P 2 O 5+3 H 2 O→ 2 H 3 PO 4 ― P 2 O 5+3 Mg. O→Mg 3(PO 4)2 ― P 2 O 5+6 Li. OH→ 2 Li 3 PO 4+ +H 2 O ―
Г)P 2 O 5 Реакция Катализатор P 2 O 5+3 H 2 O→ 2 H 3 PO 4 ― P 2 O 5+3 Mg. O→Mg 3(PO 4)2 ― P 2 O 5+6 Li. OH→ 2 Li 3 PO 4+ +H 2 O ―
 Вариант № 15
Вариант № 15
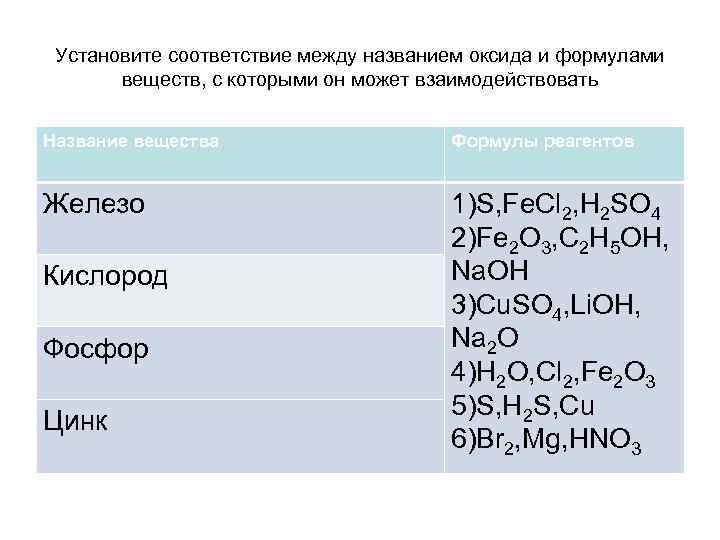 Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название вещества Формулы реагентов Железо 1)S, Fe. Cl 2, H 2 SO 4 2)Fe 2 O 3, C 2 H 5 OH, Na. OH 3)Cu. SO 4, Li. OH, Na 2 O 4)H 2 O, Cl 2, Fe 2 O 3 5)S, H 2 S, Cu 6)Br 2, Mg, HNO 3 Кислород Фосфор Цинк
Установите соответствие между названием оксида и формулами веществ, с которыми он может взаимодействовать Название вещества Формулы реагентов Железо 1)S, Fe. Cl 2, H 2 SO 4 2)Fe 2 O 3, C 2 H 5 OH, Na. OH 3)Cu. SO 4, Li. OH, Na 2 O 4)H 2 O, Cl 2, Fe 2 O 3 5)S, H 2 S, Cu 6)Br 2, Mg, HNO 3 Кислород Фосфор Цинк
 А)Fe Реакция Катализатор ― Fe+3 H 2 O→ 2 Fe(OH)3 2 Fe+3 CL 2 → 2 Fe. CL 3 Выше 250 °C Fe+Fe 2 O 3 → 3 Fe. O 900°C
А)Fe Реакция Катализатор ― Fe+3 H 2 O→ 2 Fe(OH)3 2 Fe+3 CL 2 → 2 Fe. CL 3 Выше 250 °C Fe+Fe 2 O 3 → 3 Fe. O 900°C
 Реакция Б)O 2 O 2+S→SO 2 O 2+2 H 2 S(насыщ. ) → 2 S+2 H 2 O O 2+2 Cu→ 2 Cu. O Катализатор 280— 360°C, сгорание на воздухе, примесь SO 3 На свету 400— 500°C, при избытке кислорода
Реакция Б)O 2 O 2+S→SO 2 O 2+2 H 2 S(насыщ. ) → 2 S+2 H 2 O O 2+2 Cu→ 2 Cu. O Катализатор 280— 360°C, сгорание на воздухе, примесь SO 3 На свету 400— 500°C, при избытке кислорода
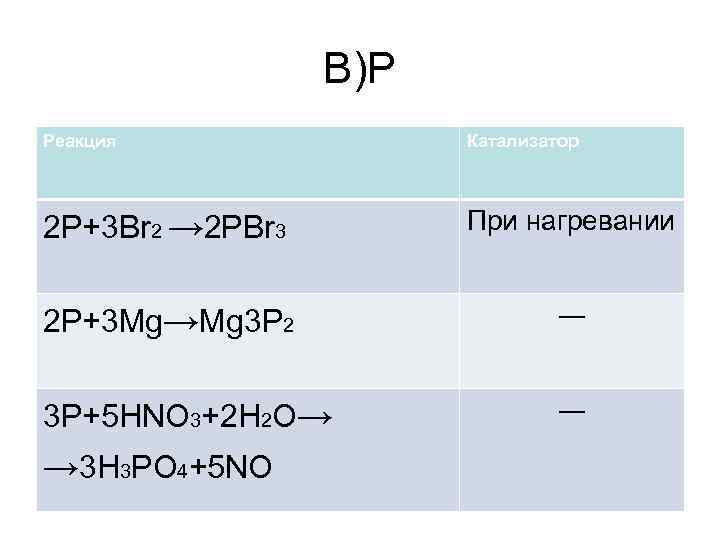 В)P Реакция Катализатор 2 P+3 Br 2 → 2 PBr 3 При нагревании 2 P+3 Mg→Mg 3 P 2 ― 3 P+5 HNO 3+2 H 2 O→ ― → 3 H 3 PO 4+5 NO
В)P Реакция Катализатор 2 P+3 Br 2 → 2 PBr 3 При нагревании 2 P+3 Mg→Mg 3 P 2 ― 3 P+5 HNO 3+2 H 2 O→ ― → 3 H 3 PO 4+5 NO
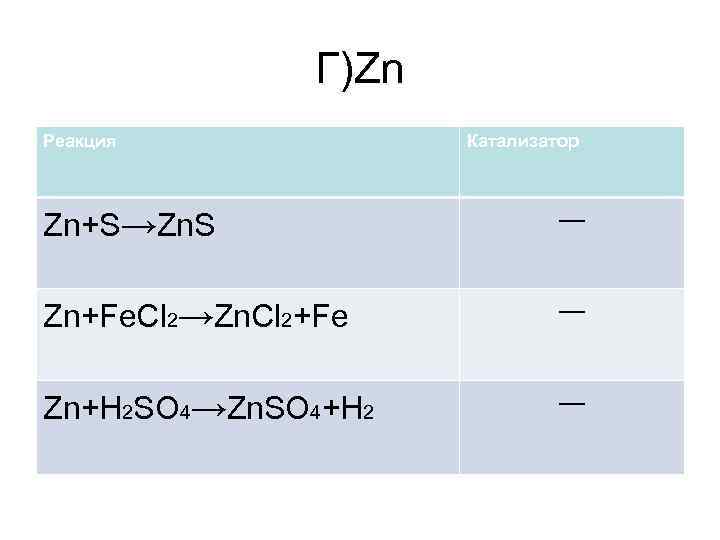 Г)Zn Реакция Катализатор Zn+S→Zn. S ― Zn+Fe. Cl 2→Zn. Cl 2+Fe ― Zn+H 2 SO 4→Zn. SO 4+H 2 ―
Г)Zn Реакция Катализатор Zn+S→Zn. S ― Zn+Fe. Cl 2→Zn. Cl 2+Fe ― Zn+H 2 SO 4→Zn. SO 4+H 2 ―


