 • Доктор химических наук • Профессор • Заслуженный деятель науки РФ • Юрий Маркович Дедков • (Московский государственный областной университет) 17. 02. 2018 1
• Доктор химических наук • Профессор • Заслуженный деятель науки РФ • Юрий Маркович Дедков • (Московский государственный областной университет) 17. 02. 2018 1
 АНАЛИТИЧЕСКАЯ ХИМИЯ (КАЧЕСТВЕННЫЙ АНАЛИЗ) 17. 02. 2018 2
АНАЛИТИЧЕСКАЯ ХИМИЯ (КАЧЕСТВЕННЫЙ АНАЛИЗ) 17. 02. 2018 2
 • «…новые, химические по существу дисциплины, которые окончательно выявились в ХХ веке как геохимия и биогеохимия, основаны на аналитической химии – области знания огромного практического и научного значения» . • • В. И. Вернадский 17. 02. 2018 3
• «…новые, химические по существу дисциплины, которые окончательно выявились в ХХ веке как геохимия и биогеохимия, основаны на аналитической химии – области знания огромного практического и научного значения» . • • В. И. Вернадский 17. 02. 2018 3
 • Наука - вся система знаний о природе, обществе, мышлении. Развитие ее идет по известной триаде «синтез - анализ (классификация) – синтез» . Классификация наук производится: - по предметному признаку (общественные, естественные, технические); - по уровневому признаку (фундаментальные или прикладные). 17. 02. 2018 4
• Наука - вся система знаний о природе, обществе, мышлении. Развитие ее идет по известной триаде «синтез - анализ (классификация) – синтез» . Классификация наук производится: - по предметному признаку (общественные, естественные, технические); - по уровневому признаку (фундаментальные или прикладные). 17. 02. 2018 4
 • Естественные науки изучают формы движения материи. • Химическая форма движения материи – изменение химического состава материального объекта. Мера изменения – качественные и количественные характеристики. • Химия - наука о веществах и процессах их превращения, сопровождающихся изменением химического состава и структуры. Мерой такого движения служат качественные и количественные характеристики объекта. • Аналитическая химия - наука о принципах и методах определения качественного и количественного состава веществ. Это естественная прикладная наука об измерении химической формы движения материи. 17. 02. 2018 5
• Естественные науки изучают формы движения материи. • Химическая форма движения материи – изменение химического состава материального объекта. Мера изменения – качественные и количественные характеристики. • Химия - наука о веществах и процессах их превращения, сопровождающихся изменением химического состава и структуры. Мерой такого движения служат качественные и количественные характеристики объекта. • Аналитическая химия - наука о принципах и методах определения качественного и количественного состава веществ. Это естественная прикладная наука об измерении химической формы движения материи. 17. 02. 2018 5
 • 1. Органический и неорганический анализ. • 2. Качественный и количественный анализ: _ _ у = х ± Δх; Δх/х = р; р ≤ 0, 33; р = 0, 33 - 0, 50; р > 0, 50 да – нет • • Качественный анализ - определение элементного состава системы. • Количественный анализ - точное определение содержания в анализируемой системе интересующих нас компонентов. 17. 02. 2018 6
• 1. Органический и неорганический анализ. • 2. Качественный и количественный анализ: _ _ у = х ± Δх; Δх/х = р; р ≤ 0, 33; р = 0, 33 - 0, 50; р > 0, 50 да – нет • • Качественный анализ - определение элементного состава системы. • Количественный анализ - точное определение содержания в анализируемой системе интересующих нас компонентов. 17. 02. 2018 6
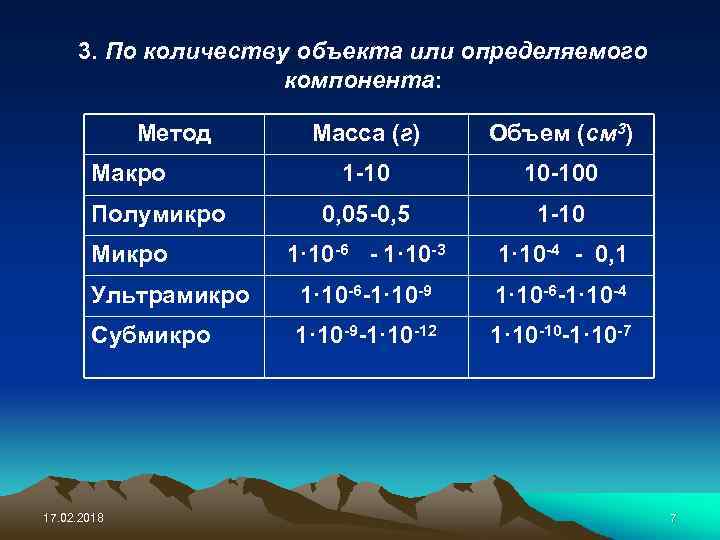 3. По количеству объекта или определяемого компонента: Метод Масса (г) Объем (см 3) 1 -10 10 -100 0, 05 -0, 5 1 -10 1· 10 -6 - 1· 10 -3 1· 10 -4 - 0, 1 Ультрамикро 1· 10 -6 -1· 10 -9 1· 10 -6 -1· 10 -4 Субмикро 1· 10 -9 -1· 10 -12 1· 10 -10 -1· 10 -7 Макро Полумикро Микро 17. 02. 2018 7
3. По количеству объекта или определяемого компонента: Метод Масса (г) Объем (см 3) 1 -10 10 -100 0, 05 -0, 5 1 -10 1· 10 -6 - 1· 10 -3 1· 10 -4 - 0, 1 Ультрамикро 1· 10 -6 -1· 10 -9 1· 10 -6 -1· 10 -4 Субмикро 1· 10 -9 -1· 10 -12 1· 10 -10 -1· 10 -7 Макро Полумикро Микро 17. 02. 2018 7
 4. По способу получения и регистрации сигнала: аналитического - химические - образование характерных химических соединений, позволяющих проводить прямые наблюдения (гравиметрия, титриметрия); инструментальные: - физико-химические - методы, связанные с переходами электронов (оптические, электрохимические, хроматографические); - физические - методы, основанные на возбуждении атомов и ядер. Реактивы: Квалификация: технический - техн. , чистый – ч. , чистый для анализа ч. д. а. , химически чистый - х. ч. , особой чистоты - о. с. ч. ; Чистота; Хранение. 17. 02. 2018 8
4. По способу получения и регистрации сигнала: аналитического - химические - образование характерных химических соединений, позволяющих проводить прямые наблюдения (гравиметрия, титриметрия); инструментальные: - физико-химические - методы, связанные с переходами электронов (оптические, электрохимические, хроматографические); - физические - методы, основанные на возбуждении атомов и ядер. Реактивы: Квалификация: технический - техн. , чистый – ч. , чистый для анализа ч. д. а. , химически чистый - х. ч. , особой чистоты - о. с. ч. ; Чистота; Хранение. 17. 02. 2018 8
 • МЕТОДИКА АНАЛИЗА – систематический набор манипуляций с пробой, позволяющий получить и достоверно интерпретировать аналитический сигнал. • АНАЛИТИЧЕСКИЙ СИГНАЛ (АС) – любое поддающееся измерению, регистрации и интерпретации свойство исследуемой системы, связанное с наличием и количеством определяемого компонента. • Полезный сигнал и фон; Зσ - критерий. • КОНТРОЛЬНЫЙ (глухой, нулевой, холостой) опыт – получение АС в системе, адекватной исследуемой, но не содержащей определяемый компонент. 17. 02. 2018 9
• МЕТОДИКА АНАЛИЗА – систематический набор манипуляций с пробой, позволяющий получить и достоверно интерпретировать аналитический сигнал. • АНАЛИТИЧЕСКИЙ СИГНАЛ (АС) – любое поддающееся измерению, регистрации и интерпретации свойство исследуемой системы, связанное с наличием и количеством определяемого компонента. • Полезный сигнал и фон; Зσ - критерий. • КОНТРОЛЬНЫЙ (глухой, нулевой, холостой) опыт – получение АС в системе, адекватной исследуемой, но не содержащей определяемый компонент. 17. 02. 2018 9
 • АНАЛИТИЧЕСКАЯ РЕАКЦИЯ: • условия выполнения должны обеспечивать максимальный AC (p. H, t°, время, концентрация реактивов и т. п. ); • обеспечивать достаточную чувствительность (открываемый минимум, предельное разбавление, нижняя граница определяемых содержаний); • обладать достаточной селективностью: специфическая – протекать с одним веществом или ионом; селективная - с небольшим числом веществ или ионов). 17. 02. 2018 10
• АНАЛИТИЧЕСКАЯ РЕАКЦИЯ: • условия выполнения должны обеспечивать максимальный AC (p. H, t°, время, концентрация реактивов и т. п. ); • обеспечивать достаточную чувствительность (открываемый минимум, предельное разбавление, нижняя граница определяемых содержаний); • обладать достаточной селективностью: специфическая – протекать с одним веществом или ионом; селективная - с небольшим числом веществ или ионов). 17. 02. 2018 10
 • АБСОЛЮТНЫЕ МЕТОДЫ АНАЛИЗА – методы, позволяющие осуществлять прямую регистрацию результата анализа (гравиметрия). • ОТНОСИТЕЛЬНЫЕ МЕТОДЫ АНАЛИЗА – методы, в ходе выполнения которых осуществляется регистрация побочного (косвенного) свойства системы, связанного с наличием определяемого или обнаруживаемого компонента. 17. 02. 2018 11
• АБСОЛЮТНЫЕ МЕТОДЫ АНАЛИЗА – методы, позволяющие осуществлять прямую регистрацию результата анализа (гравиметрия). • ОТНОСИТЕЛЬНЫЕ МЕТОДЫ АНАЛИЗА – методы, в ходе выполнения которых осуществляется регистрация побочного (косвенного) свойства системы, связанного с наличием определяемого или обнаруживаемого компонента. 17. 02. 2018 11
 • Объектом исследования аналитической химии как науки является процесс анализа, • а также те химические, физические и иные по природе процессы, которые можно использовать для проведения анализа. • Объектом исследования аналитиков-практиков являются конкретные химические вещества и их свойства. 17. 02. 2018 12
• Объектом исследования аналитической химии как науки является процесс анализа, • а также те химические, физические и иные по природе процессы, которые можно использовать для проведения анализа. • Объектом исследования аналитиков-практиков являются конкретные химические вещества и их свойства. 17. 02. 2018 12
 Химические элементы, присутствующие в некоторых объектах анализа Объект анализа Тип объекта анализа Горные породы Силикатные и минералы Сульфидные Главные компоненты Si, Al, Ca, К, Na, Fe, Mn, S, As, Sb, Fe, Zn, Pb, Cu Оксидные Осадочные карбонатные Биологические материалы 17. 02. 2018 Fe, Mn, Si, Al Ca, Mg, Si, Al. Биологически Растительные и животные е материалы ма-териалы, пищевые продукты. Органические и неорганичес -кие вещества, содержащие С, О, N, P, S, К, Na, Ca, Mg и 13 сле-ды др. элементов (Fe,
Химические элементы, присутствующие в некоторых объектах анализа Объект анализа Тип объекта анализа Горные породы Силикатные и минералы Сульфидные Главные компоненты Si, Al, Ca, К, Na, Fe, Mn, S, As, Sb, Fe, Zn, Pb, Cu Оксидные Осадочные карбонатные Биологические материалы 17. 02. 2018 Fe, Mn, Si, Al Ca, Mg, Si, Al. Биологически Растительные и животные е материалы ма-териалы, пищевые продукты. Органические и неорганичес -кие вещества, содержащие С, О, N, P, S, К, Na, Ca, Mg и 13 сле-ды др. элементов (Fe,
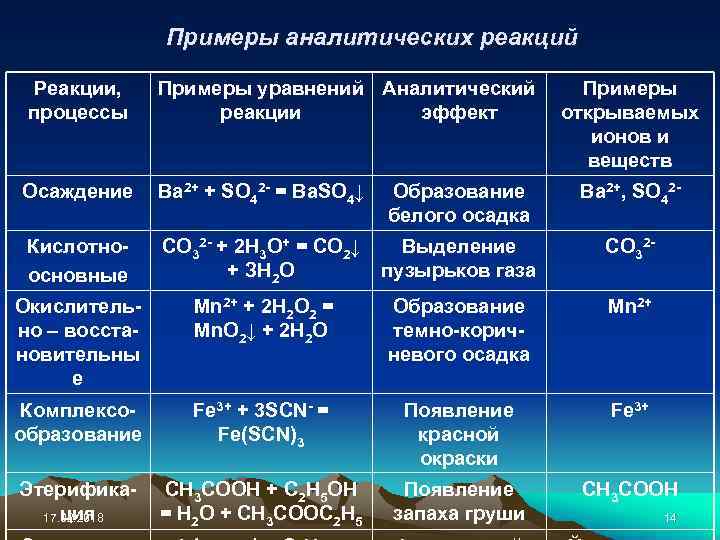 Примеры аналитических реакций Реакции, процессы Примеры уравнений Аналитический реакции эффект Примеры открываемых ионов и веществ Осаждение Ва 2+ + SO 42 - = Ba. SO 4↓ Образование белого осадка Ва 2+, SO 42 - Кислотноосновные СО 32 - + 2 Н 3 О+ = CO 2↓ + ЗН 2 О Выделение пузырьков газа СО 32 - Окислительно – восстановительны е Мn 2+ + 2 Н 2 О 2 = Мn. О 2↓ + 2 Н 2 О Образование темно-коричневого осадка Мn 2+ Комплексообразование Fe 3+ + 3 SCN- = Fe(SCN)3 Появление красной окраски Fe 3+ Этерификация 17. 02. 2018 СН 3 СООН + С 2 Н 5 ОН = Н 2 О + СН 3 СООС 2 Н 5 Появление запаха груши СН 3 СООН 14
Примеры аналитических реакций Реакции, процессы Примеры уравнений Аналитический реакции эффект Примеры открываемых ионов и веществ Осаждение Ва 2+ + SO 42 - = Ba. SO 4↓ Образование белого осадка Ва 2+, SO 42 - Кислотноосновные СО 32 - + 2 Н 3 О+ = CO 2↓ + ЗН 2 О Выделение пузырьков газа СО 32 - Окислительно – восстановительны е Мn 2+ + 2 Н 2 О 2 = Мn. О 2↓ + 2 Н 2 О Образование темно-коричневого осадка Мn 2+ Комплексообразование Fe 3+ + 3 SCN- = Fe(SCN)3 Появление красной окраски Fe 3+ Этерификация 17. 02. 2018 СН 3 СООН + С 2 Н 5 ОН = Н 2 О + СН 3 СООС 2 Н 5 Появление запаха груши СН 3 СООН 14
 Виды химического анализа • Классификация видов химического анализа: С точки зрения целей применения можно выделить методы разделения компонентов, их концентрирования, идентификации и определения. • Большинство методов относятся к гибридным, в которых сочетаются несколько этапов анализа. 17. 02. 2018 15
Виды химического анализа • Классификация видов химического анализа: С точки зрения целей применения можно выделить методы разделения компонентов, их концентрирования, идентификации и определения. • Большинство методов относятся к гибридным, в которых сочетаются несколько этапов анализа. 17. 02. 2018 15
 • - по способу получения и регистрации аналитического сигнала методы делят на химические и инструментальные; • - по характеру анализируемого объекта методы относят к органическому или неорганическому анализу, в зависимости от того, какое вещество является объектом анализа; • - по характеру получаемой информации: • качественный (из чего состоит данное вещество, какие именно компоненты входят в его состав) • количественный (точное содержание в анализируемой системе интересующих нас тех или иных компонентов или их соотношение) анализ; 17. 02. 2018 16
• - по способу получения и регистрации аналитического сигнала методы делят на химические и инструментальные; • - по характеру анализируемого объекта методы относят к органическому или неорганическому анализу, в зависимости от того, какое вещество является объектом анализа; • - по характеру получаемой информации: • качественный (из чего состоит данное вещество, какие именно компоненты входят в его состав) • количественный (точное содержание в анализируемой системе интересующих нас тех или иных компонентов или их соотношение) анализ; 17. 02. 2018 16
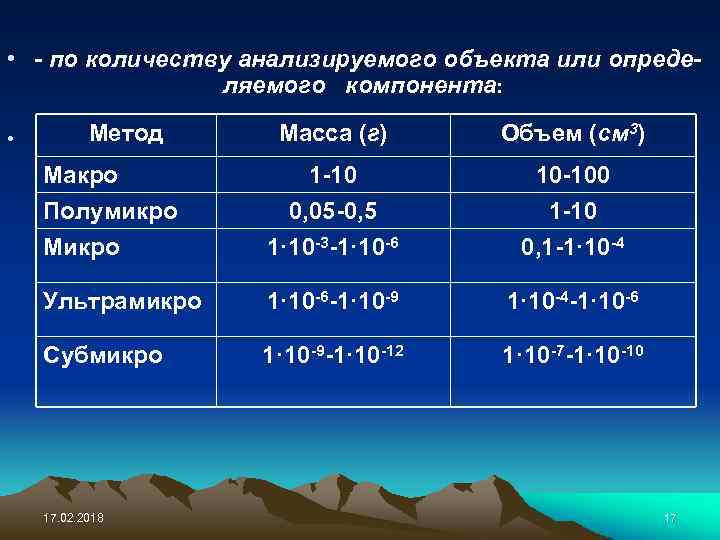 • - по количеству анализируемого объекта или определяемого компонента: • Метод Масса (г) Объем (см 3) Макро Полумикро Микро 1 -10 0, 05 -0, 5 1· 10 -3 -1· 10 -6 10 -100 1 -10 0, 1 -1· 10 -4 Ультрамикро 1· 10 -6 -1· 10 -9 1· 10 -4 -1· 10 -6 Субмикро 1· 10 -9 -1· 10 -12 1· 10 -7 -1· 10 -10 17. 02. 2018 17
• - по количеству анализируемого объекта или определяемого компонента: • Метод Масса (г) Объем (см 3) Макро Полумикро Микро 1 -10 0, 05 -0, 5 1· 10 -3 -1· 10 -6 10 -100 1 -10 0, 1 -1· 10 -4 Ультрамикро 1· 10 -6 -1· 10 -9 1· 10 -4 -1· 10 -6 Субмикро 1· 10 -9 -1· 10 -12 1· 10 -7 -1· 10 -10 17. 02. 2018 17
 • - по объектами и целям анализа: технический, клинический, криминалистический и др. ; - при исследовании органических веществ и материалов биогенного происхождения природу и количественное содержание молекул, входящих в состав исследуемого вещества устанавливают с помощью молекулярного анализа; 17. 02. 2018 18
• - по объектами и целям анализа: технический, клинический, криминалистический и др. ; - при исследовании органических веществ и материалов биогенного происхождения природу и количественное содержание молекул, входящих в состав исследуемого вещества устанавливают с помощью молекулярного анализа; 17. 02. 2018 18
 • - по природе определяемого компонента и целям анализа: • - при необходимости раздельного определения содержания разных форм одного и того же элемента используют недавно выделенный в самостоятельный вид вещественный анализ; • - функциональный (или структурно-групповой) анализ используют при определении суммарного содержания всех молекул, имеющих некоторые общие структурные особенности, близкие функциональные группы и близкие химические свойства; • - элементный анализ. • Для него применяют деструктивные методы, основанные на полной атомизации анализируемого вещества; • - с помощью фазового анализа находят распределение элементов между разными фазами исследуемого объекта. 17. 02. 2018 19
• - по природе определяемого компонента и целям анализа: • - при необходимости раздельного определения содержания разных форм одного и того же элемента используют недавно выделенный в самостоятельный вид вещественный анализ; • - функциональный (или структурно-групповой) анализ используют при определении суммарного содержания всех молекул, имеющих некоторые общие структурные особенности, близкие функциональные группы и близкие химические свойства; • - элементный анализ. • Для него применяют деструктивные методы, основанные на полной атомизации анализируемого вещества; • - с помощью фазового анализа находят распределение элементов между разными фазами исследуемого объекта. 17. 02. 2018 19
 Виды качественного анализа • а. Мокрый и сухой. • б. Пробирочный, капельный, микрокристаллоскопический, окрашивание пламени, образование перлов. • в. Дробный. • 17. 02. 2018 г. Систематический. 20
Виды качественного анализа • а. Мокрый и сухой. • б. Пробирочный, капельный, микрокристаллоскопический, окрашивание пламени, образование перлов. • в. Дробный. • 17. 02. 2018 г. Систематический. 20
 Систематический качественный анализ • Разделение катионов или анионов на группы (групповые реагенты). • Обнаружение в группах характерными (частными) реакциями. Частные реакции: - по выделению газа; - по образованию осадка; - колориметрические; - люминесцентные; - окрашивание пламени; - микрокристаллоскопические. Окрашивание пламени: Li (крас. ), Na (жел. ), К (фиол. ), Rb и Cs (фиол. крас. ) Следовательно - возможны тонкие различия. 17. 02. 2018 21
Систематический качественный анализ • Разделение катионов или анионов на группы (групповые реагенты). • Обнаружение в группах характерными (частными) реакциями. Частные реакции: - по выделению газа; - по образованию осадка; - колориметрические; - люминесцентные; - окрашивание пламени; - микрокристаллоскопические. Окрашивание пламени: Li (крас. ), Na (жел. ), К (фиол. ), Rb и Cs (фиол. крас. ) Следовательно - возможны тонкие различия. 17. 02. 2018 21
 Сероводородная схема анализа катионов • Характерны растворимость сульфидов, тиосолей, хлоридов и карбонатов, сродство к атомам S, Сℓ, О. • 1 -я группа: К+, Na+, NH 4+, Mg 2+ - нет ГР; • 2 -я группа: Ва 2+, Sr 2+, Са 2+ ; ГР - (NH 4)2 CO 3; • 3 -я группа: Al 3+, Cr 3+, Zn 2+ ; Fe 2+, Fe 3+, Ni 2+, Co 2+, Mn 2+; ГР - (NH 4)2 S + NH 4 OH, p. H 7 - 9; осаждаются сульфиды и гидроксиды; 2 Со 2+ + 3 HS- = Co 2 S 3 + ЗН+; Аl 3+ + 3 ОН- = Аl(ОН)3↓. 17. 02. 2018 22
Сероводородная схема анализа катионов • Характерны растворимость сульфидов, тиосолей, хлоридов и карбонатов, сродство к атомам S, Сℓ, О. • 1 -я группа: К+, Na+, NH 4+, Mg 2+ - нет ГР; • 2 -я группа: Ва 2+, Sr 2+, Са 2+ ; ГР - (NH 4)2 CO 3; • 3 -я группа: Al 3+, Cr 3+, Zn 2+ ; Fe 2+, Fe 3+, Ni 2+, Co 2+, Mn 2+; ГР - (NH 4)2 S + NH 4 OH, p. H 7 - 9; осаждаются сульфиды и гидроксиды; 2 Со 2+ + 3 HS- = Co 2 S 3 + ЗН+; Аl 3+ + 3 ОН- = Аl(ОН)3↓. 17. 02. 2018 22
 • 17. 02. 2018 4 -я группа: Cu 2+, Cd 2+, Hg 22+, Bi 3+, As(V), Sb 3+, Sb(V), Sn 2+, Sn(IV); ГР - H 2 S в 0, 5 M HCℓ; Sn. S 2 + Na 2 S = Na 2 Sn. S 3; 5 -я группа: Ag+, Hg 22+, Cu+, Au+; Тℓ+; ГР - 2 M HCℓ. 23
• 17. 02. 2018 4 -я группа: Cu 2+, Cd 2+, Hg 22+, Bi 3+, As(V), Sb 3+, Sb(V), Sn 2+, Sn(IV); ГР - H 2 S в 0, 5 M HCℓ; Sn. S 2 + Na 2 S = Na 2 Sn. S 3; 5 -я группа: Ag+, Hg 22+, Cu+, Au+; Тℓ+; ГР - 2 M HCℓ. 23
 Кислотно-щелочная схема анализа • 1 -я группа: Li+, K+, Na+, NH 4+ - нет ГР; • 2 -я группа: Ag+, Hg+, Cu+, Au+, Tℓ+; ГР - 2 M НСℓ; • 3 -я группа: Ва 2+, Sr 2+, Са 2+, (Рb 2+); ГР- 2 N H 2 SO 4; • 4 -я группа: Aℓ 3+, Cr 3+, Zn 2+, As 3+, As(V), (Sb 3+), Sn 2+, Sn(IV); ГР - избыток 4 N раствора Na. OH; • 5 -я группа: , Mg 2+, Fe(2+, 3+), Mn 2+, Bi 3+, Sb(V); ГР -25%-ный раствор Na. OH; • 6 -я группа: Ni 2+, Co 2+, Cu 2+, Cd 2+, Hg 2+; ГР - избыток 25%-ного раствора аммиака. 17. 02. 2018 24
Кислотно-щелочная схема анализа • 1 -я группа: Li+, K+, Na+, NH 4+ - нет ГР; • 2 -я группа: Ag+, Hg+, Cu+, Au+, Tℓ+; ГР - 2 M НСℓ; • 3 -я группа: Ва 2+, Sr 2+, Са 2+, (Рb 2+); ГР- 2 N H 2 SO 4; • 4 -я группа: Aℓ 3+, Cr 3+, Zn 2+, As 3+, As(V), (Sb 3+), Sn 2+, Sn(IV); ГР - избыток 4 N раствора Na. OH; • 5 -я группа: , Mg 2+, Fe(2+, 3+), Mn 2+, Bi 3+, Sb(V); ГР -25%-ный раствор Na. OH; • 6 -я группа: Ni 2+, Co 2+, Cu 2+, Cd 2+, Hg 2+; ГР - избыток 25%-ного раствора аммиака. 17. 02. 2018 24
 • 1 -я группа - конфигурация s 2 p 6 и заряд +1, не поляризуются и не поляризуют за исключением иона Li+, обладающего поляризующей способностью и образующего преимущественно ковалентные связи • 2 -я группа - заполненный d-уровень и бóльшая поляризующая способность (плохо растворимые фосфаты, сульфаты, карбонаты, хлориды) • 3 -я группа - аналоги 1 -ой, но заряд +2 и поляризующая способность выше • 4 -я и 5 -я группы - сильно поляризющие ионы, образующие прочные связи с атомами О • 6 -я группа - ионы с незаполненной d-орбиталью, образующие устойчивые аммиакаты 17. 02. 2018 25
• 1 -я группа - конфигурация s 2 p 6 и заряд +1, не поляризуются и не поляризуют за исключением иона Li+, обладающего поляризующей способностью и образующего преимущественно ковалентные связи • 2 -я группа - заполненный d-уровень и бóльшая поляризующая способность (плохо растворимые фосфаты, сульфаты, карбонаты, хлориды) • 3 -я группа - аналоги 1 -ой, но заряд +2 и поляризующая способность выше • 4 -я и 5 -я группы - сильно поляризющие ионы, образующие прочные связи с атомами О • 6 -я группа - ионы с незаполненной d-орбиталью, образующие устойчивые аммиакаты 17. 02. 2018 25
 • Теоретическая основа аналитической химии законы эквивалентов и действия масс. • Система – совокупность находящихся во взаимодействии веществ, мысленно обособленных от окружающей среды. – гетерогенные (грубодисперсные: cycпензии, эмульсии); – гомогенные (коллоидные и истинные растворы). 17. 02. 2018 26
• Теоретическая основа аналитической химии законы эквивалентов и действия масс. • Система – совокупность находящихся во взаимодействии веществ, мысленно обособленных от окружающей среды. – гетерогенные (грубодисперсные: cycпензии, эмульсии); – гомогенные (коллоидные и истинные растворы). 17. 02. 2018 26
 • Жидкости — промежуточное положение между газами и твердыми веществами. Характерна упорядочненость ближней сферы. • Раствор — гомогенная смесь двух или более соединений и продуктов их взаимодействия. • Истинный раствор - термодинамически устойчивая гомогенная система переменного состава, образованная двумя или бόльшим числом индивидуальных соединений. • Сольватация - взаимодействие растворенного вещества с растворителем. • Гидратация: Сl 2∙ 8 Н 2 О; Хе∙ 6 Н 2 О; С 2 Н 6∙ 6 Н 2 О; С 3 Н 8∙ 17 Н 2 О 17. 02. 2018 27
• Жидкости — промежуточное положение между газами и твердыми веществами. Характерна упорядочненость ближней сферы. • Раствор — гомогенная смесь двух или более соединений и продуктов их взаимодействия. • Истинный раствор - термодинамически устойчивая гомогенная система переменного состава, образованная двумя или бόльшим числом индивидуальных соединений. • Сольватация - взаимодействие растворенного вещества с растворителем. • Гидратация: Сl 2∙ 8 Н 2 О; Хе∙ 6 Н 2 О; С 2 Н 6∙ 6 Н 2 О; С 3 Н 8∙ 17 Н 2 О 17. 02. 2018 27
 17. 02. 2018 28
17. 02. 2018 28
 Взаимодействие вещество - растворитель» • Силы Ван-дер-Ваальса (0, 5 -1 к. Дж/моль): • дисперсионные (нейтральные молекулы, взаимодействие мгновенных электрических диполей, возникающих при движении электронов; растворение неполярных веществ); • индукционные (поляризация молекулы вещества под действием молекулы растворителя); • ориентационные (взаимодействие постоянных диполей). 17. 02. 2018 29
Взаимодействие вещество - растворитель» • Силы Ван-дер-Ваальса (0, 5 -1 к. Дж/моль): • дисперсионные (нейтральные молекулы, взаимодействие мгновенных электрических диполей, возникающих при движении электронов; растворение неполярных веществ); • индукционные (поляризация молекулы вещества под действием молекулы растворителя); • ориентационные (взаимодействие постоянных диполей). 17. 02. 2018 29
 • Силы Ван-дер-Ваальса (0, 5 -1 к. Дж/моль): - дисперсионные (нейтральные молекулы, взаимодействие мгновенных электрических диполей, возникающих при движении электронов; растворение неполярных веществ); – индукционные (поляризация молекулы вещества под действием молекулы растворителя); – ориентационные (взаимодействие постоянных диполей). 17. 02. 2018 30
• Силы Ван-дер-Ваальса (0, 5 -1 к. Дж/моль): - дисперсионные (нейтральные молекулы, взаимодействие мгновенных электрических диполей, возникающих при движении электронов; растворение неполярных веществ); – индукционные (поляризация молекулы вещества под действием молекулы растворителя); – ориентационные (взаимодействие постоянных диполей). 17. 02. 2018 30
 • Химические взаимодействия (5 – 50 к. Дж/моль): • – ион-дипольное взаимодействие; – водородные связи (ВС): R-H ←: OR 2 СН 3 ОН ← : ОН 2 • Причины образования ВС: – малый радиус иона Н+ и высокая электрическая плотность; – поляризация связи Н-Х и стремление атома Н отдать электрон: С 6 Н 6∙Н+; СНСl 3 - кислота. 17. 02. 2018 31
• Химические взаимодействия (5 – 50 к. Дж/моль): • – ион-дипольное взаимодействие; – водородные связи (ВС): R-H ←: OR 2 СН 3 ОН ← : ОН 2 • Причины образования ВС: – малый радиус иона Н+ и высокая электрическая плотность; – поляризация связи Н-Х и стремление атома Н отдать электрон: С 6 Н 6∙Н+; СНСl 3 - кислота. 17. 02. 2018 31


