Докладчик — Тиллиб Сергей Владимирович Лаборатория молекулярных биотехнологий


Докладчик - Тиллиб Сергей Владимирович Лаборатория молекулярных биотехнологий ФГБУН Институт биологии гена РАН 119334 Москва, ул. Вавилова, 34/5 [email protected] 2013 Белки групп триторакса и поликомба (trxG/PcG) как ключевые эпигенетические факторы поддержания клеточной дифференцировки

Хроматин содержит белки, которые служат структурными организаторами геномной ДНК, способствуют формированию структур более высокого порядка и, в конечном счете, собственно самой хромосомы. Хроматин ограничивает доступ факторов транскрипции к ДНК . Белки групп поликомба и триторакса участвуют в «ремоделировании» хроматина, изменяя доступность ДНК для других факторов, требующихся для транскрипции данного гена. Гены группы поликомба участвуют в репрессии генов, опосредованной формированием «закрытого» хроматина, тогда как гены группы триторакса противодействуют этой репрессии и участвуют в поддержании транскрипции гена и соответственно структуры «открытого» локального хроматина.
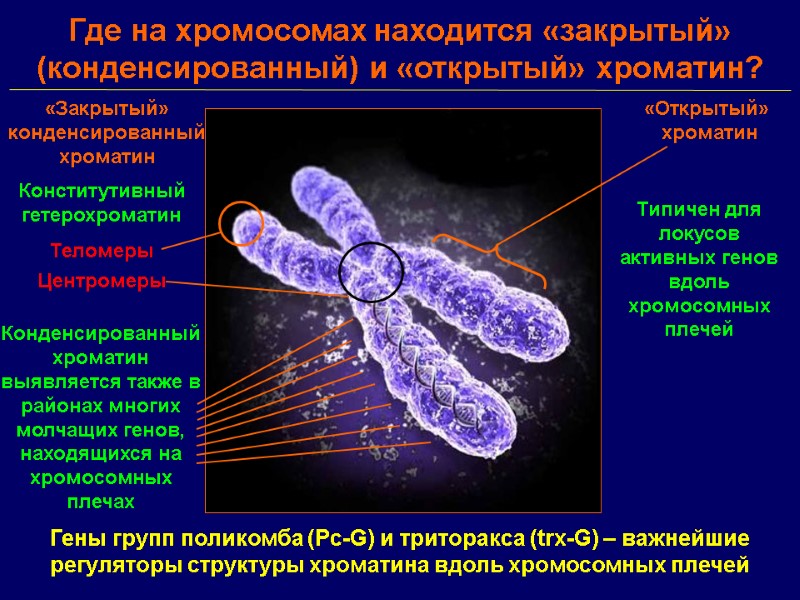
Где на хромосомах находится «закрытый» (конденсированный) и «открытый» хроматин? «Закрытый» конденсированный хроматин «Открытый» хроматин Конститутивный гетерохроматин Теломеры Центромеры Конденсированный хроматин выявляется также в районах многих молчащих генов, находящихся на хромосомных плечах Типичен для локусов активных генов вдоль хромосомных плечей Гены групп поликомба (Pc-G) и триторакса (trx-G) – важнейшие регуляторы структуры хроматина вдоль хромосомных плечей

Если до недавнего времени хроматин условно подразделяли на два подтипа, гетерохроматин и эухроматин, то ряд новых исследований предлагает существенно углубить наше представление о типах хроматина. Так, ван Штинсель (van Steensel) и др. [Fillon et al., 2010] использовали интегративный анализ экспериментальных данных по обогащению в определенных местах генома 53 негистоновых хроматиновых белков и четырех ключевых гистоновых модификаций (с помощью присоединенной к ним бактеральной ДНК-метилазы и последующего картирования сайтов метилирования аденина). По крайней мере, 5 различных типов хроматина, характеризующихся уникальными комбинациями хроматиновых архитектурных белков и гистоновых модификаций, были идентифицированы в клетках Кс167 Drosophila.

Были идентифицированы 3 различных класса репрессированного хроматина: 1) классический гетерохроматин, обнаруживаемый в центромерном райне и обогащенный НР1, Su(var)3-9 и гистоновой модификацией H3K9мe2 2) факультативный гетерохроматин, содержащий белки группы Поликомба и маркированный гистновой модификацией H3K27мe3 Картирование с высоким разрешением (базирующееся на специфичесой иммунопреципитации и последующем анализе последовательностей обогащяющихся фрагментов хроматина) в геноме Drosophila выявило существование протяженных доменов (в несколько десятков тыс.п.н. длиной), содержащих характерные маркеры связывания белков группы Поликомба, модификацированные гистоны Н3К27ме3 и белок PC, а также расположенные в более локализованых участках в этих доменах другие белки группы PcG. Эти домены были названы «Поликомб»-доменами [Nerge et al., 2006; Tolhuis et al., 2006; Schwartz et al., 2006]. 3) новый мажорный вариант («чёрный хроматин», покрывает примерно 48% генома и образует домены в несколько десятков тыс. п.н.), маркированный уникальной комбинацией семи обогощенных белков: гистон Н1, ламин, SUUR (супрессор недорепликации), Su(Hw), D1 (белок, содержащий «АТ-Hook»-домен, IAL (Ipl1-aurora-like kinase), EFF (Effete). Этот новый 3 тип репрессированного хроматина в основном обеднен генами и захватывает наиболее молчащие гены. Гистоновая модификация Н4К20мe3, предположительно, может играть важную роль в формировании этого 3 типа репрессированного хроматина.

В отличие от репрессированных типов хроматина оба идентифицированных типа активного хроматина обогащены гистоновыми модификациями, характерными для активно транскрибирующегося хроматина (Н3К4мe3 и H3K79мe3), и содержат несколько одинаковых хроматиновых белков, вовлеченных в модифицирование гистонов и деконденсацию хроматина. Основные же их отличия следующие. Один тип активного хроматина обогащен гистоновой модификацией – метилированием по Н3К36, а также соответствующим лигандом для этой модификации – Mrg15. Второй же тип активного хроматина отличается тем, что очень рано реплицируется и обогащен большими регуляторными белковыми комплексами.

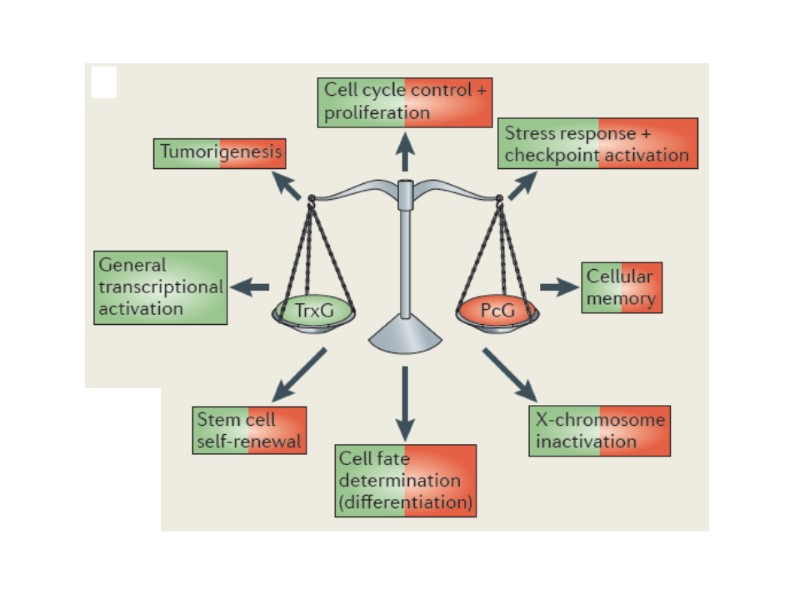
Белки групп поликомба (Polycomb Group, PcG) и триторакса (trithorax Group, trxG): эпигенетические регуляторы функционирования генома Исходно открытые в Drosophila как регуляторы гомеотических (или HOX) генов, отвечают за спецификацию плана формирования тела, а также регулируют многие гены, участвующие в клеточной дифференцировке и пролиферации Поддерживают тканеспецифическое распределение экспрессии генов, передаваемое по наследству дочерним клеткам (эпигенетическая регуляция, «клеточная память») Предполагаемый механизм функционирования: специфическое привлечение хроматин-ремоделирующих активностей к конкретным хромосомным участкам генов-мишеней («гистоновый код»); комбинация цис- и транс-взаимодействий между отдалёнными регуляторными хромосомными элементами («модули клеточной памяти») Эволюционно консервативные механизмы У млекопитающих (у человека), эти белки поддерживают дифференцировку клеток, а также их функция необходима для пролиферации и поддержания разных типов стволовых клеток, включая эмбриональные стволовые клетки. Наконец, эти белки регулируют Х-инактивацию у самок и «геномный импринтинг». Мутации, нарушающие работу этих эпигенетических факторов (PcG и trxG), ведут к серьезным патологиям, индуцируют многие типы раковых заболеваний

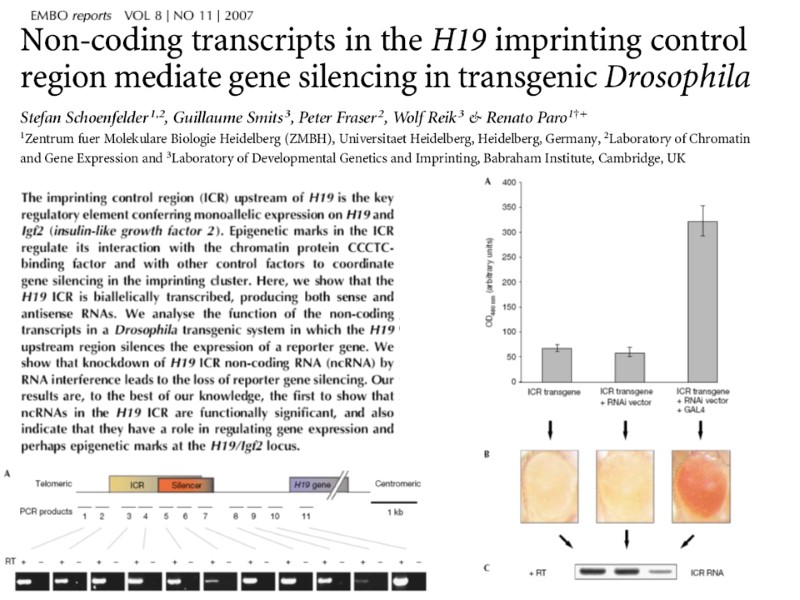
Геномный импринтинг — эпигенетический процесс, при котором экспрессия определенных генов осуществляется в зависимости от того, от какого родителя поступил аллель гена. Это ненаследуемый процесс, который не подчиняется наследованию по Менделю. Примеры: импринтинг генов вызывает экспрессию аллелей гена полученных только от матери в случае генов H19 или CDKN1C и только аллелей от отца в случае гена IGF2. Импринтинг некоторых генов в составе генома показан для насекомых, млекопитающих и цветковых растений.
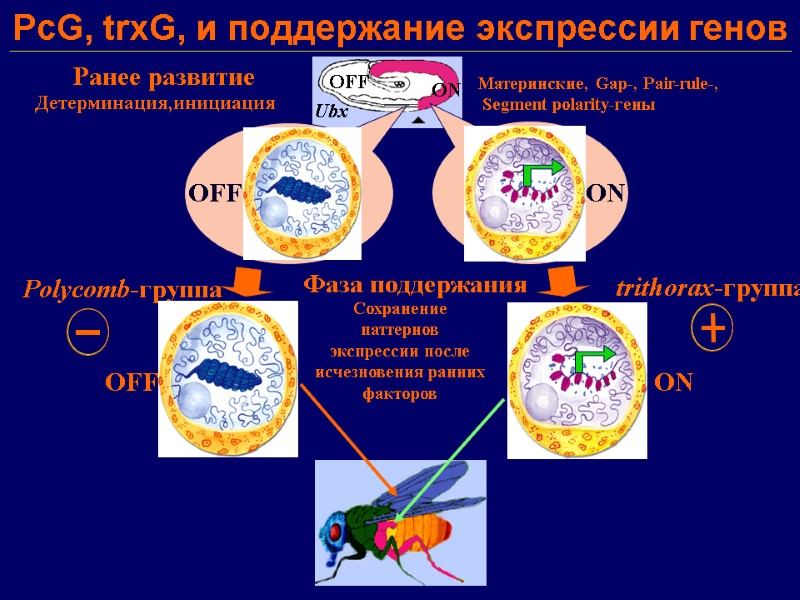
PcG, trxG, и поддержание экспрессии генов Ранее развитие Детерминация,инициация Mатеринские, Gap-, Pair-rule-, Segment polarity-гены ON OFF Ubx Polycomb-группа trithorax-группа Фаза поддержания Сохранение паттернов экспрессии после исчезновения ранних факторов ON OFF ON OFF
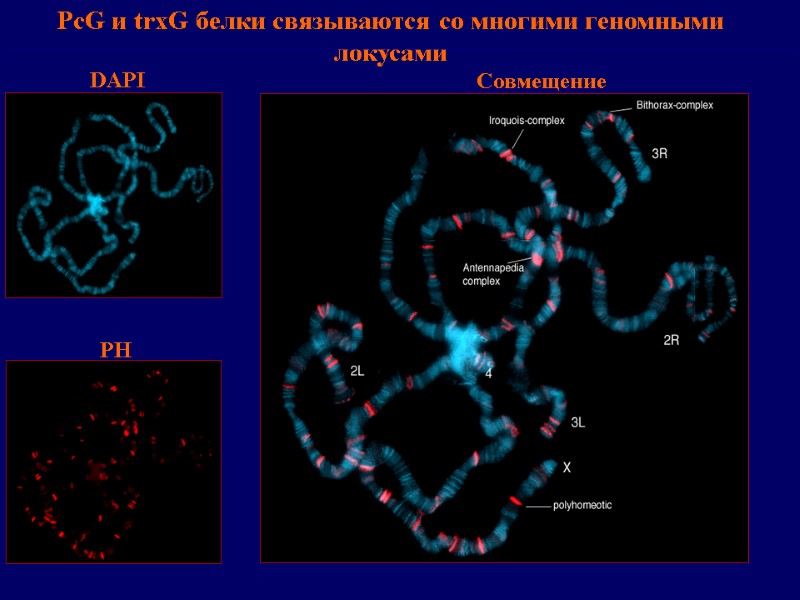
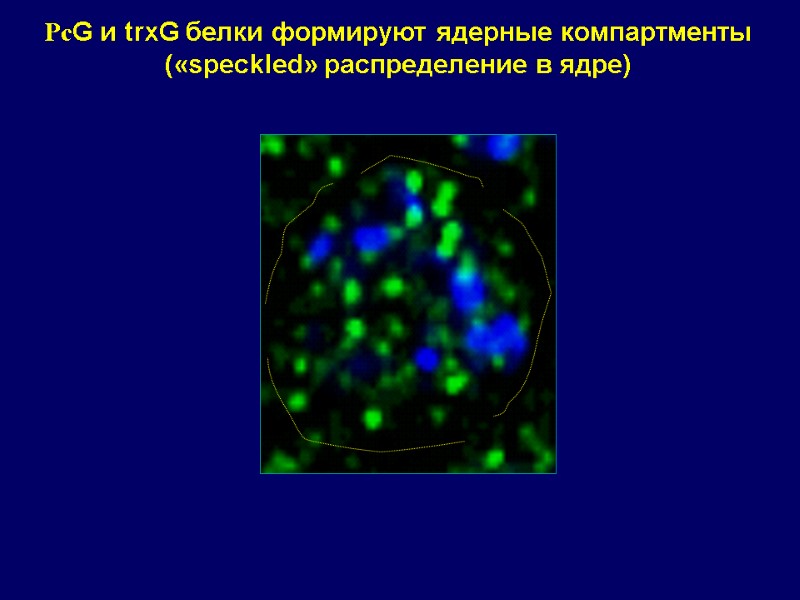
PсG и trxG белки формируют ядерные компартменты («speckled» распределение в ядре)

Связывание необходимо для поддержания репрессии (или усиления уровня экспрессии) репортерных генов Связаны с PcG/trxG-белками in vivo (на политенных хромосомах, в Х-СhIP экспериментах) Репрессия (или активация) усиливаются в присутствии множественных копий PRE/TRE (“pairing”-эффект) PcG и trxG белки осуществляют свою функцию посредством взаимодействия со специфическими регуляторными цис-элементами, PRE/TRE PRE и TRE обычно колокализуются (перекрываются)

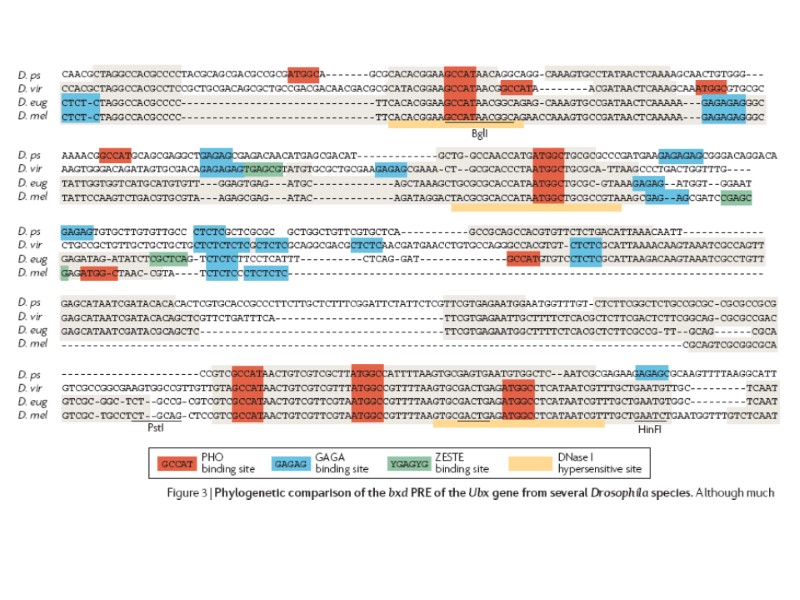
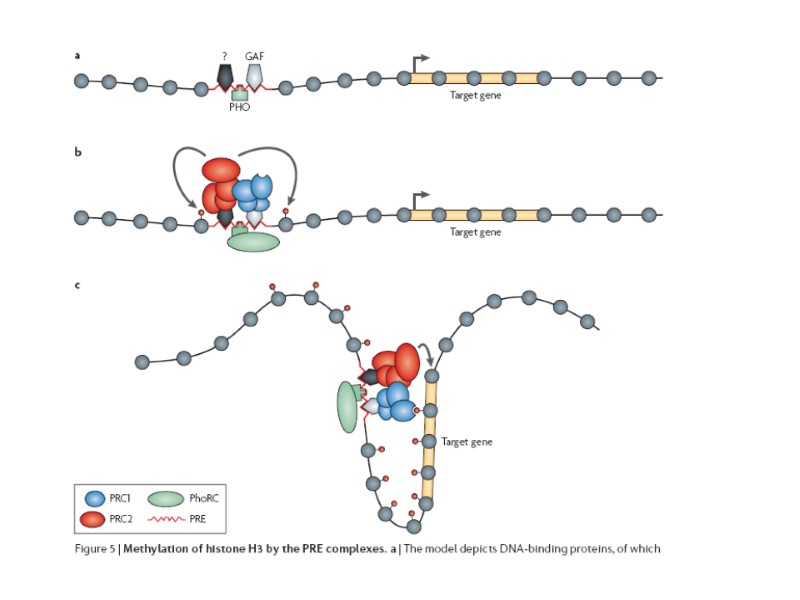
Анализ нескольких PRE/TRE дрозофилы не обнаружил в них протяженных гомологичных последовательностей, однако выявил их обогащение участками связывания для нескольких ДНК-связывающих белков: Pleihomeotic (PHO) and Pleihomeotic-like (PHOL), GAGA factor (GAF)/Pipsqueak (PSQ), Zeste, DSP (Dorsal switch protein), CtBP Grainyhead (GRH) и членов семейства Sp1/KLF. [GAF, Pipsqueak и Zeste не консервативны у позвоночных]. Число и топологическая организация этих сайтов существенно варьируют в разных PRE/TRE. PRE/TRE на сегодняшний день были функционально охарактеризованы только в геноме Drosophila. PRE/TRE определяются как элементы хромосом, которые необходимы и достаточны для рекрутирования PcG/trxG-комплексов и для соответствующего поддержания в репрессированном/активном состоянии фланкирующих промоторов.
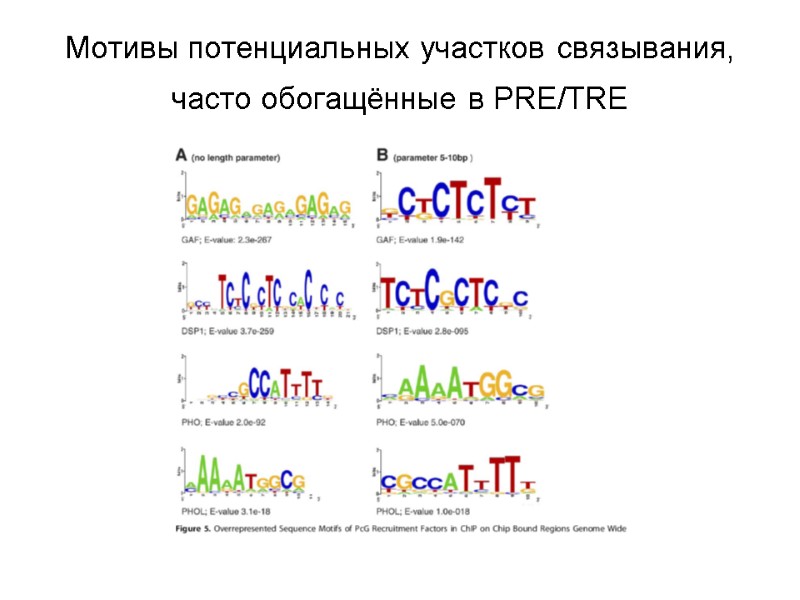
Мотивы потенциальных участков связывания, часто обогащённые в PRE/TRE

PcG-белки выявляются в составе многокомпонентных комплексов 1 комплекс, PhoRC, содержит ДНК-связывающий белок PHO (его гомолог у млекопитающих - YY1) и белок dSfmbt, узнающий моно- и диметилированные по Н3К9 и Н4К20 концы гистонов Н3 и Н4 2 комплекс, E(Z)/ESC, или Polycomb Repressive Complex 2 (PRC2), содержит 4 коровых белка: гистон-метилтрансферазу Enhancer of Zeste (E(Z)), Extra sex combs (ESC), Suppressor of zeste-12 (SU(Z)12), и ремоделирующий нуклеосому фактор 55 (NURF-55). E(Z) триметилирует лизин 27 гистона H3 (H3K27me3), и, несколько менее выраженно, лизин 9 гистона H3 (H3K9me3). 3 комплекс, PRC1, узнает эти метилированные знаки с помощью «хромодомена» белка Polycomb (PC). PC является стехиометрическим компонентом PRC1 наряду с Polyhomeotic (PH), Posterior Sex Combs (PSC), and dRING. У млекопитающих дупликация многих PcG-генов способствует большей вариабельности в составе комплексов, различающихся в разных типах клеток и на разных стадиях развития.
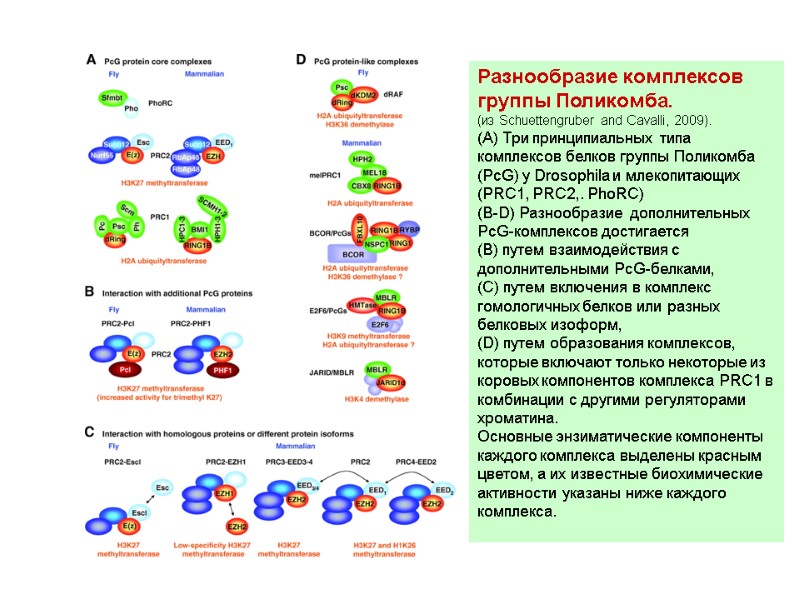
Разнообразие комплексов группы Поликомба. (из Schuettengruber and Cavalli, 2009). (A) Три принципиальных типа комплексов белков группы Поликомба (PcG) у Drosophila и млекопитающих (PRC1, PRC2,. PhoRC) (B-D) Разнообразие дополнительных PcG-комплексов достигается (В) путем взаимодействия с дополнительными PcG-белками, (С) путем включения в комплекс гомологичных белков или разных белковых изоформ, (D) путем образования комплексов, которые включают только некоторые из коровых компонентов комплекса PRC1 в комбинации с другими регуляторами хроматина. Основные энзиматические компоненты каждого комплекса выделены красным цветом, а их известные биохимические активности указаны ниже каждого комплекса.

Предполагаемый ступенчатый процесс формирования репрессионного комплекса 1 - Связывание комплекса PhoRC 2 - Привлечение комплекса PRC2 через взаимодействие с PhoRC 3 - PRC2-зависимая модификация гистонов (H3K27me3) в месте формирования комплекса 4 - Привлечение комплекса PRC1 через узнавание и связывание РС с H3K27me3 Однако, это лишь очень упрощённое представление. Только лишь PHO/PHOL-сайты связывания не достаточны для образования РС-репрессионного комплекса.

Хроматиновые комплексы группы Поликомба (PcG) у дрозофилы Bantignies and Cavalli (2011) Trends in Genetics
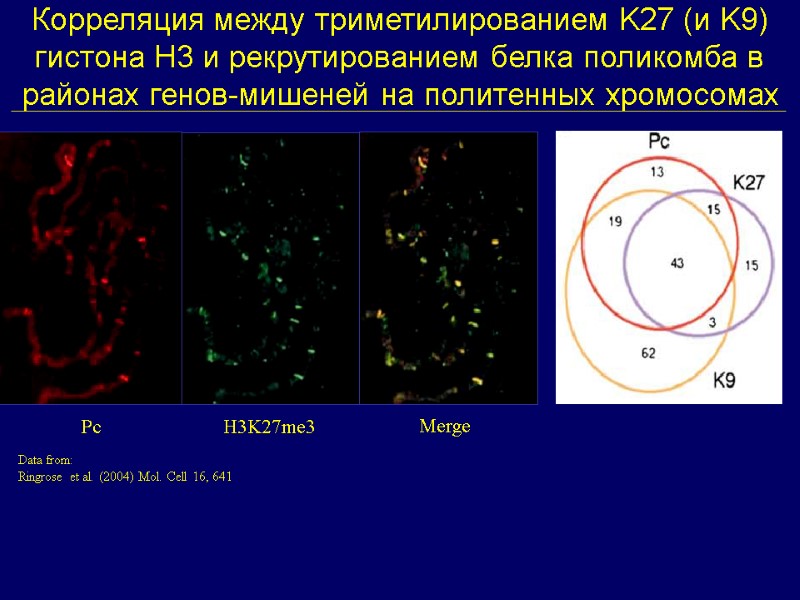
Корреляция между триметилированием K27 (и K9) гистона Н3 и рекрутированием белка поликомба в районах генов-мишеней на политенных хромосомах Pc H3K27me3 Merge Data from: Ringrose et al. (2004) Mol. Cell 16, 641

Что делает Polycomb с хроматином ? Конденсация хроматина Francis et al. (2004), Science 306, 1574 Рекомбинантные PC-содержащие комплексы способны конденсировать in vitro минихромосому из 12 нуклеосом
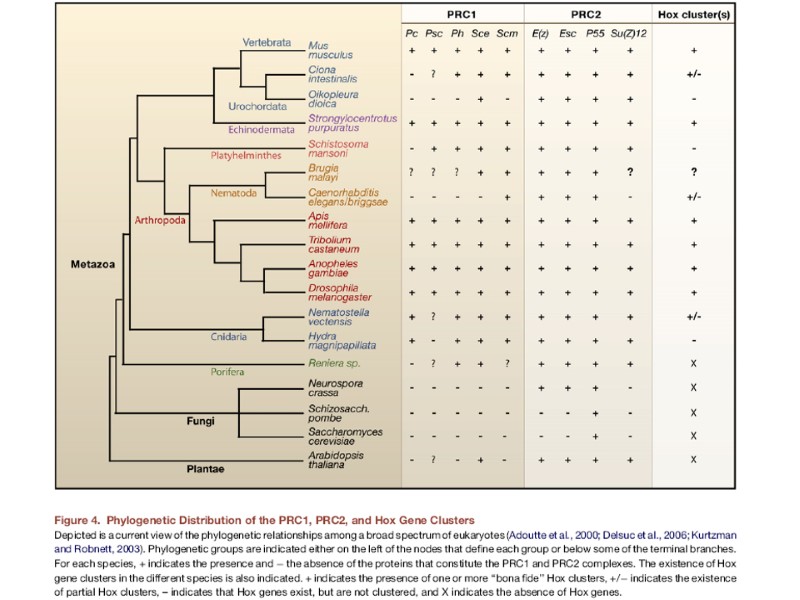
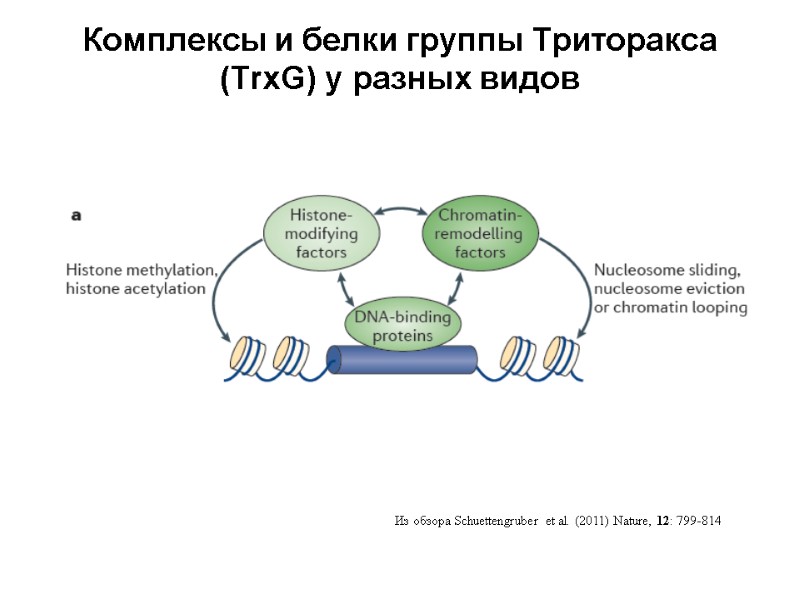
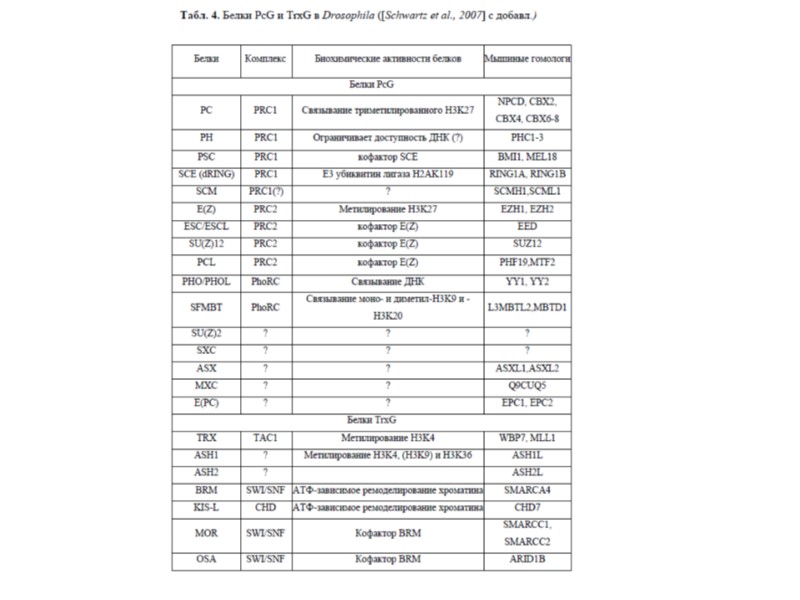
Комплексы и белки группы Триторакса (TrxG) у разных видов Из обзора Schuettengruber et al. (2011) Nature, 12: 799-814
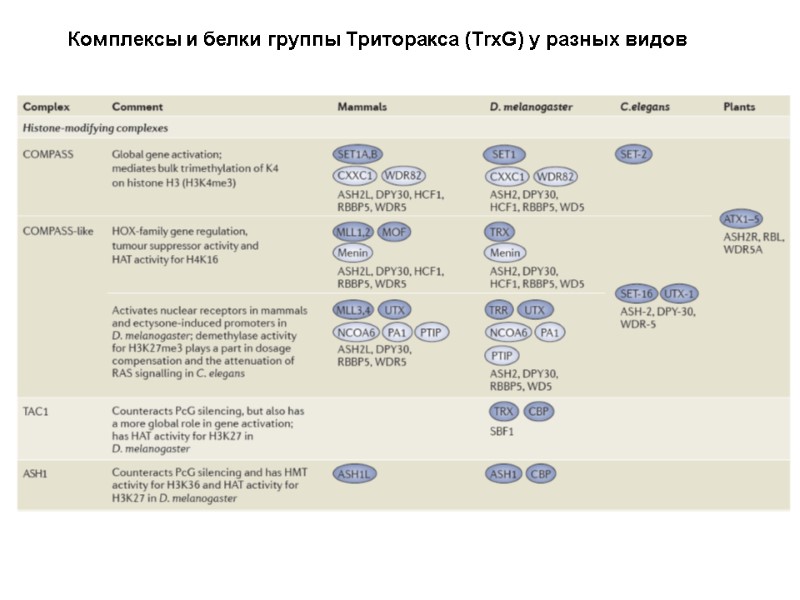
Комплексы и белки группы Триторакса (TrxG) у разных видов

Комплексы и белки группы Триторакса (TrxG) у разных видов CHD = “Chromodomain-Helicase-DNA” binding
![Эволюционное разнообразие SWI/SNF-комплексов (из [Ho and Crabtree, 2010]). Гомологичные субъединицы комплексов дрожжей Saccharomyces cerevisiae Эволюционное разнообразие SWI/SNF-комплексов (из [Ho and Crabtree, 2010]). Гомологичные субъединицы комплексов дрожжей Saccharomyces cerevisiae](https://present5.com/presentacii-2/20171208\10072-trx-pc_talk-110313.ppt\10072-trx-pc_talk-110313_27.jpg)
Эволюционное разнообразие SWI/SNF-комплексов (из [Ho and Crabtree, 2010]). Гомологичные субъединицы комплексов дрожжей Saccharomyces cerevisiae (Yeast Swi/Snf), Drosophila melanogaster (BAP, Brahma(BRM)-ассоциированные белки, и PBAP, polybromo-содержащий BAP; на рис. оба варианта показаны вместе как ВАР-комплексы) и мыши (комбинаций различных субъединиц ведут к образованию огромного разнообразия BAF-комплексов, содержащих brahma-ассоциированные факторы, BAF) обозначены одинаковыми фигурами и выделены одним цветом. Домены субъединиц, которые могут взаимодействовать с ДНК или гистоновыми модификациями показаны на поверхности соответствующих белков (объяснение - на рисунке сверху слева). В случае комплексов дрозофилы обозначены белки группы Триторакса: MOR (Moira), OSA, BRM (Brahma), SAYP (“supporter of activation of yellow protein”, E(y)3).
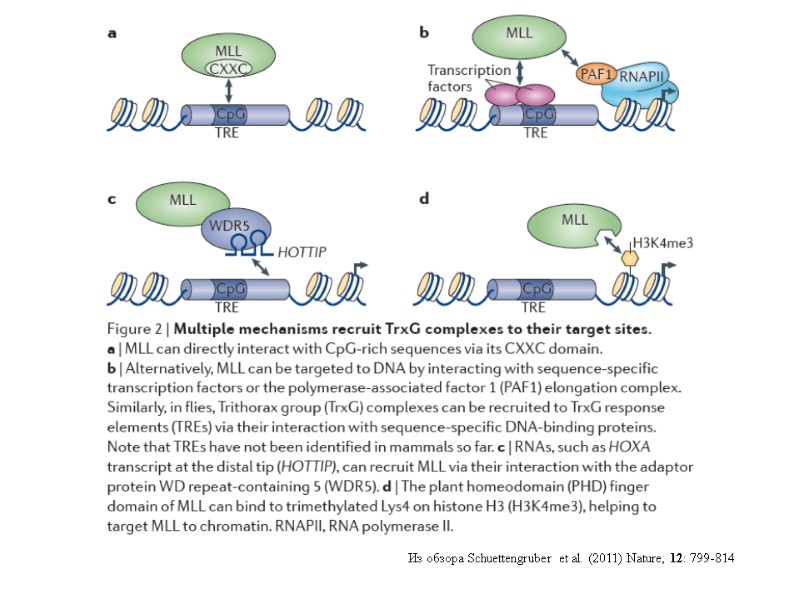
Из обзора Schuettengruber et al. (2011) Nature, 12: 799-814

OFF ON trxG Maintenance of active states (open chromatin) PRE Target gene Histone acetylation and methylation (TAC1 and ASH1 complexes) Deacetylation and methylation (ESC-E(Z) complex) Maintenance of repressed states (compact chromatin) PcG - Chromatin compaction - H2A Ubiquitination (PRC1 complex) Nucleosome remodeling (BRM complex) Ac Me K27 H3 Action of PcG and trxG complexes on chromatin Me K4 H3 Ub H2A
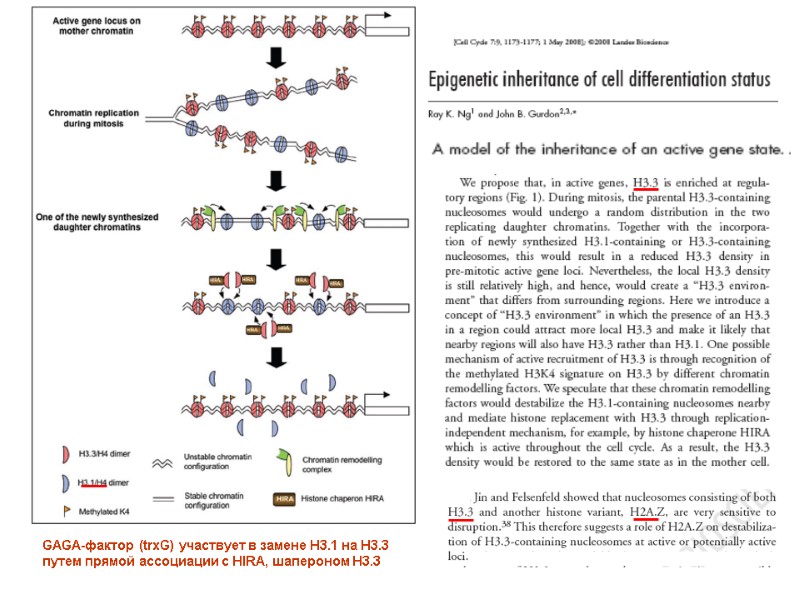
GAGA-фактор (trxG) участвует в замене H3.1 на Н3.3 путем прямой ассоциации с HIRA, шапероном Н3.3
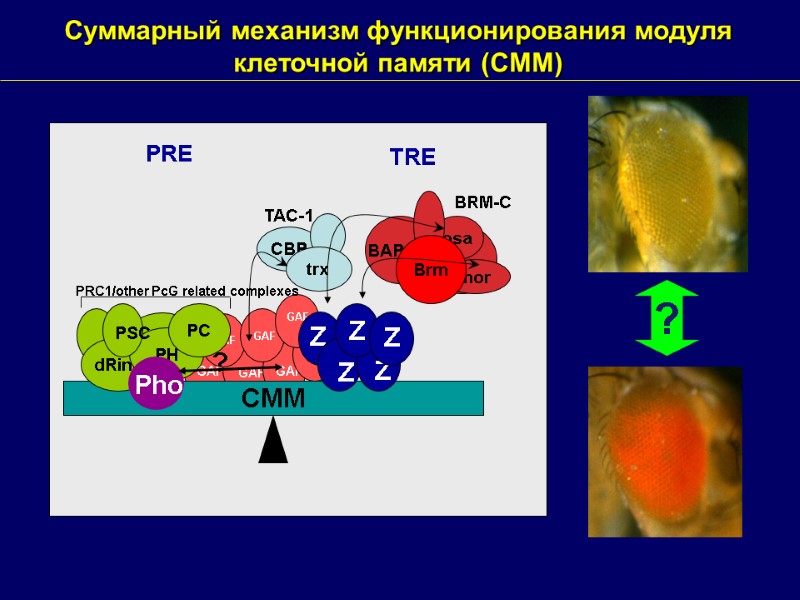
Суммарный механизм функционирования модуля клеточной памяти (CMM) CBP CMM dRing PH PC PRC1/other PcG related complexes PSC Z Z Z Z PRE TRE BAP111 osa mor BRM-C Brm ? trx TAC-1 ? Z
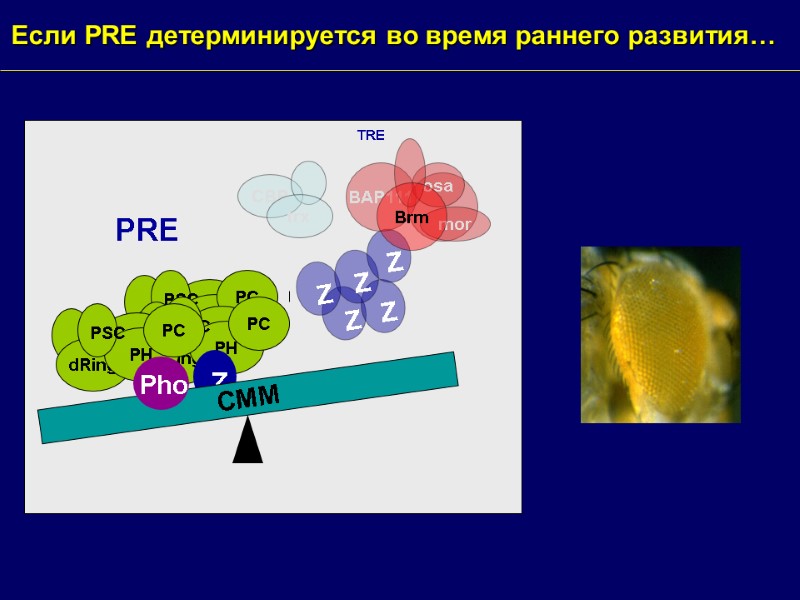
Если PRE детерминируется во время раннего развития… dRing PH PC PSC dRing PH PC PSC CMM dRing PH PC PSC PRE CBP Z Z Z Z Z BAP111 osa mor Brm trx TRE

… и когда функция TRE активируется CMM PRE TRE
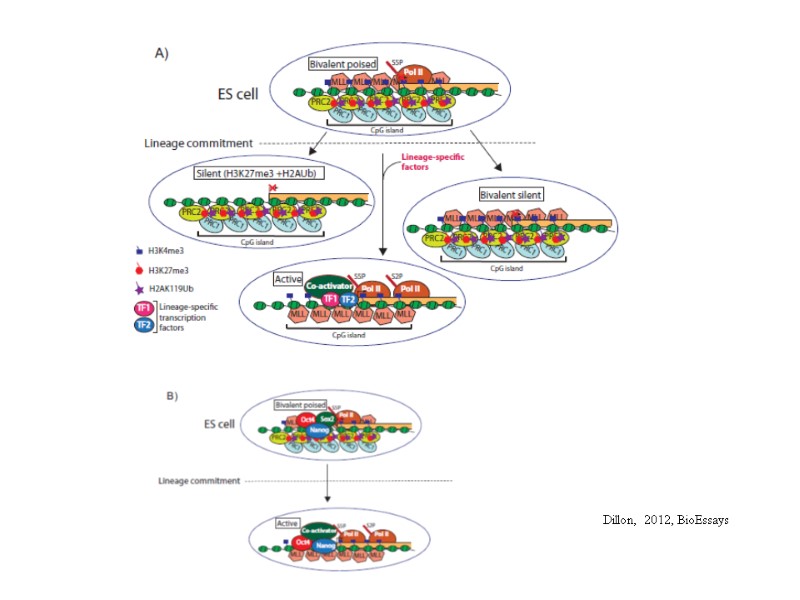
Dillon, 2012, BioEssays

Стабильное сохранение наследуемых потенциально обратимых модификаций локального хроматина (сохранение «клеточной памяти»). Механизмы поддержания эпигенетической информации на двух принципиальных стадиях клеточного цикла: репликации и митоза. Эпигенетическими называют такие «наследуемые изменения функционирования гена, которые не могут быть объяснены изменениями в последовательности ДНК» этого гена При репликации ДНК эпигенетическая информация должна быть передана в полной мере обеим дочерним цепям ДНК Во время митоза хроматин может конденсироваться в 10000 раз Основные описанные молекулярные механизмы: метилирование ДНК, модификации гистонов, белки групп Polycomb-G/Trithorax-G, некодирующие РНК, структурная организация генома в ядре

Гипотетический механизм воспроизведения (сохранения) модификаций гистонов и связанных с ними белков на дочерних цепях ДНК после репликации - ?
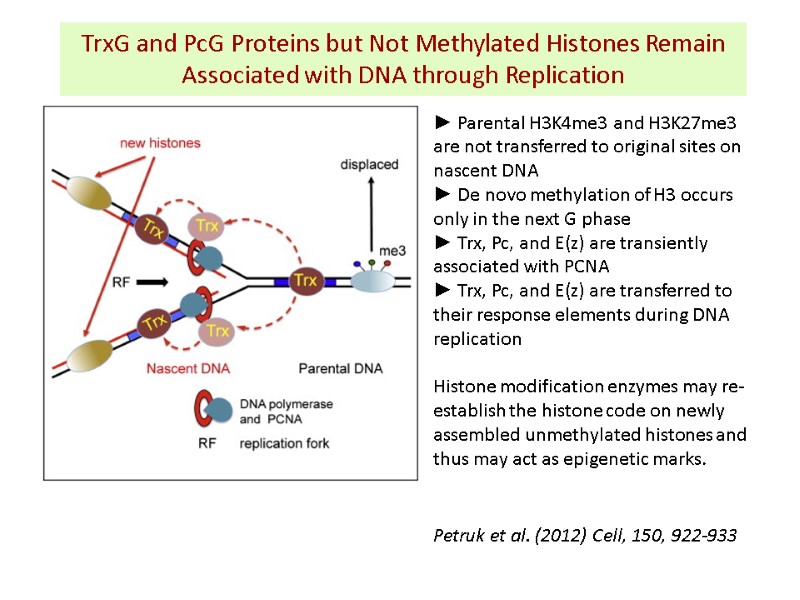
TrxG and PcG Proteins but Not Methylated Histones Remain Associated with DNA through Replication Petruk et al. (2012) Cell, 150, 922-933 ► Parental H3K4me3 and H3K27me3 are not transferred to original sites on nascent DNA ► De novo methylation of H3 occurs only in the next G phase ► Trx, Pc, and E(z) are transiently associated with PCNA ► Trx, Pc, and E(z) are transferred to their response elements during DNA replication Histone modification enzymes may re-establish the histone code on newly assembled unmethylated histones and thus may act as epigenetic marks.
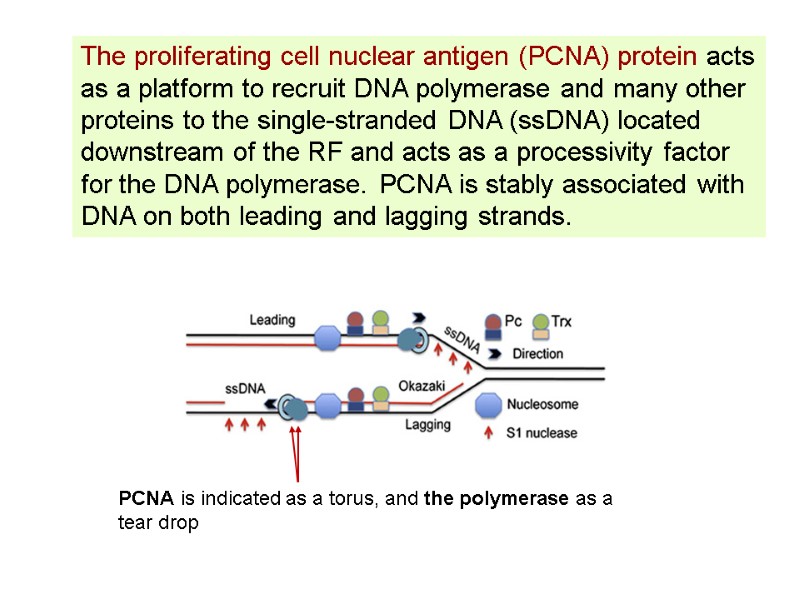
The proliferating cell nuclear antigen (PCNA) protein acts as a platform to recruit DNA polymerase and many other proteins to the single-stranded DNA (ssDNA) located downstream of the RF and acts as a processivity factor for the DNA polymerase. PCNA is stably associated with DNA on both leading and lagging strands. PCNA is indicated as a torus, and the polymerase as a tear drop

A model for the reconstitution of chromatin structure during DNA replication. MP, maintenance proteins (TrxG and PcG); RF, replication fork.




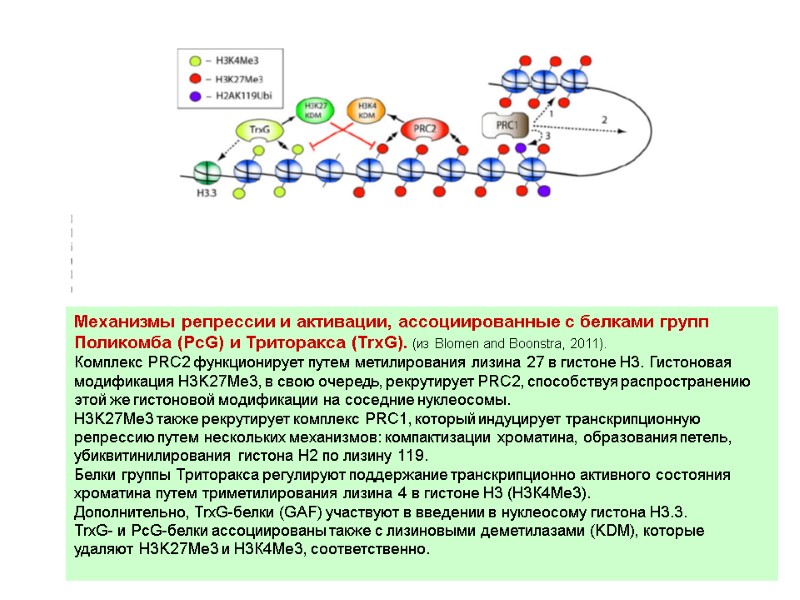
Механизмы репрессии и активации, ассоциированные с белками групп Поликомба (PcG) и Триторакса (TrxG). (из Blomen and Boonstra, 2011). Комплекс PRC2 функционирует путем метилирования лизина 27 в гистоне Н3. Гистоновая модификация H3K27Me3, в свою очередь, рекрутирует PRC2, способствуя распространению этой же гистоновой модификации на соседние нуклеосомы. H3K27Me3 также рекрутирует комплекс PRC1, который индуцирует транскрипционную репрессию путем нескольких механизмов: компактизации хроматина, образования петель, убиквитинилирования гистона Н2 по лизину 119. Белки группы Триторакса регулируют поддержание транскрипционно активного состояния хроматина путем триметилирования лизина 4 в гистоне Н3 (Н3К4Ме3). Дополнительно, TrxG-белки (GAF) участвуют в введении в нуклеосому гистона Н3.3. TrxG- и PcG-белки ассоциированы также с лизиновыми деметилазами (KDM), которые удаляют H3K27Me3 и Н3К4Ме3, соответственно.
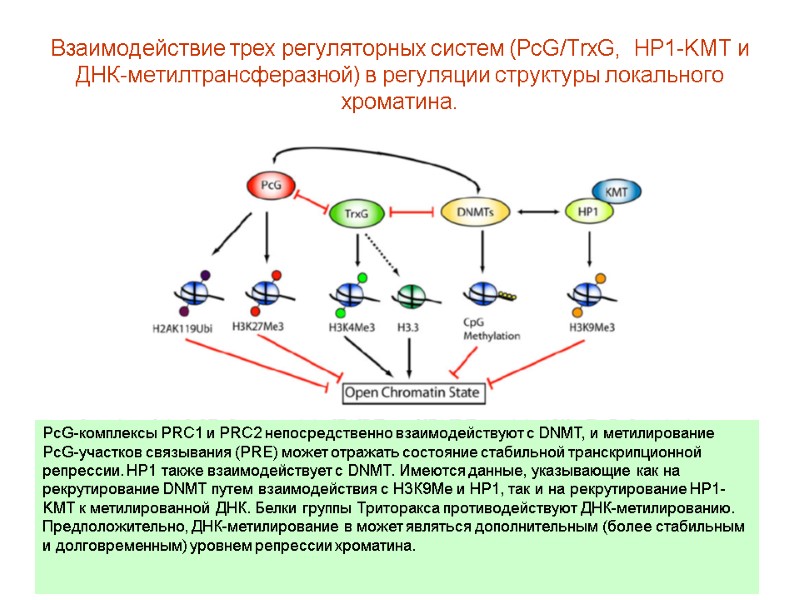
Взаимодействие трех регуляторных систем (PcG/TrxG, HP1-KMT и ДНК-метилтрансферазной) в регуляции структуры локального хроматина. PcG-комплексы PRC1 и PRC2 непосредственно взаимодействуют с DNMT, и метилирование PcG-участков связывания (PRE) может отражать состояние стабильной транскрипционной репрессии. HP1 также взаимодействует с DNMT. Имеются данные, указывающие как на рекрутирование DNMT путем взаимодействия с Н3К9Ме и HP1, так и на рекрутирование HP1-KMT к метилированной ДНК. Белки группы Триторакса противодействуют ДНК-метилированию. Предположительно, ДНК-метилирование в может являться дополнительным (более стабильным и долговременным) уровнем репрессии хроматина.
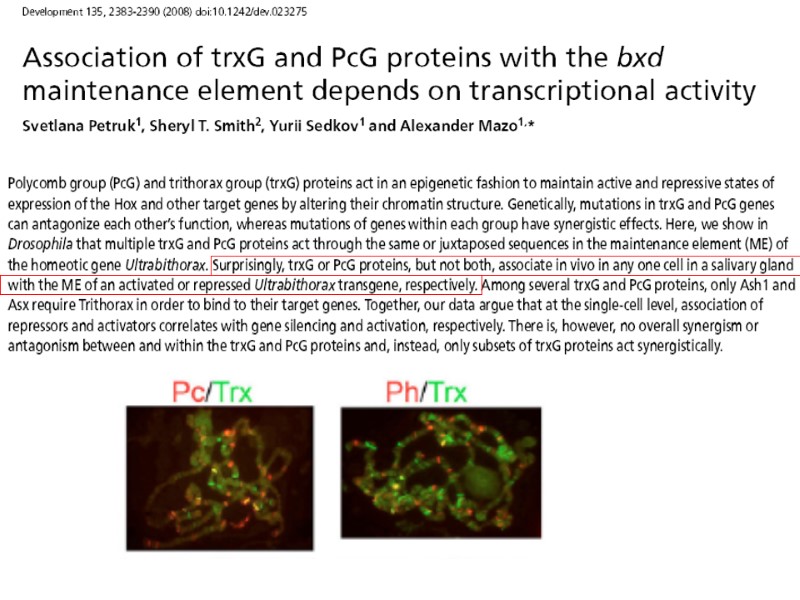

Особенности PRE и TRE, и примеры того, как их изучают в случае Drosophila (У позвоночных они пока совсем мало изучены )
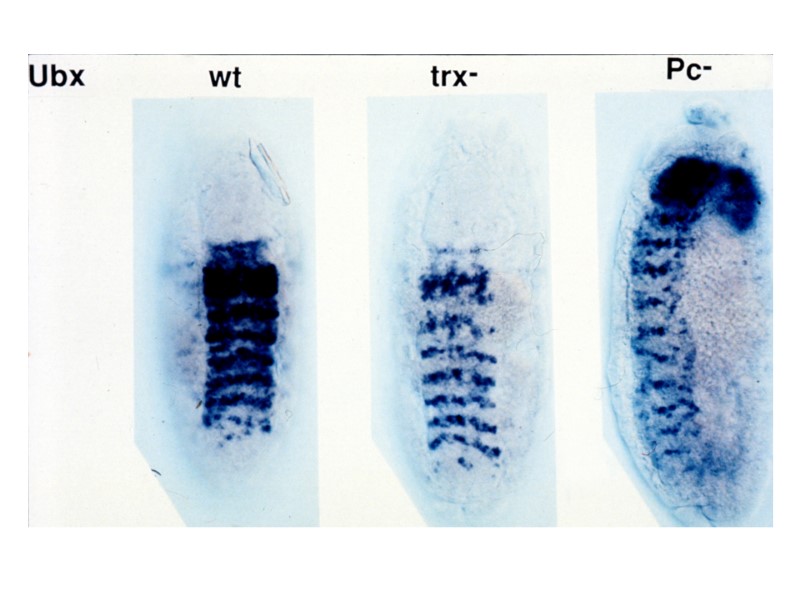
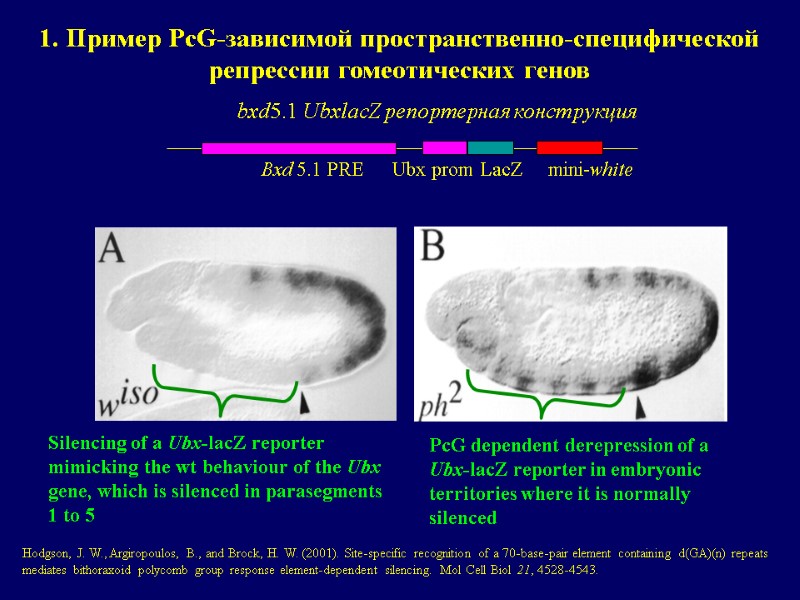
1. Пример PcG-зависимой пространственно-специфической репрессии гомеотических генов PcG dependent derepression of a Ubx-lacZ reporter in embryonic territories where it is normally silenced Silencing of a Ubx-lacZ reporter mimicking the wt behaviour of the Ubx gene, which is silenced in parasegments 1 to 5 bxd5.1 UbxlacZ репортерная конструкция Bxd 5.1 PRE Ubx prom LacZ mini-white Hodgson, J. W., Argiropoulos, B., and Brock, H. W. (2001). Site-specific recognition of a 70-base-pair element containing d(GA)(n) repeats mediates bithoraxoid polycomb group response element-dependent silencing. Mol Cell Biol 21, 4528-4543.
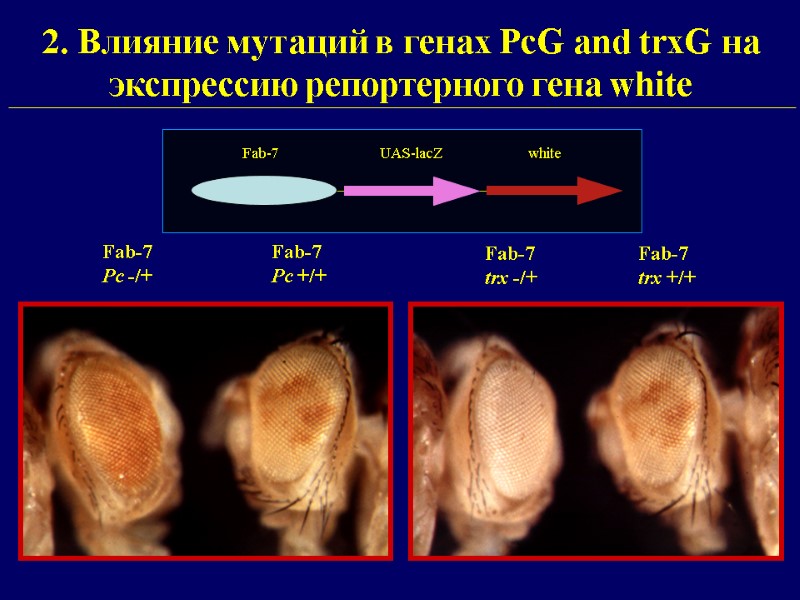
2. Влияние мутаций в генах PcG and trxG на экспрессию репортерного гена white Fab-7 Pc +/+ Fab-7 Pc -/+ Fab-7 trx +/+ Fab-7 trx -/+

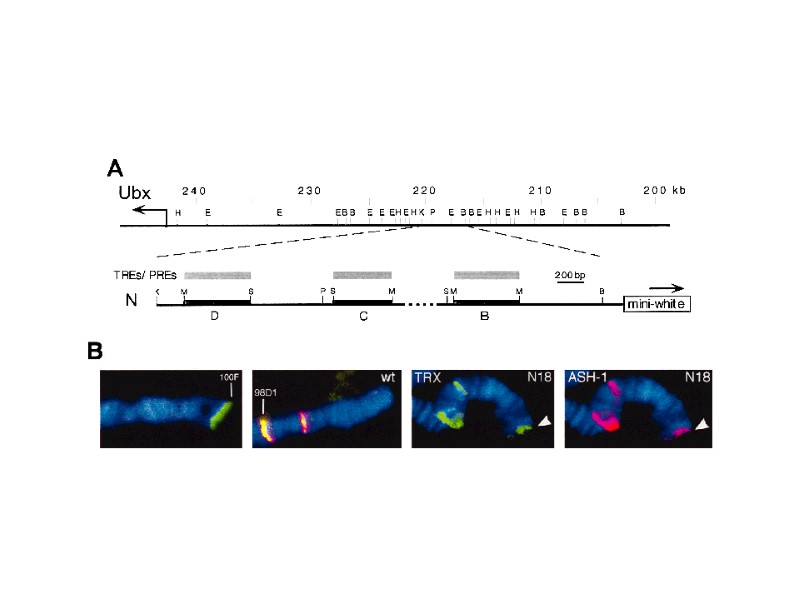

Рекрутирование PcG- and trxG-белков на PRE/TRE: анализ с помощью ChIP (иммунопреципитации сшитого in vivo и затем дробленого ультразвуком хроматина)

Дробление ультразвуком и получение хроматина (размер около 0,5-1 тыс. п.н.) Добавление антител и очистка комплексов антитело-хроматин на белок А -сефарозе, очиска ДНК и ее ПЦР-амплификация Фиксация клеток или эмбрионов формальдегидом для сшивки непосредственно контактирующих белков и участков ДНК Использование амплифицированной ДНК в качестве пробы для гибридизации на геномных ДНК-чипах. ChIP on chip
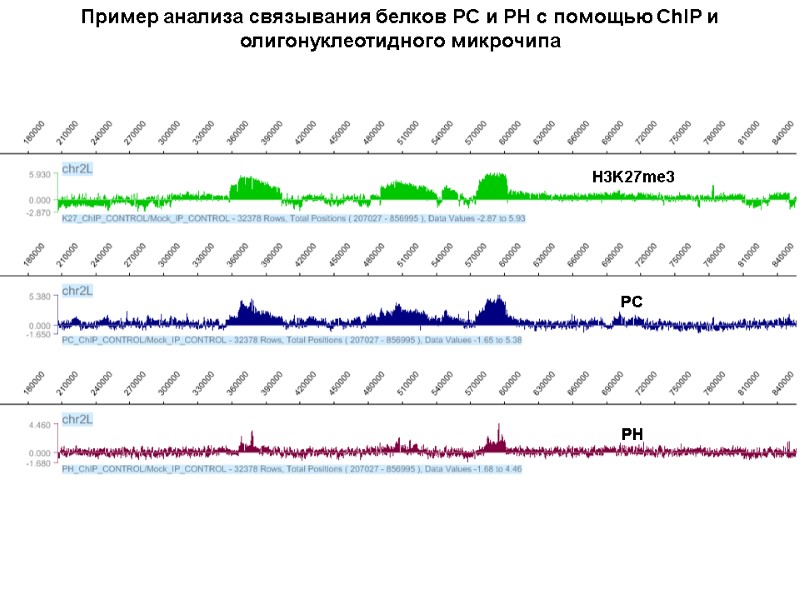
Пример анализа связывания белков PC и PH с помощью ChIP и олигонуклеотидного микрочипа PH PC H3K27me3
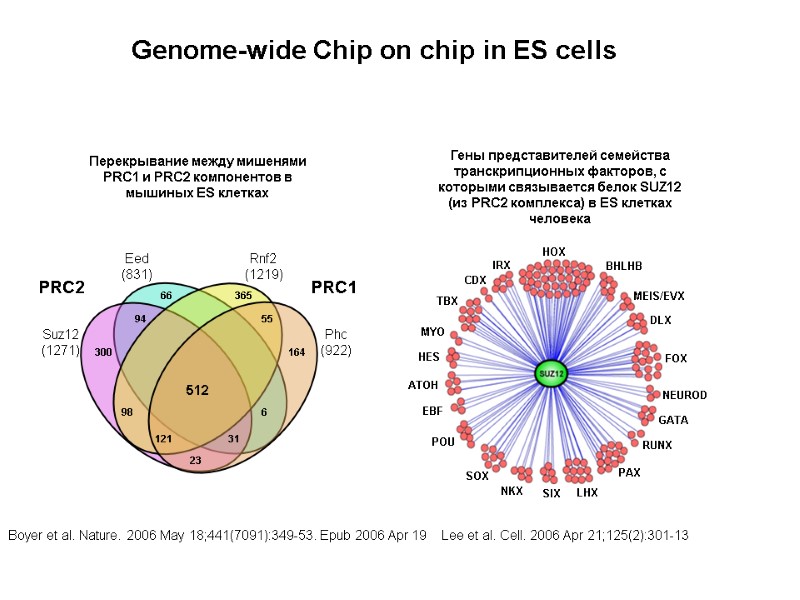
GATA ATOH LHX POU IRX DLX SIX NEUROD BHLHB PAX FOX HOX SOX TBX NKX HES EBF RUNX MYO CDX MEIS/EVX Гены представителей семейства транскрипционных факторов, с которыми связывается белок SUZ12 (из PRC2 комплекса) в ES клетках человека Перекрывание между мишенями PRC1 и PRC2 компонентов в мышиных ES клетках Eed (831) Suz12 (1271) Rnf2 (1219) Phc (922) PRC2 PRC1 66 94 300 98 6 164 55 365 121 31 512 23 Genome-wide Chip on chip in ES cells Lee et al. Cell. 2006 Apr 21;125(2):301-13 Boyer et al. Nature. 2006 May 18;441(7091):349-53. Epub 2006 Apr 19

Иммуннопреципитационное картирование TRX-ассоциированных элементов хроматина в промоторной области гена fkh в клетках слюнных желёз D. melanogaster
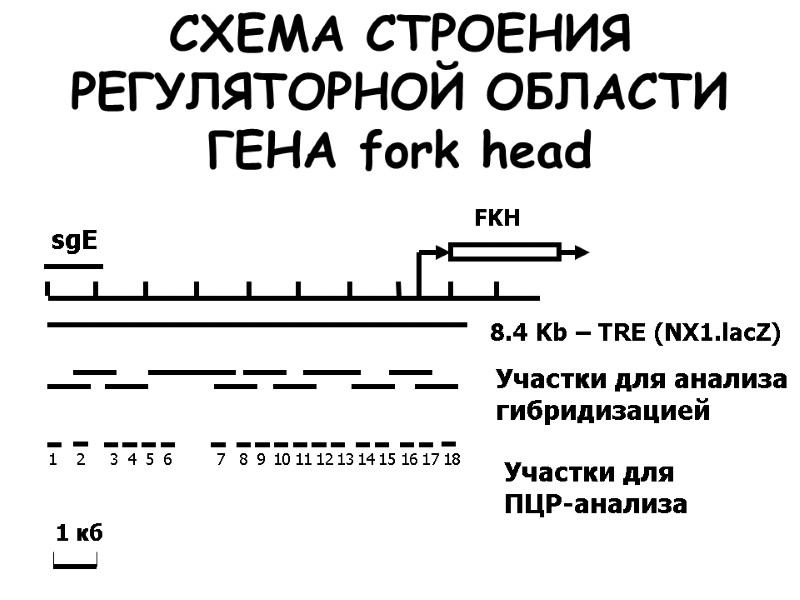
8.4 Kb – TRE (NX1.lacZ) СХЕМА СТРОЕНИЯ РЕГУЛЯТОРНОЙ ОБЛАСТИ ГЕНА fork head Участки для анализа гибридизацией Участки для ПЦР-анализа sgE 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18
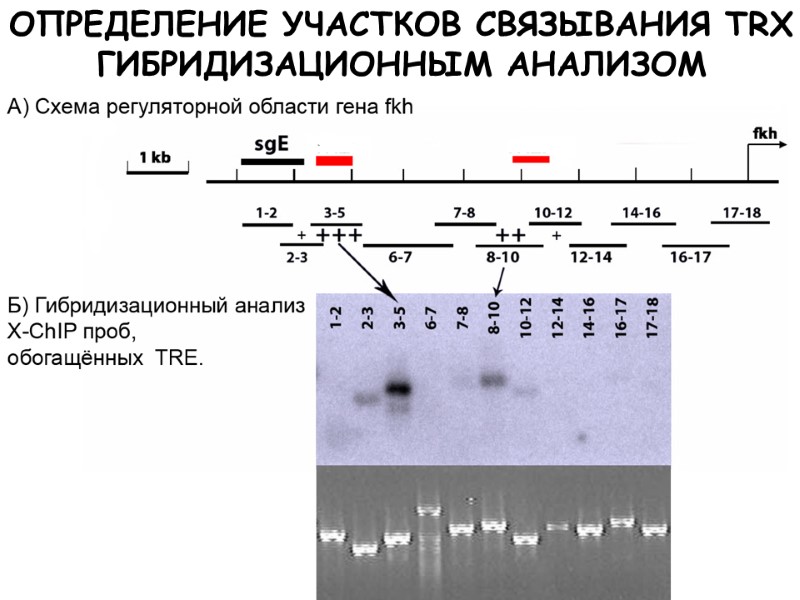
ОПРЕДЕЛЕНИЕ УЧАСТКОВ СВЯЗЫВАНИЯ TRX ГИБРИДИЗАЦИОННЫМ АНАЛИЗОМ

ОПРЕДЕЛЕНИЕ УЧАСТКОВ СВЯЗЫВАНИЯ TRX МЕТОДОМ ПРЯМОГО ПЦР С X-ChIP ПРОБ

8.4 Kb – TRE (NX1.lacZ) СХЕМА ОБОГАЩЕНИЯ ФРАГМЕНТОВ ПРИ ИММУННОПРЕЦИПИТАЦИИ С АНТИТЕЛАМИ С TRX фрагменты для анализа гибридизацией фрагменты для ПЦР-анализа sgE Участки, выбранные для дальнейшего анализа 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 FKH3-4 FKH9-11

Исследование функциональной значимости гипотетических TRE in vivo при помощи трансгенных конструкций
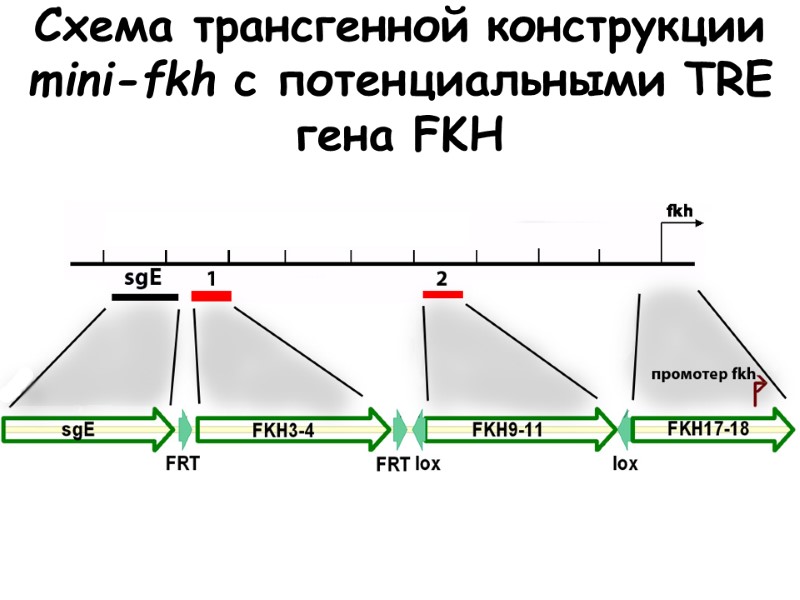
Схема трансгенной конструкции mini-fkh с потенциальными TRE гена FKH
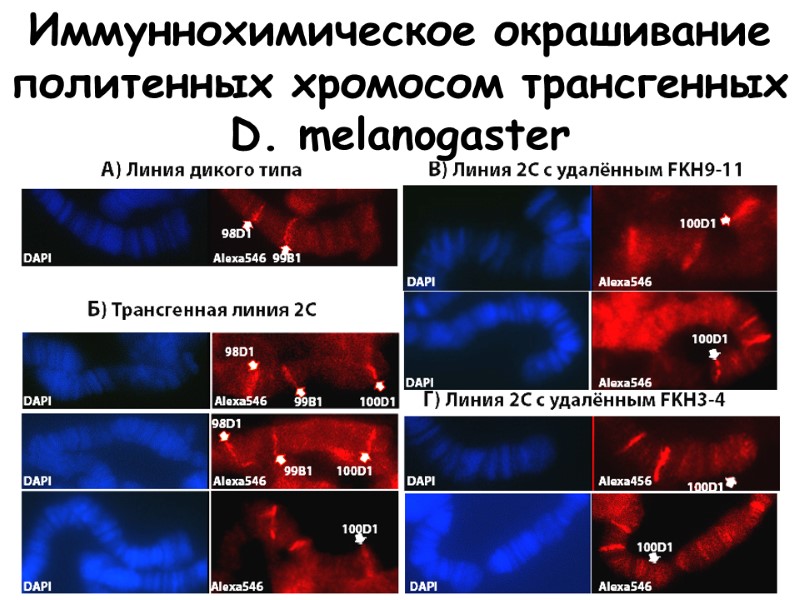
Иммуннохимическое окрашивание политенных хромосом трансгенных D. melanogaster
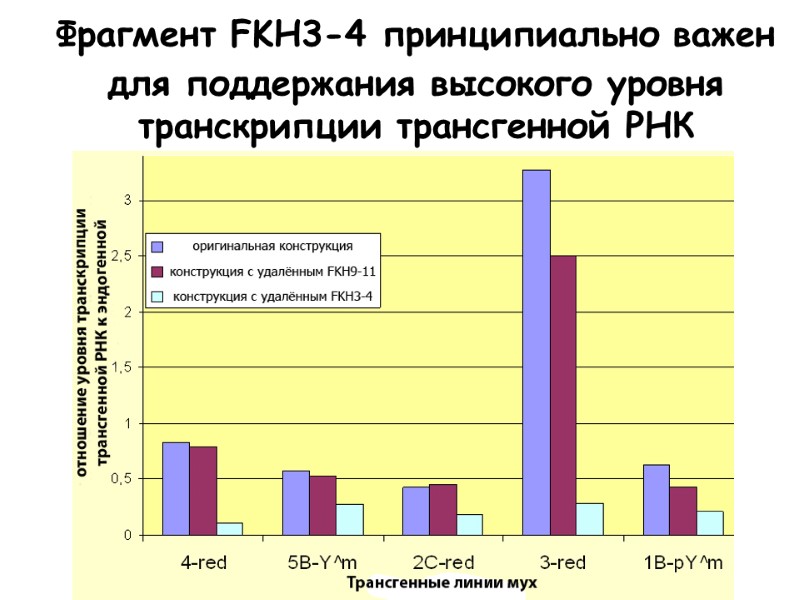
Фрагмент FKH3-4 принципиально важен для поддержания высокого уровня транскрипции трансгенной РНК

Анализ распределения модифицированных гистонов в промоторной области гена fkh
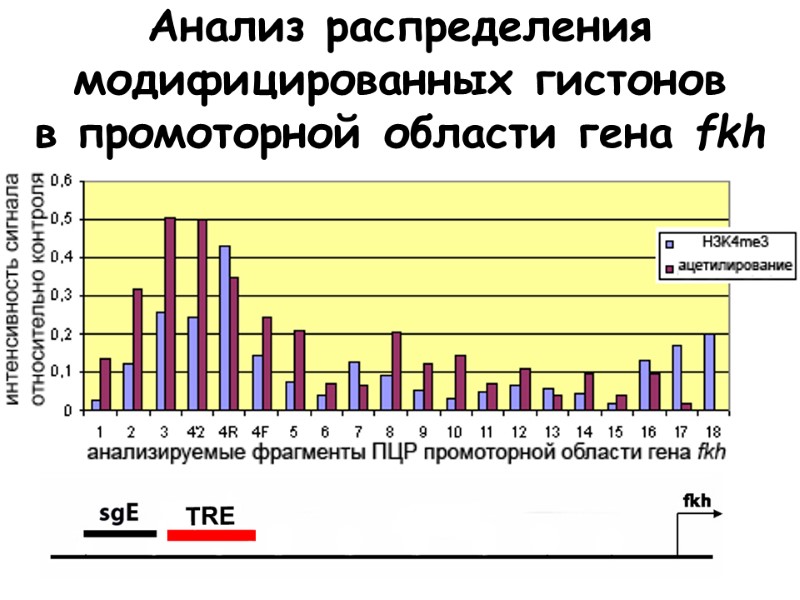
Анализ распределения модифицированных гистонов в промоторной области гена fkh

Демонстрация колокализации TRE c элементами хроматина, ассоциированными со структурами ядерного скелета
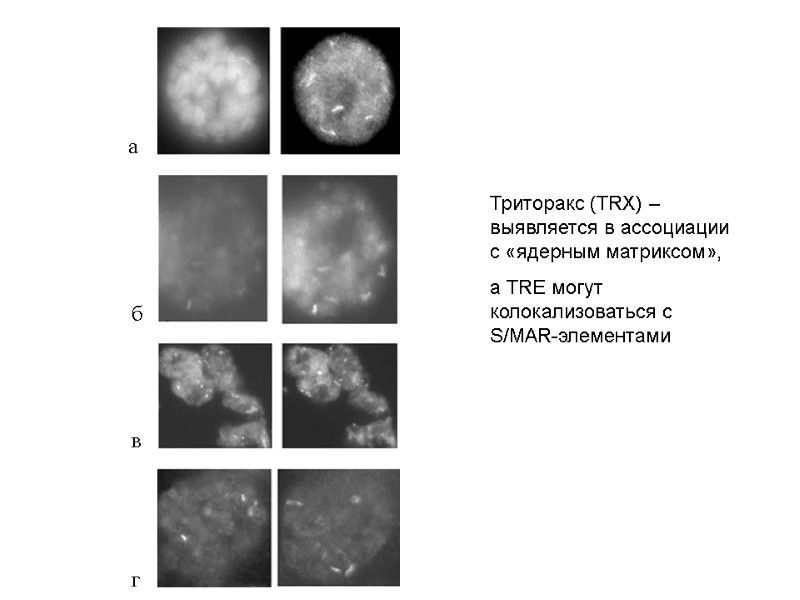
Триторакс (TRX) – выявляется в ассоциации с «ядерным матриксом», а TRE могут колокализоваться с S/MAR-элементами

Взаимодействие между различными (копиями) PREs
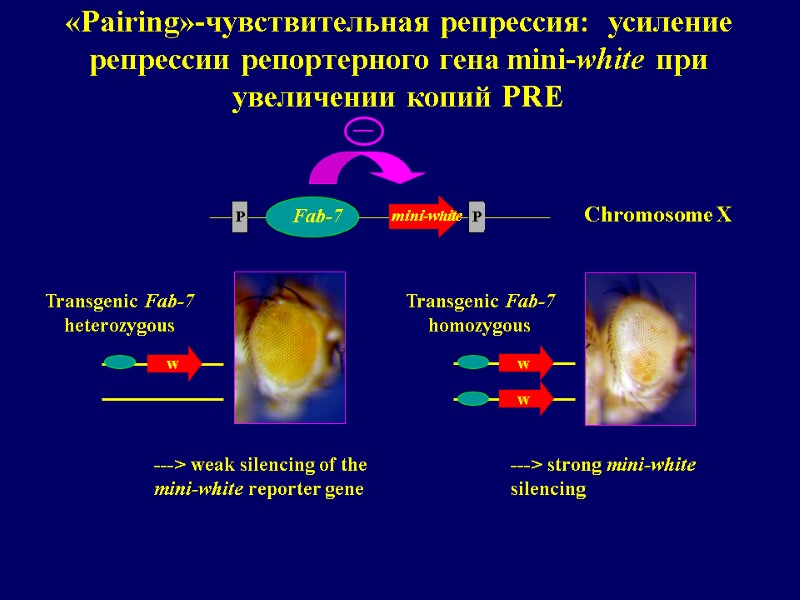
w w w Chromosome X «Pairing»-чувствительная репрессия: усиление репрессии репортерного гена mini-white при увеличении копий PRE ---> strong mini-white silencing ---> weak silencing of the mini-white reporter gene Transgenic Fab-7 heterozygous Transgenic Fab-7 homozygous
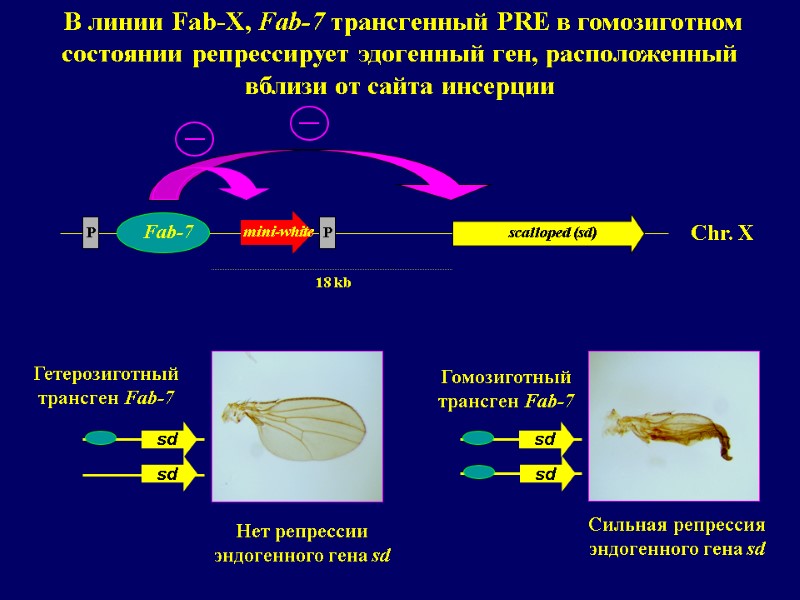
Chr. X P P В линии Fab-X, Fab-7 трансгенный PRE в гомозиготном состоянии репрессирует эдогенный ген, расположенный вблизи от сайта инсерции Fab-7 18 kb scalloped (sd) mini-white Гетерозиготный трансген Fab-7 sd sd sd sd Нет репрессии эндогенного гена sd Гомозиготный трансген Fab-7 Сильная репрессия эндогенного гена sd
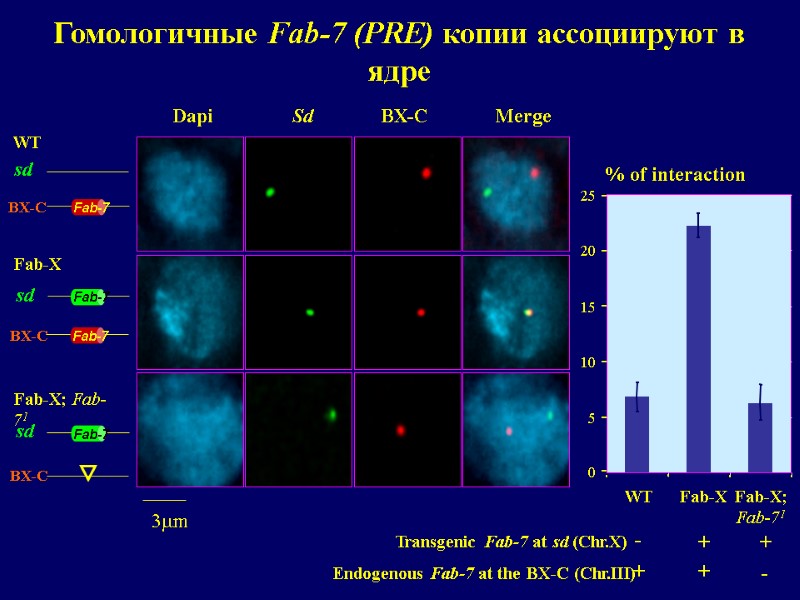
0 5 10 15 20 25 + + - Endogenous Fab-7 at the BX-C (Chr.III) 3mm - - - - - - Fab-X Fab-X; Fab-71 WT WT Fab-X Fab-X; Fab-71 + + - Transgenic Fab-7 at sd (Chr.X) Fab-7 Fab-7 Fab-7 Fab-7 sd BX-C sd BX-C sd BX-C Dapi Sd BX-C Merge Гомологичные Fab-7 (PRE) копии ассоциируют в ядре % of interaction

Два идентичных Fab-7, находящиеся на различных хромосомах (!) могут взаимодействовать в ядре, что ведет к усилению PcG-зависимой репрессии

Interactions among Polycomb Domains Are Guided by Chromosome Architecture (Tolhuis et al. (2011) PLoS Genet. 7(3): e1001343.) Polycomb group (PcG) proteins bind and regulate hundreds of genes. Previous evidence has suggested that long-range chromatin interactions may contribute to the regulation of PcG target genes. We adapted the Chromosome Conformation Capture on Chip (4C) assay to systematically map chromosomal interactions in Drosophila melanogaster larval brain tissue. Our results demonstrate that PcG target genes interact extensively with each other in nuclear space. These interactions are highly specific for PcG target genes, because non-target genes with either low or high expression show distinct interactions. Notably, interactions are mostly limited to genes on the same chromosome arm, and we demonstrate that a topological rather than a sequence-based mechanism is responsible for this constraint. Our results demonstrate that many interactions among PcG target genes exist and that these interactions are guided by overall chromosome architecture.

Участие некодирующих РНК в работе эпигенетических регуляторных систем

Мир некодирующих РНК (нкРНК) Недавние исследования показали, что большая часть генома человека транскрибируется как нкРНК Белок-кодирующая фракция геномной ДНК обратно пропорциональна сложности организма (Taft et al., 2007): у прокариот – 90% генома, в дрожжах – 68%, у нематод -25%, у насекомых – 17%, у человека – 1% (!) В последние несколько лет наблюдается все возрастающее накопление данных о центральной роли нкРНК в разнообразных эпигенетических механизмах регуляции тканеспецифической активности генов (в развитии) и ремоделирования хроматина

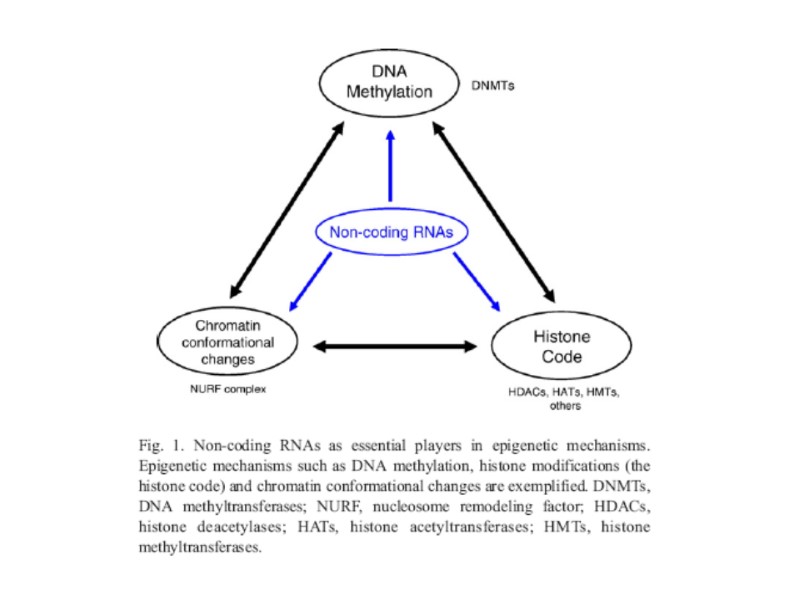

нкРНК разделяют на 2 класса 1- короткие нкРНК, функционирование которых зависит от комплементаности их последовательности: miRNA, siRNA, piRNA или rasiRNA (piwi-interacting, repeat-associated RNA); репрессия генов-мишеней 2- длинные некодирующие РНК (0.3-несколько тыс. нуклеотидов), могут работать in trans и in cis, не зависят от комплементарности последовательности

micro RNA and small interfering RNA Транскрибируются как более длинные предшественники, формирующие шпильки; обрезаются в ядре ферментом Drosha (RNase III) до ~65 п.н.; После транспортировки из ядра в цитоплазму пре-миРНК обрабатывается (обрезается) ферментом Dicer, в результате чего получается дуплекс 19-25 п.н., который включается в miRNA-inducible silencing complex (miRISC), содержащий белки семейства Argonaute и другие факторы; этот комплекс связывается с мРНК-мишенью и или деградирует её, или ингибирует ее трансляцию с помощью других механизмов Dicer и другие компоненты этой системы очень важны для процессов развития (мутации обычно ведут к смерти эмбрионов)

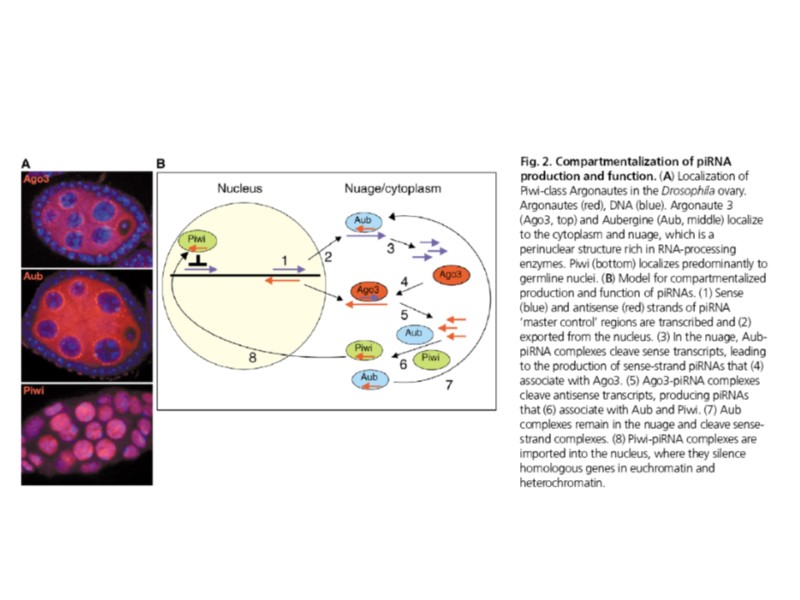
Piwi-interacting RNAs (repeat-associated RNAs) имеют размер около 24-30 нукл.; продуцируются Dicer-независимым механизмом (в отличие от miRNAs) были клонированы в результате совместной очистки со сперматогенез-специфическим членом семейства белков Argonaute – белками PIWI места их транскрипции картитруются в основном в повторяющихся элементах важны для поддержания требуемой специфичности половых клеток участвуют в консервативных в эволюции механизмах репрессии транскрипции повторяющихся элементов (у мух, рыб, млекопитающих)

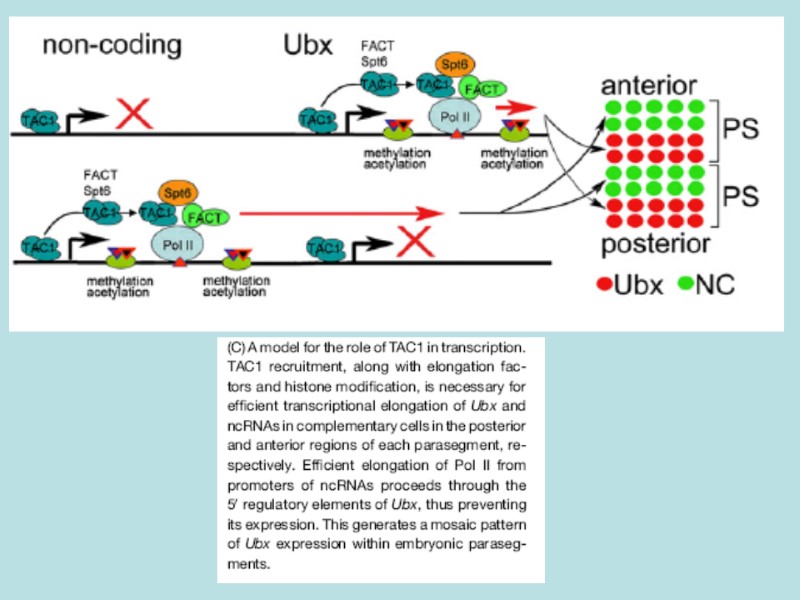
Transgenic (+hsGAL4/UAS-lacZ) assay is used to show that early embryonic transcription through a memory element (CMM, or PRE/TRE: bxd, MCP, Fab7) correlated with the relief of silencing imposed by the Polycomb group proteins A memory element remodeled by the process of transcription was able to maintain active expression of a reporter gene throughout development - In the BX-C of D.melanogaster, the segment-specific expression of noncoding intergenic transcripts during embryogenesis could fulfill this switching role for memory elements regulated by the Pc- and trx-proteins

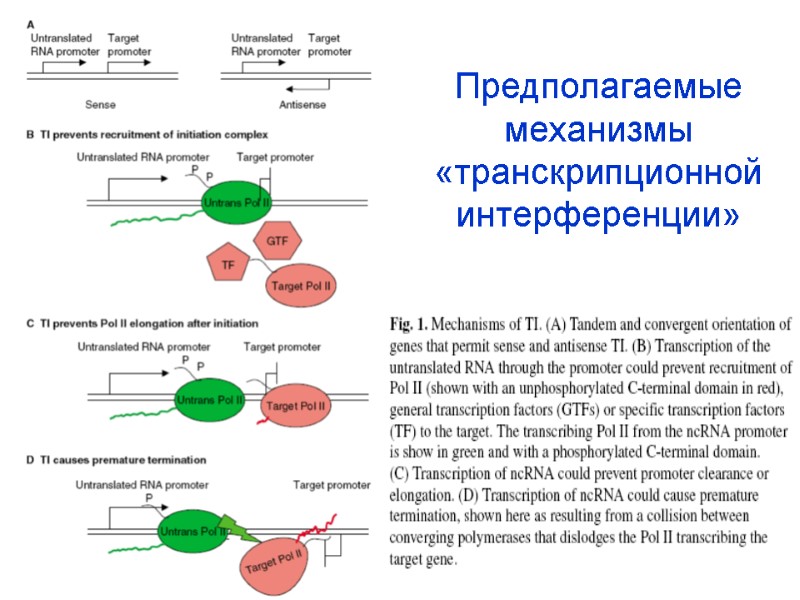
Предполагаемые механизмы «транскрипционной интерференции»
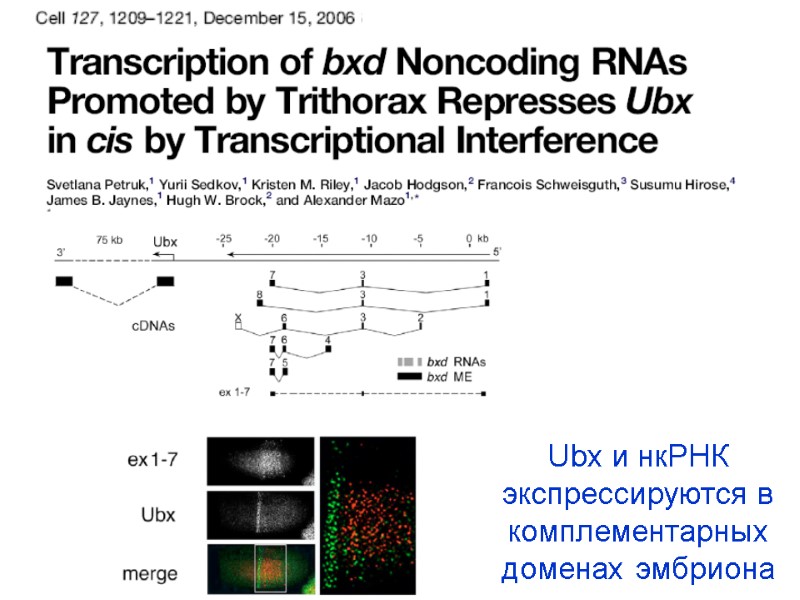
Ubx и нкРНК экспрессируются в комплементарных доменах эмбриона
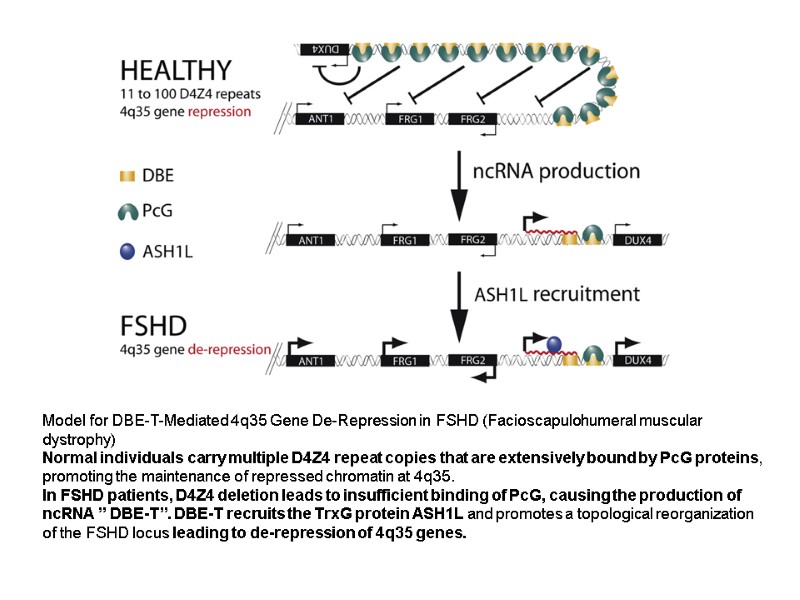
Model for DBE-T-Mediated 4q35 Gene De-Repression in FSHD (Facioscapulohumeral muscular dystrophy) Normal individuals carry multiple D4Z4 repeat copies that are extensively bound by PcG proteins, promoting the maintenance of repressed chromatin at 4q35. In FSHD patients, D4Z4 deletion leads to insufficient binding of PcG, causing the production of ncRNA ” DBE-T”. DBE-T recruits the TrxG protein ASH1L and promotes a topological reorganization of the FSHD locus leading to de-repression of 4q35 genes.
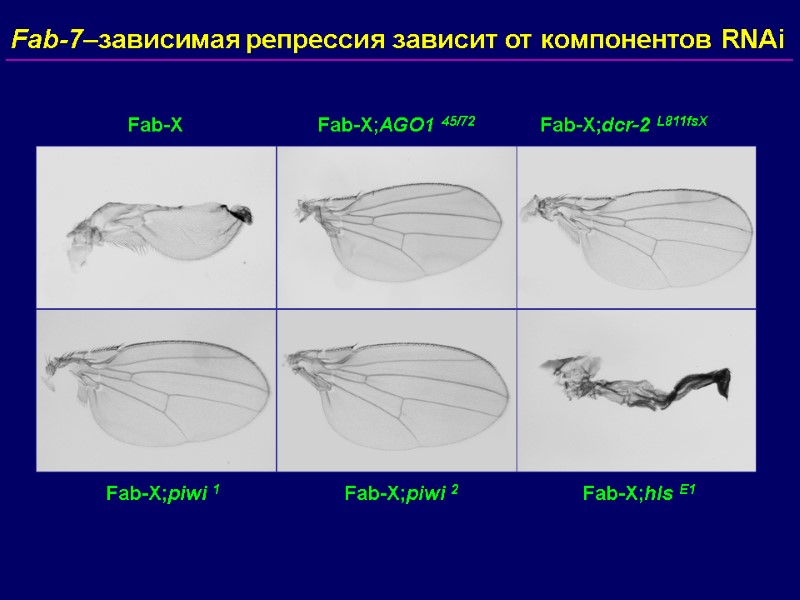
Fab-7–зависимая репрессия зависит от компонентов RNAi Fab-X Fab-X;dcr-2 L811fsX Fab-X;AGO1 45/72 Fab-X;piwi 1 Fab-X;piwi 2 Fab-X;hls E1

Ядерные RNAi-компоненты требуются для PcG-зависимой репрессии трансгенов …но не для рекрутирования PcG-белков на PRE (за исключением piwi) Взаимодействия далеко расположенных PRE нарушаются в RNAi-мутантах
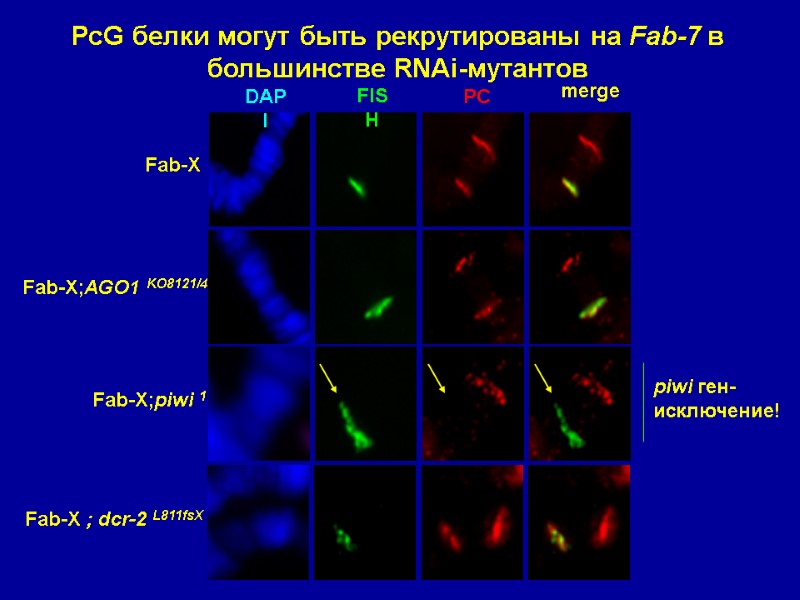
piwi ген- исключение! PcG белки могут быть рекрутированы на Fab-7 в большинстве RNAi-мутантов Fab-X Fab-X;AGO1 KO8121/45 Fab-X;piwi 1 Fab-X ; dcr-2 L811fsX DAPI FISH PC merge
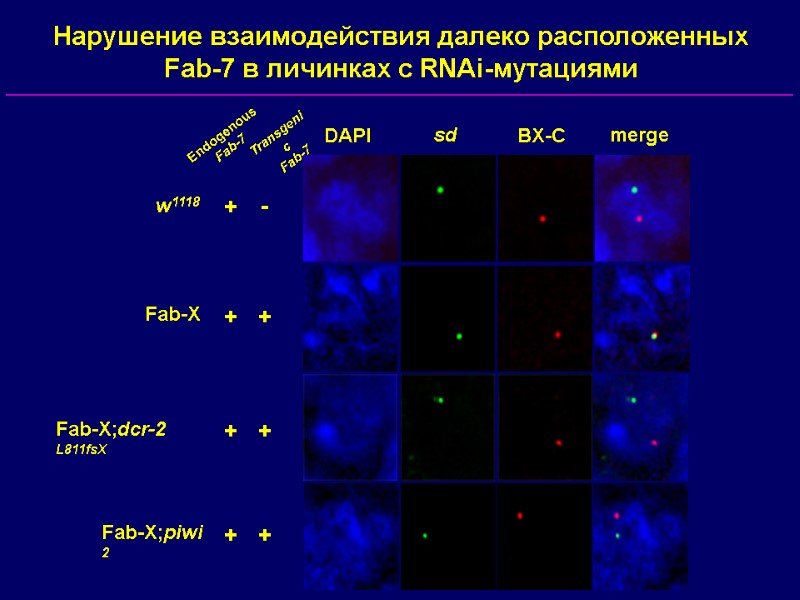
DAPI sd BX-C merge w1118 Fab-X Fab-X;piwi 2 Endogenous Fab-7 Transgenic Fab-7 + + + - + + + + Fab-X;dcr-2 L811fsX Нарушение взаимодействия далеко расположенных Fab-7 в личинках с RNAi-мутациями

Спасибо за внимание
10072-trx-pc_talk-110313.ppt
- Количество слайдов: 98

