cebfce8109574498ca3514643b803d9c.ppt
- Количество слайдов: 32
 Доклад на тему: «Спектрофотометрическое определение йода и йодсодержащих анионов при использовании электрохимического окисления» кандидата химических наук, ас. кафедры медицинской и биоорганической химии Тишаковой Татьяны Станиславовны 12 февраля 2013 г.
Доклад на тему: «Спектрофотометрическое определение йода и йодсодержащих анионов при использовании электрохимического окисления» кандидата химических наук, ас. кафедры медицинской и биоорганической химии Тишаковой Татьяны Станиславовны 12 февраля 2013 г.
 Цель работы: улучшение аналитических характеристик определения йодид-, йодат- и перйодат-ионов спектрофотометрическим методом, расширение сферы совместного использования спектрофотометрии и кулонометрии и разработка методики определения микроколичеств йода и йодида, йодата и перйодата при совместном присутствии в водных растворах. 2
Цель работы: улучшение аналитических характеристик определения йодид-, йодат- и перйодат-ионов спектрофотометрическим методом, расширение сферы совместного использования спектрофотометрии и кулонометрии и разработка методики определения микроколичеств йода и йодида, йодата и перйодата при совместном присутствии в водных растворах. 2
 • ЗАДАЧИ: • 1. Изучить условия, которые обеспечивают линейную зависимость • • светопоглощения ионных ассоциатов йод-йодидных комплексных анионов с брильянтовым зеленым от концентрации йодида в методике спектрофотометрического определения йодида с предварительным электрохимическим окислением в кухонной соли, питьевой воде. 2. Изучить процессы электрохимического окисления/восстановления на платиновых электродах и оптимизировать условия кулонометрического определения йодата и перйодата индивидуально и при совместном присутствии в растворах. 3. Исследовать возможности и оптимизировать условия спектрофотометрического определения йода, йодида, йодата и перйодата индивидуально и при совместном присутствии с использованием электрохимического окисления/восстановления. 4. Оценить аналитические характеристики (диапазон линейности, граница обнаружения, степень экстракции) спектрофотометрического определения йода, йодида, йодата и перйодата индивидуально и при совместном присутствии с использованием электрохимического окисления/восстановления. 5. Разработать методики определения йодида, йодата и перйодата и подготовить их к аттестации в соответствии с ГОСТ 8. 010 – 99 «Методики выполнения измерений. Основные положения» . 3
• ЗАДАЧИ: • 1. Изучить условия, которые обеспечивают линейную зависимость • • светопоглощения ионных ассоциатов йод-йодидных комплексных анионов с брильянтовым зеленым от концентрации йодида в методике спектрофотометрического определения йодида с предварительным электрохимическим окислением в кухонной соли, питьевой воде. 2. Изучить процессы электрохимического окисления/восстановления на платиновых электродах и оптимизировать условия кулонометрического определения йодата и перйодата индивидуально и при совместном присутствии в растворах. 3. Исследовать возможности и оптимизировать условия спектрофотометрического определения йода, йодида, йодата и перйодата индивидуально и при совместном присутствии с использованием электрохимического окисления/восстановления. 4. Оценить аналитические характеристики (диапазон линейности, граница обнаружения, степень экстракции) спектрофотометрического определения йода, йодида, йодата и перйодата индивидуально и при совместном присутствии с использованием электрохимического окисления/восстановления. 5. Разработать методики определения йодида, йодата и перйодата и подготовить их к аттестации в соответствии с ГОСТ 8. 010 – 99 «Методики выполнения измерений. Основные положения» . 3
 • Научная новизна заключается в расширении возможности объединения оптического (спектрофотометрии) и электрохимического (кулонометрии) методов определения микроколичеств йода и йодида, йодата и перйодата индивидуально и при совместном присутствии. • 1. Впервые показано, что перйодат может быть электрохимически преобразован в йодат в условиях электрохимического восстановления до йодида (йода) при потенциале 0. 25 В, с последующим окислением полученных продуктов до йодата на платиновых электродах при потенциале 1. 1 В относительно насыщенного хлоридсеребрянного электрода сравнения. 4
• Научная новизна заключается в расширении возможности объединения оптического (спектрофотометрии) и электрохимического (кулонометрии) методов определения микроколичеств йода и йодида, йодата и перйодата индивидуально и при совместном присутствии. • 1. Впервые показано, что перйодат может быть электрохимически преобразован в йодат в условиях электрохимического восстановления до йодида (йода) при потенциале 0. 25 В, с последующим окислением полученных продуктов до йодата на платиновых электродах при потенциале 1. 1 В относительно насыщенного хлоридсеребрянного электрода сравнения. 4
 • 2. Впервые показано, что совокупность процедур: нагревание раствора брильянтового зеленого в среде серной кислоты, насыщение анализируемого раствора азотом, пропускание установленного избытка количества электричества при электрохимическом окислении йодида до йодата в присутствии бромида обеспечивает удовлетворительную сходимость измерений в методике спектрофотометрического определения йодида с использованием электрохимического окисления. • 3. Разработаны методики определения йодата и перйодата при совместном присутствии кулонометрическим и спектрофотометрическим методами с использованием электрохимических редокс-реакций. 5
• 2. Впервые показано, что совокупность процедур: нагревание раствора брильянтового зеленого в среде серной кислоты, насыщение анализируемого раствора азотом, пропускание установленного избытка количества электричества при электрохимическом окислении йодида до йодата в присутствии бромида обеспечивает удовлетворительную сходимость измерений в методике спектрофотометрического определения йодида с использованием электрохимического окисления. • 3. Разработаны методики определения йодата и перйодата при совместном присутствии кулонометрическим и спектрофотометрическим методами с использованием электрохимических редокс-реакций. 5
 • Определение йодида в виде ионного ассоциата йодйодидных комплексов с катионокрасителем брильянтовым зеленым состоит из следующих стадий: • 1) электрохимическое окисление йодид-ионов до йодат-ионов • на платиновом электроде при потенциале 0. 25 В 2) восстановление электрохимически полученного йодата в избытке йодида с образованием комплексных анионов I 3 -; • 3) экстракция в четыреххлористый углерод ионных ассоциатов йод-йодидных комплексных анионов с брильянтовым зеленым; • 4) измерение светопоглощения ионного ассоциата. 6
• Определение йодида в виде ионного ассоциата йодйодидных комплексов с катионокрасителем брильянтовым зеленым состоит из следующих стадий: • 1) электрохимическое окисление йодид-ионов до йодат-ионов • на платиновом электроде при потенциале 0. 25 В 2) восстановление электрохимически полученного йодата в избытке йодида с образованием комплексных анионов I 3 -; • 3) экстракция в четыреххлористый углерод ионных ассоциатов йод-йодидных комплексных анионов с брильянтовым зеленым; • 4) измерение светопоглощения ионного ассоциата. 6
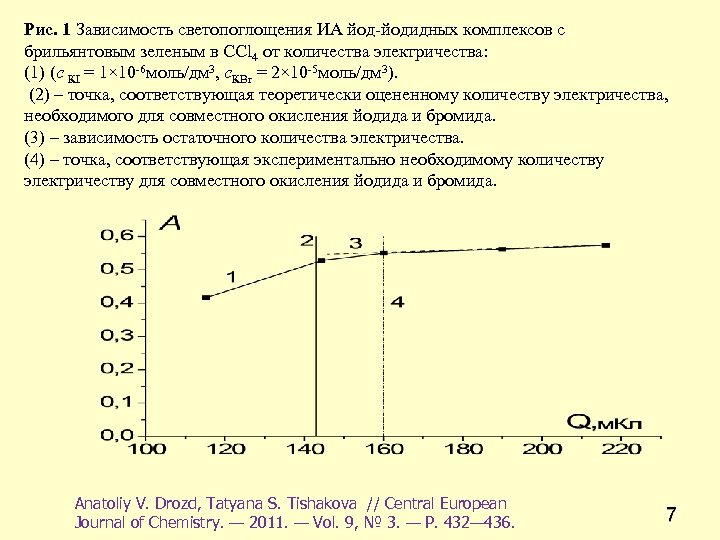 Рис. 1 Зависимость светопоглощения ИА йод-йодидных комплексов с брильянтовым зеленым в ССl 4 от количества электричества: (1) (с КІ = 1× 10 -6 моль/дм 3, с. КВr = 2× 10 -5 моль/дм 3). (2) – точка, соответствующая теоретически оцененному количеству электричества, необходимого для совместного окисления йодида и бромида. (3) – зависимость остаточного количества электричества. (4) – точка, соответствующая экспериментально необходимому количеству электричеству для совместного окисления йодида и бромида. Anatoliy V. Drozd, Tatyana S. Tishakova // Central European Journal of Chemistry. — 2011. — Vol. 9, № 3. — Р. 432— 436. 7
Рис. 1 Зависимость светопоглощения ИА йод-йодидных комплексов с брильянтовым зеленым в ССl 4 от количества электричества: (1) (с КІ = 1× 10 -6 моль/дм 3, с. КВr = 2× 10 -5 моль/дм 3). (2) – точка, соответствующая теоретически оцененному количеству электричества, необходимого для совместного окисления йодида и бромида. (3) – зависимость остаточного количества электричества. (4) – точка, соответствующая экспериментально необходимому количеству электричеству для совместного окисления йодида и бромида. Anatoliy V. Drozd, Tatyana S. Tishakova // Central European Journal of Chemistry. — 2011. — Vol. 9, № 3. — Р. 432— 436. 7
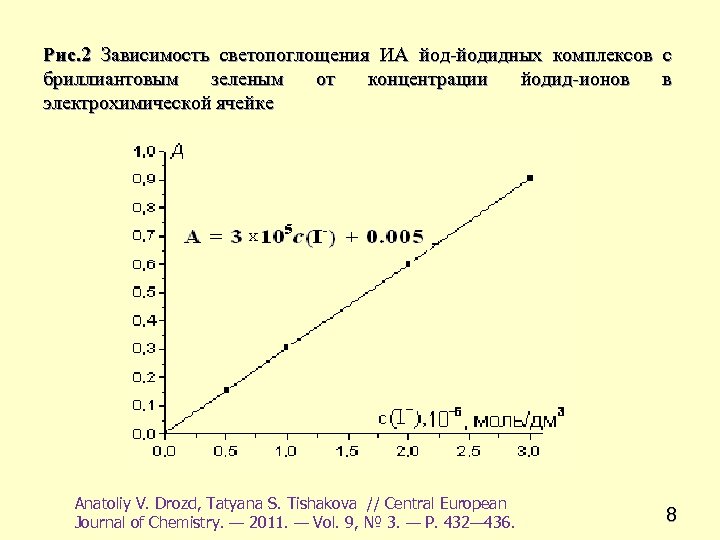 Рис. 2 Зависимость светопоглощения ИА йод-йодидных комплексов с бриллиантовым зеленым от концентрации йодид-ионов в электрохимической ячейке Anatoliy V. Drozd, Tatyana S. Tishakova // Central European Journal of Chemistry. — 2011. — Vol. 9, № 3. — Р. 432— 436. 8
Рис. 2 Зависимость светопоглощения ИА йод-йодидных комплексов с бриллиантовым зеленым от концентрации йодид-ионов в электрохимической ячейке Anatoliy V. Drozd, Tatyana S. Tishakova // Central European Journal of Chemistry. — 2011. — Vol. 9, № 3. — Р. 432— 436. 8
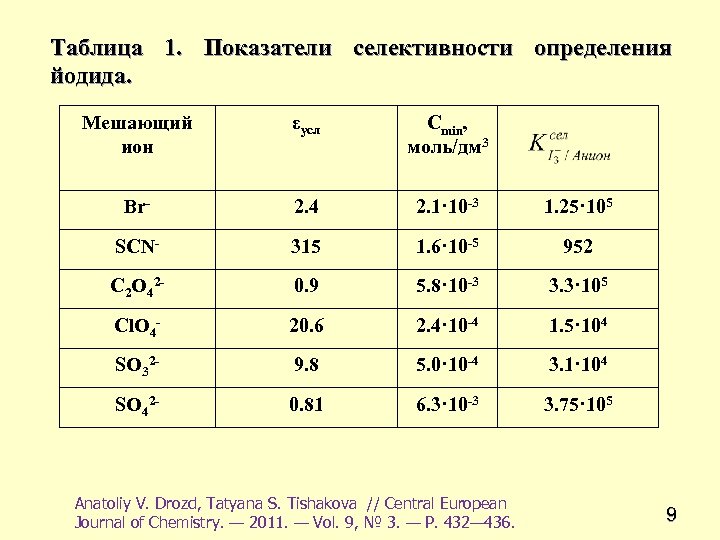 Таблица 1. Показатели селективности определения йодида. Мешающий ион εусл Сmin, моль/дм 3 Br- 2. 4 2. 1· 10 -3 1. 25· 105 SCN- 315 1. 6· 10 -5 952 C 2 O 42 - 0. 9 5. 8· 10 -3 3. 3· 105 Cl. O 4 - 20. 6 2. 4· 10 -4 1. 5· 104 SO 32 - 9. 8 5. 0· 10 -4 3. 1· 104 SO 42 - 0. 81 6. 3· 10 -3 3. 75· 105 Anatoliy V. Drozd, Tatyana S. Tishakova // Central European Journal of Chemistry. — 2011. — Vol. 9, № 3. — Р. 432— 436. 9
Таблица 1. Показатели селективности определения йодида. Мешающий ион εусл Сmin, моль/дм 3 Br- 2. 4 2. 1· 10 -3 1. 25· 105 SCN- 315 1. 6· 10 -5 952 C 2 O 42 - 0. 9 5. 8· 10 -3 3. 3· 105 Cl. O 4 - 20. 6 2. 4· 10 -4 1. 5· 104 SO 32 - 9. 8 5. 0· 10 -4 3. 1· 104 SO 42 - 0. 81 6. 3· 10 -3 3. 75· 105 Anatoliy V. Drozd, Tatyana S. Tishakova // Central European Journal of Chemistry. — 2011. — Vol. 9, № 3. — Р. 432— 436. 9
 • Сmin, моль/дм 3 = SA/εусл. , Где S A = 0. 005. • Кsel = εусл. , БЗAn/εБЗ 3 • εум, ДЗAn- условный молярный коэффициент поглощения ИА • аниона с брильянтовым зеленым; εБЗІ3 – наклон градуировочной зависимости при определении йодида в виде ионного ассоциата брильянтового зеленого с йод-йодидными комплексными анионами. 10
• Сmin, моль/дм 3 = SA/εусл. , Где S A = 0. 005. • Кsel = εусл. , БЗAn/εБЗ 3 • εум, ДЗAn- условный молярный коэффициент поглощения ИА • аниона с брильянтовым зеленым; εБЗІ3 – наклон градуировочной зависимости при определении йодида в виде ионного ассоциата брильянтового зеленого с йод-йодидными комплексными анионами. 10
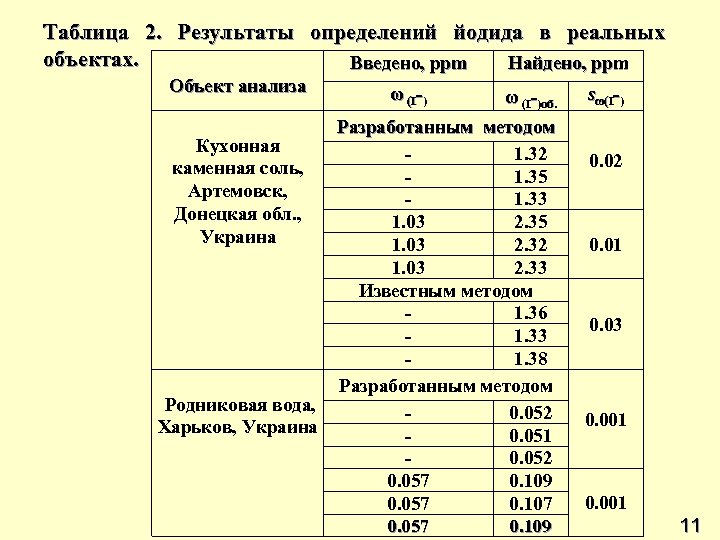 Таблица 2. Результаты определений йодида в реальных объектах. Введено, ppm Найдено, ppm Объект анализа Кухонная каменная соль, Артемовск, Донецкая обл. , Украина Родниковая вода, Харьков, Украина ω (I-)об. Разработанным методом 1. 32 1. 35 1. 33 1. 03 2. 35 1. 03 2. 32 1. 03 2. 33 Известным методом 1. 36 1. 33 1. 38 Разработанным методом 0. 052 0. 051 0. 052 0. 057 0. 109 0. 057 0. 107 0. 057 0. 109 sω(I-) 0. 02 0. 01 0. 03 0. 001 11
Таблица 2. Результаты определений йодида в реальных объектах. Введено, ppm Найдено, ppm Объект анализа Кухонная каменная соль, Артемовск, Донецкая обл. , Украина Родниковая вода, Харьков, Украина ω (I-)об. Разработанным методом 1. 32 1. 35 1. 33 1. 03 2. 35 1. 03 2. 32 1. 03 2. 33 Известным методом 1. 36 1. 33 1. 38 Разработанным методом 0. 052 0. 051 0. 052 0. 057 0. 109 0. 057 0. 107 0. 057 0. 109 sω(I-) 0. 02 0. 01 0. 03 0. 001 11
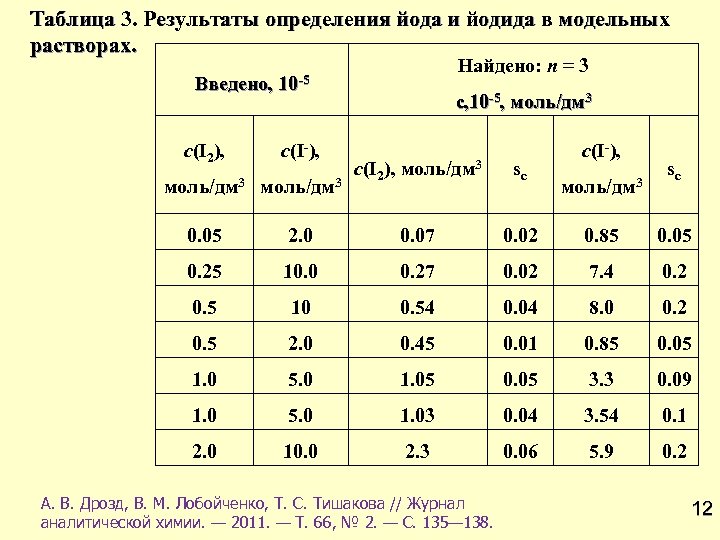 Таблица 3. Результаты определения йода и йодида в модельных растворах. Введено, Найдено: n = 3 10 -5 с(I 2), с(I-), моль/дм 3 0. 05 с, 10 -5, моль/дм 3 с(I-), с(I 2), моль/дм 3 sc 2. 0 0. 07 0. 02 0. 85 0. 05 0. 25 10. 0 0. 27 0. 02 7. 4 0. 2 0. 5 10 0. 54 0. 04 8. 0 0. 2 0. 5 2. 0 0. 45 0. 01 0. 85 0. 05 1. 0 5. 0 1. 05 0. 05 3. 3 0. 09 1. 0 5. 0 1. 03 0. 04 3. 54 0. 1 2. 0 10. 0 2. 3 0. 06 5. 9 0. 2 А. В. Дрозд, В. М. Лобойченко, Т. С. Тишакова // Журнал аналитической химии. — 2011. — Т. 66, № 2. — С. 135— 138. моль/дм 3 sc 12
Таблица 3. Результаты определения йода и йодида в модельных растворах. Введено, Найдено: n = 3 10 -5 с(I 2), с(I-), моль/дм 3 0. 05 с, 10 -5, моль/дм 3 с(I-), с(I 2), моль/дм 3 sc 2. 0 0. 07 0. 02 0. 85 0. 05 0. 25 10. 0 0. 27 0. 02 7. 4 0. 2 0. 5 10 0. 54 0. 04 8. 0 0. 2 0. 5 2. 0 0. 45 0. 01 0. 85 0. 05 1. 0 5. 0 1. 05 0. 05 3. 3 0. 09 1. 0 5. 0 1. 03 0. 04 3. 54 0. 1 2. 0 10. 0 2. 3 0. 06 5. 9 0. 2 А. В. Дрозд, В. М. Лобойченко, Т. С. Тишакова // Журнал аналитической химии. — 2011. — Т. 66, № 2. — С. 135— 138. моль/дм 3 sc 12
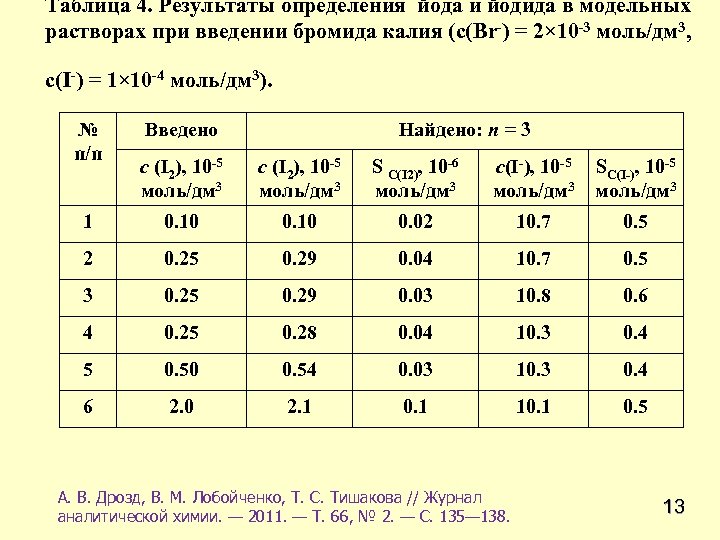 Таблица 4. Результаты определения йода и йодида в модельных растворах при введении бромида калия (с(Br-) = 2× 10 -3 моль/дм 3, с(I-) = 1× 10 -4 моль/дм 3). № п/п Найдено: n = 3 Введено с (I 2), 10 -5 моль/дм 3 S С(I 2), 10 -6 моль/дм 3 с(I-), 10 -5 моль/дм 3 SС(I-), 10 -5 моль/дм 3 1 0. 10 0. 02 10. 7 0. 5 2 0. 25 0. 29 0. 04 10. 7 0. 5 3 0. 25 0. 29 0. 03 10. 8 0. 6 4 0. 25 0. 28 0. 04 10. 3 0. 4 5 0. 50 0. 54 0. 03 10. 3 0. 4 6 2. 0 2. 1 0. 1 10. 1 0. 5 А. В. Дрозд, В. М. Лобойченко, Т. С. Тишакова // Журнал аналитической химии. — 2011. — Т. 66, № 2. — С. 135— 138. 13
Таблица 4. Результаты определения йода и йодида в модельных растворах при введении бромида калия (с(Br-) = 2× 10 -3 моль/дм 3, с(I-) = 1× 10 -4 моль/дм 3). № п/п Найдено: n = 3 Введено с (I 2), 10 -5 моль/дм 3 S С(I 2), 10 -6 моль/дм 3 с(I-), 10 -5 моль/дм 3 SС(I-), 10 -5 моль/дм 3 1 0. 10 0. 02 10. 7 0. 5 2 0. 25 0. 29 0. 04 10. 7 0. 5 3 0. 25 0. 29 0. 03 10. 8 0. 6 4 0. 25 0. 28 0. 04 10. 3 0. 4 5 0. 50 0. 54 0. 03 10. 3 0. 4 6 2. 0 2. 1 0. 1 10. 1 0. 5 А. В. Дрозд, В. М. Лобойченко, Т. С. Тишакова // Журнал аналитической химии. — 2011. — Т. 66, № 2. — С. 135— 138. 13
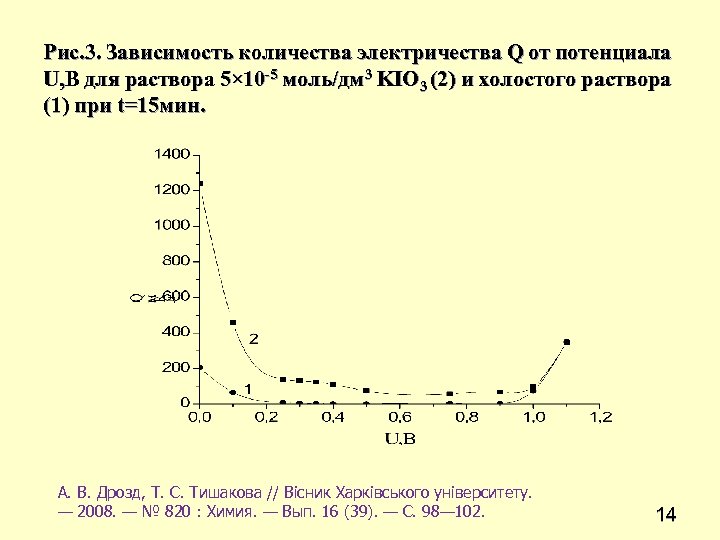 Рис. 3. Зависимость количества электричества Q от потенциала U, В для раствора 5× 10 -5 моль/дм 3 KIO 3 (2) и холостого раствора (1) при t=15 мин. А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 14
Рис. 3. Зависимость количества электричества Q от потенциала U, В для раствора 5× 10 -5 моль/дм 3 KIO 3 (2) и холостого раствора (1) при t=15 мин. А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 14
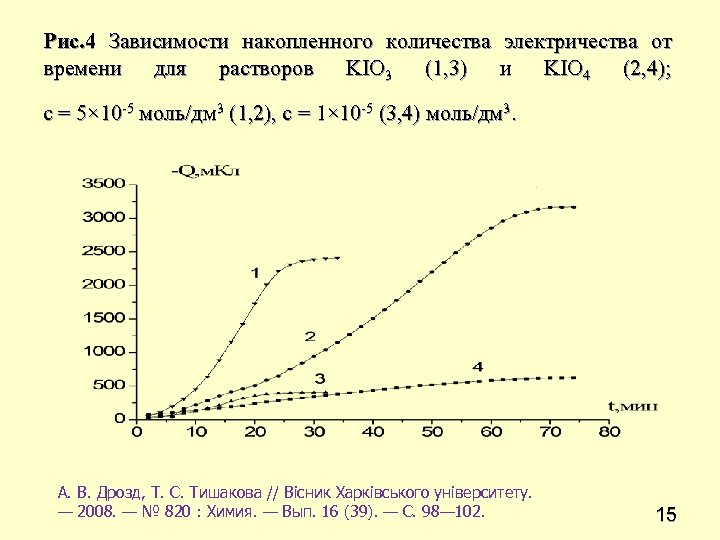 Рис. 4 Зависимости накопленного количества электричества от времени для растворов KIO 3 (1, 3) и KIO 4 (2, 4); с = 5× 10 -5 моль/дм 3 (1, 2), c = 1× 10 -5 (3, 4) моль/дм 3. А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 15
Рис. 4 Зависимости накопленного количества электричества от времени для растворов KIO 3 (1, 3) и KIO 4 (2, 4); с = 5× 10 -5 моль/дм 3 (1, 2), c = 1× 10 -5 (3, 4) моль/дм 3. А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 15
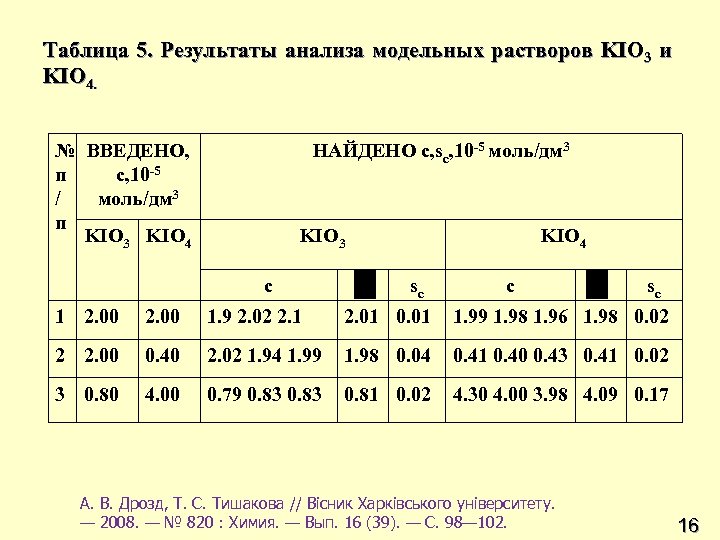 Таблица 5. Результаты анализа модельных растворов KIO 3 и KIO 4. № ВВЕДЕНО, п c, 10 -5 / моль/дм 3 п KIO 3 KIO 4 НАЙДЕНО с, sс, 10 -5 моль/дм 3 KIO 3 c KIO 4 sс c sс 1 2. 00 1. 9 2. 02 2. 1 2. 01 0. 01 1. 99 1. 98 1. 96 1. 98 0. 02 2 2. 00 0. 40 2. 02 1. 94 1. 99 1. 98 0. 04 0. 41 0. 40 0. 43 0. 41 0. 02 3 0. 80 4. 00 0. 79 0. 83 0. 81 0. 02 4. 30 4. 00 3. 98 4. 09 0. 17 А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 16
Таблица 5. Результаты анализа модельных растворов KIO 3 и KIO 4. № ВВЕДЕНО, п c, 10 -5 / моль/дм 3 п KIO 3 KIO 4 НАЙДЕНО с, sс, 10 -5 моль/дм 3 KIO 3 c KIO 4 sс c sс 1 2. 00 1. 9 2. 02 2. 1 2. 01 0. 01 1. 99 1. 98 1. 96 1. 98 0. 02 2 2. 00 0. 40 2. 02 1. 94 1. 99 1. 98 0. 04 0. 41 0. 40 0. 43 0. 41 0. 02 3 0. 80 4. 00 0. 79 0. 83 0. 81 0. 02 4. 30 4. 00 3. 98 4. 09 0. 17 А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 16
 • c(IO 3 -) = Qi/ F ne V • где, • Q – количество электричества, Кл; F – постоянная Фарадея, Кл/моль; ne число электронов в полуреакции восстановления; V – объем раствора в ячейке, дм 3. • Для характеристики сходимости измерений в границах исследованного диапазона по уравнению рассчитано среднее отклонение от действительных значений концентраций: • • где, N – число анализируемых растворов, • i – их текущий индекс, • свведено, снайдено, – введенные и найденные концентрации. 17
• c(IO 3 -) = Qi/ F ne V • где, • Q – количество электричества, Кл; F – постоянная Фарадея, Кл/моль; ne число электронов в полуреакции восстановления; V – объем раствора в ячейке, дм 3. • Для характеристики сходимости измерений в границах исследованного диапазона по уравнению рассчитано среднее отклонение от действительных значений концентраций: • • где, N – число анализируемых растворов, • i – их текущий индекс, • свведено, снайдено, – введенные и найденные концентрации. 17
 Определение иодата и периодата при совместном присутствии состоит из трех стадий: 1) В первой порции анализируемого раствора смесь анионов взаимодействует с избытком иодид-ионов. После добавления красителя ионные ассоциаты образовавшегося иод-иодидного комплекса с бриллиантовым зеленым экстрагируются в неполярный растворитель (ССl 4) и аналитическим сигналом является светопоглощение экстракта (максимум при длине волны 645 нм). 2) Во второй порции анализируемого раствора проводят электрохимическое восстановление иодата и периодата при потенциале 0. 25 В в течение 1 часа и затем проводят электрохимическое окисление продуктов до иодата при потенциале 1. 1 В в течение 1 часа. 3) К порции анализируемого раствора, электрохимически преобразованной на стадии 2, добавляют избыток иодида. Иодат взаимодействует с иодидом с образованием иод-иодидных комплексов, которые экстрагируют с бриллиантовым зеленым в 18 ССl 4 и измеряют светопоглощение экстракта.
Определение иодата и периодата при совместном присутствии состоит из трех стадий: 1) В первой порции анализируемого раствора смесь анионов взаимодействует с избытком иодид-ионов. После добавления красителя ионные ассоциаты образовавшегося иод-иодидного комплекса с бриллиантовым зеленым экстрагируются в неполярный растворитель (ССl 4) и аналитическим сигналом является светопоглощение экстракта (максимум при длине волны 645 нм). 2) Во второй порции анализируемого раствора проводят электрохимическое восстановление иодата и периодата при потенциале 0. 25 В в течение 1 часа и затем проводят электрохимическое окисление продуктов до иодата при потенциале 1. 1 В в течение 1 часа. 3) К порции анализируемого раствора, электрохимически преобразованной на стадии 2, добавляют избыток иодида. Иодат взаимодействует с иодидом с образованием иод-иодидных комплексов, которые экстрагируют с бриллиантовым зеленым в 18 ССl 4 и измеряют светопоглощение экстракта.
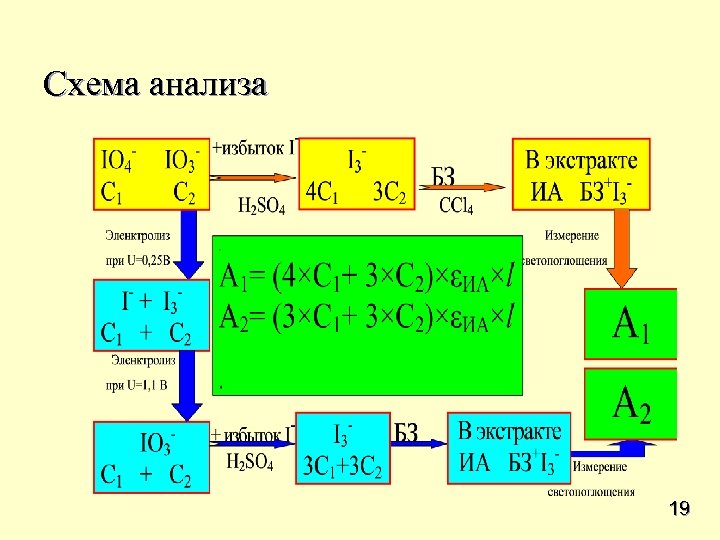 Схема анализа 19
Схема анализа 19
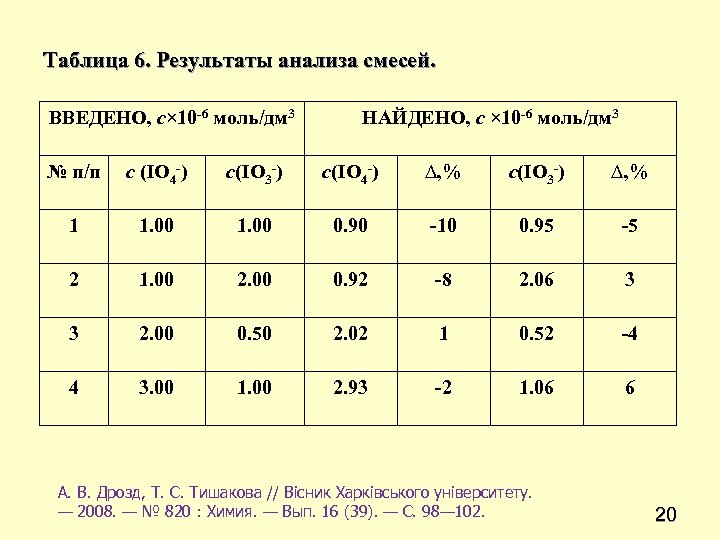 Таблица 6. Результаты анализа смесей. ВВЕДЕНО, c× 10 -6 моль/дм 3 НАЙДЕНО, c × 10 -6 моль/дм 3 № п/п c (IO 4 -) c(IO 3 -) c(IO 4 -) ∆, % c(IO 3 -) ∆, % 1 1. 00 0. 90 -10 0. 95 -5 2 1. 00 2. 00 0. 92 -8 2. 06 3 3 2. 00 0. 50 2. 02 1 0. 52 -4 4 3. 00 1. 00 2. 93 -2 1. 06 6 А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 20
Таблица 6. Результаты анализа смесей. ВВЕДЕНО, c× 10 -6 моль/дм 3 НАЙДЕНО, c × 10 -6 моль/дм 3 № п/п c (IO 4 -) c(IO 3 -) c(IO 4 -) ∆, % c(IO 3 -) ∆, % 1 1. 00 0. 90 -10 0. 95 -5 2 1. 00 2. 00 0. 92 -8 2. 06 3 3 2. 00 0. 50 2. 02 1 0. 52 -4 4 3. 00 1. 00 2. 93 -2 1. 06 6 А. В. Дрозд, Т. С. Тишакова // Вісник Харківського університету. — 2008. — № 820 : Химия. — Вып. 16 (39). — С. 98— 102. 20
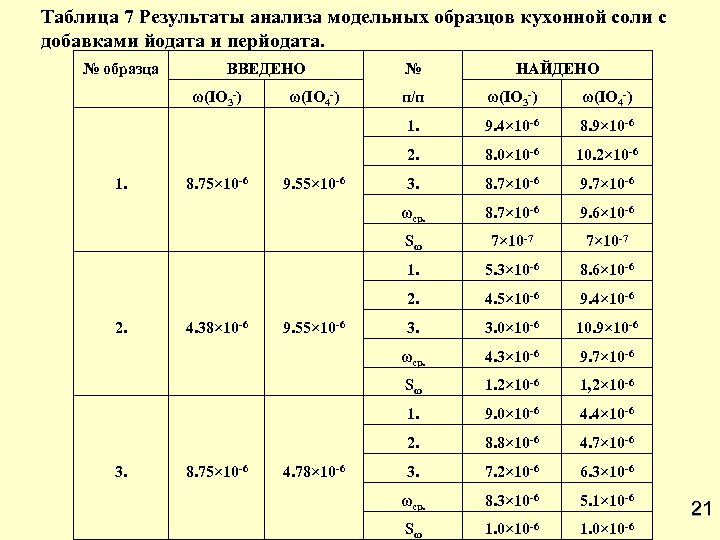 Таблица 7 Результаты анализа модельных образцов кухонной соли с добавками йодата и перйодата. № образца ВВЕДЕНО ω(IO 3 -) НАЙДЕНО 8. 7× 10 -6 9. 7× 10 -6 8. 7× 10 -6 9. 6× 10 -6 7× 10 -7 5. 3× 10 -6 8. 6× 10 -6 4. 5× 10 -6 9. 4× 10 -6 3. 0× 10 -6 10. 9× 10 -6 4. 3× 10 -6 9. 7× 10 -6 1. 2× 10 -6 1, 2× 10 -6 1. 9. 0× 10 -6 4. 4× 10 -6 2. 4. 78× 10 -6 3. Sω 8. 75× 10 -6 10. 2× 10 -6 ωср. 3. 8. 0× 10 -6 2. 9. 55× 10 -6 8. 9× 10 -6 1. 4. 38× 10 -6 9. 4× 10 -6 Sω 2. ω(IO 4 -) ωср. 9. 55× 10 -6 ω(IO 3 -) 2. 8. 75× 10 -6 п/п 1. ω(IO 4 -) № 8. 8× 10 -6 4. 7× 10 -6 3. 7. 2× 10 -6 6. 3× 10 -6 ωср. 8. 3× 10 -6 5. 1× 10 -6 Sω 1. 0× 10 -6 21
Таблица 7 Результаты анализа модельных образцов кухонной соли с добавками йодата и перйодата. № образца ВВЕДЕНО ω(IO 3 -) НАЙДЕНО 8. 7× 10 -6 9. 7× 10 -6 8. 7× 10 -6 9. 6× 10 -6 7× 10 -7 5. 3× 10 -6 8. 6× 10 -6 4. 5× 10 -6 9. 4× 10 -6 3. 0× 10 -6 10. 9× 10 -6 4. 3× 10 -6 9. 7× 10 -6 1. 2× 10 -6 1, 2× 10 -6 1. 9. 0× 10 -6 4. 4× 10 -6 2. 4. 78× 10 -6 3. Sω 8. 75× 10 -6 10. 2× 10 -6 ωср. 3. 8. 0× 10 -6 2. 9. 55× 10 -6 8. 9× 10 -6 1. 4. 38× 10 -6 9. 4× 10 -6 Sω 2. ω(IO 4 -) ωср. 9. 55× 10 -6 ω(IO 3 -) 2. 8. 75× 10 -6 п/п 1. ω(IO 4 -) № 8. 8× 10 -6 4. 7× 10 -6 3. 7. 2× 10 -6 6. 3× 10 -6 ωср. 8. 3× 10 -6 5. 1× 10 -6 Sω 1. 0× 10 -6 21
 • ВЫВОДЫ: На основе расширения сферы совместного использования • • • спектрофотометрии и кулонометрии обоснована возможность улучшения аналитических характеристик определения йодид-, йодат- и перйодат-ионов и разработаны методики определения микроколичеств йода и йодида, йодата и перйодата при совместном присутствии в растворах. 1. Методика экстракционно-спектрофотометрического определения йодида с брильянтовым зеленым, с использованием электрохимического окисления в сравнении с известным проточно-инжекционным спектрофотометрическим определением характеризуется: повышением чувствительности определения в 5 раз; высокой селективностью определения; отсутствием избытка химического окислителя; устранением влияния примесей, поглощающих в видимом спектральном диапазоне; уменьшением погрешности определения. 2. Использование объединения двух методов: спектрофотометрии и кулонометрии, что было известно только для определения йодида и бромида обеспечивает определение йода и йодида; йодата и перйодата при совместном присутствии. 3. Составляющие процедуры методики спектрофотометрического определения йодида в кухонной соли, питьевой воде: нагревание аликвоты рабочего раствора брильянтового зеленого в среде серной кислоты, насыщение азотом бидистилированной воды и пропускание азота в делительную воронку перед экстракцией, обеспечивает уменьшение светопоглощение «холостого опыта» в 23 раза и получение воспроизводимого и стабильного аналитического сигнала. 22
• ВЫВОДЫ: На основе расширения сферы совместного использования • • • спектрофотометрии и кулонометрии обоснована возможность улучшения аналитических характеристик определения йодид-, йодат- и перйодат-ионов и разработаны методики определения микроколичеств йода и йодида, йодата и перйодата при совместном присутствии в растворах. 1. Методика экстракционно-спектрофотометрического определения йодида с брильянтовым зеленым, с использованием электрохимического окисления в сравнении с известным проточно-инжекционным спектрофотометрическим определением характеризуется: повышением чувствительности определения в 5 раз; высокой селективностью определения; отсутствием избытка химического окислителя; устранением влияния примесей, поглощающих в видимом спектральном диапазоне; уменьшением погрешности определения. 2. Использование объединения двух методов: спектрофотометрии и кулонометрии, что было известно только для определения йодида и бромида обеспечивает определение йода и йодида; йодата и перйодата при совместном присутствии. 3. Составляющие процедуры методики спектрофотометрического определения йодида в кухонной соли, питьевой воде: нагревание аликвоты рабочего раствора брильянтового зеленого в среде серной кислоты, насыщение азотом бидистилированной воды и пропускание азота в делительную воронку перед экстракцией, обеспечивает уменьшение светопоглощение «холостого опыта» в 23 раза и получение воспроизводимого и стабильного аналитического сигнала. 22
 • 4. Кулонометрическое определение ІО 3− и ІО 4− при совместном присутствии • • • основано на последовательности восстановления ионов при использовании рабочего потенциала U=0. 25 B относительно насыщенного хлоридсеребрянного электрода сравнения. При насыщении анализируемого раствора азотом степень превращения анионов до йодида увеличивается. Скорость электрохимического восстановления возрастает в 2 раза в присутствии в растворе хлорида калия за сет повышения плотности тока. 5. Введение в анализируемый раствор бромидов в 20 -ти кратном избытке обеспечивает правильность результатов определения йода и йодида по методике йодирования флуоресцеина с предварительным электрохимическим окислением. 6. Спектрофотометрическое определение йодата и перйодата при совместном присутствии основывается на экстракции ионных ассоциатов брильянтового зеленого с йод-йодидными комплексами, образованными из исходной смеси ионов и последовательного электрохимического превращения перйодата в йодат и решения системы уравнений. Границы определения спектрофотометрическим методом йодат- и перйодат - ионов при совместном присутствии по методике спектрофотометрического определения составляют сlim(IO 4 -) =2. 4× 10 -7 моль/дм 3, сlim(IO 3 -) = 1. 8× 10 -7 моль/дм 3. 23
• 4. Кулонометрическое определение ІО 3− и ІО 4− при совместном присутствии • • • основано на последовательности восстановления ионов при использовании рабочего потенциала U=0. 25 B относительно насыщенного хлоридсеребрянного электрода сравнения. При насыщении анализируемого раствора азотом степень превращения анионов до йодида увеличивается. Скорость электрохимического восстановления возрастает в 2 раза в присутствии в растворе хлорида калия за сет повышения плотности тока. 5. Введение в анализируемый раствор бромидов в 20 -ти кратном избытке обеспечивает правильность результатов определения йода и йодида по методике йодирования флуоресцеина с предварительным электрохимическим окислением. 6. Спектрофотометрическое определение йодата и перйодата при совместном присутствии основывается на экстракции ионных ассоциатов брильянтового зеленого с йод-йодидными комплексами, образованными из исходной смеси ионов и последовательного электрохимического превращения перйодата в йодат и решения системы уравнений. Границы определения спектрофотометрическим методом йодат- и перйодат - ионов при совместном присутствии по методике спектрофотометрического определения составляют сlim(IO 4 -) =2. 4× 10 -7 моль/дм 3, сlim(IO 3 -) = 1. 8× 10 -7 моль/дм 3. 23
 • 7. Методика экстракционно-фотометрического определения йодида с • • использованием электрохимического окисления характеризуется диапазоном линейности 3× 10 -7 - 3× 10 -6 моль/дм 3 с границей определения 5× 10 -8 моль/дм 3. При изменении концентрации йодид-ионов в растворе впервые измерена константа экстракции (Kextr) ионного ассоциата йод-йодидных комплексов с брильянтовым зеленым в четыреххлористый углерод, которая составляет 115± 5. 8. Методика определения йодат- и перйодат- ионов спектрофотометрическим методом с использованием предварительного электрохимического окисления в соли кухонной и методика определения йодид– ионов спектрофотометрическим методом с использованием предварительного электрохимического окисления в воде питьевой разработаны и подготовлены к аттестации в соответствии с ГОСТ 8. 010 – 99 «Методики выполнения измерений. Основные положения» . 24
• 7. Методика экстракционно-фотометрического определения йодида с • • использованием электрохимического окисления характеризуется диапазоном линейности 3× 10 -7 - 3× 10 -6 моль/дм 3 с границей определения 5× 10 -8 моль/дм 3. При изменении концентрации йодид-ионов в растворе впервые измерена константа экстракции (Kextr) ионного ассоциата йод-йодидных комплексов с брильянтовым зеленым в четыреххлористый углерод, которая составляет 115± 5. 8. Методика определения йодат- и перйодат- ионов спектрофотометрическим методом с использованием предварительного электрохимического окисления в соли кухонной и методика определения йодид– ионов спектрофотометрическим методом с использованием предварительного электрохимического окисления в воде питьевой разработаны и подготовлены к аттестации в соответствии с ГОСТ 8. 010 – 99 «Методики выполнения измерений. Основные положения» . 24
 • Спасибо за внимание! 25
• Спасибо за внимание! 25
 • • • • 1. Дрозд А. В. Определение йодат- и перйодат ионов методом потенциостатической кулонометрии на платиновом электроде / А. В. Дрозд, Т. С. Тишакова // Вестник Харьк. Ун-та: Химия. – 2008. - Вып. 16 (39), № 820. – С. 98 - 101. 2. Дрозд А. В. Спектрофотометрическое определение йодата и перйодата при совместном присутствии / А. В. Дрозд, Т. С. Тишакова // Вестник Харьк. Ун-та: Химия. – 2010. - Вып. 18(41), № 895. – С. 101 - 106. 3. Дрозд А. В. Спектрофотометрическое определение йодидов по продуктам галогенирования флуоресцеина с использованием электрохимического окисления / А. В. Дрозд, В. М. Лобойченко, Т. С. Тишакова // Журн. аналит. химии. – 2011 – Т. 66, № 2. – С. 135 – 138. 4. Anatoliy V DRozd Spectrophotometric determination of trace amounts of iodide-ions in form of ionic associate with brilliant green using electrochemical oxidation / Anatoliy Drozd, Tatyana S Tishakova // Central European Journal of Chemistry. – Vol. 9, № №. – Р. 432 -436. 5. Пат. 55782. Україна. МПК (2011) G 01 N 21/01. Спосіб фотометричного визначення концентрації йодат- і перйодат-іонів у розчині при сумісній присутності / А. В. Дрозд, Т. С. Тішакова, заявник та патентовласник Харкіськ. нац. ун-т ім. В. Н. Каразіна № U 2010 07063; заявл. 07. 06. 2010; опубл. 27. 12. 2010, Бюл. № 24. – 10 с. , табл. 5. 6. Тишакова Т. С. Спектрофотометрическое определение йодида в виде ионного ассоциата после предварительного электрохимического окисления / Т. С. Тишакова, В. М. Белик // Сьома Всеукраїнська конференція студентів і аспірантів «Сучасні проблеми хімії» 18 – 19 травня 2006 року. Київ: зб. тез доп. – К. , 2006. - С. 265. 7. Белик В. М Фотометрическое определение йодид -ионов в виде ионного ассоциата йод – йодидных комплексов с катионокрасителем при использовании электрохимического окисления / В. М. Белик, А. В Дрозд, Т. С. Тишакова // Сесія Наукової Ради з проблеми «Аналітична хімія» , Наукова конференція «Аналітичний контроль якості та безпеки продукції промислового виробництва і продовольчої сировини. Питання підготовки фахівців для випробувальних лабораторій» . Програма і матеріали. Одеса, 22 – 26 травня 2006 р. – О. , 2006 р. - С. 12. 8. Белик В. М. Спектрофотометрическое определение йода и йодид - ионов в растворе при совместном присутствии / В. М. Белик, А. В. Дрозд, Т. С. Тишакова, Л. В. Миненко // Сесія Наукової Ради НАН України з проблеми «Аналітична хімія» . Програма та тези доповідей. 14 – 17 травня 2007 р. , Харків. – Х. , 2007. - С. 70. 9. Дрозд А. В. Кулонометрическое определение двух йодсодержащих анионов при совместном присутствии / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. VII Всеросс. конф. по электрохим. методам анализа с междунар. Участием «ЭМА - 2008» 1 – 6 июня 2008 г. Уфа – Абзаково. – Уфа, 2008 - С. 35. 10. Тишакова Т. С. Возможности определения йодата и перйодата, йодида и йода при совместном присутствии с использованием кулонометрического метода / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. , VII Украинская конференция по аналитической химии с международным участием. Одеса, 8 – 12 сентября 2008 г. – О. , 2008 г. - С. 147. 11. Тішакова Т. С. Кулонометричне і спектрофотометричне, з використанням електрохімічного окиснення, визначення йодвмісних аніонів / А. В. Дрозд, Т. С. Тішакова // Тези доп. Науково-практичного семінару студентів, аспірантів і молодих учених «Прикладні аспекти електрохімічного аналізу» . Львів, 9 – 10 жовтня 2008 р. , Львів 2008. – С. 9. 12. Дрозд А. В. Спектрофотометрическое определение йодат-и перйодат-ионов при использовании предварительного электрохимического окисления / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. VII Всеросс. конф. по анализу объектов окружающей среды «Экоаналитика - 2009» 21 – 27 июня 2009 г. Йошкар-Ола. – Йошкар-Ола. - 2009 – С. 84. 13. Дрозд А. В. Определение двух йодсодержащих частиц в растворе при использовании сочетания двух методов анализа / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. III Всеросс. конф. с междунар. участием «Аналитика России 2009» 20 -24 сентября 2009 г. Краснодар – К. , 2009. - С. 280. 14. Тішакова Т. С. Спектрофотометричне визначення йоду та йодвмістних аніонів при використанні електрохімічного окиснення / Т. С. Тішакова, А. В. Дрозд // Тези доп. Річної сесії наукової ради НАН України з проблеми «Аналітична хімія» 17 -23 травня 2010 р. , м. 26 Гурзуф – Г. , 2010. – С. 53.
• • • • 1. Дрозд А. В. Определение йодат- и перйодат ионов методом потенциостатической кулонометрии на платиновом электроде / А. В. Дрозд, Т. С. Тишакова // Вестник Харьк. Ун-та: Химия. – 2008. - Вып. 16 (39), № 820. – С. 98 - 101. 2. Дрозд А. В. Спектрофотометрическое определение йодата и перйодата при совместном присутствии / А. В. Дрозд, Т. С. Тишакова // Вестник Харьк. Ун-та: Химия. – 2010. - Вып. 18(41), № 895. – С. 101 - 106. 3. Дрозд А. В. Спектрофотометрическое определение йодидов по продуктам галогенирования флуоресцеина с использованием электрохимического окисления / А. В. Дрозд, В. М. Лобойченко, Т. С. Тишакова // Журн. аналит. химии. – 2011 – Т. 66, № 2. – С. 135 – 138. 4. Anatoliy V DRozd Spectrophotometric determination of trace amounts of iodide-ions in form of ionic associate with brilliant green using electrochemical oxidation / Anatoliy Drozd, Tatyana S Tishakova // Central European Journal of Chemistry. – Vol. 9, № №. – Р. 432 -436. 5. Пат. 55782. Україна. МПК (2011) G 01 N 21/01. Спосіб фотометричного визначення концентрації йодат- і перйодат-іонів у розчині при сумісній присутності / А. В. Дрозд, Т. С. Тішакова, заявник та патентовласник Харкіськ. нац. ун-т ім. В. Н. Каразіна № U 2010 07063; заявл. 07. 06. 2010; опубл. 27. 12. 2010, Бюл. № 24. – 10 с. , табл. 5. 6. Тишакова Т. С. Спектрофотометрическое определение йодида в виде ионного ассоциата после предварительного электрохимического окисления / Т. С. Тишакова, В. М. Белик // Сьома Всеукраїнська конференція студентів і аспірантів «Сучасні проблеми хімії» 18 – 19 травня 2006 року. Київ: зб. тез доп. – К. , 2006. - С. 265. 7. Белик В. М Фотометрическое определение йодид -ионов в виде ионного ассоциата йод – йодидных комплексов с катионокрасителем при использовании электрохимического окисления / В. М. Белик, А. В Дрозд, Т. С. Тишакова // Сесія Наукової Ради з проблеми «Аналітична хімія» , Наукова конференція «Аналітичний контроль якості та безпеки продукції промислового виробництва і продовольчої сировини. Питання підготовки фахівців для випробувальних лабораторій» . Програма і матеріали. Одеса, 22 – 26 травня 2006 р. – О. , 2006 р. - С. 12. 8. Белик В. М. Спектрофотометрическое определение йода и йодид - ионов в растворе при совместном присутствии / В. М. Белик, А. В. Дрозд, Т. С. Тишакова, Л. В. Миненко // Сесія Наукової Ради НАН України з проблеми «Аналітична хімія» . Програма та тези доповідей. 14 – 17 травня 2007 р. , Харків. – Х. , 2007. - С. 70. 9. Дрозд А. В. Кулонометрическое определение двух йодсодержащих анионов при совместном присутствии / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. VII Всеросс. конф. по электрохим. методам анализа с междунар. Участием «ЭМА - 2008» 1 – 6 июня 2008 г. Уфа – Абзаково. – Уфа, 2008 - С. 35. 10. Тишакова Т. С. Возможности определения йодата и перйодата, йодида и йода при совместном присутствии с использованием кулонометрического метода / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. , VII Украинская конференция по аналитической химии с международным участием. Одеса, 8 – 12 сентября 2008 г. – О. , 2008 г. - С. 147. 11. Тішакова Т. С. Кулонометричне і спектрофотометричне, з використанням електрохімічного окиснення, визначення йодвмісних аніонів / А. В. Дрозд, Т. С. Тішакова // Тези доп. Науково-практичного семінару студентів, аспірантів і молодих учених «Прикладні аспекти електрохімічного аналізу» . Львів, 9 – 10 жовтня 2008 р. , Львів 2008. – С. 9. 12. Дрозд А. В. Спектрофотометрическое определение йодат-и перйодат-ионов при использовании предварительного электрохимического окисления / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. VII Всеросс. конф. по анализу объектов окружающей среды «Экоаналитика - 2009» 21 – 27 июня 2009 г. Йошкар-Ола. – Йошкар-Ола. - 2009 – С. 84. 13. Дрозд А. В. Определение двух йодсодержащих частиц в растворе при использовании сочетания двух методов анализа / А. В. Дрозд, Т. С. Тишакова // Тезисы докл. III Всеросс. конф. с междунар. участием «Аналитика России 2009» 20 -24 сентября 2009 г. Краснодар – К. , 2009. - С. 280. 14. Тішакова Т. С. Спектрофотометричне визначення йоду та йодвмістних аніонів при використанні електрохімічного окиснення / Т. С. Тішакова, А. В. Дрозд // Тези доп. Річної сесії наукової ради НАН України з проблеми «Аналітична хімія» 17 -23 травня 2010 р. , м. 26 Гурзуф – Г. , 2010. – С. 53.
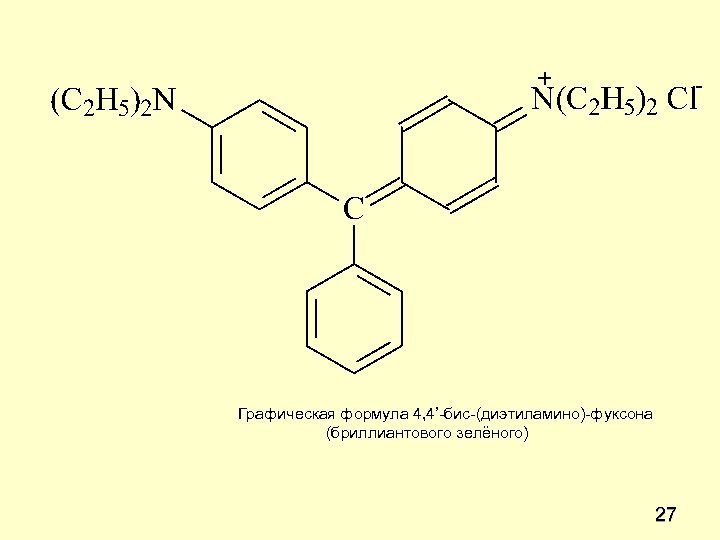 Графическая формула 4, 4’-бис-(диэтиламино)-фуксона (бриллиантового зелёного) 27
Графическая формула 4, 4’-бис-(диэтиламино)-фуксона (бриллиантового зелёного) 27
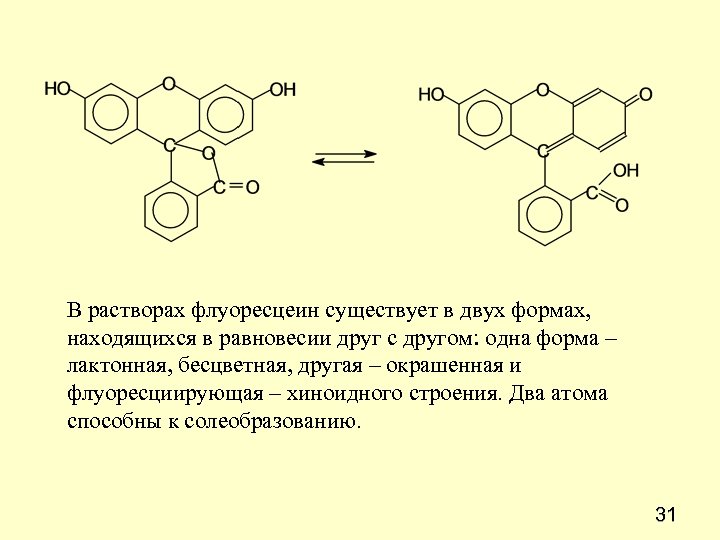 В растворах флуоресцеин существует в двух формах, находящихся в равновесии друг с другом: одна форма – лактонная, бесцветная, другая – окрашенная и флуоресциирующая – хиноидного строения. Два атома способны к солеобразованию. 31
В растворах флуоресцеин существует в двух формах, находящихся в равновесии друг с другом: одна форма – лактонная, бесцветная, другая – окрашенная и флуоресциирующая – хиноидного строения. Два атома способны к солеобразованию. 31
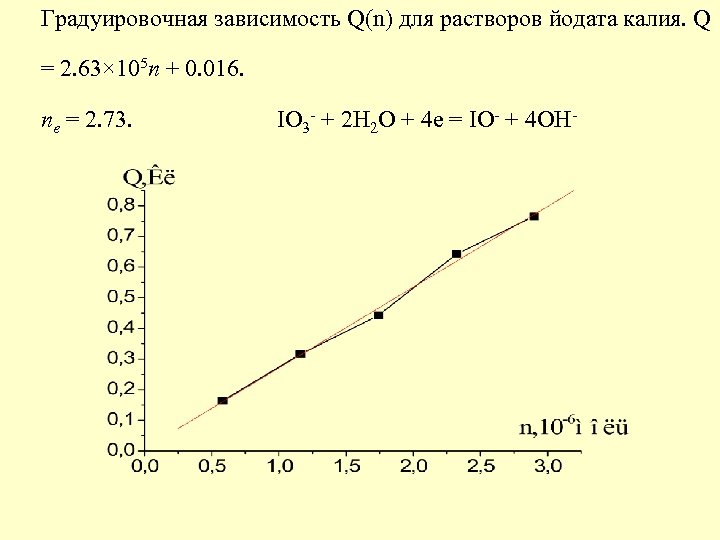 Градуировочная зависимость Q(n) для растворов йодата калия. Q n = 2. 73. IO + 2 H O + 4 e = IO + 4 OH = 2. 63× 105 n + 0. 016. e 3 - 2 - -
Градуировочная зависимость Q(n) для растворов йодата калия. Q n = 2. 73. IO + 2 H O + 4 e = IO + 4 OH = 2. 63× 105 n + 0. 016. e 3 - 2 - -
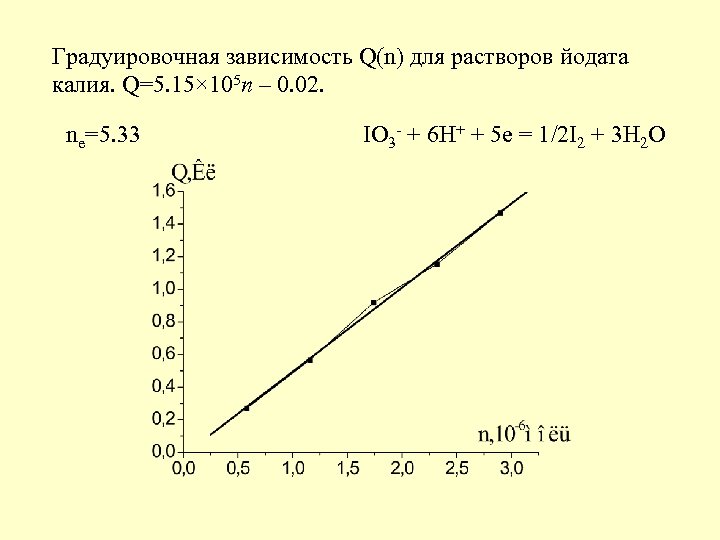 Градуировочная зависимость Q(n) для растворов йодата калия. Q=5. 15× 105 n – 0. 02. n =5. 33 IO + 6 H + 5 e = 1/2 I + 3 H O e 3 - + 2 2
Градуировочная зависимость Q(n) для растворов йодата калия. Q=5. 15× 105 n – 0. 02. n =5. 33 IO + 6 H + 5 e = 1/2 I + 3 H O e 3 - + 2 2
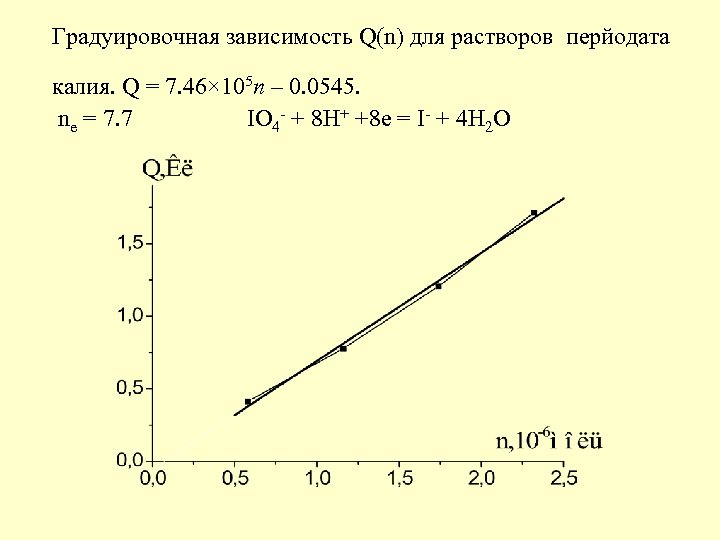 Градуировочная зависимость Q(n) для растворов перйодата калия. Q = 7. 46× 105 n – 0. 0545. ne = 7. 7 IO 4 - + 8 H+ +8 e = I- + 4 H 2 O
Градуировочная зависимость Q(n) для растворов перйодата калия. Q = 7. 46× 105 n – 0. 0545. ne = 7. 7 IO 4 - + 8 H+ +8 e = I- + 4 H 2 O
 32
32


