Добро пожаловать!2.ppt
- Количество слайдов: 40

Добро пожаловать!

Бумажная хроматография!

Бумажная хроматография. Из первого слова вам понятно, что это нечто связанное с бумагой; а второе слово «хроматография» означает «цвет» (хрома) и «писать» (графия). Сложите их, и вы получите «писать цветом на бумаге» .

Бумажная хроматография является важнейшим тестом в науке. Тщательно проанализировав состав химического вещества по цвету, ученый может легко установить исходные вещества. Легко понять, что хроматография, действительно достойная изучения, работает именно за счет капиллярного эффекта – способа, которым вода распространяется в бумаге.

Колонка — содержит хроматографический сорбент, выполняет функцию разделения смеси на индивидуальные компоненты. Элюент — подвижная фаза: газ, жидкость или (реже) сверхкритический флюид. Неподвижная фаза — твердая фаза или жидкость, связанная на инертном носителе, в адсорбционной хроматографии — сорбент. Хроматограмма — результат регистрирования зависимости концентрации компонентов на выходе из колонки от времени. Детектор — устройство для регистрации концентрации компонентов смеси на выходе из колонки. Хроматограф — прибор для проведения хроматографии.
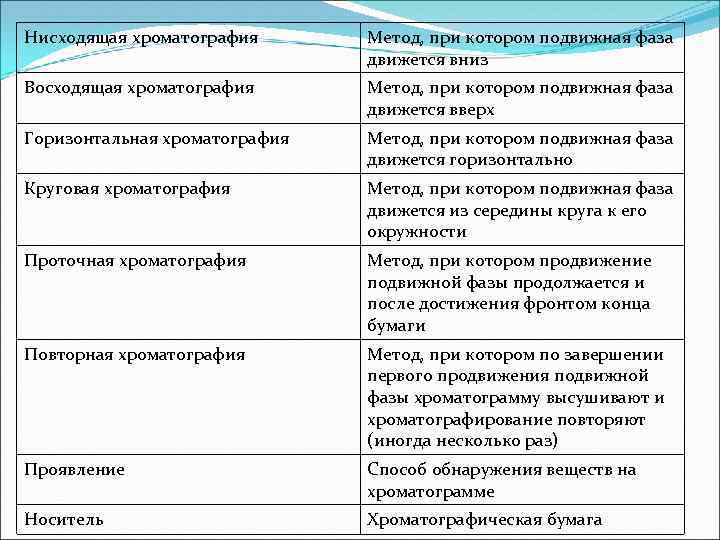
Нисходящая хроматография Метод, при котором подвижная фаза движется вниз Восходящая хроматография Метод, при котором подвижная фаза движется вверх Горизонтальная хроматография Метод, при котором подвижная фаза движется горизонтально Круговая хроматография Метод, при котором подвижная фаза движется из середины круга к его окружности Проточная хроматография Метод, при котором продвижение подвижной фазы продолжается и после достижения фронтом конца бумаги Повторная хроматография Метод, при котором по завершении первого продвижения подвижной фазы хроматограмму высушивают и хроматографирование повторяют (иногда несколько раз) Проявление Способ обнаружения веществ на хроматограмме Носитель Хроматографическая бумага
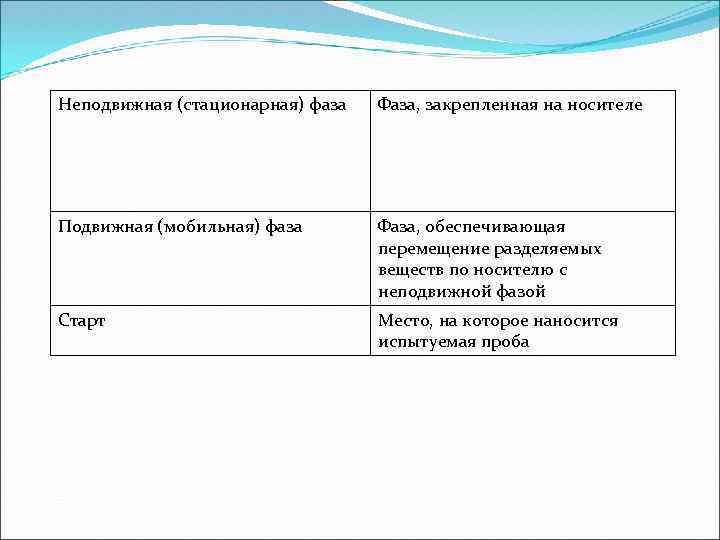
Неподвижная (стационарная) фаза Фаза, закрепленная на носителе Подвижная (мобильная) фаза Фаза, обеспечивающая перемещение разделяемых веществ по носителю с неподвижной фазой Старт Место, на которое наносится испытуемая проба

В бумажной хроматографии используют специальные сорта бумаги, различающиеся по номерам, с возрастанием которых плотность бумаги увеличивается. Бумага удерживает в порах воду, которая и является неподвижной жидкой фазой. Раствор пробы наносят в виде капель на лист бумаги на некотором расстоянии от края. После испарения растворителя край листа помещают в герметическую камеру, содержащую проявитель — подвижную жидкую фазу (например, спирты, кетоны, фенолы, четырёххлористый углерод, хлороформ и другие их смеси, а также смеси с неорганическими растворителями). При этом происходит передвижение исходного пятна по току проявителя и разделение смеси на компоненты. Если вещества не окрашены, то хроматограмму проявляют, например, опрыскиванием раствором индикатора, рассматривают в ультрафиолетовых лучах и пр. Отношение расстояния Rf, пройденного пятном I, к расстоянию, пройденному фронтом проявителя m, при одинаковых условиях эксперимента является постоянной величиной; Rf для различных веществ отличаются по значению и могут быть использованы для идентификации соединений.
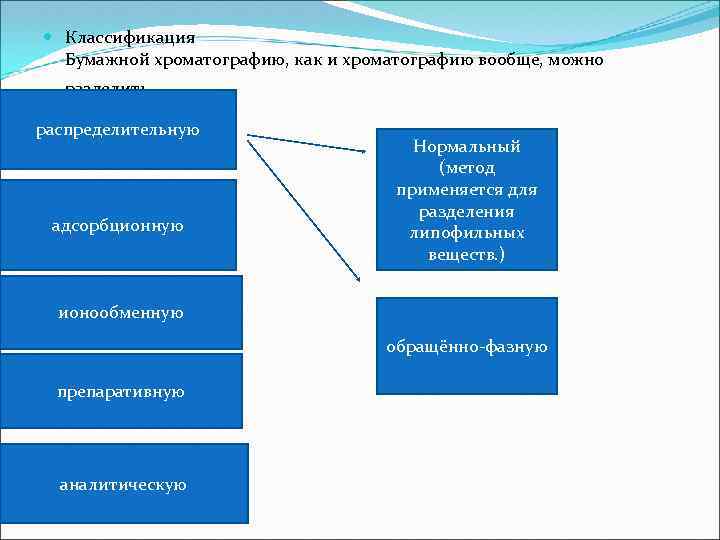
Классификация Бумажной хроматографию, как и хроматографию вообще, можно разделить распределительную адсорбционную Нормальный (метод применяется для разделения липофильных веществ. ) ионообменную обращённо фазную препаративную аналитическую

Количественные определения различных веществ в пятнах хроматограммы ведутся обычными аналитическими методами. Различают : одномерные, двумерные, круговые, колоночные и электрофоретические хроматограммы.

I. Адсорбционная хроматография основана на избирательной адсорбции отдельных компонентов анализируемой смеси соответствующими адсорбентами. При работе этим методом анализируемый раствор пропускают через колонку, заполненную мелкими зернами адсорбента. Применяют адсорбционную хроматографию для разделения неэлектролитов, паров и газов. II. Распределительная хроматография основана на использовании различия коэффициентов сорбируемости отдельных компонентов анализируемой смеси между двумя несмешивающимися жидкостями. Одна из жидкостей (неподвижная) находится в порах пористого вещества (носителя), а вторая (подвижная) представляет собой другой растворитель, не смешивающийся с первым.

Этот растворитель пропускают через колонку с небольшой скоростью. Различные величины коэффициентов распределения обеспечивают неодинаковую скорость движения и разделения компонентов смеси. Коэффициент распределения вещества между двумя несмешивающимися растворителями есть отношение концентрации вещества в подвижном растворителе к концентрации того же вещества в неподвижном растворителе: (К = Сподв/Снеподв).

Иногда в качестве носителя для неподвижного растворителя вместо колонки используют полоски или листы фильтровальной бумаги, не содержащей минеральных примесей. В этом случае каплю испытуемого раствора наносят на край полоски бумаги, которую подвешивают в закрытой камере, опустив ее край с нанесенной на нее каплей испытуемого раствора в сосуд подвижным растворителем (движителем), который, перемещаясь по бумаге, смачивает ее. При этом каждое содержащееся в анализируемой смеси вещество перемещается с присущей ему скоростью в том же направлении, что и движитель.

Особым видом распределительной хроматографии является газожидкостная хроматография (ГЖК). В качестве неподвижной фазы используют различные нелетучие жидкости, нанесенные на инертный твердый носитель; в качестве подвижной фазы газообразные азот, водород, гелий, двуокись углерода и др. Разделение смесей методом ГЖК осуществляется в колонках, представляющих собой трубки с внутренним диаметром 1 6 мм и длиной 1 5 м, заполненные инертным носителем, например диатомитом, пропитанным нелетучей жидкостью, или стальные и стеклянные капилляры диаметром 0, 2 0, 3 мм и длиной 25 100 м с жидкой фазой, нанесенной на стенки этих капилляров (капиллярная газожидкостная хроматография).

. Ионообменная хроматография основана на использовании ионообменных процессов, протекающих между подвижными ионами адсорбента и ионами электролита при пропускании раствора анализируемого вещества через колонку, заполненную ионообменным веществом (ионитом). Иониты представляют собой нерастворимые неорганические и органические высокомолекулярные соединения, содержащие активные (ионогенные) группы. Подвижные ионы этих групп способны при контакте с растворами электролитов обмениваться на катионы или анионы растворенного вещества. В качестве ионитов применяют окись алюминия (для хроматографии), пермутин, сульфоуголь и разнообразные ионообменные вещества ионообменные смолы. Иониты делят на катиониты, способные к катионному обмену (содержат активные группы: SO 3 H, COOH, OH); аниониты, способные к анионному обмену (активные группы: NH 2, =NH); амфолиты – ионообменные вещества, обладающие амфотерными свойствами.

IV. Осадочная хроматография основана на различной растворимости осадков, образуемых различными компонентами анализируемой смеси со специальными реактивами, нанесенными на высокодисперсное вещество. Анализируемые растворы пропускают через колонку, заполненную пористым веществом (носителем). Носитель пропитан реактивом осадителем, который образует с ионами раствора осадки, имеющие различную растворимость. Образовавшиеся осадки в зависимости от растворимости располагаются в определенной последовательности по высоте колонки.

V. Эксклюзионная (молекулярно ситовая) хроматография основана на разной проницаемости молекул компонентов в неподвижную фазу (высокопористый неионогенный гель). Эксклюзионная хроматография подразделяется на гельпроникающую (ГПХ), в которой элюент – неводный растворитель, и гель фильтрацию, где элюент – вода.

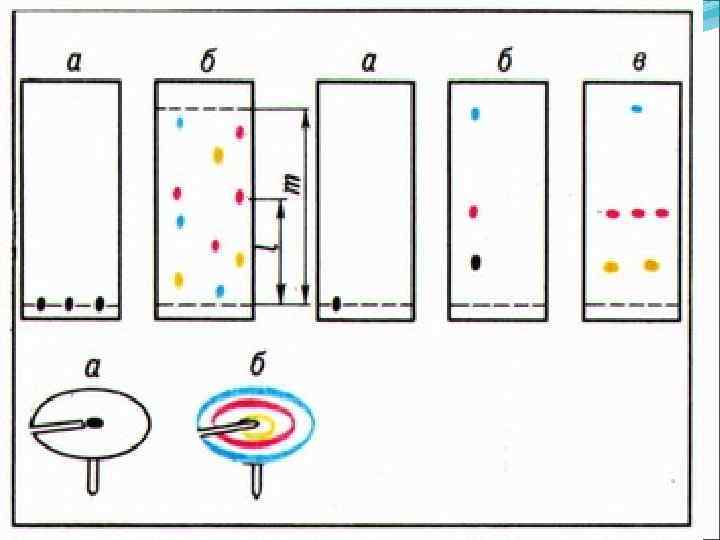
Внося в центр листка смоченной фильтровальной бумаги каплю смеси красных и синих чернил и аккуратно нанося по кап лям чистую воду, вы скоро получите точно такую же картинку. Внизу— кольцевая хроматограмма на бумаге слож ной смеси шести различных аминокислот,
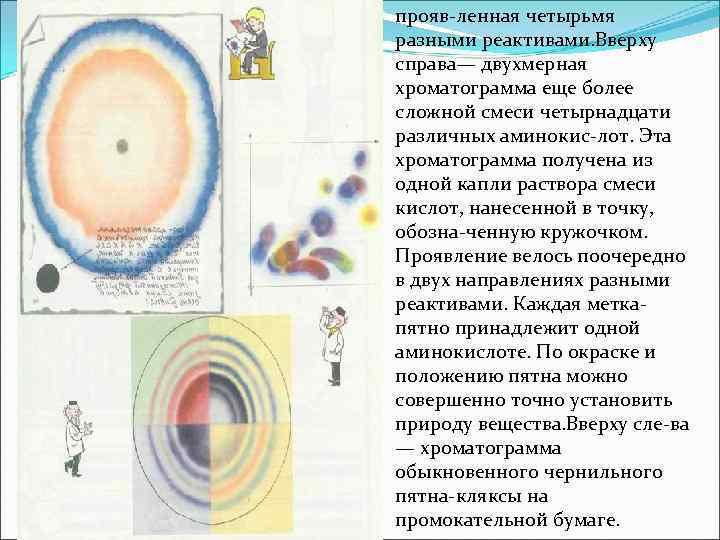
прояв ленная четырьмя разными реактивами. Вверху справа— двухмерная хроматограмма еще более сложной смеси четырнадцати различных аминокис лот. Эта хроматограмма получена из одной капли раствора смеси кислот, нанесенной в точку, обозна ченную кружочком. Проявление велось поочередно в двух направлениях разными реактивами. Каждая метка пятно принадлежит одной аминокислоте. По окраске и положению пятна можно совершенно точно установить природу вещества. Вверху сле ва — хроматограмма обыкновенного чернильного пятна кляксы на промокательной бумаге.


Проявление хроматограмм Проявление компонентов на хроматограмме проводят одним из способов, приведенных ниже. Физические методы(Визуально, при дневном свете, отмечают на хроматограмме положение пятен цветных веществ. При наличии флуоресцирующих веществ проявление проводят в УФ свете. ) Химические методы(Хроматограммы проявляют жидкими и газообразными проявителями, используя реакцию имеющихся на хроматограмме соединений с подходящим реагентом проявителем с образованием окрашенного или флуоресцирующего вещества. Жидкие проявители наносят пульверизатором или используют реагенты в аэрозольной упаковке, газообразные применяют, поместив хроматограмму в пары проявителя. )

Хроматограмму кладут горизонтально на лист фильтровальной бумаги или оставляют подвешенной на стеклянной палочке и опрыскивают как можно более мелкими каплями (туманом) проявителя всю площадь хроматограммы вначале с одной, а потом с другой стороны. При проявлении газообразным проявителем хроматограмму подвешивают в камере, в которую помещен летучий реагент (например, кристаллы йода), или на дне которой проявитель получают химическим путем (например, оксиды азота получают путем добавления твердого нитрита натрия к раствору соляной кислоты).

Биологические методы Хроматограммы проявляют, используя биологическую активность хроматографируемых веществ. Качественная оценка хроматограммы заключается в определении положения пятна или полосы, которое характеризуется значением R f=a/b, где a расстояние от центра пятна пробы до стартовой линии, мм; b расстояние от фронта растворителя до стартовой линии, мм, или значением Rx: Rx= a/c, где c расстояние от центра пятна вещества сравнения до стартовой линии, мм.

Определение количества искомого компонента в пробе проводят путем сравнения размеров и интенсивности окраски его пятна с пятнами вещества сравнения, нанесенными на бумагу в интервале значений концентрации, указанных в нормативно технической документации на испытуемый реактив, и обработанными в условиях испытания. Оценку проводят визуально или с помощью аппаратуры (например, денситометра, устройства для сканирования пятен компонентов на бумаге), или путем элюирования пятен и последующего фотометрического определения оптической плотности растворов. Хроматограммы хранят в условиях, препятствующих появлению взаимных оттисков хроматограмм (например, с прокладками из фильтровальной бумаги). Если характер пятен позволяет, то на хроматограммы наносят слой быстросохнущего лака. В случае необходимости проводят зарисовку контура хроматограммы или фотографирование.
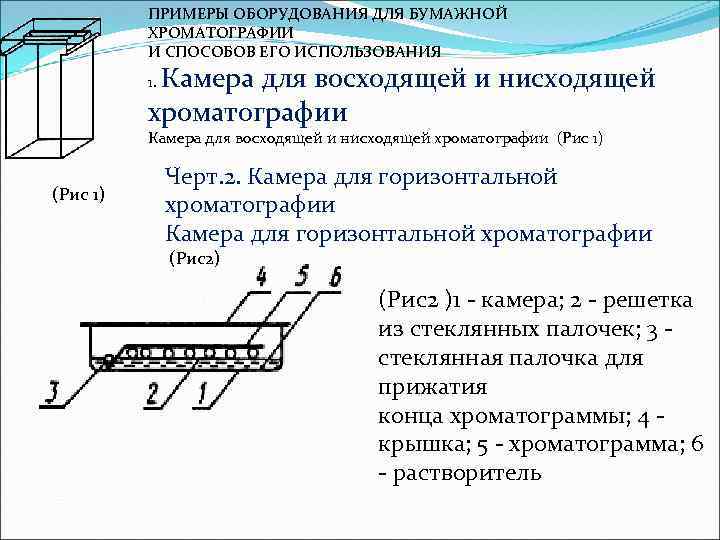
ПРИМЕРЫ ОБОРУДОВАНИЯ ДЛЯ БУМАЖНОЙ ХРОМАТОГРАФИИ И СПОСОБОВ ЕГО ИСПОЛЬЗОВАНИЯ Камера для восходящей и нисходящей хроматографии 1. Камера для восходящей и нисходящей хроматографии (Рис 1) Черт. 2. Камера для горизонтальной хроматографии (Рис2) (Рис2 )1 камера; 2 решетка из стеклянных палочек; 3 стеклянная палочка для прижатия конца хроматограммы; 4 крышка; 5 хроматограмма; 6 растворитель
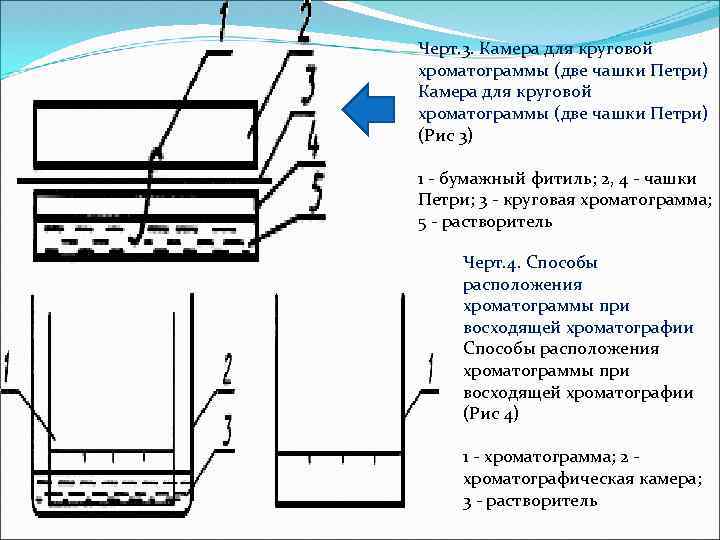
Черт. 3. Камера для круговой хроматограммы (две чашки Петри) (Рис 3) 1 бумажный фитиль; 2, 4 чашки Петри; 3 круговая хроматограмма; 5 растворитель Черт. 4. Способы расположения хроматограммы при восходящей хроматографии (Рис 4) 1 хроматограмма; 2 хроматографическая камера; 3 растворитель
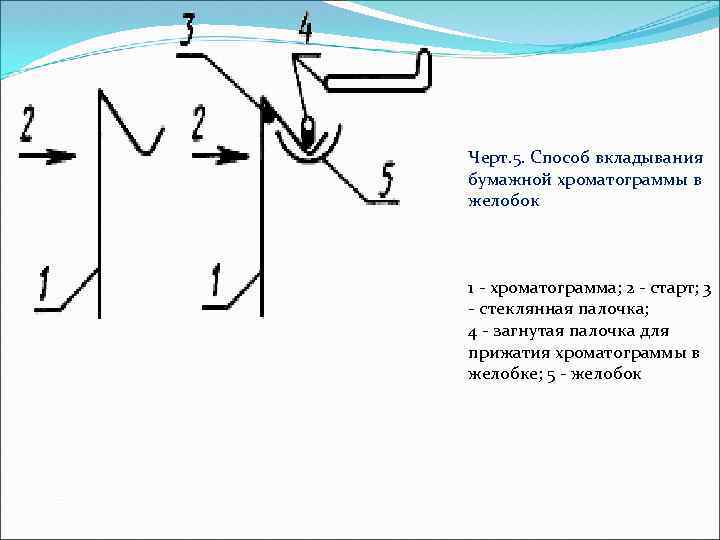
Черт. 5. Способ вкладывания бумажной хроматограммы в желобок 1 хроматограмма; 2 старт; 3 стеклянная палочка; 4 загнутая палочка для прижатия хроматограммы в желобке; 5 желобок

Двумерную хроматограмму получают разделением пятен одномерной хроматограммы другим проявителем в направлении, перпендикулярном первому ряду пятен. На круговой хроматограмме пятно, помещённое в центре листа, размывают по концентрическим окружностям. В колоночной бумажной хроматографии разделение проводят на бумажных дисках, плотно вставленных в цилиндрическую колонку. Для получения электрофоретических хроматограмм бумажный лист пропитывают электролитом, закрепляют между электродами, наносят анализируемую смесь, подключают электроды к источнику постоянного тока и одновременно на бумагу подают подвижный растворитель в направлении, перпендикулярном направлению силовых линий электрического тока.

В этом методе разделение компонентов происходит вследствие их неодинакового распределения между двумя жидкими фазами и разной скорости перемещения веществ под действием электрического поля. Бумажную хроматографию используют для разделения и анализа неорганических и органических веществ в природных и промышленных материалах (например, определяют смолы в нефтепродуктах, редкоземельные элементы в горных породах и минералах).

Хроматографические методы незаменимы в контроле качества пищевых продуктов. Пищевую ценность продуктов определяют, анализируя аминокислотный состав белков, изомерный состав жирных кислот и глицеридов в жирах, углеводы, органические кислоты и витамины. В последние годы многие из этих анализов выполняются с помощью высокоэффективной жидкостной хроматографии. Для оценки безопасности продуктов в них выявляют пищевые добавки (консерванты, антиоксиданты, подслащивающие вещества, красители и др. ), определяют свежесть продуктов, устанавливают ранние стадии порчи и допустимые сроки хранения.

В пищевых продуктах методами хроматографии можно обнаружить такие загрязняющие вещества, как пестициды, нитрозамины, микотоксины (афлатоксины, охратоксин А, зеараленон и др. ), полиядерные ароматические соединения, биогенные амины, нитраты и др. Загрязнение пищевых продуктов возможно и вследствие проникновения вредных веществ из материалов упаковки, в частности, хлористого винила, бензола, пластификаторов и др. В мясных продуктах определяют анаболитические стероиды, гормоны и другие типы фармацевтических препаратов, злоупотребление которыми характерно для интенсивного животноводства. Отдельная область применения газовой хроматографии анализ состава аромата пищевых продуктов. Обнаружены тысячи летучих компонентов, из которых лишь несколько десятков определяют характер запаха, остальные придают запаху и вкусу продукта индивидуальность.

В последние годы возникло новое направление энантиоселективный анализ компонентов пищи. По соотношению оптических изомеров аминокислот, оксикислот и некоторых иных соединений можно однозначно установить, является ли данный продукт натуральным или содержит синтетические имитаторы и добавки. Энантиомерный анализ показал, что микроволновая обработка пищевых продуктов, в отличие от жесткой термической, не приводит к рацемизации аминокислот. Однако все молочные продукты, подвергнутые процессам брожения, содержат немало (нетоксичных) D аланина и D аспарагиновой кислоты продуктов жизнедеятельности молочнокислых бактерий.

В природных жирах преобладают цис изомеры жирных кислот. Недавно обнаружено, что транс изомеры повышают содержание липопротеинов низкой плотности и уменьшают концентрацию липопротеинов высокой плотности в крови, что может способствовать развитию атеросклероза. Разработка методики газохроматографического разделения и анализа всех изомеров жирных кислот заставила производителей в несколько раз снизить содержание транс изомеров ненасыщенных кислот в маргарине.

Методом газовой хроматографии в некоторых сырах выявлено много нежелательных физиологически активных биогенных аминов, и эти сорта сыра были запрещены. В Японии в пищевых продуктах используется L триптофан, полученный с помощью генной инженерии и биотехнологии. И когда у тысяч людей обнаружили неизвестное ранее заболевание и десятки заболевших умерли, хроматографическими методами было установлено, что эти трагические последствия вызваны наличием токсичных загрязнений в триптофане (выявлено 60 примесей). Газохроматографическому анализу подвергаются вина, коньяки и другая спиртосодержащая продукция.

Теперь опять вернемся к фальшивому сливочному маслу. Есть такое масло — «Крестьянское» . С виду — масло как масло. Пахнет как сливочное. Вкусное. Для начала решено было проверить сколько в нем триглицеридов. В настоящем масле триглицеридов от массы всех липидов — большинство. В среднем — 98%. Для проверки применяем метод тонкослойной хроматографии. Используем пластинки Sorbfil. Хроматографическая система самая простая — бензол.



Спасибо за внимание!
Добро пожаловать!2.ppt