Лекция 1 Органическая химия начало.ppt
- Количество слайдов: 13
 До начала ХIХ века вещества делили по происхождению на минеральные, животные и растительные. В 1807 году шведский химик И. Я. Берцелиус ввел в науку термин «органические вещества» , объединив в одну группу вещества растительного и животного происхождения. Науку об этих веществах он предложил называть органической химией. В начале ХIХ века считалось, что органические вещества в искусственных условиях получить нельзя, они образуются только в живых организмах или под их воздействием. Ошибочность этого представления была доказана синтезами органических веществ в лабораторных условиях: в 1828 году немецкий химик Ф. Велер синтезирует мочевину, его соотечественник А. В. Кольбе в 1845 г. получает уксусную кислоту, в 1854 г. французский химик П. Э. Бертло – жиры, в 1861 г. русский химик А. М. Бутлеров – сахаристое вещество.
До начала ХIХ века вещества делили по происхождению на минеральные, животные и растительные. В 1807 году шведский химик И. Я. Берцелиус ввел в науку термин «органические вещества» , объединив в одну группу вещества растительного и животного происхождения. Науку об этих веществах он предложил называть органической химией. В начале ХIХ века считалось, что органические вещества в искусственных условиях получить нельзя, они образуются только в живых организмах или под их воздействием. Ошибочность этого представления была доказана синтезами органических веществ в лабораторных условиях: в 1828 году немецкий химик Ф. Велер синтезирует мочевину, его соотечественник А. В. Кольбе в 1845 г. получает уксусную кислоту, в 1854 г. французский химик П. Э. Бертло – жиры, в 1861 г. русский химик А. М. Бутлеров – сахаристое вещество.
 Вопрос: На каком основании органические вещества выделяют в отдельные группы, классы? Каковы их отличительные признаки? С 2 Н 2 О 2 – уксусная кислота С 3 Н 3 О – ацетон С 2 Н 6 О – спирт С 6 Н 12 N 4 – сухой горючий уротропин C 6 H 8 O 6 – витамин С C 12 H 22 O 11 – сахар CХHУ – парафиновая свеча, нефтепродукты (C 6 H 10 O 5)n - целлюлоза
Вопрос: На каком основании органические вещества выделяют в отдельные группы, классы? Каковы их отличительные признаки? С 2 Н 2 О 2 – уксусная кислота С 3 Н 3 О – ацетон С 2 Н 6 О – спирт С 6 Н 12 N 4 – сухой горючий уротропин C 6 H 8 O 6 – витамин С C 12 H 22 O 11 – сахар CХHУ – парафиновая свеча, нефтепродукты (C 6 H 10 O 5)n - целлюлоза
 Признаки органических веществ: 1. Содержат все – углерод. 2. Горят или разлагаются с образованием углеродсодержащих продуктов. 3. Имеют низкие температуры кипения и плавления. Органическая химия – наука об органических веществах, их строении, свойствах, методах получения. Предметом изучения органической химии являются углеводороды и их производные.
Признаки органических веществ: 1. Содержат все – углерод. 2. Горят или разлагаются с образованием углеродсодержащих продуктов. 3. Имеют низкие температуры кипения и плавления. Органическая химия – наука об органических веществах, их строении, свойствах, методах получения. Предметом изучения органической химии являются углеводороды и их производные.
 Теория Бутлерова: Строение органических веществ зависит не только какие элементы и в каком количестве входят в молекулу вещества, а в строгой определенной последовательности соединения атомов углерода друг с другом в молекуле, характерной и единственной для данного вещества. А. М. Бутлеров открыл и обосновал (теоретически и практически) теории изомерии. Изомеры – соединения, которые имеют одинаковую массу, одинаковый качественный и количественный состав, но отличаются порядком соединения атомов углерода друг с другом, т. е. разным химическим строением.
Теория Бутлерова: Строение органических веществ зависит не только какие элементы и в каком количестве входят в молекулу вещества, а в строгой определенной последовательности соединения атомов углерода друг с другом в молекуле, характерной и единственной для данного вещества. А. М. Бутлеров открыл и обосновал (теоретически и практически) теории изомерии. Изомеры – соединения, которые имеют одинаковую массу, одинаковый качественный и количественный состав, но отличаются порядком соединения атомов углерода друг с другом, т. е. разным химическим строением.
 Число возможных изомеров Число атомных частиц углерода в молекуле алкана Число возможных изомеров 4 5 6 7 8 9 10 11 2 3 5 9 18 35 75 159 Пример: Пентан С 5 Н 12 – имеет 3 изомера: 1. Н 3 С – СН 2 –СН 3 2. Н 3 С – СН 2 – СН 3 3. СН 3 1. 3. Н 3 С – СН 3 2. СН 3
Число возможных изомеров Число атомных частиц углерода в молекуле алкана Число возможных изомеров 4 5 6 7 8 9 10 11 2 3 5 9 18 35 75 159 Пример: Пентан С 5 Н 12 – имеет 3 изомера: 1. Н 3 С – СН 2 –СН 3 2. Н 3 С – СН 2 – СН 3 3. СН 3 1. 3. Н 3 С – СН 3 2. СН 3
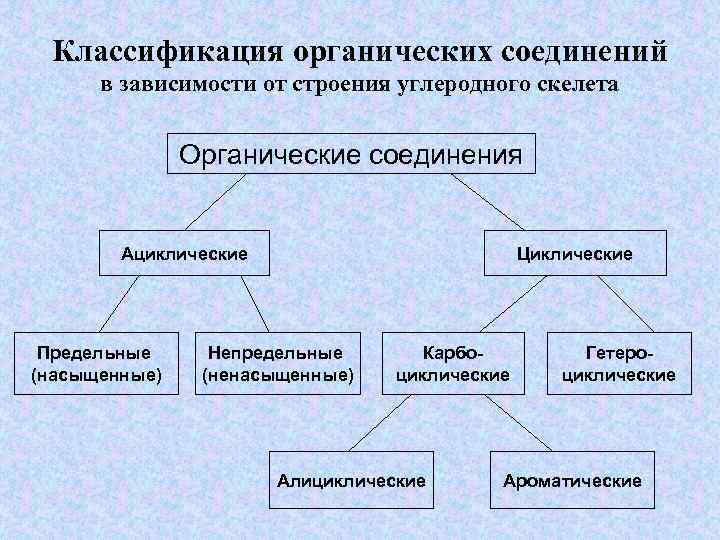 Классификация органических соединений в зависимости от строения углеродного скелета Органические соединения Ациклические Предельные (насыщенные) Циклические Непредельные (ненасыщенные) Карбоциклические Алициклические Гетероциклические Ароматические
Классификация органических соединений в зависимости от строения углеродного скелета Органические соединения Ациклические Предельные (насыщенные) Циклические Непредельные (ненасыщенные) Карбоциклические Алициклические Гетероциклические Ароматические
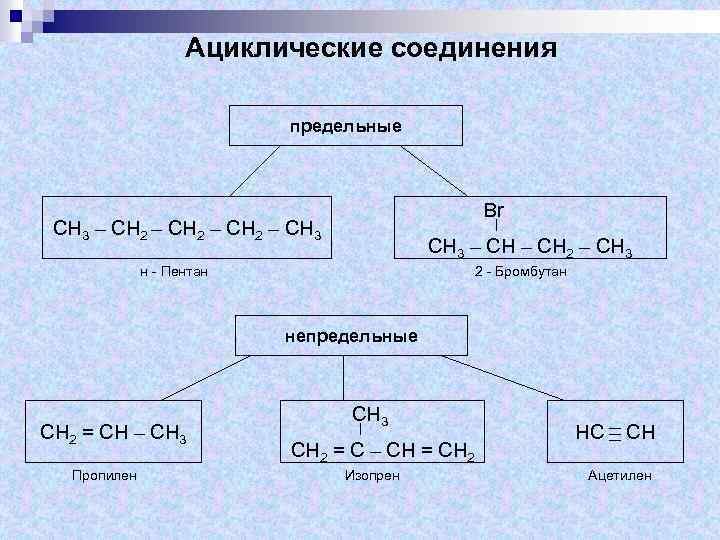 Ациклические соединения предельные Br СН 3 – СН 2 – СН 3 – СН 2 – СН 3 н - Пентан 2 - Бромбутан непредельные СН 2 = СН – СН 3 Пропилен СН 3 СН 2 = С – СН = СН 2 Изопрен НС СН Ацетилен
Ациклические соединения предельные Br СН 3 – СН 2 – СН 3 – СН 2 – СН 3 н - Пентан 2 - Бромбутан непредельные СН 2 = СН – СН 3 Пропилен СН 3 СН 2 = С – СН = СН 2 Изопрен НС СН Ацетилен
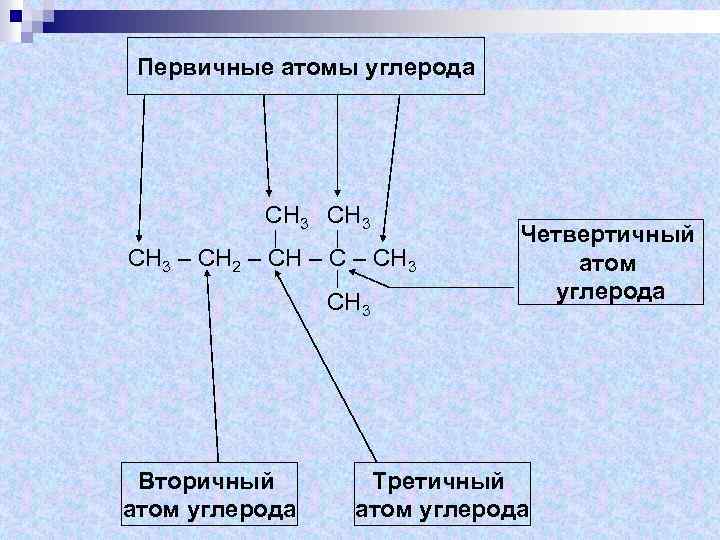 Первичные атомы углерода СН 3 – СН 2 – СН 3 СН 3 Вторичный атом углерода Четвертичный атом углерода Третичный атом углерода
Первичные атомы углерода СН 3 – СН 2 – СН 3 СН 3 Вторичный атом углерода Четвертичный атом углерода Третичный атом углерода
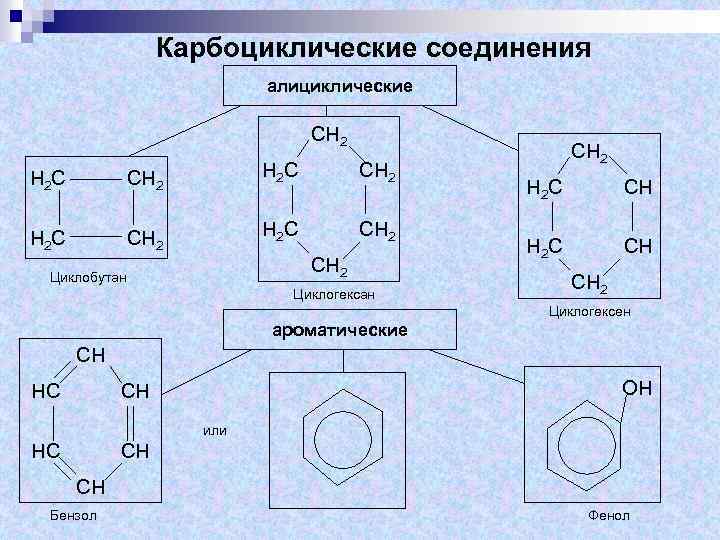 Карбоциклические соединения алициклические СН 2 Н 2 С СН 2 Циклобутан Циклогексан СН 2 С СН СН 2 Циклогексен ароматические СН НС ОН СН или НС СН СН Бензол Фенол
Карбоциклические соединения алициклические СН 2 Н 2 С СН 2 Циклобутан Циклогексан СН 2 С СН СН 2 Циклогексен ароматические СН НС ОН СН или НС СН СН Бензол Фенол
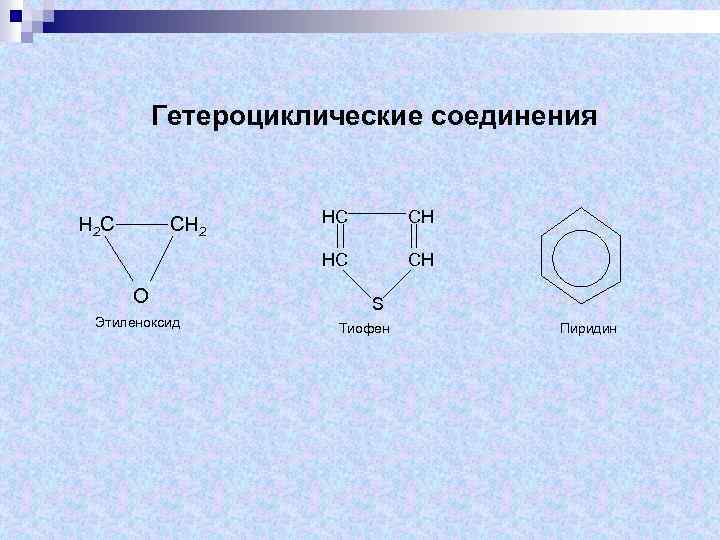 Гетероциклические соединения СН 2 О Этиленоксид НС СН НС Н 2 С СН S Тиофен Пиридин
Гетероциклические соединения СН 2 О Этиленоксид НС СН НС Н 2 С СН S Тиофен Пиридин
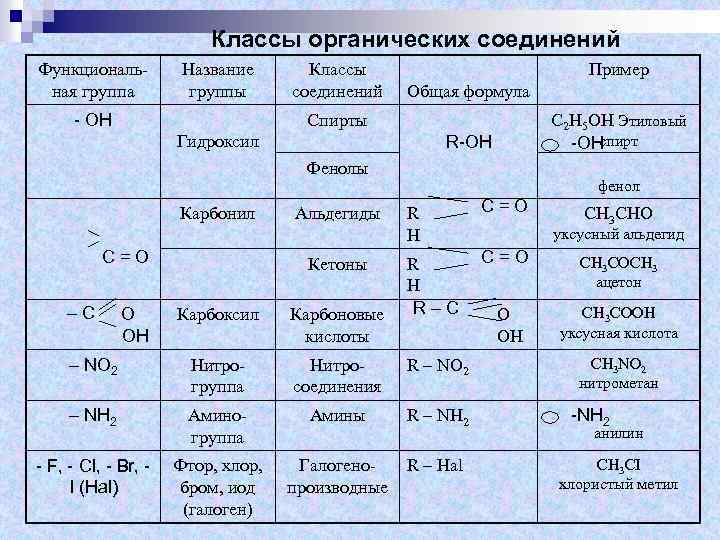 Классы органических соединений Функциональная группа Название группы - ОН Классы соединений Пример Общая формула Спирты R-OH Гидроксил Фенолы Карбонил C=O –C O OH Альдегиды фенол R H C=O R H R–C Карбоновые O кислоты OH Кетоны Карбоксил С 2 Н 5 ОН Этиловый спирт -OH – NO 2 Нитрогруппа Нитросоединения R – NO 2 – NH 2 Аминогруппа Амины R – NH 2 - F, - Cl, - Br, I (Hal) Фтор, хлор, бром, иод (галоген) Галогено- производные R – Hal СН 3 СНО уксусный альдегид СН 3 СОСН 3 ацетон СН 3 СООН уксусная кислота СН 3 NO 2 нитрометан -NН 2 анилин СН 3 СI хлористый метил
Классы органических соединений Функциональная группа Название группы - ОН Классы соединений Пример Общая формула Спирты R-OH Гидроксил Фенолы Карбонил C=O –C O OH Альдегиды фенол R H C=O R H R–C Карбоновые O кислоты OH Кетоны Карбоксил С 2 Н 5 ОН Этиловый спирт -OH – NO 2 Нитрогруппа Нитросоединения R – NO 2 – NH 2 Аминогруппа Амины R – NH 2 - F, - Cl, - Br, I (Hal) Фтор, хлор, бром, иод (галоген) Галогено- производные R – Hal СН 3 СНО уксусный альдегид СН 3 СОСН 3 ацетон СН 3 СООН уксусная кислота СН 3 NO 2 нитрометан -NН 2 анилин СН 3 СI хлористый метил
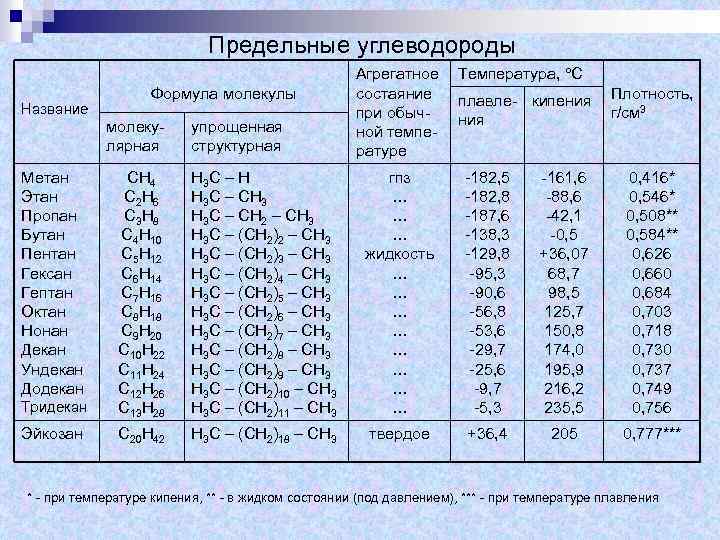 Предельные углеводороды Название Формула молекулы молекулярная упрощенная структурная Агрегатное состаяние при обычной температуре Температура, С плавле- кипения Плотность, г/см 3 Тридекан СН 4 С 2 Н 6 С 3 Н 8 С 4 Н 10 С 5 Н 12 С 6 Н 14 С 7 Н 16 С 8 Н 18 С 9 Н 20 С 10 Н 22 С 11 Н 24 С 12 Н 26 С 13 Н 28 Н 3 С – Н Н 3 С – СН 3 Н 3 С – СН 2 – СН 3 Н 3 С – (СН 2)3 – СН 3 Н 3 С – (СН 2)4 – СН 3 Н 3 С – (СН 2)5 – СН 3 Н 3 С – (СН 2)6 – СН 3 Н 3 С – (СН 2)7 – СН 3 Н 3 С – (СН 2)8 – СН 3 Н 3 С – (СН 2)9 – СН 3 Н 3 С – (СН 2)10 – СН 3 Н 3 С – (СН 2)11 – СН 3 гпз … … … жидкость … … … … -182, 5 -182, 8 -187, 6 -138, 3 -129, 8 -95, 3 -90, 6 -56, 8 -53, 6 -29, 7 -25, 6 -9, 7 -5, 3 -161, 6 -88, 6 -42, 1 -0, 5 +36, 07 68, 7 98, 5 125, 7 150, 8 174, 0 195, 9 216, 2 235, 5 0, 416* 0, 546* 0, 508** 0, 584** 0, 626 0, 660 0, 684 0, 703 0, 718 0, 730 0, 737 0, 749 0, 756 Эйкозан С 20 Н 42 Н 3 С – (СН 2)18 – СН 3 твердое +36, 4 205 0, 777*** Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан Ундекан Додекан * - при температуре кипения, ** - в жидком состоянии (под давлением), *** - при температуре плавления
Предельные углеводороды Название Формула молекулы молекулярная упрощенная структурная Агрегатное состаяние при обычной температуре Температура, С плавле- кипения Плотность, г/см 3 Тридекан СН 4 С 2 Н 6 С 3 Н 8 С 4 Н 10 С 5 Н 12 С 6 Н 14 С 7 Н 16 С 8 Н 18 С 9 Н 20 С 10 Н 22 С 11 Н 24 С 12 Н 26 С 13 Н 28 Н 3 С – Н Н 3 С – СН 3 Н 3 С – СН 2 – СН 3 Н 3 С – (СН 2)3 – СН 3 Н 3 С – (СН 2)4 – СН 3 Н 3 С – (СН 2)5 – СН 3 Н 3 С – (СН 2)6 – СН 3 Н 3 С – (СН 2)7 – СН 3 Н 3 С – (СН 2)8 – СН 3 Н 3 С – (СН 2)9 – СН 3 Н 3 С – (СН 2)10 – СН 3 Н 3 С – (СН 2)11 – СН 3 гпз … … … жидкость … … … … -182, 5 -182, 8 -187, 6 -138, 3 -129, 8 -95, 3 -90, 6 -56, 8 -53, 6 -29, 7 -25, 6 -9, 7 -5, 3 -161, 6 -88, 6 -42, 1 -0, 5 +36, 07 68, 7 98, 5 125, 7 150, 8 174, 0 195, 9 216, 2 235, 5 0, 416* 0, 546* 0, 508** 0, 584** 0, 626 0, 660 0, 684 0, 703 0, 718 0, 730 0, 737 0, 749 0, 756 Эйкозан С 20 Н 42 Н 3 С – (СН 2)18 – СН 3 твердое +36, 4 205 0, 777*** Метан Этан Пропан Бутан Пентан Гексан Гептан Октан Нонан Декан Ундекан Додекан * - при температуре кипения, ** - в жидком состоянии (под давлением), *** - при температуре плавления
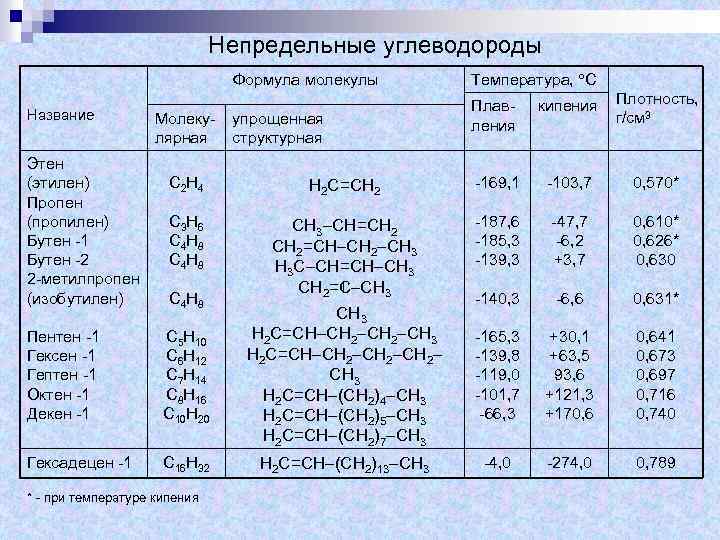 Непредельные углеводороды Формула молекулы Название Этен (этилен) Пропен (пропилен) Бутен -1 Бутен -2 2 -метилпропен (изобутилен) Молекулярная упрощенная структурная Температура, С Плавления кипения Плотность, г/см 3 С 2 Н 4 Н 2 С=СН 2 -169, 1 -103, 7 0, 570* С 3 Н 6 С 4 Н 8 СН 3–СН=СН 2=СН–СН 2–СН 3 Н 3 С–СН=СН–СН 3 СН 2=С–СН 3 -187, 6 -185, 3 -139, 3 -47, 7 -6, 2 +3, 7 0, 610* 0, 626* 0, 630 -140, 3 -6, 6 0, 631* -165, 3 -139, 8 -119, 0 -101, 7 -66, 3 +30, 1 +63, 5 93, 6 +121, 3 +170, 641 0, 673 0, 697 0, 716 0, 740 -4, 0 -274, 0 0, 789 С 4 Н 8 Пентен -1 Гексен -1 Гептен -1 Октен -1 Декен -1 С 5 Н 10 С 6 Н 12 С 7 Н 14 С 8 Н 16 С 10 Н 20 СН 3 Н 2 С=СН–СН 2–СН 2– СН 3 Н 2 С=СН–(СН 2)4–СН 3 Н 2 С=СН–(СН 2)5–СН 3 Н 2 С=СН–(СН 2)7–СН 3 Гексадецен -1 С 16 Н 32 Н 2 С=СН–(СН 2)13–СН 3 * - при температуре кипения
Непредельные углеводороды Формула молекулы Название Этен (этилен) Пропен (пропилен) Бутен -1 Бутен -2 2 -метилпропен (изобутилен) Молекулярная упрощенная структурная Температура, С Плавления кипения Плотность, г/см 3 С 2 Н 4 Н 2 С=СН 2 -169, 1 -103, 7 0, 570* С 3 Н 6 С 4 Н 8 СН 3–СН=СН 2=СН–СН 2–СН 3 Н 3 С–СН=СН–СН 3 СН 2=С–СН 3 -187, 6 -185, 3 -139, 3 -47, 7 -6, 2 +3, 7 0, 610* 0, 626* 0, 630 -140, 3 -6, 6 0, 631* -165, 3 -139, 8 -119, 0 -101, 7 -66, 3 +30, 1 +63, 5 93, 6 +121, 3 +170, 641 0, 673 0, 697 0, 716 0, 740 -4, 0 -274, 0 0, 789 С 4 Н 8 Пентен -1 Гексен -1 Гептен -1 Октен -1 Декен -1 С 5 Н 10 С 6 Н 12 С 7 Н 14 С 8 Н 16 С 10 Н 20 СН 3 Н 2 С=СН–СН 2–СН 2– СН 3 Н 2 С=СН–(СН 2)4–СН 3 Н 2 С=СН–(СН 2)5–СН 3 Н 2 С=СН–(СН 2)7–СН 3 Гексадецен -1 С 16 Н 32 Н 2 С=СН–(СН 2)13–СН 3 * - при температуре кипения


