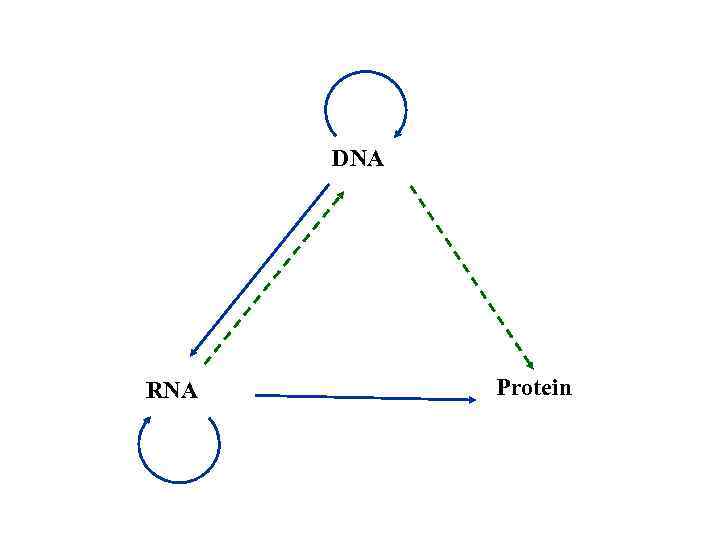
 DNA RNA Protein
DNA RNA Protein
 Лекция 7. Транскрипция ДНК Синтез РНК на ДНК-матрице называется транскрипцией (transcribe— переписывать). Во многих отношениях она аналогична репликации ДНК (одна из нитей ДНК служит матрицей). 1956 – открыт фермент полирибонуклеотидфосфатаза (Очоа, Гринберг-Монато) NDP poly (N) работает без матрицы ADP poly(A) в клетке функция расщепления, а не синтеза 1959 – Weiss обнаружил ДНК-зависимую РНК-полимеразную активность 1961 – Жак Моно и Франсуа Жакоб обнаружили м. РНК и предложили гипотезу существования информационной РНК: ДНК – РНК – белок 1965 – Francois Jacob, Jacques L. Monod, Andre M. Lwoff - Нобелевская премия (M&P) за обнаружение м. РНК и структуру оперона 1999 – установлена структура РНК-полимеразы термофильной бактерии Thermus aquaticus 2001 – установлена структура РНК-полимеразы дрожжей
Лекция 7. Транскрипция ДНК Синтез РНК на ДНК-матрице называется транскрипцией (transcribe— переписывать). Во многих отношениях она аналогична репликации ДНК (одна из нитей ДНК служит матрицей). 1956 – открыт фермент полирибонуклеотидфосфатаза (Очоа, Гринберг-Монато) NDP poly (N) работает без матрицы ADP poly(A) в клетке функция расщепления, а не синтеза 1959 – Weiss обнаружил ДНК-зависимую РНК-полимеразную активность 1961 – Жак Моно и Франсуа Жакоб обнаружили м. РНК и предложили гипотезу существования информационной РНК: ДНК – РНК – белок 1965 – Francois Jacob, Jacques L. Monod, Andre M. Lwoff - Нобелевская премия (M&P) за обнаружение м. РНК и структуру оперона 1999 – установлена структура РНК-полимеразы термофильной бактерии Thermus aquaticus 2001 – установлена структура РНК-полимеразы дрожжей
 Типы РНК - матричные (messager), информационные РНК (м. РНК), направляют синтез белковых молекул; 5 % РНК; - транспортные РНК (т. РНК); 10 % РНК; - рибосомные РНК (р. РНК), компоненты рибосом; 80 -85 % РНК; - малые РНК (мя. РНК, мц. РНК, мяк. РНК), принимают участие в сплайсинге, процессинге р. РНК в ядрышке, формировании 3’-концов гистоновых м. РНК, полиаденилировании, химической модификации; < 2 % РНК. Отличия РНК от ДНК - сахарный остов состоит из рибозы вместо основания тимина (Т) используется основание урацил (U) одноцепочечная. Транскрипция отличается от репликации рядом особенностей: • • РНК-продукт не остается комлпементарно связанным с матрицей. Как только синтез завершен, исходная спираль ДНК восстанавливается, а РНК освобождается. РНК короче ДНК, т. к. являются копиями 1 гена или нескольких генов.
Типы РНК - матричные (messager), информационные РНК (м. РНК), направляют синтез белковых молекул; 5 % РНК; - транспортные РНК (т. РНК); 10 % РНК; - рибосомные РНК (р. РНК), компоненты рибосом; 80 -85 % РНК; - малые РНК (мя. РНК, мц. РНК, мяк. РНК), принимают участие в сплайсинге, процессинге р. РНК в ядрышке, формировании 3’-концов гистоновых м. РНК, полиаденилировании, химической модификации; < 2 % РНК. Отличия РНК от ДНК - сахарный остов состоит из рибозы вместо основания тимина (Т) используется основание урацил (U) одноцепочечная. Транскрипция отличается от репликации рядом особенностей: • • РНК-продукт не остается комлпементарно связанным с матрицей. Как только синтез завершен, исходная спираль ДНК восстанавливается, а РНК освобождается. РНК короче ДНК, т. к. являются копиями 1 гена или нескольких генов.
 Синтез РНК Первый нуклеотид входит в состав цепи, сохраняя свою трифосфатную группу. Элонгация цепи происходит в результате атаки 3’OH группы последнего нуклеотида в цепи 5’ α-Р следующего нуклеозидтрифосфата с освобождением пирофосфата, который затем расщепляется до неорганического фосфата, обеспечивая необратимость реакции. Полимераза катализирует первую реакцию, а фосфатаза вторую: RNAn + NPPP RNAn+1 + PPi 2 Pi ДНК 5’ – ATGATAGA- 3’ смысловая цепь 3’ - TACTATCT – 5’ матричная цепь РНК 5’ – AUGAUAGA – 3’
Синтез РНК Первый нуклеотид входит в состав цепи, сохраняя свою трифосфатную группу. Элонгация цепи происходит в результате атаки 3’OH группы последнего нуклеотида в цепи 5’ α-Р следующего нуклеозидтрифосфата с освобождением пирофосфата, который затем расщепляется до неорганического фосфата, обеспечивая необратимость реакции. Полимераза катализирует первую реакцию, а фосфатаза вторую: RNAn + NPPP RNAn+1 + PPi 2 Pi ДНК 5’ – ATGATAGA- 3’ смысловая цепь 3’ - TACTATCT – 5’ матричная цепь РНК 5’ – AUGAUAGA – 3’
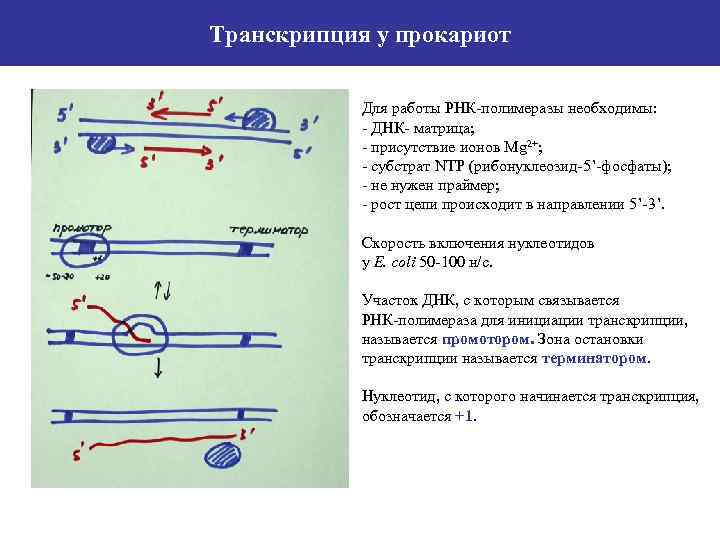 Транскрипция у прокариот Для работы РНК-полимеразы необходимы: - ДНК- матрица; - присутствие ионов Mg 2+; - субстрат NTP (рибонуклеозид-5’-фосфаты); - не нужен праймер; - рост цепи происходит в направлении 5’-3’. Скорость включения нуклеотидов у E. coli 50 -100 н/с. Участок ДНК, с которым связывается РНК-полимераза для инициации транскрипции, называется промотором. Зона остановки транскрипции называется терминатором. Нуклеотид, с которого начинается транскрипция, обозначается +1.
Транскрипция у прокариот Для работы РНК-полимеразы необходимы: - ДНК- матрица; - присутствие ионов Mg 2+; - субстрат NTP (рибонуклеозид-5’-фосфаты); - не нужен праймер; - рост цепи происходит в направлении 5’-3’. Скорость включения нуклеотидов у E. coli 50 -100 н/с. Участок ДНК, с которым связывается РНК-полимераза для инициации транскрипции, называется промотором. Зона остановки транскрипции называется терминатором. Нуклеотид, с которого начинается транскрипция, обозначается +1.
 У прокариот одна РНК- полимераза α 2ββ’ωσ – холофермент (~487 к. Да) α 2ββ’ –core (сердцевина) β - 1342 АК, 150. 62 к. Да β’ - 1407 АК, 155. 16 к. Да каталитическая функция α - 329 АК, 36. 51 к. Да ω - 70 -80 к. Да сборка РНК-полимеразы β участвует в связывании NTTT и построении полинуклеотидной цепи РНК, β’ – осуществляет связывание с ДНК и раскрытие спирали ДНК. Комплекс α 2 β’ служит для взаимодействия с промотором, узнавание которого происходит только после присоединения σ. Две малые субъединицы в виде димера α 2 присоединяются к большому димеру ββ’ с внешней стороны и необходимы для сборки больших субъединиц. ω также необходима для сборки РНКполимеразы. σ - определяет специфичность РНК-полимеразы. Существует 3 группы σ субъединиц: 1. σ70, ~1000 молекул, 70 к. Да – главная. Необходима для присоединения к промоторам большинства генов, экспрессирующихся в экспоненциальной фазе. 2. 7 минорных σ<σ70, для транскрипции ограниченного числа генов, например, σ38 , 50 генов, необходимых для перехода в стационарную фазу, σ19 – транспорт железа, σ24 – тепловой и окислительный стресс, σ54 – метаболизм азота. 3. σ32, разнообразные по последовательности, различные специальные гены, например, гены теплового шока.
У прокариот одна РНК- полимераза α 2ββ’ωσ – холофермент (~487 к. Да) α 2ββ’ –core (сердцевина) β - 1342 АК, 150. 62 к. Да β’ - 1407 АК, 155. 16 к. Да каталитическая функция α - 329 АК, 36. 51 к. Да ω - 70 -80 к. Да сборка РНК-полимеразы β участвует в связывании NTTT и построении полинуклеотидной цепи РНК, β’ – осуществляет связывание с ДНК и раскрытие спирали ДНК. Комплекс α 2 β’ служит для взаимодействия с промотором, узнавание которого происходит только после присоединения σ. Две малые субъединицы в виде димера α 2 присоединяются к большому димеру ββ’ с внешней стороны и необходимы для сборки больших субъединиц. ω также необходима для сборки РНКполимеразы. σ - определяет специфичность РНК-полимеразы. Существует 3 группы σ субъединиц: 1. σ70, ~1000 молекул, 70 к. Да – главная. Необходима для присоединения к промоторам большинства генов, экспрессирующихся в экспоненциальной фазе. 2. 7 минорных σ<σ70, для транскрипции ограниченного числа генов, например, σ38 , 50 генов, необходимых для перехода в стационарную фазу, σ19 – транспорт железа, σ24 – тепловой и окислительный стресс, σ54 – метаболизм азота. 3. σ32, разнообразные по последовательности, различные специальные гены, например, гены теплового шока.
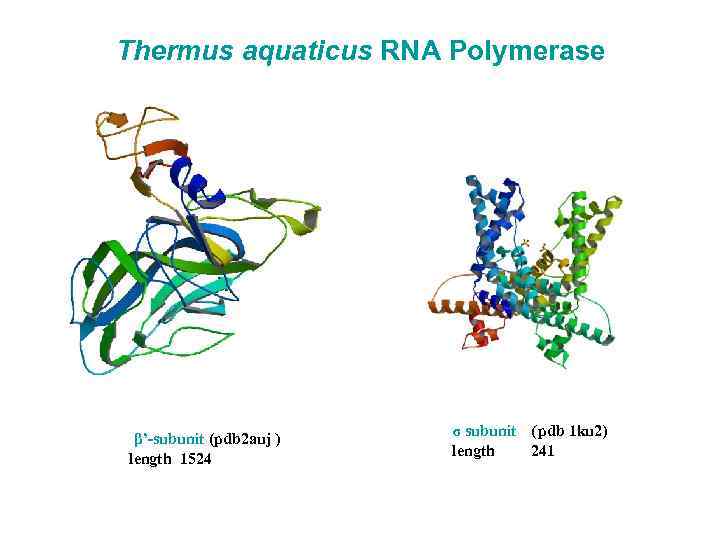 Thermus aquaticus RNA Polymerase β’-subunit (pdb 2 auj ) length 1524 σ subunit (pdb 1 ku 2) length 241
Thermus aquaticus RNA Polymerase β’-subunit (pdb 2 auj ) length 1524 σ subunit (pdb 1 ku 2) length 241
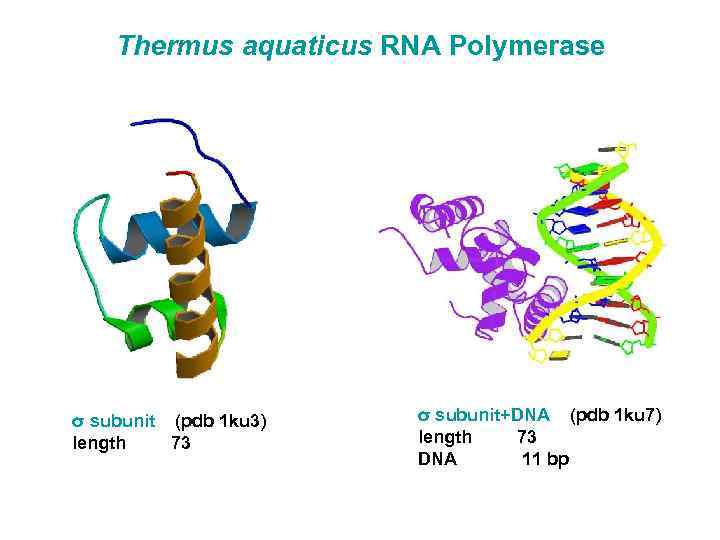 Thermus aquaticus RNA Polymerase σ subunit (pdb 1 ku 3) length 73 σ subunit+DNA (pdb 1 ku 7) length 73 DNA 11 bp
Thermus aquaticus RNA Polymerase σ subunit (pdb 1 ku 3) length 73 σ subunit+DNA (pdb 1 ku 7) length 73 DNA 11 bp
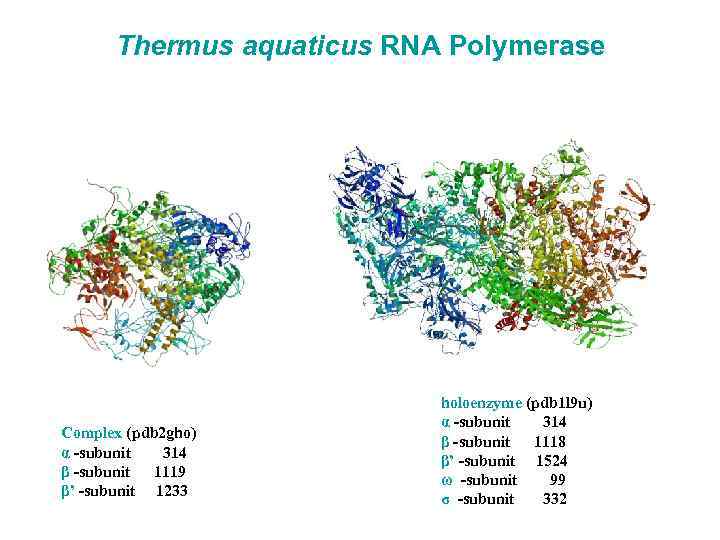 Thermus aquaticus RNA Polymerase Complex (pdb 2 gho) α -subunit 314 β -subunit 1119 β’ -subunit 1233 holoenzyme (pdb 1 l 9 u) α -subunit 314 β -subunit 1118 β’ -subunit 1524 ω -subunit 99 σ -subunit 332
Thermus aquaticus RNA Polymerase Complex (pdb 2 gho) α -subunit 314 β -subunit 1119 β’ -subunit 1233 holoenzyme (pdb 1 l 9 u) α -subunit 314 β -subunit 1118 β’ -subunit 1524 ω -subunit 99 σ -subunit 332
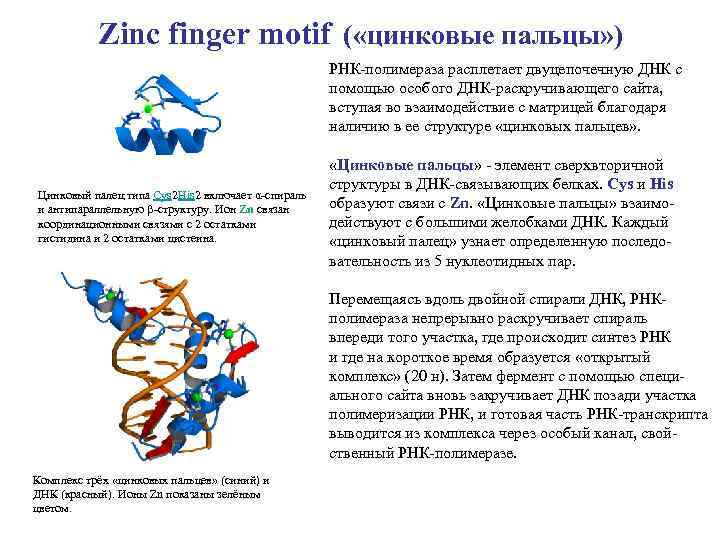 Zinc finger motif ( «цинковые пальцы» ) РНК-полимераза расплетает двуцепочечную ДНК с помощью особого ДНК-раскручивающего сайта, вступая во взаимодействие с матрицей благодаря наличию в ее структуре «цинковых пальцев» . Цинковый палец типа Cys 2 His 2 включает α-спираль и антипараллельную β-структуру. Ион Zn связан координационными связями с 2 остатками гистидина и 2 остатками цистеина. «Цинковые пальцы» - элемент сверхвторичной структуры в ДНК-связывающих белках. Cys и His образуют связи с Zn. «Цинковые пальцы» взаимодействуют с большими желобками ДНК. Каждый «цинковый палец» узнает определенную последовательность из 5 нуклеотидных пар. Перемещаясь вдоль двойной спирали ДНК, РНКполимераза непрерывно раскручивает спираль впереди того участка, где происходит синтез РНК и где на короткое время образуется «открытый комплекс» (20 н). Затем фермент с помощью специального сайта вновь закручивает ДНК позади участка полимеризации РНК, и готовая часть РНК-транскрипта выводится из комплекса через особый канал, свойственный РНК-полимеразе. Комплекс трёх «цинковых пальцев» (синий) и ДНК (красный). Ионы Zn показаны зелёным цветом.
Zinc finger motif ( «цинковые пальцы» ) РНК-полимераза расплетает двуцепочечную ДНК с помощью особого ДНК-раскручивающего сайта, вступая во взаимодействие с матрицей благодаря наличию в ее структуре «цинковых пальцев» . Цинковый палец типа Cys 2 His 2 включает α-спираль и антипараллельную β-структуру. Ион Zn связан координационными связями с 2 остатками гистидина и 2 остатками цистеина. «Цинковые пальцы» - элемент сверхвторичной структуры в ДНК-связывающих белках. Cys и His образуют связи с Zn. «Цинковые пальцы» взаимодействуют с большими желобками ДНК. Каждый «цинковый палец» узнает определенную последовательность из 5 нуклеотидных пар. Перемещаясь вдоль двойной спирали ДНК, РНКполимераза непрерывно раскручивает спираль впереди того участка, где происходит синтез РНК и где на короткое время образуется «открытый комплекс» (20 н). Затем фермент с помощью специального сайта вновь закручивает ДНК позади участка полимеризации РНК, и готовая часть РНК-транскрипта выводится из комплекса через особый канал, свойственный РНК-полимеразе. Комплекс трёх «цинковых пальцев» (синий) и ДНК (красный). Ионы Zn показаны зелёным цветом.
 Основные элементы промоторной области ДНК у E. coli Промотор: +1 – точка старта 2 consensus (на смысловой нити): -35 – T 82 T 84 G 78 A 65 C 54 A 95 необходим для связывания РНК-полимеразы, узнается σ-фактором; различные σ-факторы узнают различные последовательности; -10 – T 80 A 95 T 45 A 60 A 50 T 96 “Pribnow box” или “TATA-box” необходим для определения первого нуклеотида считывания, необходим для преобразования закрытого промоторного комплекса в открытый; Интервал между блоками важен, потому что размещает эти два мотива на одной и той же стороне двойной спирали, что облегчает из взаимодействие с ДНК-связывающими компонентами РНКполимеразы. Consensus -35 и -10 участвуют в регуляции скорости экспрессии генов. На некоторых промоторах инициация происходит каждые 1 -2 сек, на других через 1 час. promote - способствовать
Основные элементы промоторной области ДНК у E. coli Промотор: +1 – точка старта 2 consensus (на смысловой нити): -35 – T 82 T 84 G 78 A 65 C 54 A 95 необходим для связывания РНК-полимеразы, узнается σ-фактором; различные σ-факторы узнают различные последовательности; -10 – T 80 A 95 T 45 A 60 A 50 T 96 “Pribnow box” или “TATA-box” необходим для определения первого нуклеотида считывания, необходим для преобразования закрытого промоторного комплекса в открытый; Интервал между блоками важен, потому что размещает эти два мотива на одной и той же стороне двойной спирали, что облегчает из взаимодействие с ДНК-связывающими компонентами РНКполимеразы. Consensus -35 и -10 участвуют в регуляции скорости экспрессии генов. На некоторых промоторах инициация происходит каждые 1 -2 сек, на других через 1 час. promote - способствовать
 Инициация транскрипции у прокариот В отсутствии σ-фактора core-фермент взаимодействует с ДНК неспецифически. Когда core-фермент ассоциирует c σ-фактором, полный холофермент способен узнавать и связываться с -35 блоком промоторной области ДНК, после чего образуется закрытый промоторный комплекс, в котором РНК-полимераза охватывает ~ 80 пн. Закрытый промоторный комплекс преобразуется в открытую форму за cчет совместного действия β’- и σ-субъединиц, которые разрывают пары оснований в пределах блока -10, обогащенного АТ-парами. РНК-полимераза катализирует с помощью «цинковых пальцев» открытие одного витка ДНК. При этом образуется открытый комплекс и матрица становится доступной для синтеза РНК. Вскоре после завершения инициации σ-фактор диссоциирует, преобразуя холофермент в core- комплекс, обладающий способностью к элонгации транскрипции. Первоначально core-фермент покрывает ~ 60 пн ДНК, но вскоре после начала элонгации полимераза подвергается второму конформационному изменению, сокращая свою зону охвата до ~ 30 -40 пн.
Инициация транскрипции у прокариот В отсутствии σ-фактора core-фермент взаимодействует с ДНК неспецифически. Когда core-фермент ассоциирует c σ-фактором, полный холофермент способен узнавать и связываться с -35 блоком промоторной области ДНК, после чего образуется закрытый промоторный комплекс, в котором РНК-полимераза охватывает ~ 80 пн. Закрытый промоторный комплекс преобразуется в открытую форму за cчет совместного действия β’- и σ-субъединиц, которые разрывают пары оснований в пределах блока -10, обогащенного АТ-парами. РНК-полимераза катализирует с помощью «цинковых пальцев» открытие одного витка ДНК. При этом образуется открытый комплекс и матрица становится доступной для синтеза РНК. Вскоре после завершения инициации σ-фактор диссоциирует, преобразуя холофермент в core- комплекс, обладающий способностью к элонгации транскрипции. Первоначально core-фермент покрывает ~ 60 пн ДНК, но вскоре после начала элонгации полимераза подвергается второму конформационному изменению, сокращая свою зону охвата до ~ 30 -40 пн.
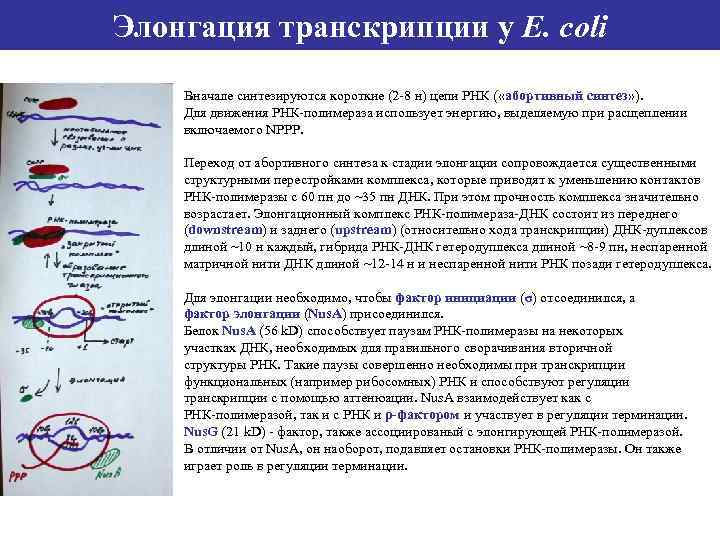 Элонгация транскрипции у E. coli Вначале синтезируются короткие (2 -8 н) цепи РНК ( «абортивный синтез» ). Для движения РНК-полимераза использует энергию, выделяемую при расщеплении включаемого NРРР. Переход от абортивного синтеза к стадии элонгации сопровождается существенными структурными перестройками комплекса, которые приводят к уменьшению контактов РНК-полимеразы с 60 пн до ~35 пн ДНК. При этом прочность комплекса значительно возрастает. Элонгационный комплекс РНК-полимераза-ДНК состоит из переднего (downstream) и заднего (upstream) (относительно хода транскрипции) ДНК-дуплексов длиной ~10 н каждый, гибрида РНК-ДНК гетеродуплекса длиной ~8 -9 пн, неспаренной матричной нити ДНК длиной ~12 -14 н и неспаренной нити РНК позади гетеродуплекса. Для элонгации необходимо, чтобы фактор инициации (σ) отсоединился, а фактор элонгации (Nus. A) присоединился. Белок Nus. A (56 k. D) способствует паузам РНК-полимеразы на некоторых участках ДНК, необходимых для правильного сворачивания вторичной структуры РНК. Такие паузы совершенно необходимы при транскрипции функциональных (например рибосомных) РНК и способствуют регуляции транскрипции с помощью аттенюации. Nus. A взаимодействует как с РНК-полимеразой, так и с РНК и ρ-фактором и участвует в регуляции терминации. Nus. G (21 k. D) - фактор, также ассоциированый с элонгирующей РНК-полимеразой. В отличии от Nus. A, он наоборот, подавляет остановки РНК-полимеразы. Он также играет роль в регуляции терминации.
Элонгация транскрипции у E. coli Вначале синтезируются короткие (2 -8 н) цепи РНК ( «абортивный синтез» ). Для движения РНК-полимераза использует энергию, выделяемую при расщеплении включаемого NРРР. Переход от абортивного синтеза к стадии элонгации сопровождается существенными структурными перестройками комплекса, которые приводят к уменьшению контактов РНК-полимеразы с 60 пн до ~35 пн ДНК. При этом прочность комплекса значительно возрастает. Элонгационный комплекс РНК-полимераза-ДНК состоит из переднего (downstream) и заднего (upstream) (относительно хода транскрипции) ДНК-дуплексов длиной ~10 н каждый, гибрида РНК-ДНК гетеродуплекса длиной ~8 -9 пн, неспаренной матричной нити ДНК длиной ~12 -14 н и неспаренной нити РНК позади гетеродуплекса. Для элонгации необходимо, чтобы фактор инициации (σ) отсоединился, а фактор элонгации (Nus. A) присоединился. Белок Nus. A (56 k. D) способствует паузам РНК-полимеразы на некоторых участках ДНК, необходимых для правильного сворачивания вторичной структуры РНК. Такие паузы совершенно необходимы при транскрипции функциональных (например рибосомных) РНК и способствуют регуляции транскрипции с помощью аттенюации. Nus. A взаимодействует как с РНК-полимеразой, так и с РНК и ρ-фактором и участвует в регуляции терминации. Nus. G (21 k. D) - фактор, также ассоциированый с элонгирующей РНК-полимеразой. В отличии от Nus. A, он наоборот, подавляет остановки РНК-полимеразы. Он также играет роль в регуляции терминации.
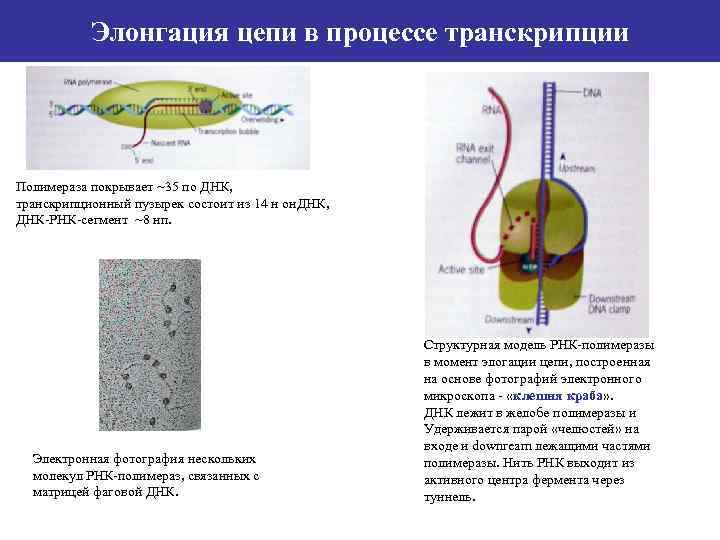 Элонгация цепи в процессе транскрипции Полимераза покрывает ~35 по ДНК, транскрипционный пузырек состоит из 14 н он. ДНК, ДНК-РНК-сегмент ~8 нп. Электронная фотография нескольких молекул РНК-полимераз, связанных с матрицей фаговой ДНК. Структурная модель РНК-полимеразы в момент элогации цепи, построенная на основе фотографий электронного микроскопа - «клешня краба» . ДНК лежит в желобе полимеразы и Удерживается парой «челюстей» на входе и downream лежащими частями полимеразы. Нить РНК выходит из активного центра фермента через туннель.
Элонгация цепи в процессе транскрипции Полимераза покрывает ~35 по ДНК, транскрипционный пузырек состоит из 14 н он. ДНК, ДНК-РНК-сегмент ~8 нп. Электронная фотография нескольких молекул РНК-полимераз, связанных с матрицей фаговой ДНК. Структурная модель РНК-полимеразы в момент элогации цепи, построенная на основе фотографий электронного микроскопа - «клешня краба» . ДНК лежит в желобе полимеразы и Удерживается парой «челюстей» на входе и downream лежащими частями полимеразы. Нить РНК выходит из активного центра фермента через туннель.
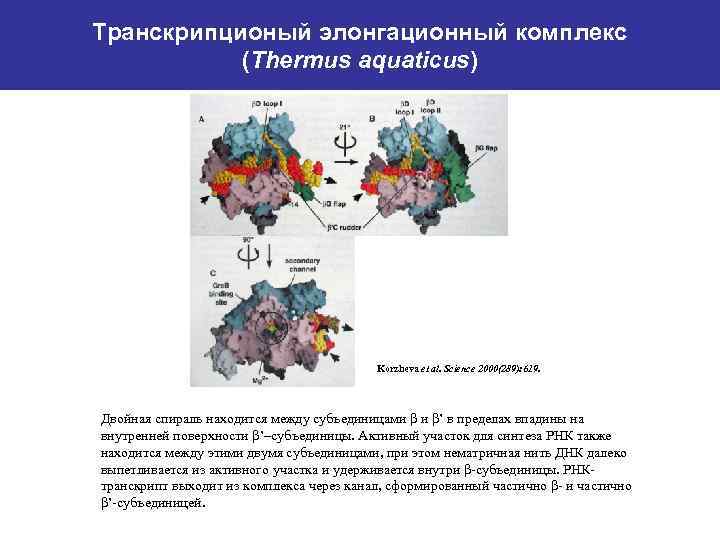 Транскрипционый элонгационный комплекс (Thermus aquaticus) Korzheva et al. Science 2000(289): 619. Двойная спираль находится между субъединицами β и β’ в пределах впадины на внутренней поверхности β’–субъединицы. Активный участок для синтеза РНК также находится между этими двумя субъединицами, при этом нематричная нить ДНК далеко выпетливается из активного участка и удерживается внутри β-субъединицы. РНКтранскрипт выходит из комплекса через канал, сформированный частично β- и частично β’-субъединицей.
Транскрипционый элонгационный комплекс (Thermus aquaticus) Korzheva et al. Science 2000(289): 619. Двойная спираль находится между субъединицами β и β’ в пределах впадины на внутренней поверхности β’–субъединицы. Активный участок для синтеза РНК также находится между этими двумя субъединицами, при этом нематричная нить ДНК далеко выпетливается из активного участка и удерживается внутри β-субъединицы. РНКтранскрипт выходит из комплекса через канал, сформированный частично β- и частично β’-субъединицей.
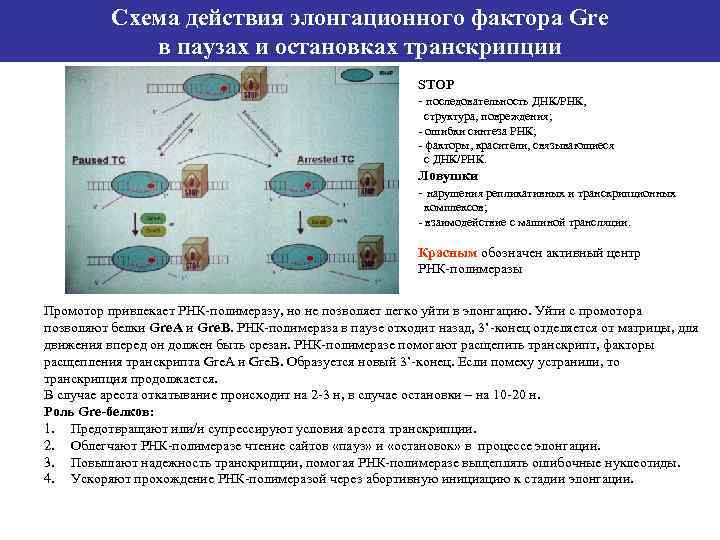 Схема действия элонгационного фактора Gre в паузах и остановках транскрипции STOP - последовательность ДНК/РНК, структура, повреждения; - ошибки синтеза РНК; - факторы, красители, связывающиеся с ДНК/РНК. Ловушки - нарушения репликативных и транскрипционных комплексов; - взаимодействие с машиной трансляции. Красным обозначен активный центр РНК-полимеразы Промотор привлекает РНК-полимеразу, но не позволяет легко уйти в элонгацию. Уйти с промотора позволяют белки Gre. А и Gre. В. РНК-полимераза в паузе отходит назад, 3’-конец отделяется от матрицы, для движения вперед он должен быть срезан. РНК-полимеразе помогают расщепить транскрипт, факторы расщепления транскрипта Gre. A и Gre. B. Образуется новый 3’-конец. Если помеху устранили, то транскрипция продолжается. В случае ареста откатывание происходит на 2 -3 н, в случае остановки – на 10 -20 н. Роль Gre-белков: 1. Предотвращают или/и супрессируют условия ареста транскрипции. 2. Облегчают РНК-полимеразе чтение сайтов «пауз» и «остановок» в процессе элонгации. 3. Повышают надежность транскрипции, помогая РНК-полимеразе выщеплять ошибочные нуклеотиды. 4. Ускоряют прохождение РНК-полимеразой через абортивную инициацию к стадии элонгации.
Схема действия элонгационного фактора Gre в паузах и остановках транскрипции STOP - последовательность ДНК/РНК, структура, повреждения; - ошибки синтеза РНК; - факторы, красители, связывающиеся с ДНК/РНК. Ловушки - нарушения репликативных и транскрипционных комплексов; - взаимодействие с машиной трансляции. Красным обозначен активный центр РНК-полимеразы Промотор привлекает РНК-полимеразу, но не позволяет легко уйти в элонгацию. Уйти с промотора позволяют белки Gre. А и Gre. В. РНК-полимераза в паузе отходит назад, 3’-конец отделяется от матрицы, для движения вперед он должен быть срезан. РНК-полимеразе помогают расщепить транскрипт, факторы расщепления транскрипта Gre. A и Gre. B. Образуется новый 3’-конец. Если помеху устранили, то транскрипция продолжается. В случае ареста откатывание происходит на 2 -3 н, в случае остановки – на 10 -20 н. Роль Gre-белков: 1. Предотвращают или/и супрессируют условия ареста транскрипции. 2. Облегчают РНК-полимеразе чтение сайтов «пауз» и «остановок» в процессе элонгации. 3. Повышают надежность транскрипции, помогая РНК-полимеразе выщеплять ошибочные нуклеотиды. 4. Ускоряют прохождение РНК-полимеразой через абортивную инициацию к стадии элонгации.
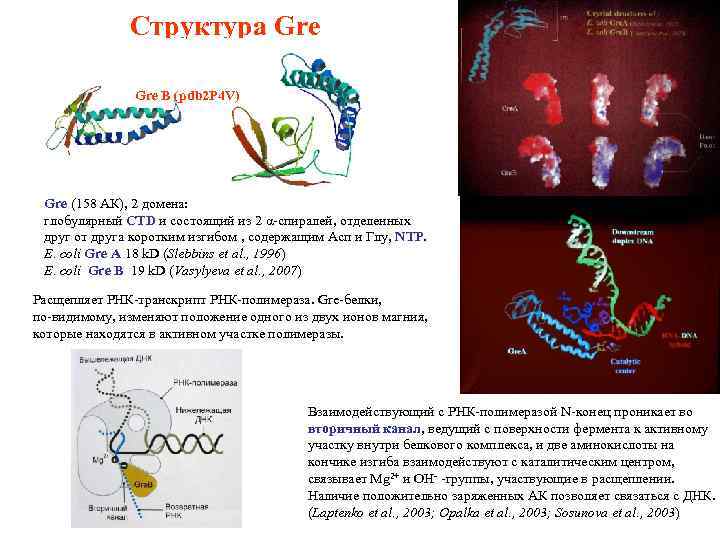 Структура Gre B (pdb 2 P 4 V) Gre (158 АК), 2 домена: глобулярный CTD и состоящий из 2 α-спиралей, отделенных друг от друга коротким изгибом , содержащим Асп и Глу, NTP. E. coli Gre A 18 k. D (Slebbins et al. , 1996) E. coli Gre B 19 k. D (Vasylyeva et al. , 2007) Расщепляет РНК-транскрипт РНК-полимераза. Gre-белки, по-видимому, изменяют положение одного из двух ионов магния, которые находятся в активном участке полимеразы. Взаимодействующий с РНК-полимеразой N-конец проникает во вторичный канал, ведущий с поверхности фермента к активному участку внутри белкового комплекса, и две аминокислоты на кончике изгиба взаимодействуют с каталитическим центром, связывает Mg 2+ и ОН- -группы, участвующие в расщеплении. Наличие положительно заряженных АК позволяет связаться с ДНК. (Laptenko et al. , 2003; Opalka et al. , 2003; Sosunova et al. , 2003)
Структура Gre B (pdb 2 P 4 V) Gre (158 АК), 2 домена: глобулярный CTD и состоящий из 2 α-спиралей, отделенных друг от друга коротким изгибом , содержащим Асп и Глу, NTP. E. coli Gre A 18 k. D (Slebbins et al. , 1996) E. coli Gre B 19 k. D (Vasylyeva et al. , 2007) Расщепляет РНК-транскрипт РНК-полимераза. Gre-белки, по-видимому, изменяют положение одного из двух ионов магния, которые находятся в активном участке полимеразы. Взаимодействующий с РНК-полимеразой N-конец проникает во вторичный канал, ведущий с поверхности фермента к активному участку внутри белкового комплекса, и две аминокислоты на кончике изгиба взаимодействуют с каталитическим центром, связывает Mg 2+ и ОН- -группы, участвующие в расщеплении. Наличие положительно заряженных АК позволяет связаться с ДНК. (Laptenko et al. , 2003; Opalka et al. , 2003; Sosunova et al. , 2003)
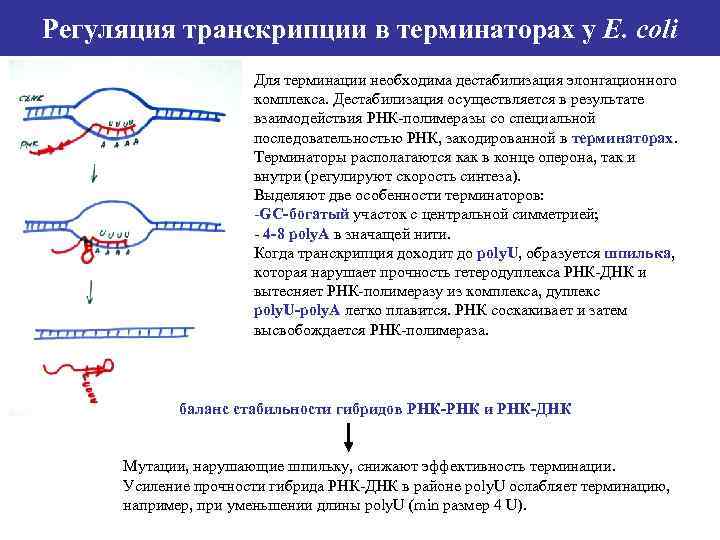 Регуляция транскрипции в терминаторах у E. coli Для терминации необходима дестабилизация элонгационного комплекса. Дестабилизация осуществляется в результате взаимодействия РНК-полимеразы со специальной последовательностью РНК, закодированной в терминаторах. Терминаторы располагаются как в конце оперона, так и внутри (регулируют скорость синтеза). Выделяют две особенности терминаторов: -GC-богатый участок с центральной симметрией; - 4 -8 poly. А в значащей нити. Когда транскрипция доходит до poly. U, образуется шпилька, которая нарушает прочность гетеродуплекса РНК-ДНК и вытесняет РНК-полимеразу из комплекса, дуплекс poly. U-poly. A легко плавится. РНК соскакивает и затем высвобождается РНК-полимераза. баланс стабильности гибридов РНК-РНК и РНК-ДНК Мутации, нарушающие шпильку, снижают эффективность терминации. Усиление прочности гибрида РНК-ДНК в районе poly. U ослабляет терминацию, например, при уменьшении длины poly. U (min размер 4 U).
Регуляция транскрипции в терминаторах у E. coli Для терминации необходима дестабилизация элонгационного комплекса. Дестабилизация осуществляется в результате взаимодействия РНК-полимеразы со специальной последовательностью РНК, закодированной в терминаторах. Терминаторы располагаются как в конце оперона, так и внутри (регулируют скорость синтеза). Выделяют две особенности терминаторов: -GC-богатый участок с центральной симметрией; - 4 -8 poly. А в значащей нити. Когда транскрипция доходит до poly. U, образуется шпилька, которая нарушает прочность гетеродуплекса РНК-ДНК и вытесняет РНК-полимеразу из комплекса, дуплекс poly. U-poly. A легко плавится. РНК соскакивает и затем высвобождается РНК-полимераза. баланс стабильности гибридов РНК-РНК и РНК-ДНК Мутации, нарушающие шпильку, снижают эффективность терминации. Усиление прочности гибрида РНК-ДНК в районе poly. U ослабляет терминацию, например, при уменьшении длины poly. U (min размер 4 U).
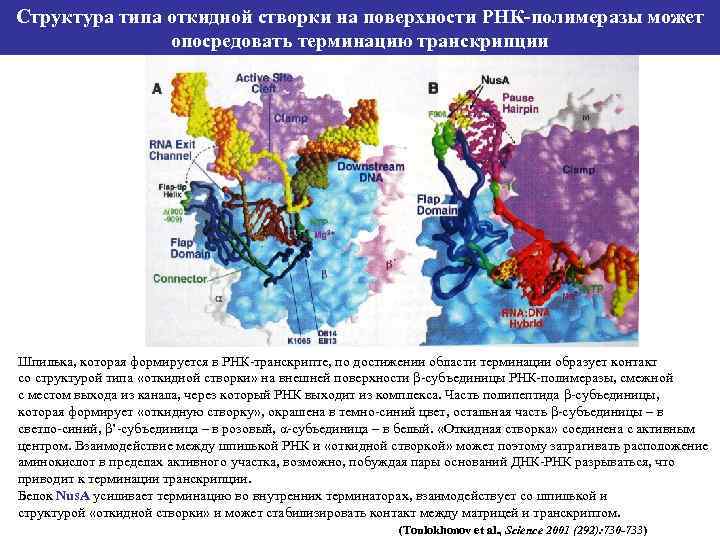 Структура типа откидной створки на поверхности РНК-полимеразы может опосредовать терминацию транскрипции Шпилька, которая формируется в РНК-транскрипте, по достижении области терминации образует контакт со структурой типа «откидной створки» на внешней поверхности β-субъединицы РНК-полимеразы, смежной с местом выхода из канала, через который РНК выходит из комплекса. Часть полипептида β-субъединицы, которая формирует «откидную створку» , окрашена в темно-синий цвет, остальная часть β-субъединицы – в светло-синий, β’-субъединица – в розовый, α-субъединица – в белый. «Откидная створка» соединена с активным центром. Взаимодействие между шпилькой РНК и «откидной створкой» может поэтому затрагивать расположение аминокислот в пределах активного участка, возможно, побуждая пары оснований ДНК-РНК разрываться, что приводит к терминации транскрипции. Белок Nus. A усиливает терминацию во внутренних терминаторах, взаимодействует со шпилькой и структурой «откидной створки» и может стабилизировать контакт между матрицей и транскриптом. (Toulokhonov et al. , Science 2001 (292): 730 -733)
Структура типа откидной створки на поверхности РНК-полимеразы может опосредовать терминацию транскрипции Шпилька, которая формируется в РНК-транскрипте, по достижении области терминации образует контакт со структурой типа «откидной створки» на внешней поверхности β-субъединицы РНК-полимеразы, смежной с местом выхода из канала, через который РНК выходит из комплекса. Часть полипептида β-субъединицы, которая формирует «откидную створку» , окрашена в темно-синий цвет, остальная часть β-субъединицы – в светло-синий, β’-субъединица – в розовый, α-субъединица – в белый. «Откидная створка» соединена с активным центром. Взаимодействие между шпилькой РНК и «откидной створкой» может поэтому затрагивать расположение аминокислот в пределах активного участка, возможно, побуждая пары оснований ДНК-РНК разрываться, что приводит к терминации транскрипции. Белок Nus. A усиливает терминацию во внутренних терминаторах, взаимодействует со шпилькой и структурой «откидной створки» и может стабилизировать контакт между матрицей и транскриптом. (Toulokhonov et al. , Science 2001 (292): 730 -733)
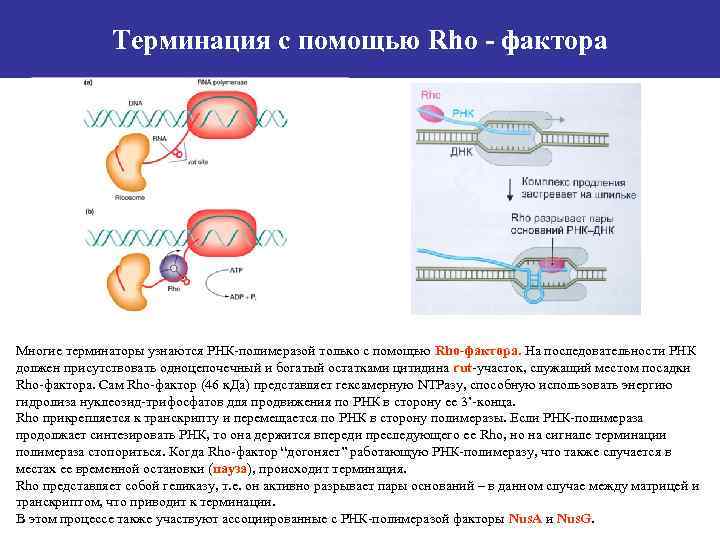 Терминация с помощью Rho - фактора Многие терминаторы узнаются РНК-полимеразой только с помощью Rho-фактора. На последовательности РНК должен присутствовать одноцепочечный и богатый остатками цитидина rut-участок, служащий местом посадки Rho-фактора. Сам Rho-фактор (46 к. Да) представляет гексамерную NTPазу, способную использовать энергию гидролиза нуклеозид-трифосфатов для продвижения по РНК в сторону ее 3’-конца. Rho прикрепляется к транскрипту и перемещается по РНК в сторону полимеразы. Если РНК-полимераза продолжает синтезировать РНК, то она держится впереди преследующего ее Rho, но на сигнале терминации полимераза стопориться. Когда Rho-фактор “догоняет” работающую РНК-полимеразу, что также случается в местах ее временной остановки (пауза), происходит терминация. Rho представляет собой геликазу, т. е. он активно разрывает пары оснований – в данном случае между матрицей и транскриптом, что приводит к терминации. В этом процессе также участвуют ассоциированные с РНК-полимеразой факторы Nus. A и Nus. G.
Терминация с помощью Rho - фактора Многие терминаторы узнаются РНК-полимеразой только с помощью Rho-фактора. На последовательности РНК должен присутствовать одноцепочечный и богатый остатками цитидина rut-участок, служащий местом посадки Rho-фактора. Сам Rho-фактор (46 к. Да) представляет гексамерную NTPазу, способную использовать энергию гидролиза нуклеозид-трифосфатов для продвижения по РНК в сторону ее 3’-конца. Rho прикрепляется к транскрипту и перемещается по РНК в сторону полимеразы. Если РНК-полимераза продолжает синтезировать РНК, то она держится впереди преследующего ее Rho, но на сигнале терминации полимераза стопориться. Когда Rho-фактор “догоняет” работающую РНК-полимеразу, что также случается в местах ее временной остановки (пауза), происходит терминация. Rho представляет собой геликазу, т. е. он активно разрывает пары оснований – в данном случае между матрицей и транскриптом, что приводит к терминации. В этом процессе также участвуют ассоциированные с РНК-полимеразой факторы Nus. A и Nus. G.


