ОММ Lecture 03 - Reparation, Recombination.pptx
- Количество слайдов: 72
 DNA REPAIR
DNA REPAIR
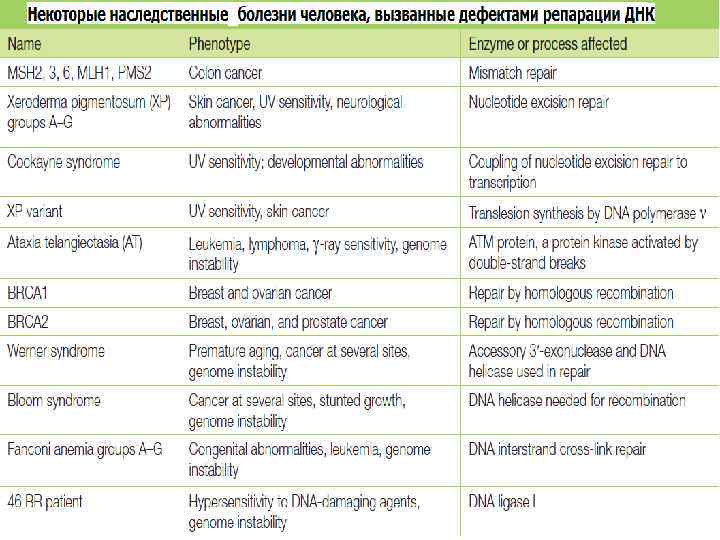
 Причины появления повреждений в ДНК Для поддержания генетической стабильности организма необходимо не только точно реплицировать ДНК, но так же и исправлять возникающие в ней повреждения. • Ошибки репликации • Повреждения ДНК эндогенными агентами: Гидролиз (депуринизация, дезаминирование) • Повреждения ДНК экзогенными агентами облучение повреждение химическими агентами (например, алкилирование) • Репликация «через повреждения» с использованием полимераз, отличающихся низкой точностью копирования • и др.
Причины появления повреждений в ДНК Для поддержания генетической стабильности организма необходимо не только точно реплицировать ДНК, но так же и исправлять возникающие в ней повреждения. • Ошибки репликации • Повреждения ДНК эндогенными агентами: Гидролиз (депуринизация, дезаминирование) • Повреждения ДНК экзогенными агентами облучение повреждение химическими агентами (например, алкилирование) • Репликация «через повреждения» с использованием полимераз, отличающихся низкой точностью копирования • и др.
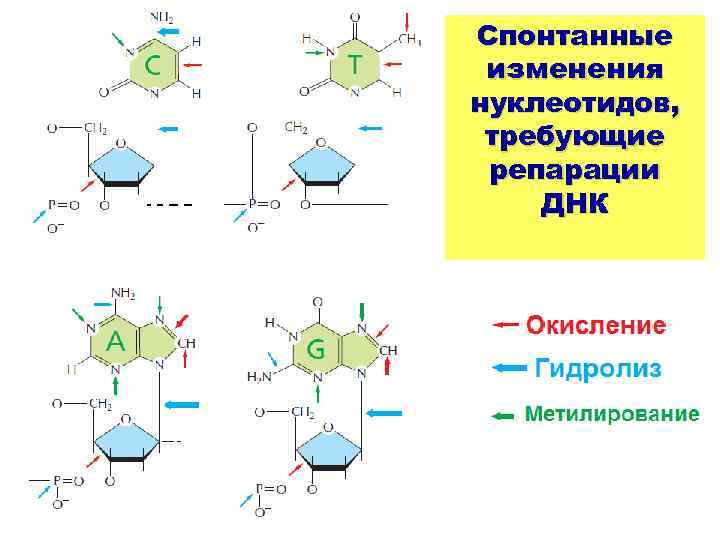 Спонтанные изменения нуклеотидов, требующие репарации ДНК
Спонтанные изменения нуклеотидов, требующие репарации ДНК
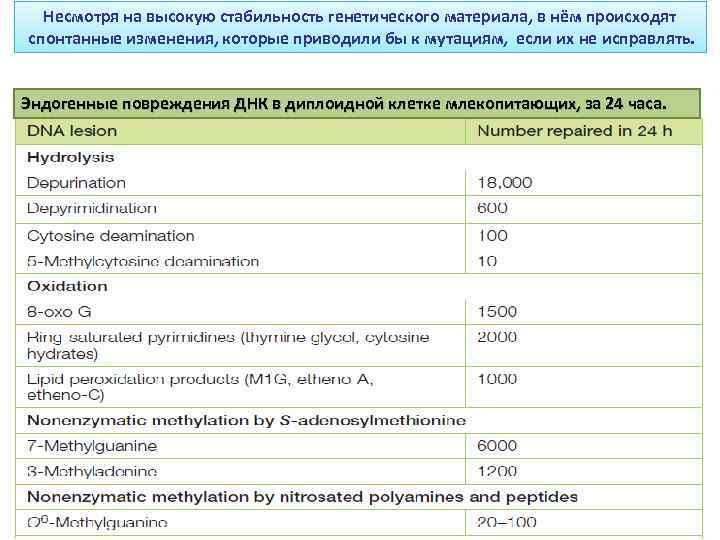 Несмотря на высокую стабильность генетического материала, в нём происходят спонтанные изменения, которые приводили бы к мутациям, если их не исправлять. Эндогенные повреждения ДНК в диплоидной клетке млекопитающих, за 24 часа.
Несмотря на высокую стабильность генетического материала, в нём происходят спонтанные изменения, которые приводили бы к мутациям, если их не исправлять. Эндогенные повреждения ДНК в диплоидной клетке млекопитающих, за 24 часа.
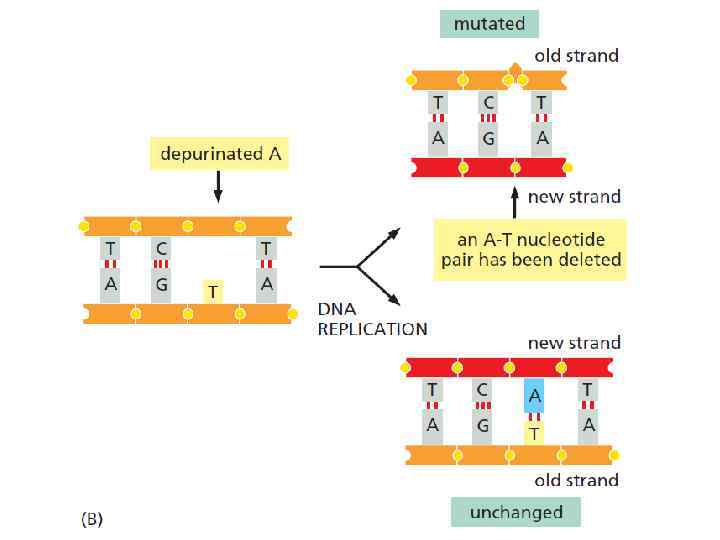
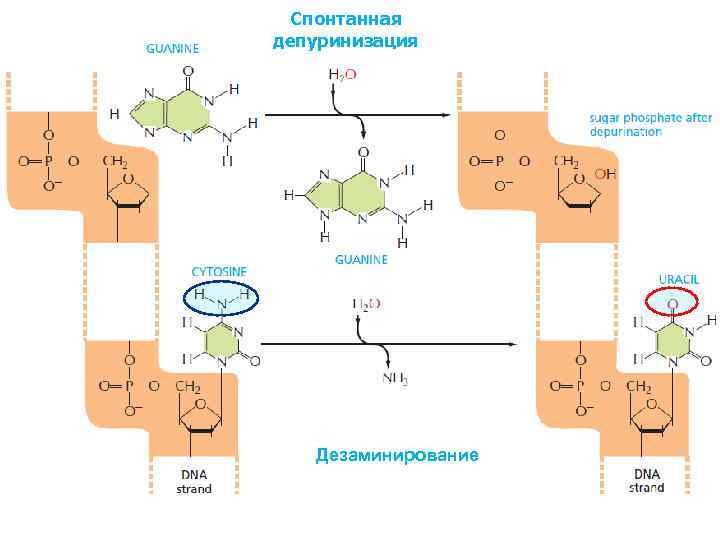 Спонтанная депуринизация Дезаминирование
Спонтанная депуринизация Дезаминирование
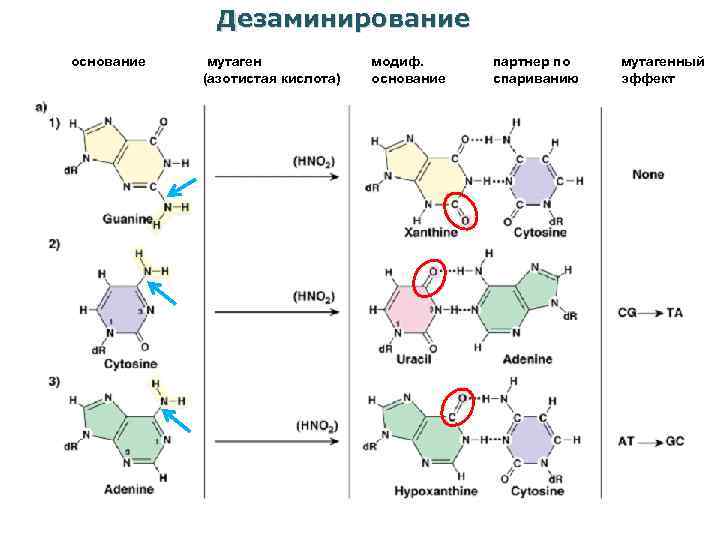 Дезаминирование основание мутаген (азотистая кислота) модиф. основание партнер по спариванию мутагенный эффект
Дезаминирование основание мутаген (азотистая кислота) модиф. основание партнер по спариванию мутагенный эффект
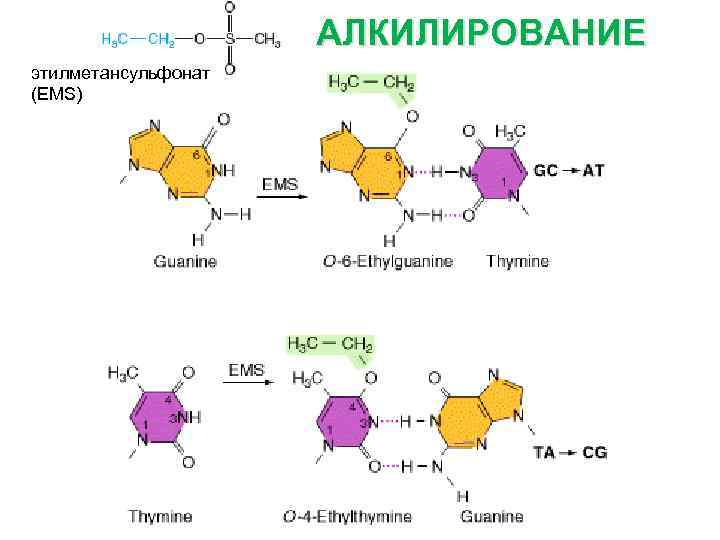 АЛКИЛИРОВАНИЕ этилметансульфонат (EMS)
АЛКИЛИРОВАНИЕ этилметансульфонат (EMS)
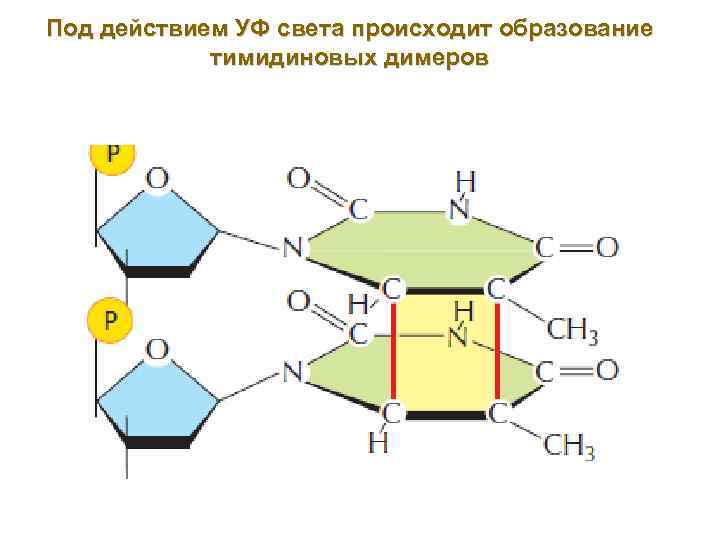 Под действием УФ света происходит образование тимидиновых димеров
Под действием УФ света происходит образование тимидиновых димеров

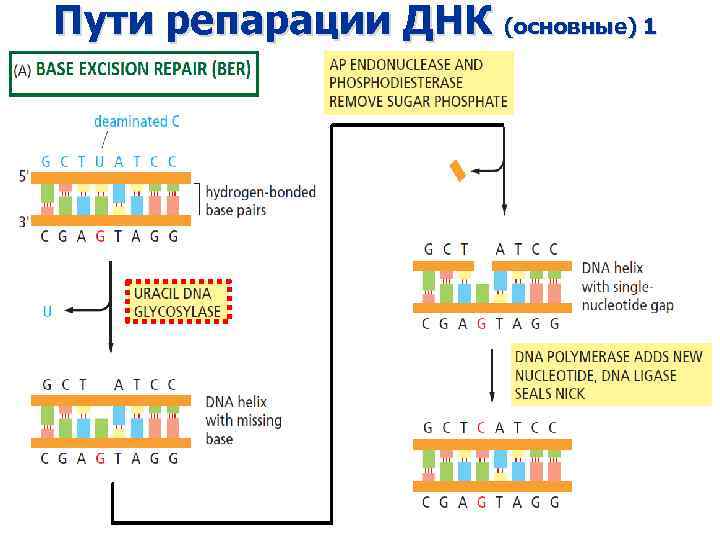 Пути репарации ДНК (основные) 1
Пути репарации ДНК (основные) 1
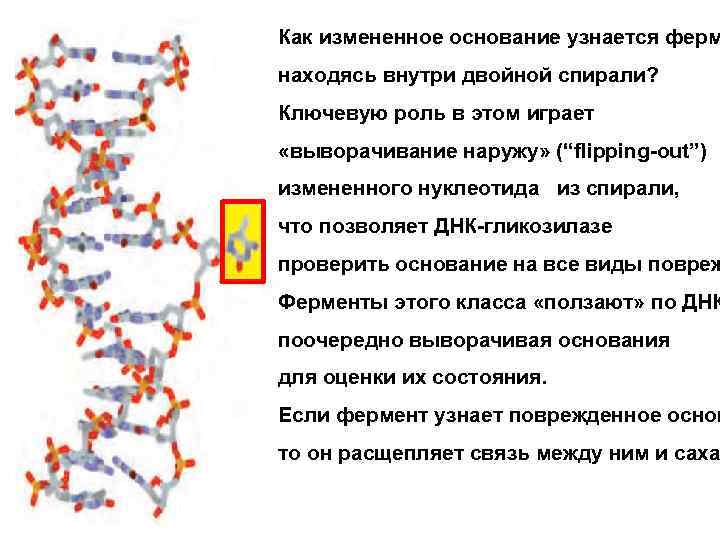 Как измененное основание узнается ферм находясь внутри двойной спирали? Ключевую роль в этом играет «выворачивание наружу» (“flipping-out”) измененного нуклеотида из спирали, что позволяет ДНК-гликозилазе проверить основание на все виды повреж Ферменты этого класса «ползают» по ДНК поочередно выворачивая основания для оценки их состояния. Если фермент узнает поврежденное основ то он расщепляет связь между ним и саха
Как измененное основание узнается ферм находясь внутри двойной спирали? Ключевую роль в этом играет «выворачивание наружу» (“flipping-out”) измененного нуклеотида из спирали, что позволяет ДНК-гликозилазе проверить основание на все виды повреж Ферменты этого класса «ползают» по ДНК поочередно выворачивая основания для оценки их состояния. Если фермент узнает поврежденное основ то он расщепляет связь между ним и саха
 Основные типы повреждений, которые удаляются посредством BER (большая часть не блокирует репликацию) • Окисленные основания, в том числе 8 -oкси-G, который спаривается с А, вызывая GC --> TA трансверсии • Дезоксиурацил • Различные продукты алкилирования оснований (например, 3 -me. A) • Спонтанно возникающие апуриновые сайты
Основные типы повреждений, которые удаляются посредством BER (большая часть не блокирует репликацию) • Окисленные основания, в том числе 8 -oкси-G, который спаривается с А, вызывая GC --> TA трансверсии • Дезоксиурацил • Различные продукты алкилирования оснований (например, 3 -me. A) • Спонтанно возникающие апуриновые сайты
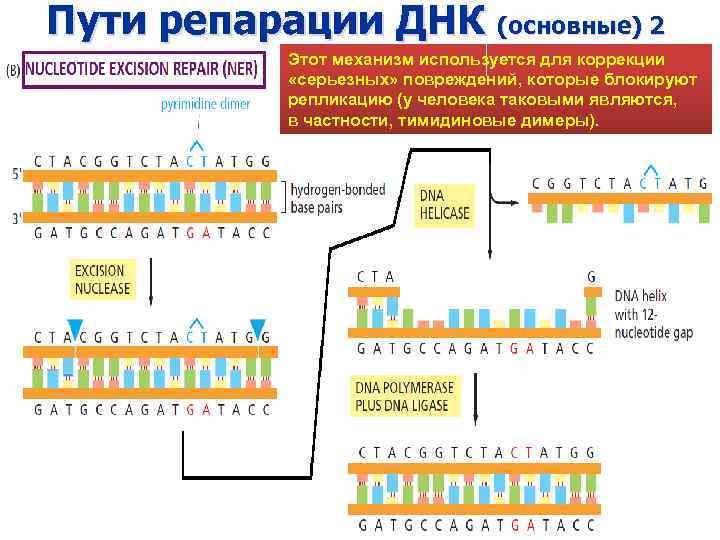 Пути репарации ДНК (основные) 2 Этот механизм используется для коррекции «серьезных» повреждений, которые блокируют репликацию (у человека таковыми являются, в частности, тимидиновые димеры).
Пути репарации ДНК (основные) 2 Этот механизм используется для коррекции «серьезных» повреждений, которые блокируют репликацию (у человека таковыми являются, в частности, тимидиновые димеры).
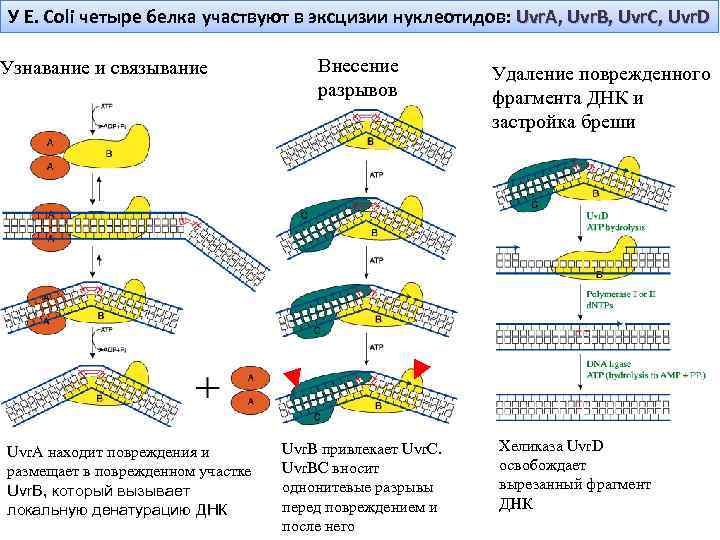 У E. Coli четыре белка участвуют в эксцизии нуклеотидов: Uvr. A, Uvr. B, Uvr. C, Uvr. D Узнавание и связывание Uvr. A находит повреждения и размещает в поврежденном участке Uvr. B, который вызывает локальную денатурацию ДНК Внесение разрывов Uvr. B привлекает Uvr. C. Uvr. BC вносит однонитевые разрывы перед повреждением и после него Удаление поврежденного фрагмента ДНК и застройка бреши Хеликаза Uvr. D освобождает вырезанный фрагмент ДНК
У E. Coli четыре белка участвуют в эксцизии нуклеотидов: Uvr. A, Uvr. B, Uvr. C, Uvr. D Узнавание и связывание Uvr. A находит повреждения и размещает в поврежденном участке Uvr. B, который вызывает локальную денатурацию ДНК Внесение разрывов Uvr. B привлекает Uvr. C. Uvr. BC вносит однонитевые разрывы перед повреждением и после него Удаление поврежденного фрагмента ДНК и застройка бреши Хеликаза Uvr. D освобождает вырезанный фрагмент ДНК
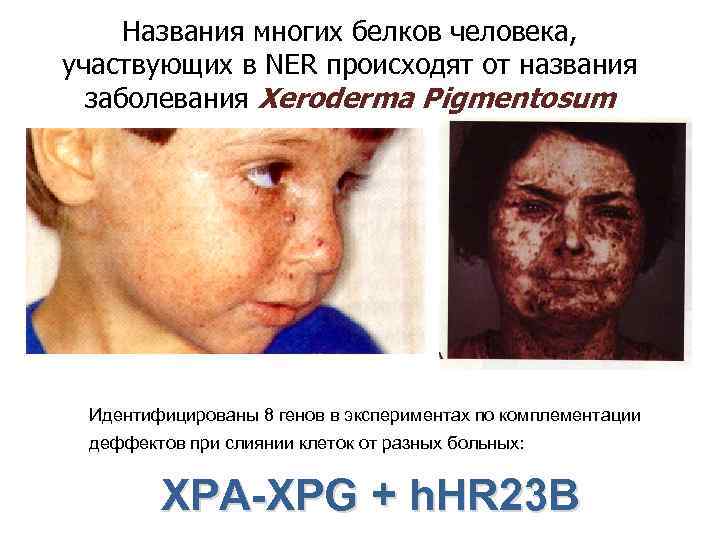 Названия многих белков человека, участвующих в NER происходят от названия заболевания Xeroderma Pigmentosum Идентифицированы 8 генов в экспериментах по комплементации деффектов при слиянии клеток от разных больных: XPA-XPG + h. HR 23 B
Названия многих белков человека, участвующих в NER происходят от названия заболевания Xeroderma Pigmentosum Идентифицированы 8 генов в экспериментах по комплементации деффектов при слиянии клеток от разных больных: XPA-XPG + h. HR 23 B
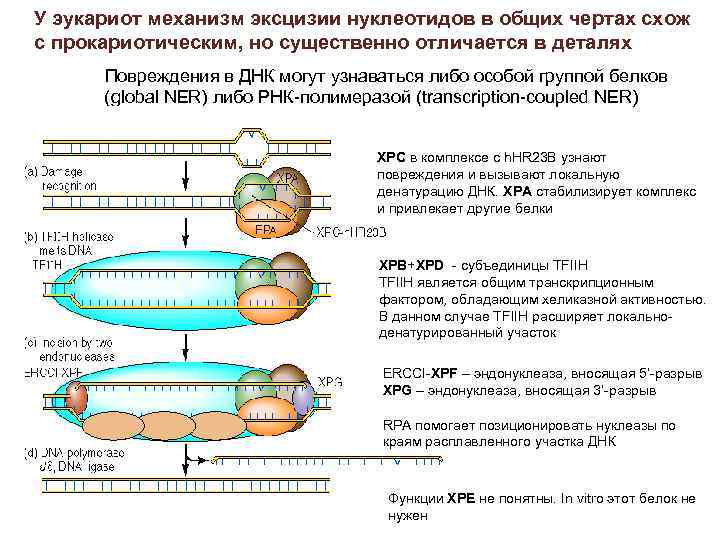 У эукариот механизм эксцизии нуклеотидов в общих чертах схож с прокариотическим, но существенно отличается в деталях Повреждения в ДНК могут узнаваться либо особой группой белков (global NER) либо РНК-полимеразой (transcription-coupled NER) XPC в комплексе с h. HR 23 B узнают повреждения и вызывают локальную денатурацию ДНК. XPA стабилизирует комплекс и привлекает другие белки XPB+XPD - субъединицы TFIIH является общим транскрипционным фактором, обладающим хеликазной активностью. В данном случае TFIIH расширяет локальноденатурированный участок ERCCI-XPF – эндонуклеаза, вносящая 5’-разрыв XPG – эндонуклеаза, вносящая 3’-разрыв RPA помогает позиционировать нуклеазы по краям расплавленного участка ДНК Функции XPE не понятны. In vitro этот белок не нужен
У эукариот механизм эксцизии нуклеотидов в общих чертах схож с прокариотическим, но существенно отличается в деталях Повреждения в ДНК могут узнаваться либо особой группой белков (global NER) либо РНК-полимеразой (transcription-coupled NER) XPC в комплексе с h. HR 23 B узнают повреждения и вызывают локальную денатурацию ДНК. XPA стабилизирует комплекс и привлекает другие белки XPB+XPD - субъединицы TFIIH является общим транскрипционным фактором, обладающим хеликазной активностью. В данном случае TFIIH расширяет локальноденатурированный участок ERCCI-XPF – эндонуклеаза, вносящая 5’-разрыв XPG – эндонуклеаза, вносящая 3’-разрыв RPA помогает позиционировать нуклеазы по краям расплавленного участка ДНК Функции XPE не понятны. In vitro этот белок не нужен
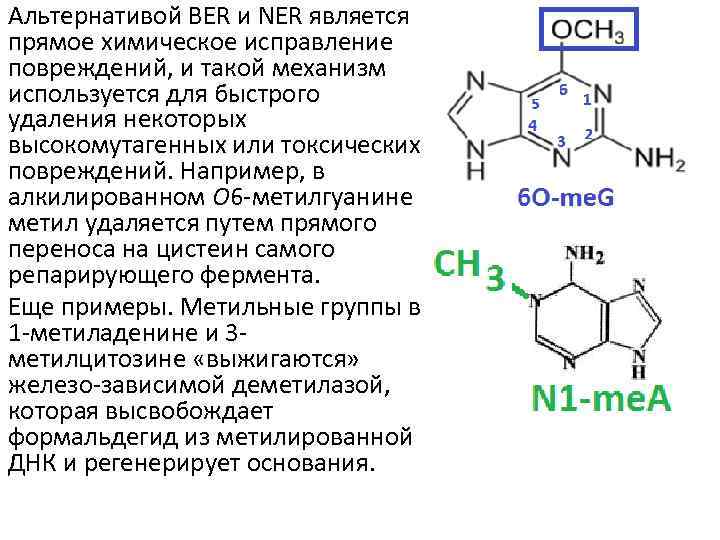 Альтернативой BER и NER является прямое химическое исправление повреждений, и такой механизм используется для быстрого удаления некоторых высокомутагенных или токсических повреждений. Например, в алкилированном O 6 -метилгуанине метил удаляется путем прямого переноса на цистеин самого репарирующего фермента. Еще примеры. Метильные группы в 1 -метиладенине и 3 метилцитозине «выжигаются» железо-зависимой деметилазой, которая высвобождает формальдегид из метилированной ДНК и регенерирует основания.
Альтернативой BER и NER является прямое химическое исправление повреждений, и такой механизм используется для быстрого удаления некоторых высокомутагенных или токсических повреждений. Например, в алкилированном O 6 -метилгуанине метил удаляется путем прямого переноса на цистеин самого репарирующего фермента. Еще примеры. Метильные группы в 1 -метиладенине и 3 метилцитозине «выжигаются» железо-зависимой деметилазой, которая высвобождает формальдегид из метилированной ДНК и регенерирует основания.
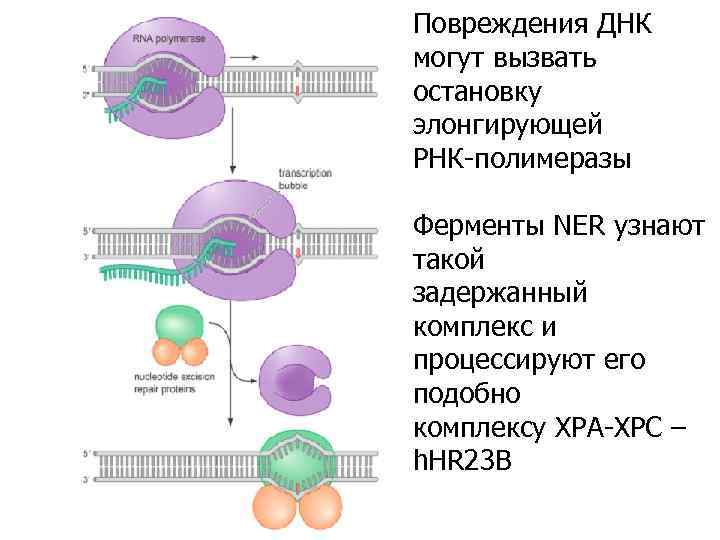 Повреждения ДНК могут вызвать остановку элонгирующей РНК-полимеразы Ферменты NER узнают такой задержанный комплекс и процессируют его подобно комплексу XPA-XPC – h. HR 23 B
Повреждения ДНК могут вызвать остановку элонгирующей РНК-полимеразы Ферменты NER узнают такой задержанный комплекс и процессируют его подобно комплексу XPA-XPC – h. HR 23 B
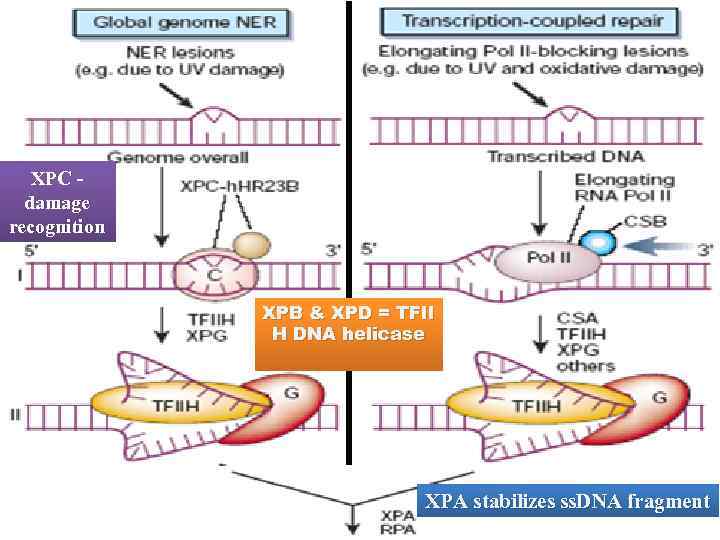 XPC damage recognition XPB & XPD = TFII H DNA helicase XPA stabilizes ss. DNA fragment
XPC damage recognition XPB & XPD = TFII H DNA helicase XPA stabilizes ss. DNA fragment
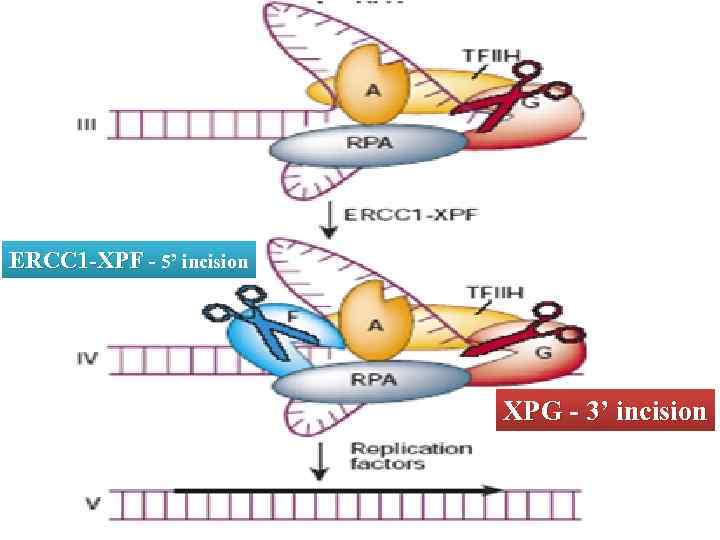 ERCC 1 -XPF - 5’ incision XPG - 3’ incision
ERCC 1 -XPF - 5’ incision XPG - 3’ incision
 Исправление ошибок репликации (Мismatch repair) • ДНК полимеразы (даже те, у которых есть корректирующая активность) все равно делают ошибки, которые надо исправлять • Система репарации ошибок репликации должна • 1. Быстро находить ошибки • 2. Различать родительскую и новосинтезированную • цепь с тем, чтобы в неспаренном участке • заменить ошибочно включенный нуклеотид
Исправление ошибок репликации (Мismatch repair) • ДНК полимеразы (даже те, у которых есть корректирующая активность) все равно делают ошибки, которые надо исправлять • Система репарации ошибок репликации должна • 1. Быстро находить ошибки • 2. Различать родительскую и новосинтезированную • цепь с тем, чтобы в неспаренном участке • заменить ошибочно включенный нуклеотид
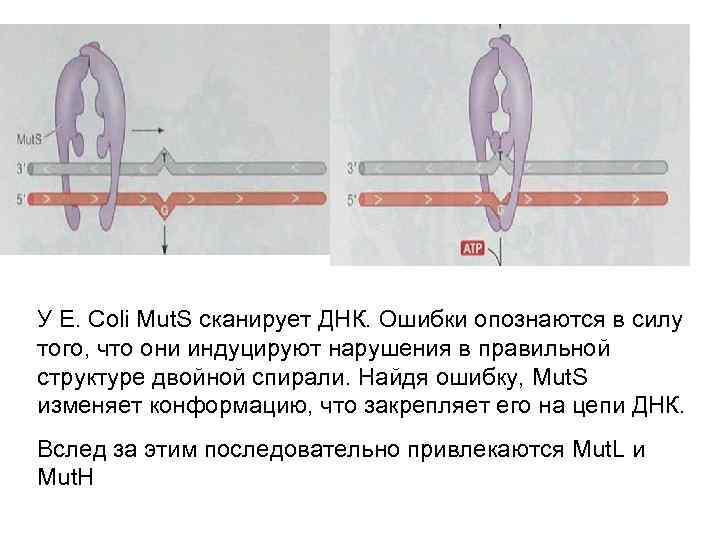 У E. Coli Mut. S сканирует ДНК. Ошибки опознаются в силу того, что они индуцируют нарушения в правильной структуре двойной спирали. Найдя ошибку, Mut. S изменяет конформацию, что закрепляет его на цепи ДНК. Вслед за этим последовательно привлекаются Mut. L и Mut. H
У E. Coli Mut. S сканирует ДНК. Ошибки опознаются в силу того, что они индуцируют нарушения в правильной структуре двойной спирали. Найдя ошибку, Mut. S изменяет конформацию, что закрепляет его на цепи ДНК. Вслед за этим последовательно привлекаются Mut. L и Mut. H
 Что узнается ? • Mut. S димер (у дрожжей, Msh 2/Msh 3 или Msh 2/Msh 6 гетеродимер) • Эксперименты по связыванию с ДНК in vitro и репарации гетеродуплексов in vivo показали, что MMR узнает все комбинации неспаренных оснований, кроме C: C, а также короткие <4 п. н. делеции и инсерции ( «инделы» ) • неправильные пары G: T and A: C и инсерции/делеции в 1 п. особенно хорошо узнаются. Эти нарушения являются наиболее частыми ошибками ДНКполимераз
Что узнается ? • Mut. S димер (у дрожжей, Msh 2/Msh 3 или Msh 2/Msh 6 гетеродимер) • Эксперименты по связыванию с ДНК in vitro и репарации гетеродуплексов in vivo показали, что MMR узнает все комбинации неспаренных оснований, кроме C: C, а также короткие <4 п. н. делеции и инсерции ( «инделы» ) • неправильные пары G: T and A: C и инсерции/делеции в 1 п. особенно хорошо узнаются. Эти нарушения являются наиболее частыми ошибками ДНКполимераз
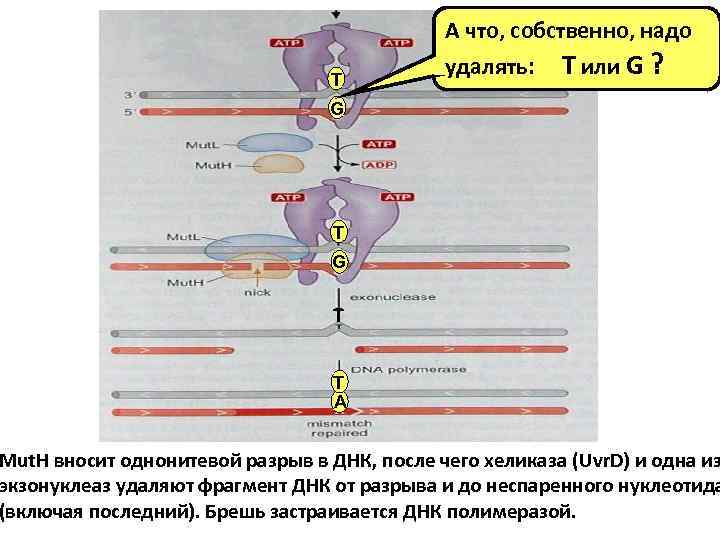 А что, собственно, надо T удалять: T или G ? G T T A Mut. H вносит однонитевой разрыв в ДНК, после чего хеликаза (Uvr. D) и одна из экзонуклеаз удаляют фрагмент ДНК от разрыва и до неспаренного нуклеотида (включая последний). Брешь застраивается ДНК полимеразой.
А что, собственно, надо T удалять: T или G ? G T T A Mut. H вносит однонитевой разрыв в ДНК, после чего хеликаза (Uvr. D) и одна из экзонуклеаз удаляют фрагмент ДНК от разрыва и до неспаренного нуклеотида (включая последний). Брешь застраивается ДНК полимеразой.
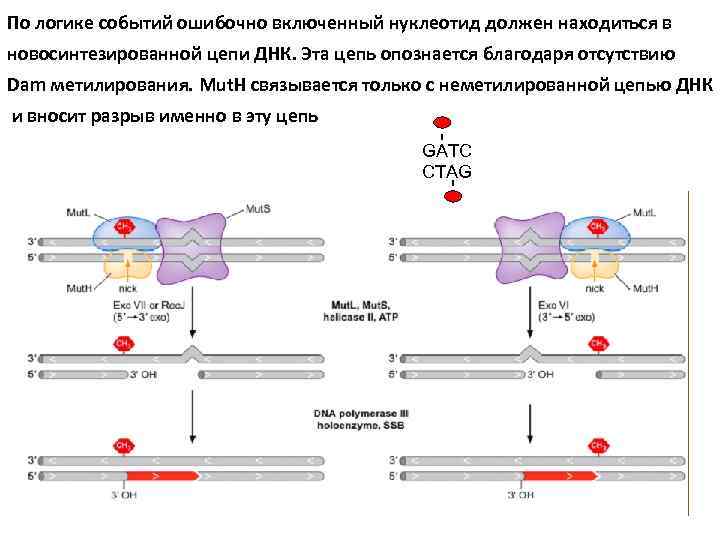 По логике событий ошибочно включенный нуклеотид должен находиться в новосинтезированной цепи ДНК. Эта цепь опознается благодаря отсутствию Dam метилирования. Mut. H связывается только с неметилированной цепью ДНК и вносит разрыв именно в эту цепь GATC CTAG
По логике событий ошибочно включенный нуклеотид должен находиться в новосинтезированной цепи ДНК. Эта цепь опознается благодаря отсутствию Dam метилирования. Mut. H связывается только с неметилированной цепью ДНК и вносит разрыв именно в эту цепь GATC CTAG
 В эукариотических клетках также существует система коррекции ошибок репликации Обнаружены гомологи Mut. S и Mut. L; гомолога Mut. H не обнаружено гомологи Mut. S (MSH — Mut. S homolog) образуют два гетеродимерных комплекса: ♣ MSH 2 -MSH 6 (Mut. Sα) узнает неспаренные нуклеотиды и короткие «инделы» ♣ MSH 2 -MSH 3 (Mut. Sβ) узнает длинные «инделы» Механизм распознавания новосинтезированной цепи не известен
В эукариотических клетках также существует система коррекции ошибок репликации Обнаружены гомологи Mut. S и Mut. L; гомолога Mut. H не обнаружено гомологи Mut. S (MSH — Mut. S homolog) образуют два гетеродимерных комплекса: ♣ MSH 2 -MSH 6 (Mut. Sα) узнает неспаренные нуклеотиды и короткие «инделы» ♣ MSH 2 -MSH 3 (Mut. Sβ) узнает длинные «инделы» Механизм распознавания новосинтезированной цепи не известен
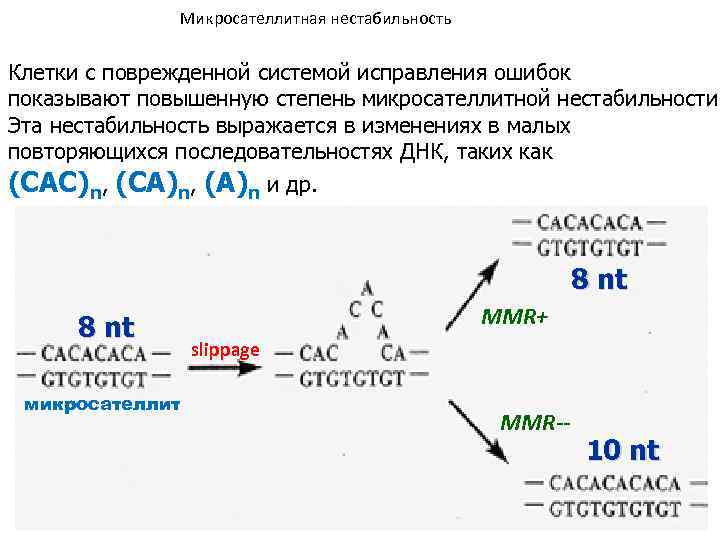 Микросателлитная нестабильность Клетки с поврежденной системой исправления ошибок показывают повышенную степень микросателлитной нестабильности Эта нестабильность выражается в изменениях в малых повторяющихся последовательностях ДНК, таких как (САС)n, (CA)n, (A)n и др. 8 nt микросателлит MMR+ slippage MMR-- 10 nt
Микросателлитная нестабильность Клетки с поврежденной системой исправления ошибок показывают повышенную степень микросателлитной нестабильности Эта нестабильность выражается в изменениях в малых повторяющихся последовательностях ДНК, таких как (САС)n, (CA)n, (A)n и др. 8 nt микросателлит MMR+ slippage MMR-- 10 nt
 А если не успели всё починить, а ДНК уже реплицируется?
А если не успели всё починить, а ДНК уже реплицируется?
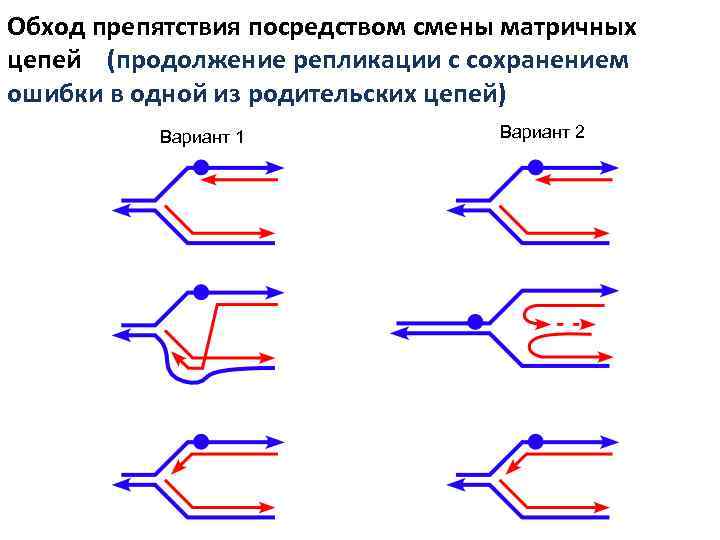 Обход препятствия посредством смены матричных цепей (продолжение репликации с сохранением ошибки в одной из родительских цепей) Вариант 1 Вариант 2
Обход препятствия посредством смены матричных цепей (продолжение репликации с сохранением ошибки в одной из родительских цепей) Вариант 1 Вариант 2
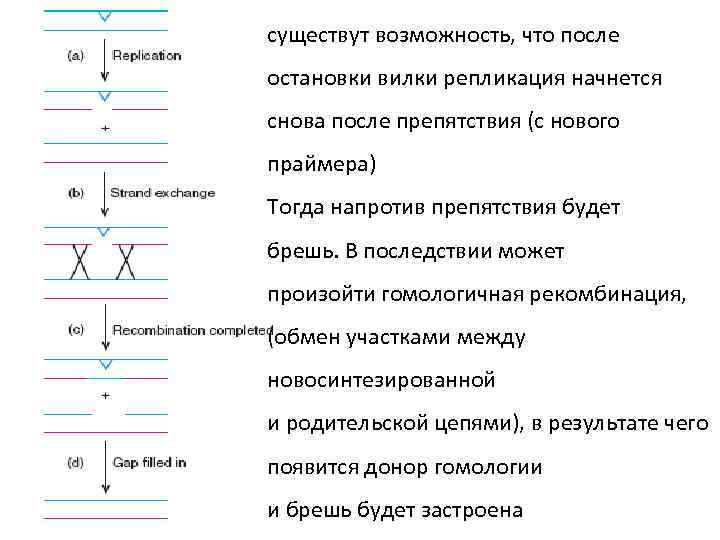 существут возможность, что после остановки вилки репликация начнется снова после препятствия (с нового праймера) Тогда напротив препятствия будет брешь. В последствии может произойти гомологичная рекомбинация, (обмен участками между новосинтезированной и родительской цепями), в результате чего появится донор гомологии и брешь будет застроена
существут возможность, что после остановки вилки репликация начнется снова после препятствия (с нового праймера) Тогда напротив препятствия будет брешь. В последствии может произойти гомологичная рекомбинация, (обмен участками между новосинтезированной и родительской цепями), в результате чего появится донор гомологии и брешь будет застроена
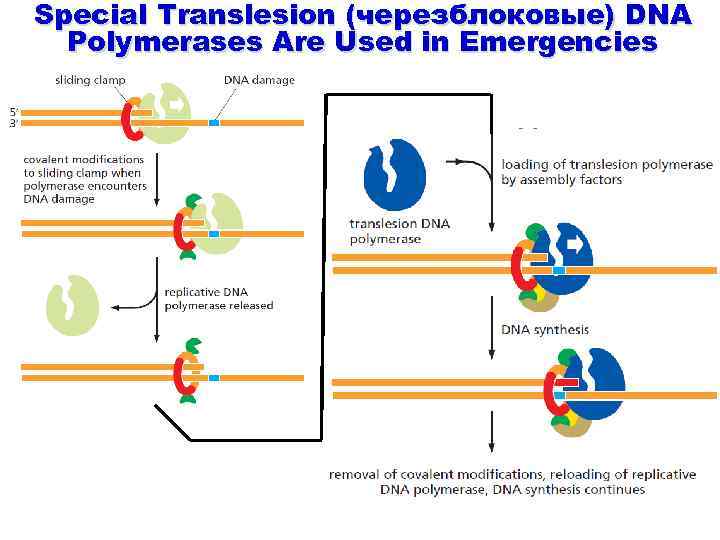 Special Translesion (черезблоковые) DNA Polymerases Are Used in Emergencies
Special Translesion (черезблоковые) DNA Polymerases Are Used in Emergencies
 «черезблоковый» синтез катализируемой «мутасомой» (DNA pol V) Cowcatcher model Locomotive cowcatcher (скотосбрасыватель)
«черезблоковый» синтез катализируемой «мутасомой» (DNA pol V) Cowcatcher model Locomotive cowcatcher (скотосбрасыватель)
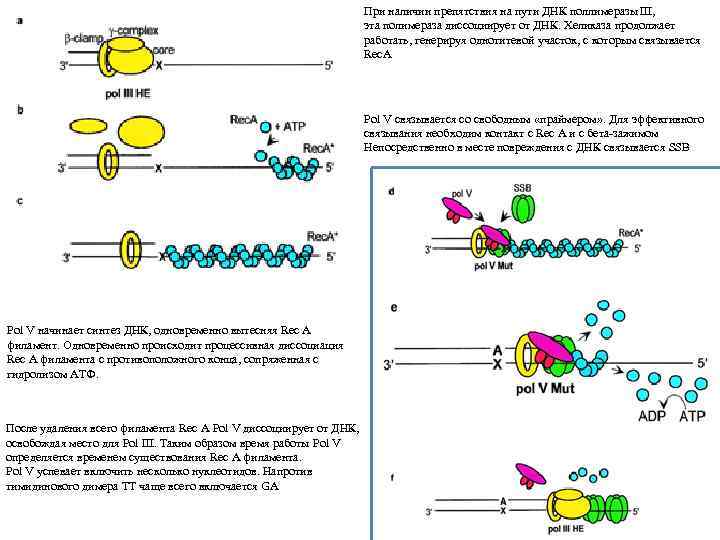 При наличии препятствия на пути ДНК поллимеразы III, эта полимераза диссоциирует от ДНК. Хеликаза продолжает работать, генерируя однотитевой участок, с которым связывается Rec. A Pol V связывается со свободным «праймером» . Для эффективного связывания необходим контакт с Rec A и с бета-зажимом Непосредственно в месте повреждения с ДНК связывается SSB Pol V начинает синтез ДНК, одновременно вытесняя Rec A филамент. Одновременно происходит процессивная диссоциация Rec A филамента с противоположного конца, сопряженная с гидролизом ATФ. После удаления всего филамента Rec A Pol V диссоциирует от ДНК, освобождая место для Pol III. Таким образом время работы Pol V определяется временем существования Rec A филамента. Pol V успевает включить несколько нуклеотидов. Напротив тимидинового димера ТТ чаще всего включается GA
При наличии препятствия на пути ДНК поллимеразы III, эта полимераза диссоциирует от ДНК. Хеликаза продолжает работать, генерируя однотитевой участок, с которым связывается Rec. A Pol V связывается со свободным «праймером» . Для эффективного связывания необходим контакт с Rec A и с бета-зажимом Непосредственно в месте повреждения с ДНК связывается SSB Pol V начинает синтез ДНК, одновременно вытесняя Rec A филамент. Одновременно происходит процессивная диссоциация Rec A филамента с противоположного конца, сопряженная с гидролизом ATФ. После удаления всего филамента Rec A Pol V диссоциирует от ДНК, освобождая место для Pol III. Таким образом время работы Pol V определяется временем существования Rec A филамента. Pol V успевает включить несколько нуклеотидов. Напротив тимидинового димера ТТ чаще всего включается GA
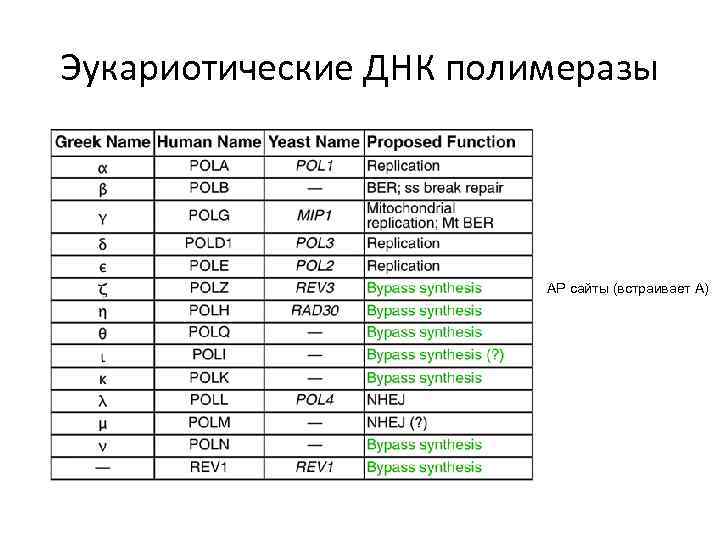 Эукариотические ДНК полимеразы АР сайты (встраивает А)
Эукариотические ДНК полимеразы АР сайты (встраивает А)
 Репарация двунитевых разрывов (SOS) Двунитевые разрывы в ДНК возникают: под действием ионизирующего излучения под действием некоторых химических агентов, в частности, ингибиторов ДНК топоизомеразы II Существует два основных пути репарации двунитевых разрывов: гомологичная рекомбинация негомологичное соединение концов ДНК (NHEJ)
Репарация двунитевых разрывов (SOS) Двунитевые разрывы в ДНК возникают: под действием ионизирующего излучения под действием некоторых химических агентов, в частности, ингибиторов ДНК топоизомеразы II Существует два основных пути репарации двунитевых разрывов: гомологичная рекомбинация негомологичное соединение концов ДНК (NHEJ)
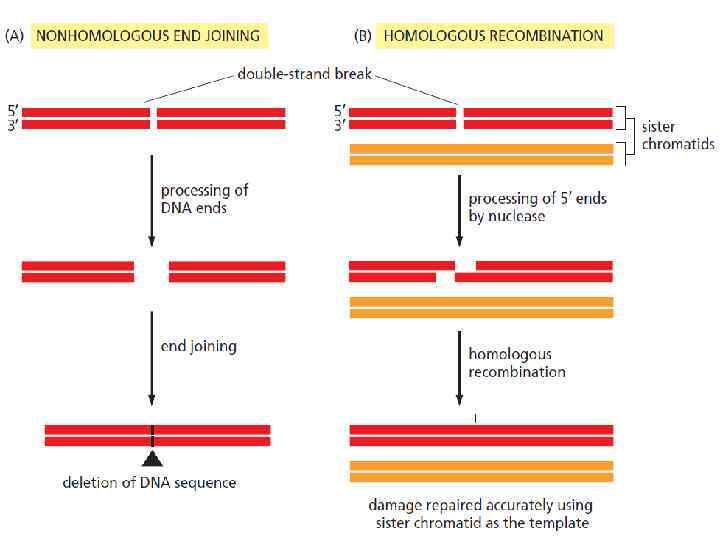
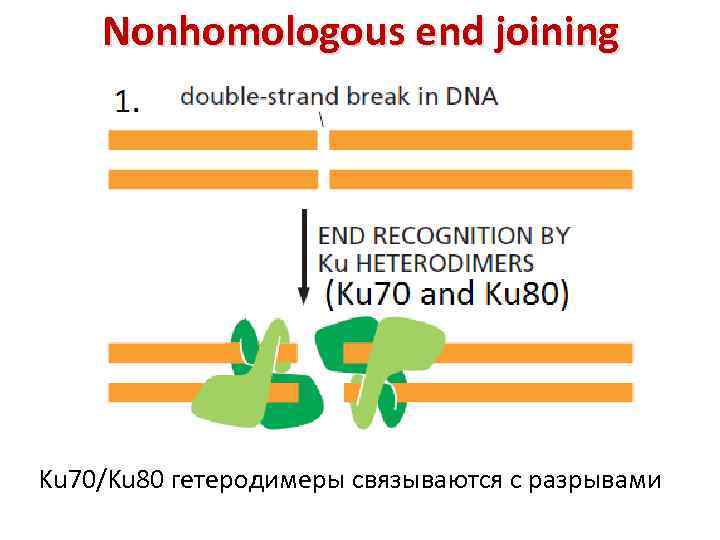 Nonhomologous end joining Ku 70/Ku 80 гетеродимеры связываются с разрывами
Nonhomologous end joining Ku 70/Ku 80 гетеродимеры связываются с разрывами
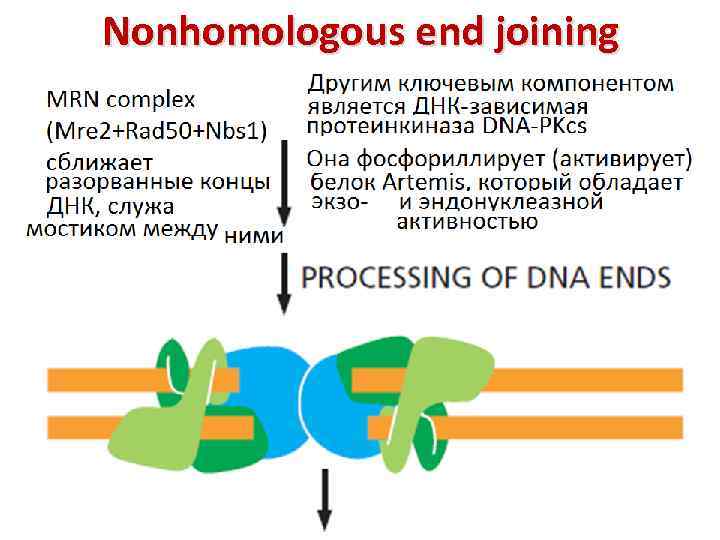 Nonhomologous end joining
Nonhomologous end joining
 Nonhomologous end joining
Nonhomologous end joining
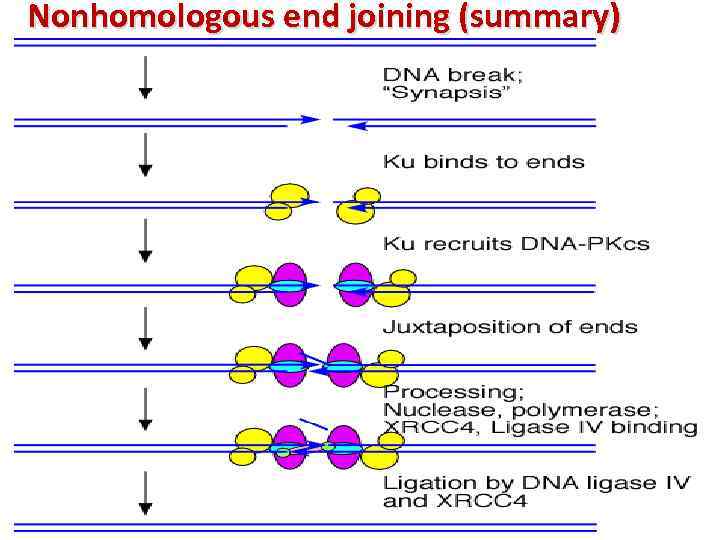 Nonhomologous end joining (summary)
Nonhomologous end joining (summary)
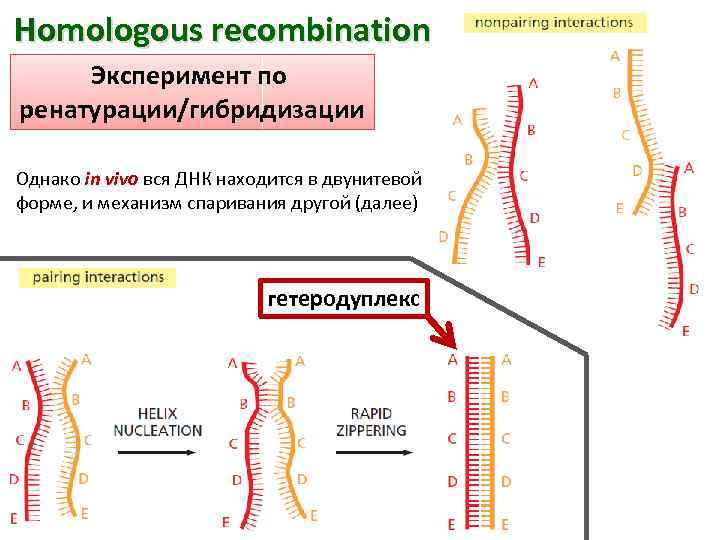 Homologous recombination Эксперимент по ренатурации/гибридизации Однако in vivo вся ДНК находится в двунитевой форме, и механизм спаривания другой (далее) гетеродуплекс
Homologous recombination Эксперимент по ренатурации/гибридизации Однако in vivo вся ДНК находится в двунитевой форме, и механизм спаривания другой (далее) гетеродуплекс
 В отличие от NHEJ-механизма, при гомологично рекомбинации требуется поврежденную цепь пр в соприкосновение с неповрежденной гомологи цепью, которая будет служить в качестве образ Поэтому ГР может происходить сразу после реп ДНК, когда дочерние цепи лежат близко друг к д
В отличие от NHEJ-механизма, при гомологично рекомбинации требуется поврежденную цепь пр в соприкосновение с неповрежденной гомологи цепью, которая будет служить в качестве образ Поэтому ГР может происходить сразу после реп ДНК, когда дочерние цепи лежат близко друг к д
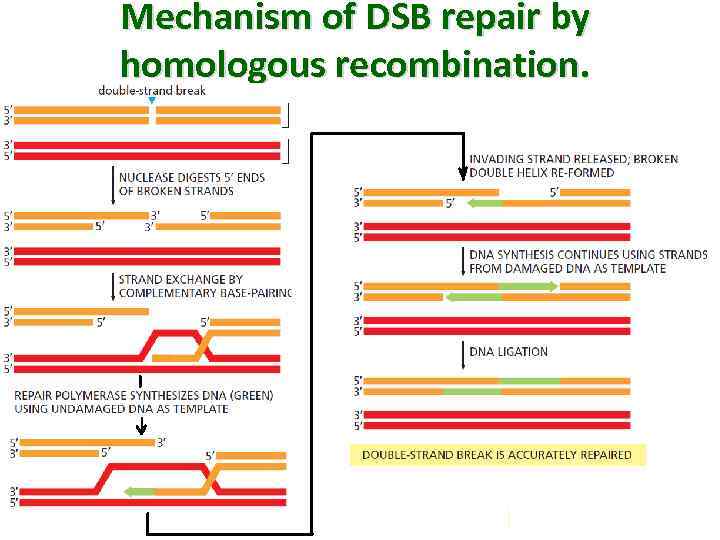 Mechanism of DSB repair by homologous recombination.
Mechanism of DSB repair by homologous recombination.
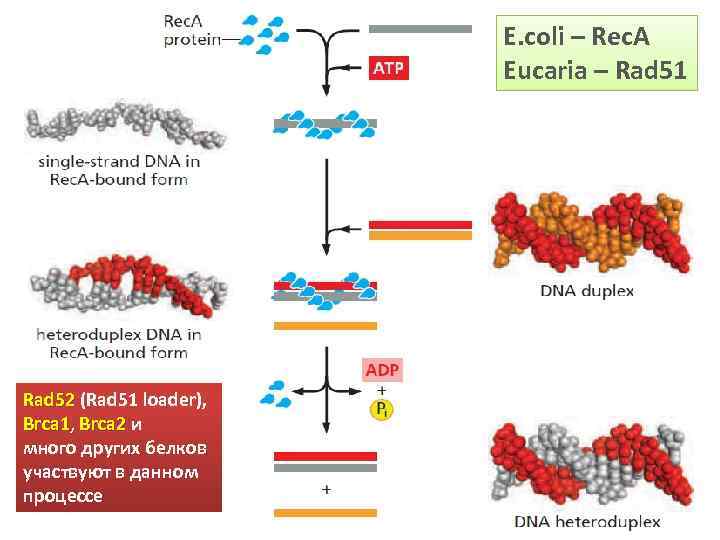 E. coli – Rec. A Eucaria – Rad 51 Rad 52 (Rad 51 loader), Brca 1, Brca 2 и много других белков участвуют в данном процессе
E. coli – Rec. A Eucaria – Rad 51 Rad 52 (Rad 51 loader), Brca 1, Brca 2 и много других белков участвуют в данном процессе
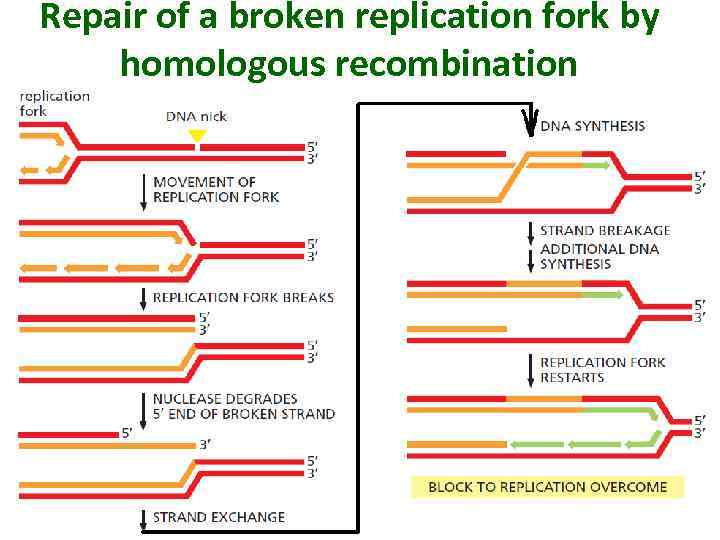 Repair of a broken replication fork by homologous recombination
Repair of a broken replication fork by homologous recombination
 Потеря гетерозиготности • Иногда при ГР используется не сестринская, а гомологичная копия (вместо исправления материнской разорванной хромосомы используется не сестринская материнская, а отцовская гомологичная хромосома и наоборот). • Поскольку последовательности ДНК в гомологах различаются, такой тип исправления может привести к конверсии участка материнской хромосомы в отцовский (и наоборот). Такая конверсия называется потерей гетерозиготности и может в некоторых случаях (если в отцовской хромосоме в данном участке присутствуют онкомутации) приводить к онкозаболеваниям.
Потеря гетерозиготности • Иногда при ГР используется не сестринская, а гомологичная копия (вместо исправления материнской разорванной хромосомы используется не сестринская материнская, а отцовская гомологичная хромосома и наоборот). • Поскольку последовательности ДНК в гомологах различаются, такой тип исправления может привести к конверсии участка материнской хромосомы в отцовский (и наоборот). Такая конверсия называется потерей гетерозиготности и может в некоторых случаях (если в отцовской хромосоме в данном участке присутствуют онкомутации) приводить к онкозаболеваниям.
 • BRCA 1 и BRCA 2 – участники гомологичной рекомбинации. Мутации в них ведут к наследственным формам рака груди и яичника. • BRCA 1 регулирует ранний процессинг концов в разорванной ДНК, и без него не происходит должной подготовки DSB к ГР, вместо этого такой разрыв репарируется по механизму NHEJ, вносящим мутации. • BRCA 2 связывает Rad 51 и не дает ему полимеризоваться на ДНК без надобности, поддерживая его в неактивной форме до той поры, пока он не будет нужен. При обнаружении поврежденной ДНК BRCA 2 быстро доставляет Rad 51 к месту повреждения и позиционирует его на ss. DNA активный Rad 51.
• BRCA 1 и BRCA 2 – участники гомологичной рекомбинации. Мутации в них ведут к наследственным формам рака груди и яичника. • BRCA 1 регулирует ранний процессинг концов в разорванной ДНК, и без него не происходит должной подготовки DSB к ГР, вместо этого такой разрыв репарируется по механизму NHEJ, вносящим мутации. • BRCA 2 связывает Rad 51 и не дает ему полимеризоваться на ДНК без надобности, поддерживая его в неактивной форме до той поры, пока он не будет нужен. При обнаружении поврежденной ДНК BRCA 2 быстро доставляет Rad 51 к месту повреждения и позиционирует его на ss. DNA активный Rad 51.
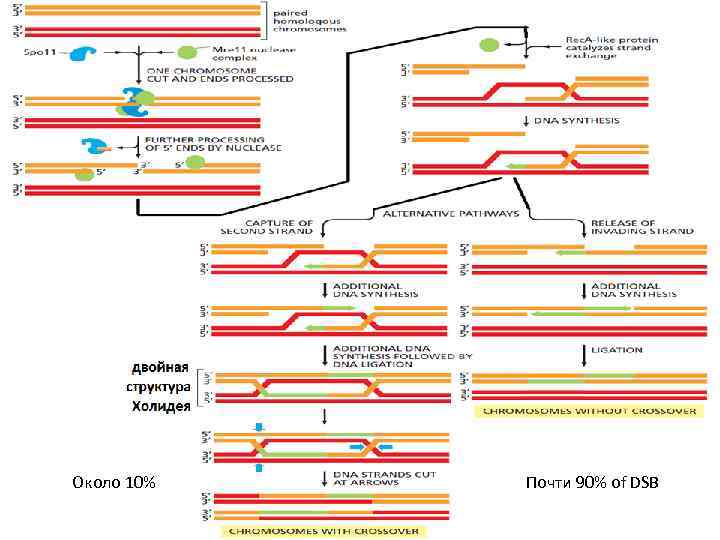 Около 10% Почти 90% of DSB
Около 10% Почти 90% of DSB
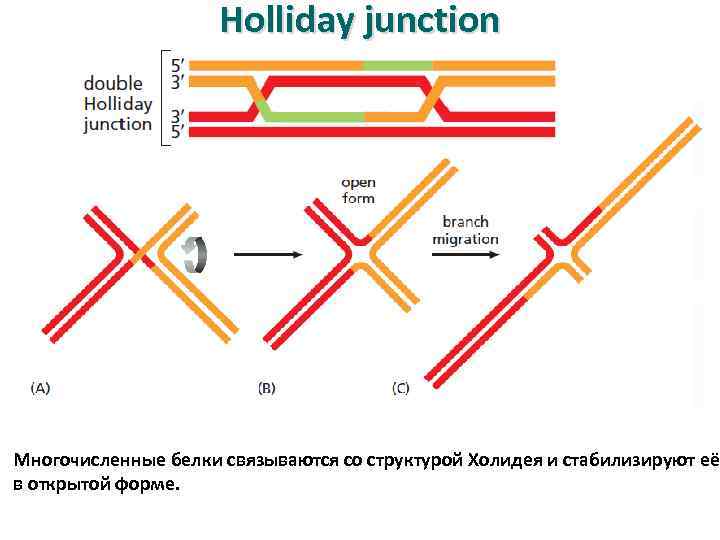 Holliday junction Многочисленные белки связываются со структурой Холидея и стабилизируют её в открытой форме.
Holliday junction Многочисленные белки связываются со структурой Холидея и стабилизируют её в открытой форме.
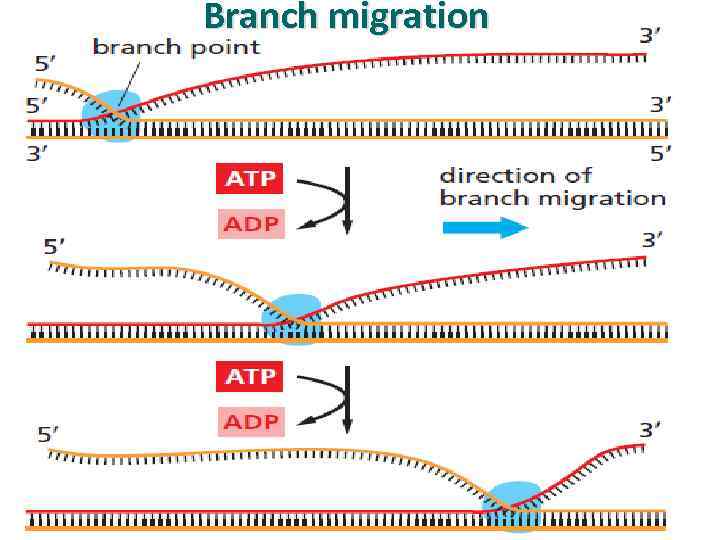 Branch migration
Branch migration
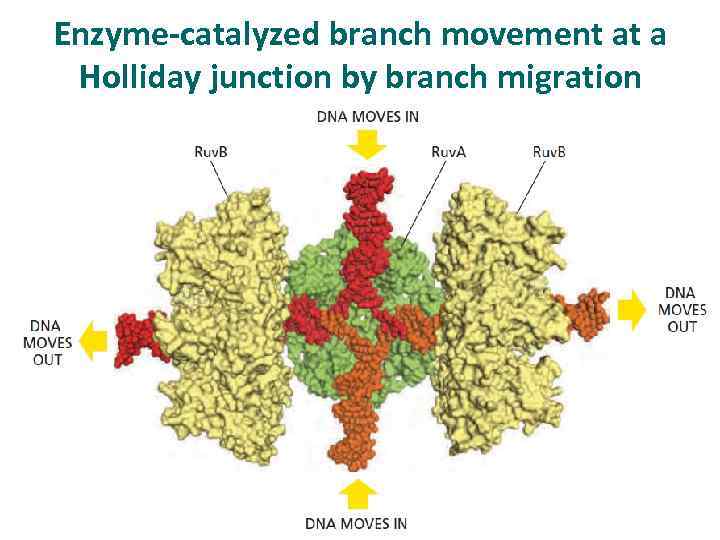 Enzyme-catalyzed branch movement at a Holliday junction by branch migration
Enzyme-catalyzed branch movement at a Holliday junction by branch migration
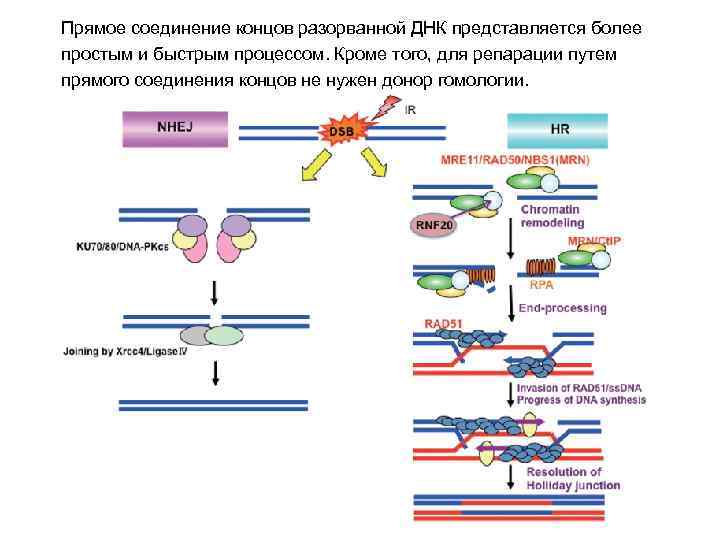 Прямое соединение концов разорванной ДНК представляется более простым и быстрым процессом. Кроме того, для репарации путем прямого соединения концов не нужен донор гомологии.
Прямое соединение концов разорванной ДНК представляется более простым и быстрым процессом. Кроме того, для репарации путем прямого соединения концов не нужен донор гомологии.
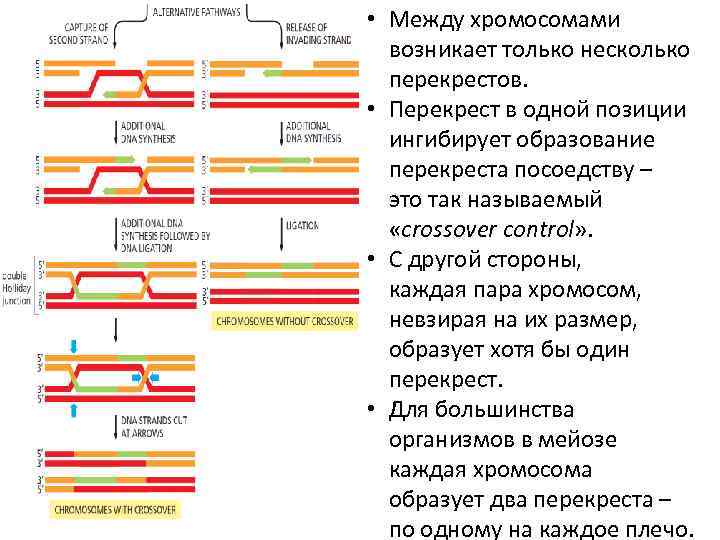 • Между хромосомами возникает только несколько перекрестов. • Перекрест в одной позиции ингибирует образование перекреста посоедству – это так называемый «crossover control» . • С другой стороны, каждая пара хромосом, невзирая на их размер, образует хотя бы один перекрест. • Для большинства организмов в мейозе каждая хромосома образует два перекреста – по одному на каждое плечо.
• Между хромосомами возникает только несколько перекрестов. • Перекрест в одной позиции ингибирует образование перекреста посоедству – это так называемый «crossover control» . • С другой стороны, каждая пара хромосом, невзирая на их размер, образует хотя бы один перекрест. • Для большинства организмов в мейозе каждая хромосома образует два перекреста – по одному на каждое плечо.
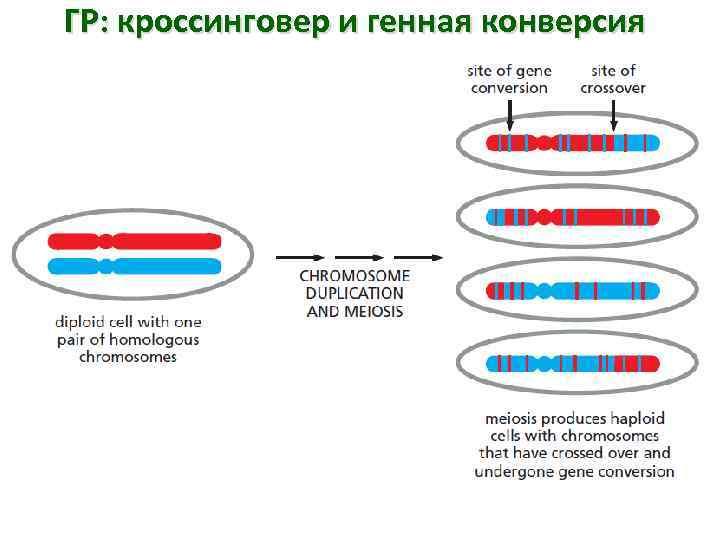 ГР: кроссинговер и генная конверсия
ГР: кроссинговер и генная конверсия
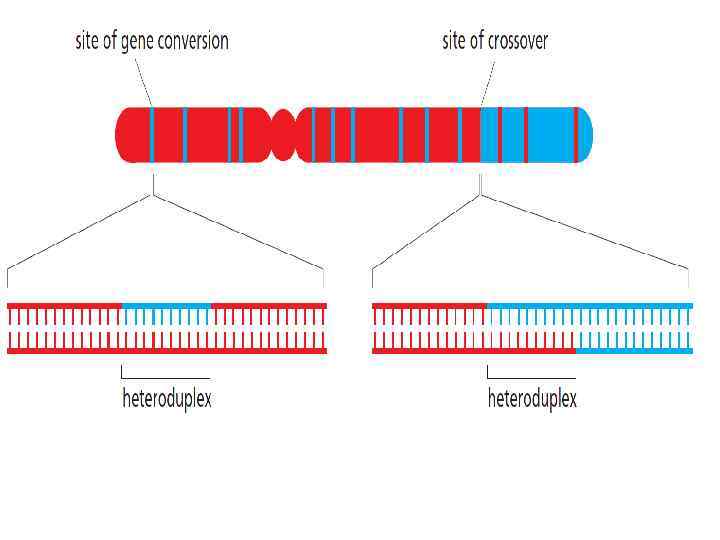
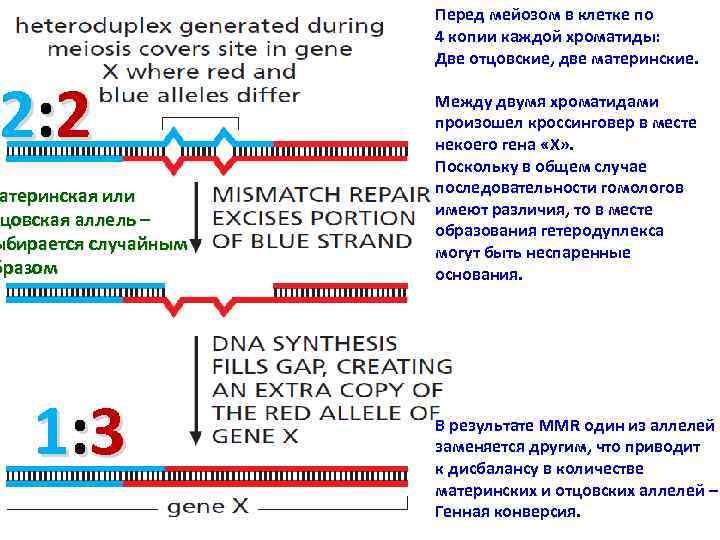 2: 2 атеринская или тцовская аллель – ыбирается случайным бразом 1: 3 Перед мейозом в клетке по 4 копии каждой хроматиды: Две отцовские, две материнские. Между двумя хроматидами произошел кроссинговер в месте некоего гена «Х» . Поскольку в общем случае последовательности гомологов имеют различия, то в месте образования гетеродуплекса могут быть неспаренные основания. В результате MMR один из аллелей заменяется другим, что приводит к дисбалансу в количестве материнских и отцовских аллелей – Генная конверсия.
2: 2 атеринская или тцовская аллель – ыбирается случайным бразом 1: 3 Перед мейозом в клетке по 4 копии каждой хроматиды: Две отцовские, две материнские. Между двумя хроматидами произошел кроссинговер в месте некоего гена «Х» . Поскольку в общем случае последовательности гомологов имеют различия, то в месте образования гетеродуплекса могут быть неспаренные основания. В результате MMR один из аллелей заменяется другим, что приводит к дисбалансу в количестве материнских и отцовских аллелей – Генная конверсия.
 TRANSPOSITION AND CONSERVATIVE SITE-SPECIFIC RECOMBINATION
TRANSPOSITION AND CONSERVATIVE SITE-SPECIFIC RECOMBINATION
 Мобильные генетические элементы (транспозоны) ДНК транспозоны (у прокариот и эукариот) для перемещения нужна транспозаза (интеграза) возможно простое перемещение (без увеличения числа копий) либо создание новых копий Ретро-транспозоны (у эукариот) перемещение всегда посредством создания новой копии промежуточная РНК-копия обратная транскриптаза
Мобильные генетические элементы (транспозоны) ДНК транспозоны (у прокариот и эукариот) для перемещения нужна транспозаза (интеграза) возможно простое перемещение (без увеличения числа копий) либо создание новых копий Ретро-транспозоны (у эукариот) перемещение всегда посредством создания новой копии промежуточная РНК-копия обратная транскриптаза
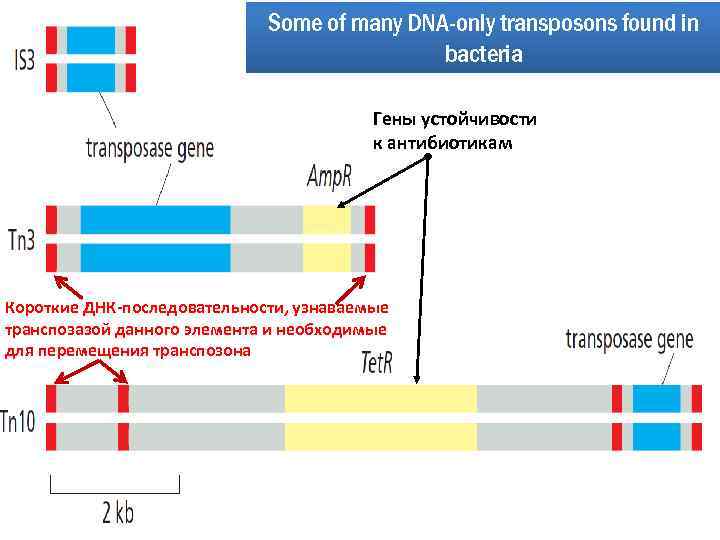 Some of many DNA-only transposons found in bacteria Гены устойчивости к антибиотикам Короткие ДНК-последовательности, узнаваемые транспозазой данного элемента и необходимые для перемещения транспозона
Some of many DNA-only transposons found in bacteria Гены устойчивости к антибиотикам Короткие ДНК-последовательности, узнаваемые транспозазой данного элемента и необходимые для перемещения транспозона
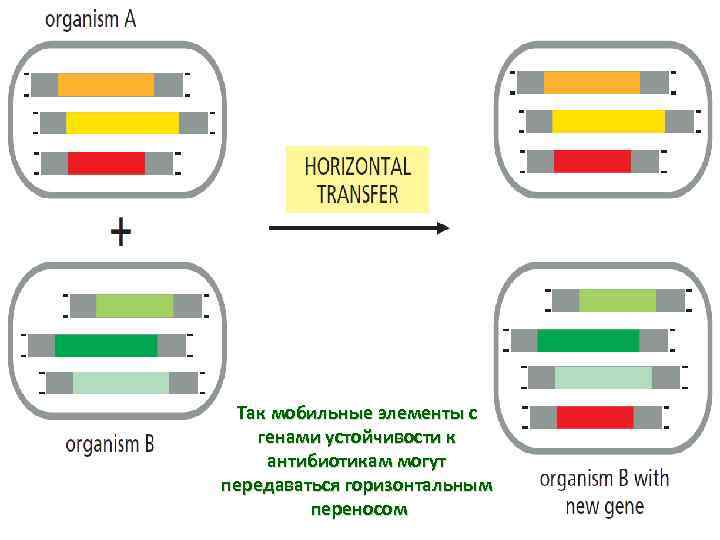 Так мобильные элементы с генами устойчивости к антибиотикам могут передаваться горизонтальным переносом
Так мобильные элементы с генами устойчивости к антибиотикам могут передаваться горизонтальным переносом


 retroviral-like retrotransposons Сходны с ретровирусами, но сами не могут покидать хозяйскую клетку. 1. Весь ретротранспозон транскрибируется системой транскрипции хозяйской клетки. 2. После трансляции с него синтезируется обратная транскриптаза, которая синтезирует на ds. DNA на матрице РНК, используя РНК-ДНК гибрид в качестве интермедиата. 3. Как и ретровирус, линейная ds. DNA теперь интегрируется в геном хозяйской клетки, используя закодированную в ретротранспозоне интегразу. 4. Теперь мобильный элемент может передаваться потомству клетки.
retroviral-like retrotransposons Сходны с ретровирусами, но сами не могут покидать хозяйскую клетку. 1. Весь ретротранспозон транскрибируется системой транскрипции хозяйской клетки. 2. После трансляции с него синтезируется обратная транскриптаза, которая синтезирует на ds. DNA на матрице РНК, используя РНК-ДНК гибрид в качестве интермедиата. 3. Как и ретровирус, линейная ds. DNA теперь интегрируется в геном хозяйской клетки, используя закодированную в ретротранспозоне интегразу. 4. Теперь мобильный элемент может передаваться потомству клетки.
 nonretroviral retrotransposons Третий большой класс мобильных элементов, большинство из которых в геноме человека неподвижно, однако некоторые представители являются подвижными. Например L 1 -элемент (от аббревиатуры LINE - Long Interspersed Nuclear Element (ок. 500 тыс копий) L 1 -элемент ответственнен за один из типов гемофилии, возникающей вследствие встраивания этого элемента в ген участвующего в свертывании крови белка Фактор VIII (Антигемофильный глобулин)
nonretroviral retrotransposons Третий большой класс мобильных элементов, большинство из которых в геноме человека неподвижно, однако некоторые представители являются подвижными. Например L 1 -элемент (от аббревиатуры LINE - Long Interspersed Nuclear Element (ок. 500 тыс копий) L 1 -элемент ответственнен за один из типов гемофилии, возникающей вследствие встраивания этого элемента в ген участвующего в свертывании крови белка Фактор VIII (Антигемофильный глобулин)

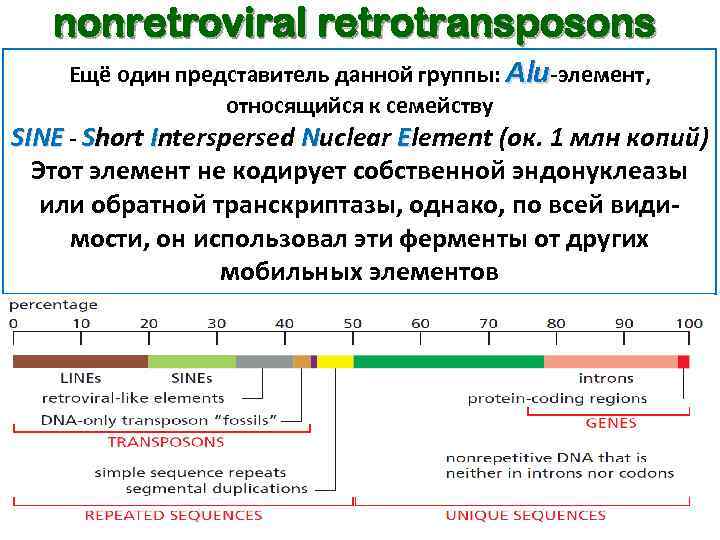 nonretroviral retrotransposons Ещё один представитель данной группы: Alu-элемент, относящийся к семейству SINE - Short Interspersed Nuclear Element (ок. 1 млн копий) Этот элемент не кодирует собственной эндонуклеазы или обратной транскриптазы, однако, по всей видимости, он использовал эти ферменты от других мобильных элементов
nonretroviral retrotransposons Ещё один представитель данной группы: Alu-элемент, относящийся к семейству SINE - Short Interspersed Nuclear Element (ок. 1 млн копий) Этот элемент не кодирует собственной эндонуклеазы или обратной транскриптазы, однако, по всей видимости, он использовал эти ферменты от других мобильных элементов
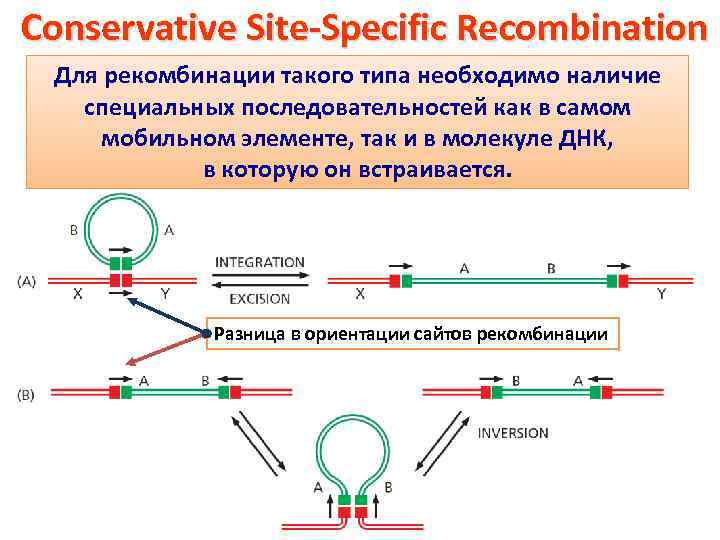 Conservative Site-Specific Recombination Для рекомбинации такого типа необходимо наличие специальных последовательностей как в самом мобильном элементе, так и в молекуле ДНК, в которую он встраивается. Разница в ориентации сайтов рекомбинации
Conservative Site-Specific Recombination Для рекомбинации такого типа необходимо наличие специальных последовательностей как в самом мобильном элементе, так и в молекуле ДНК, в которую он встраивается. Разница в ориентации сайтов рекомбинации
 Сайт-специфическая рекомбинация используется некоторыми ДНКсодержащими вирусами • При этом вирус встраивает свою ДНК в ДНК клетки-хозяина, беспрепятственно реплицируется в ней (как часть клеточной ДНК) и передается ничего не подозревающей клеткой её потомкам. • Однако при неблагоприятных обстоятельствах ДНК вируса может вырезаться из клеточной и «покидать тонущий корабль» ввиде собравшихся вирусных частиц.
Сайт-специфическая рекомбинация используется некоторыми ДНКсодержащими вирусами • При этом вирус встраивает свою ДНК в ДНК клетки-хозяина, беспрепятственно реплицируется в ней (как часть клеточной ДНК) и передается ничего не подозревающей клеткой её потомкам. • Однако при неблагоприятных обстоятельствах ДНК вируса может вырезаться из клеточной и «покидать тонущий корабль» ввиде собравшихся вирусных частиц.
 Отличия сайт-специфической рекомбинации от транспозиции • SSR требует наличия специальных сайтов у обоих участников процесса (сайт-специфичность). Для транспозиции необходимо наличие специальных (узнаваемых рекомбиназой) лишь у транспозона, последовательность же хозяйской ДНК для большинстватранспозонов может быть любой. • Сами механизмы фундаментально различны. В SSR рекомбиназа действует подобно топоизомеразам, образовывая транзиентную высокоэнергетичную ковалентную связь с ДНК, используя энергию этой связи для перегруппировки ДНК. При этом все разорванные фосфодиэфирные связи к концу процесса возвращаются на прежнее место (консервативность). Транспозиция не действует по такому механизму и после неё зачастую остаются бреши в ДНК, которые должны быть репарированы ДНК-полимеразами.
Отличия сайт-специфической рекомбинации от транспозиции • SSR требует наличия специальных сайтов у обоих участников процесса (сайт-специфичность). Для транспозиции необходимо наличие специальных (узнаваемых рекомбиназой) лишь у транспозона, последовательность же хозяйской ДНК для большинстватранспозонов может быть любой. • Сами механизмы фундаментально различны. В SSR рекомбиназа действует подобно топоизомеразам, образовывая транзиентную высокоэнергетичную ковалентную связь с ДНК, используя энергию этой связи для перегруппировки ДНК. При этом все разорванные фосфодиэфирные связи к концу процесса возвращаются на прежнее место (консервативность). Транспозиция не действует по такому механизму и после неё зачастую остаются бреши в ДНК, которые должны быть репарированы ДНК-полимеразами.
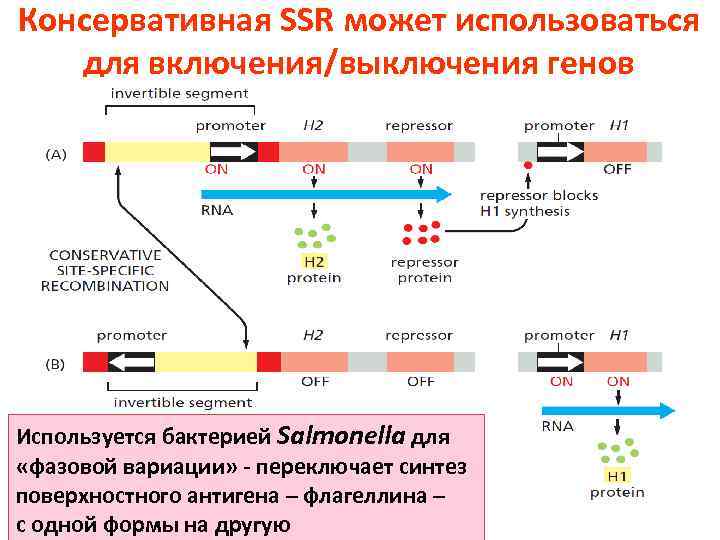 Консервативная SSR может использоваться для включения/выключения генов Используется бактерией Salmonella для «фазовой вариации» - переключает синтез поверхностного антигена – флагеллина – с одной формы на другую
Консервативная SSR может использоваться для включения/выключения генов Используется бактерией Salmonella для «фазовой вариации» - переключает синтез поверхностного антигена – флагеллина – с одной формы на другую


