d6e144ab162312770f5367f045e46545.ppt
- Количество слайдов: 54
 DIU National Infections Ostéo-Articulaires Lundi 9 janvier 2017 12 h-13 h EPIDÉMIOLOGIE DE LA RÉSISTANCE AUX ANTIBIOTIQUES ET SENSIBILITÉ IN VITRO AUX Pr. Vincent CATTOIR Service de Bactériologie-Hygiène hospitalière, CHU de Rennes NOUVELLES MOLÉCULES « Entérocoques » ) CNR de la Résistance aux Antibiotiques (laboratoire associé Faculté de Médecine, Université de Rennes 1 Email: vincent. cattoir@chu-rennes. fr
DIU National Infections Ostéo-Articulaires Lundi 9 janvier 2017 12 h-13 h EPIDÉMIOLOGIE DE LA RÉSISTANCE AUX ANTIBIOTIQUES ET SENSIBILITÉ IN VITRO AUX Pr. Vincent CATTOIR Service de Bactériologie-Hygiène hospitalière, CHU de Rennes NOUVELLES MOLÉCULES « Entérocoques » ) CNR de la Résistance aux Antibiotiques (laboratoire associé Faculté de Médecine, Université de Rennes 1 Email: vincent. cattoir@chu-rennes. fr
 Pathogènes multi-résistants Enterococcus spp. Staphylococcus aureus Klebsiella pneumoniae Acinetobacter baumannii Pseudomonas aeruginosa Enterobacter spp. Caractéristiques communes : 1. Pathogènes opportunistes 2. Infections nosocomiales 3. Multi-résistance aux ATB 4. Transferts de gènes fréquents 5. Adaptés à l’environnement hosp. 6. Epidémies hospitalières Rice, JID 2008
Pathogènes multi-résistants Enterococcus spp. Staphylococcus aureus Klebsiella pneumoniae Acinetobacter baumannii Pseudomonas aeruginosa Enterobacter spp. Caractéristiques communes : 1. Pathogènes opportunistes 2. Infections nosocomiales 3. Multi-résistance aux ATB 4. Transferts de gènes fréquents 5. Adaptés à l’environnement hosp. 6. Epidémies hospitalières Rice, JID 2008
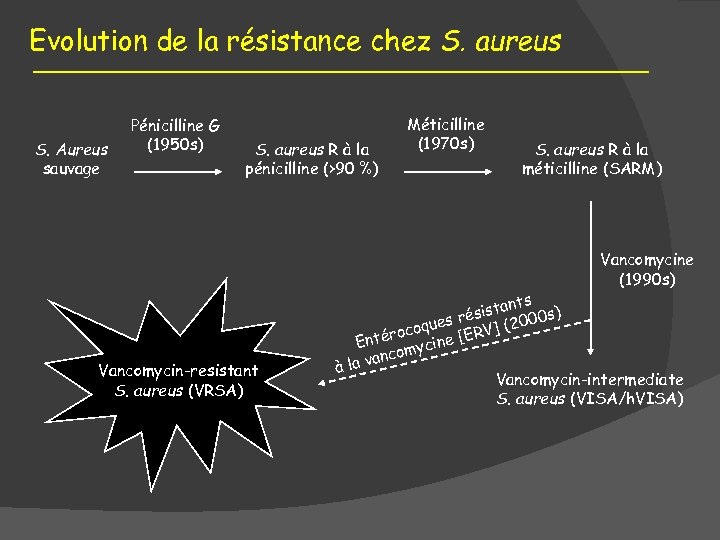 Evolution de la résistance chez S. aureus S. Aureus sauvage Pénicilline G (1950 s) S. aureus R à la pénicilline (>90 %) Méticilline (1970 s) S. aureus R à la méticilline (SARM) Vancomycine (1990 s) Vancomycin-resistant S. aureus (VRSA) 26% nts sista 00 s) 0 es ré coqu [ERV] (2 ro Enté mycine nco la va à Vancomycin-intermediate S. aureus (VISA/h. VISA)
Evolution de la résistance chez S. aureus S. Aureus sauvage Pénicilline G (1950 s) S. aureus R à la pénicilline (>90 %) Méticilline (1970 s) S. aureus R à la méticilline (SARM) Vancomycine (1990 s) Vancomycin-resistant S. aureus (VRSA) 26% nts sista 00 s) 0 es ré coqu [ERV] (2 ro Enté mycine nco la va à Vancomycin-intermediate S. aureus (VISA/h. VISA)
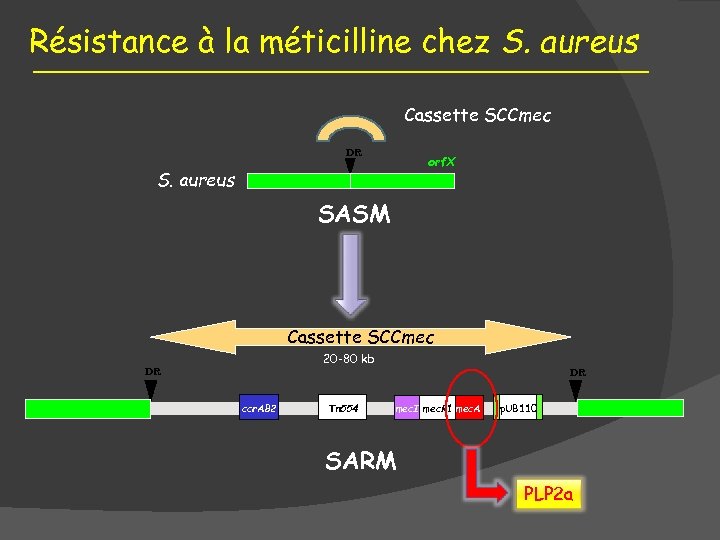 Résistance à la méticilline chez S. aureus Cassette SCCmec DR orf. X S. aureus SASM Cassette SCCmec 20 -80 kb DR ccr. AB 2 Tn 554 DR mec. I mec. R 1 mec. A p. UB 110 SARM PLP 2 a
Résistance à la méticilline chez S. aureus Cassette SCCmec DR orf. X S. aureus SASM Cassette SCCmec 20 -80 kb DR ccr. AB 2 Tn 554 DR mec. I mec. R 1 mec. A p. UB 110 SARM PLP 2 a
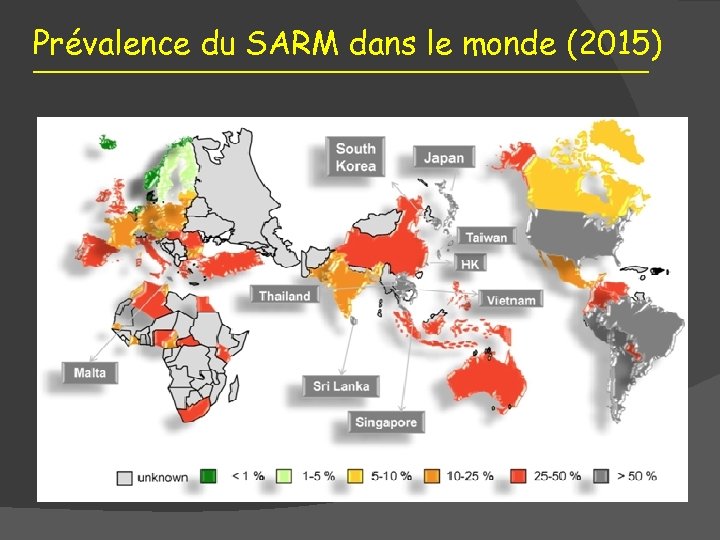 Prévalence du SARM dans le monde (2015)
Prévalence du SARM dans le monde (2015)
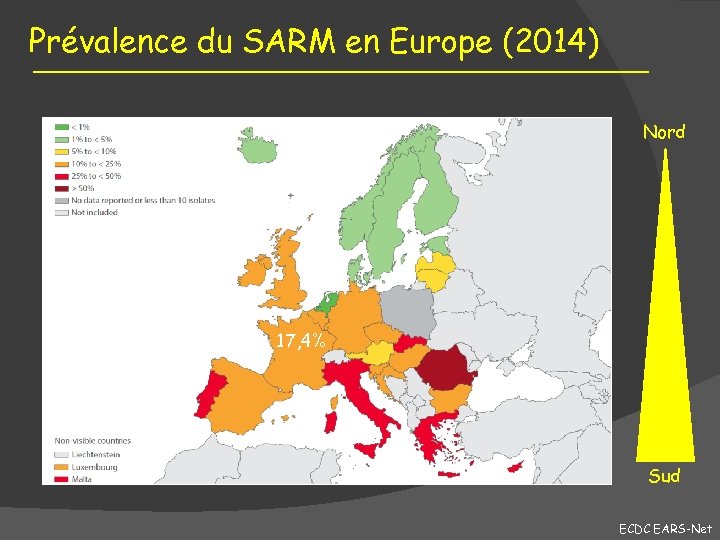 Prévalence du SARM en Europe (2014) Nord 17, 4% Sud ECDC EARS-Net
Prévalence du SARM en Europe (2014) Nord 17, 4% Sud ECDC EARS-Net
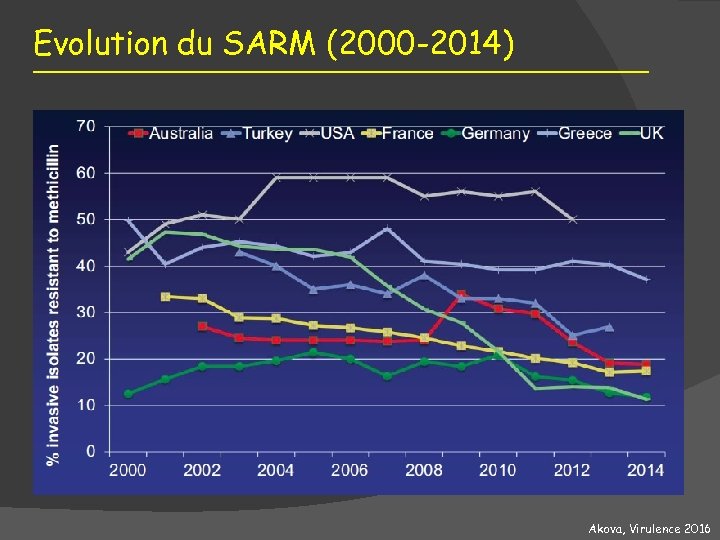 Evolution du SARM (2000 -2014) Akova, Virulence 2016
Evolution du SARM (2000 -2014) Akova, Virulence 2016
 SARM communautaire PVL(+) Ø Diffusion mondiale de souches de SARM communautaires PVL(+) (forte prévalence aux EU [USA 300], faible prévalence en Europe – sauf Grèce)
SARM communautaire PVL(+) Ø Diffusion mondiale de souches de SARM communautaires PVL(+) (forte prévalence aux EU [USA 300], faible prévalence en Europe – sauf Grèce)
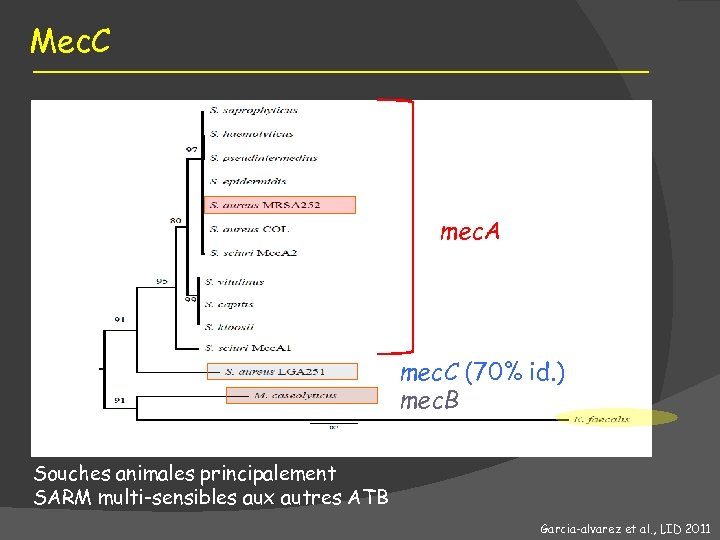 Mec. C mec. A mec. C (70% id. ) mec. B Souches animales principalement SARM multi-sensibles aux autres ATB Garcia-alvarez et al. , LID 2011
Mec. C mec. A mec. C (70% id. ) mec. B Souches animales principalement SARM multi-sensibles aux autres ATB Garcia-alvarez et al. , LID 2011
 Résistance aux glycopeptides Vancomycin-resistant S. aureus (VRSA) Vanco 1 2 4 8 16 32 Vancomycin-intermediate S. aureus (VISA) Vanco 1 2 4 8 16 32 Hetero-VISA (resistant subpopulation at a frequency of 10 -4 -10 -6) Vanco 1 2 4 8 16 32 Holmes et al. , JCM 2012
Résistance aux glycopeptides Vancomycin-resistant S. aureus (VRSA) Vanco 1 2 4 8 16 32 Vancomycin-intermediate S. aureus (VISA) Vanco 1 2 4 8 16 32 Hetero-VISA (resistant subpopulation at a frequency of 10 -4 -10 -6) Vanco 1 2 4 8 16 32 Holmes et al. , JCM 2012
 VRSA v 1ère description en 2002 (Michigan, EU) avec l’acquisition de l’opéron van. A par un SARM (à partir d’un ERV) v. Nombre limité de souches cliniques (n = 35) : Continent Country No. North America US 13 South America Brazil 1 Asia India Iran Pakistan 16 3 1 Europe Portugal 1 Toutes des souches de SARM van. A (+) v. Facteurs de risque : plaies cutanées chroniques, TTT par vancomycine, co-colonisation/co-infection par SARM/ERV Chang et al. , NEJM 2003, Sievert et al. , CID 2008; Melo-Cristino et al. Lancet 2013; Moravvej et al. , IJAA 2013; Limbago et al. , JCM 2014; Rossi et al. , NEJM 2014
VRSA v 1ère description en 2002 (Michigan, EU) avec l’acquisition de l’opéron van. A par un SARM (à partir d’un ERV) v. Nombre limité de souches cliniques (n = 35) : Continent Country No. North America US 13 South America Brazil 1 Asia India Iran Pakistan 16 3 1 Europe Portugal 1 Toutes des souches de SARM van. A (+) v. Facteurs de risque : plaies cutanées chroniques, TTT par vancomycine, co-colonisation/co-infection par SARM/ERV Chang et al. , NEJM 2003, Sievert et al. , CID 2008; Melo-Cristino et al. Lancet 2013; Moravvej et al. , IJAA 2013; Limbago et al. , JCM 2014; Rossi et al. , NEJM 2014
![VISA et h. VISA (59% ST 239 [CC 8]) Zhang et al. , PLo. VISA et h. VISA (59% ST 239 [CC 8]) Zhang et al. , PLo.](https://present5.com/presentation/d6e144ab162312770f5367f045e46545/image-12.jpg) VISA et h. VISA (59% ST 239 [CC 8]) Zhang et al. , PLo. S One 2015
VISA et h. VISA (59% ST 239 [CC 8]) Zhang et al. , PLo. S One 2015
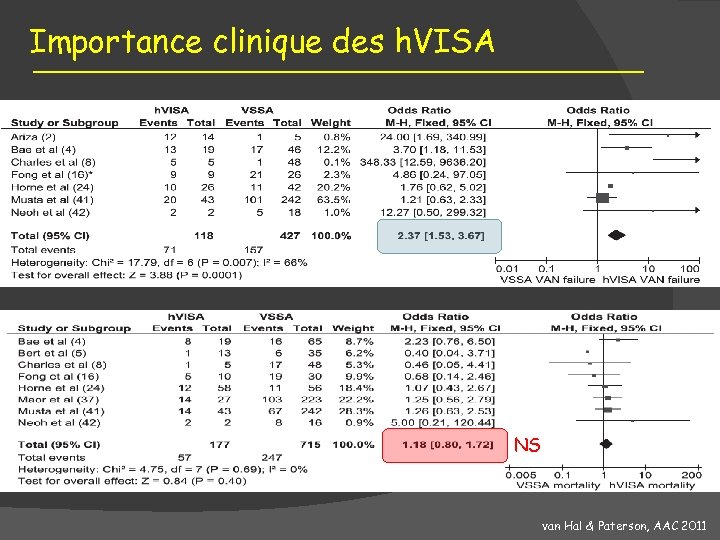 Importance clinique des h. VISA NS van Hal & Paterson, AAC 2011
Importance clinique des h. VISA NS van Hal & Paterson, AAC 2011
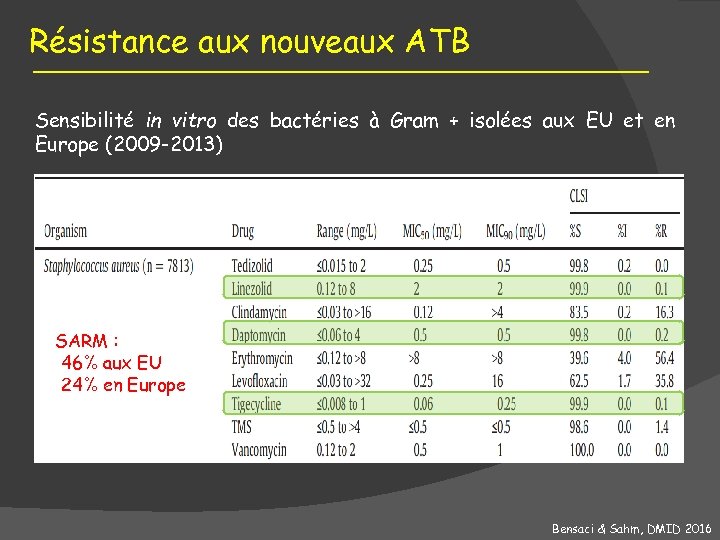 Résistance aux nouveaux ATB Sensibilité in vitro des bactéries à Gram + isolées aux EU et en Europe (2009 -2013) SARM : 46% aux EU 24% en Europe Bensaci & Sahm, DMID 2016
Résistance aux nouveaux ATB Sensibilité in vitro des bactéries à Gram + isolées aux EU et en Europe (2009 -2013) SARM : 46% aux EU 24% en Europe Bensaci & Sahm, DMID 2016
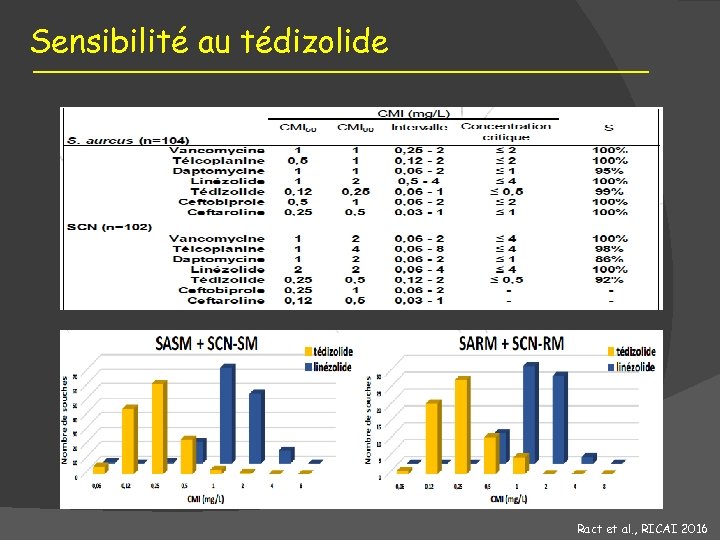 Sensibilité au tédizolide Ract et al. , RICAI 2016
Sensibilité au tédizolide Ract et al. , RICAI 2016
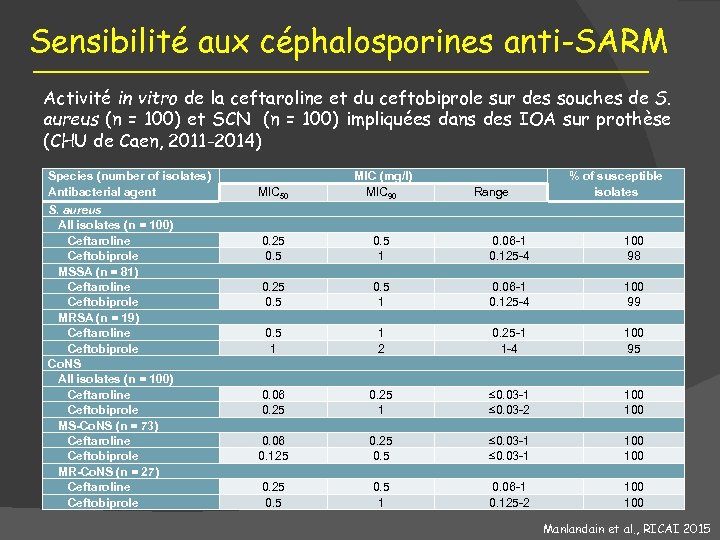 Sensibilité aux céphalosporines anti-SARM Activité in vitro de la ceftaroline et du ceftobiprole sur des souches de S. aureus (n = 100) et SCN (n = 100) impliquées dans des IOA sur prothèse (CHU de Caen, 2011 -2014) Species (number of isolates) Antibacterial agent S. aureus All isolates (n = 100) Ceftaroline Ceftobiprole MSSA (n = 81) Ceftaroline Ceftobiprole MRSA (n = 19) Ceftaroline Ceftobiprole Co. NS All isolates (n = 100) Ceftaroline Ceftobiprole MS-Co. NS (n = 73) Ceftaroline Ceftobiprole MR-Co. NS (n = 27) Ceftaroline Ceftobiprole MIC 50 MIC (mg/l) MIC 90 0. 25 0. 5 1 0. 06 -1 0. 125 -4 100 98 0. 25 0. 5 1 0. 06 -1 0. 125 -4 100 99 0. 5 1 1 2 0. 25 -1 1 -4 100 95 0. 06 0. 25 1 ≤ 0. 03 -2 100 0. 06 0. 125 0. 5 ≤ 0. 03 -1 100 0. 25 0. 5 1 0. 06 -1 0. 125 -2 100 Range % of susceptible isolates Manlandain et al. , RICAI 2015
Sensibilité aux céphalosporines anti-SARM Activité in vitro de la ceftaroline et du ceftobiprole sur des souches de S. aureus (n = 100) et SCN (n = 100) impliquées dans des IOA sur prothèse (CHU de Caen, 2011 -2014) Species (number of isolates) Antibacterial agent S. aureus All isolates (n = 100) Ceftaroline Ceftobiprole MSSA (n = 81) Ceftaroline Ceftobiprole MRSA (n = 19) Ceftaroline Ceftobiprole Co. NS All isolates (n = 100) Ceftaroline Ceftobiprole MS-Co. NS (n = 73) Ceftaroline Ceftobiprole MR-Co. NS (n = 27) Ceftaroline Ceftobiprole MIC 50 MIC (mg/l) MIC 90 0. 25 0. 5 1 0. 06 -1 0. 125 -4 100 98 0. 25 0. 5 1 0. 06 -1 0. 125 -4 100 99 0. 5 1 1 2 0. 25 -1 1 -4 100 95 0. 06 0. 25 1 ≤ 0. 03 -2 100 0. 06 0. 125 0. 5 ≤ 0. 03 -1 100 0. 25 0. 5 1 0. 06 -1 0. 125 -2 100 Range % of susceptible isolates Manlandain et al. , RICAI 2015
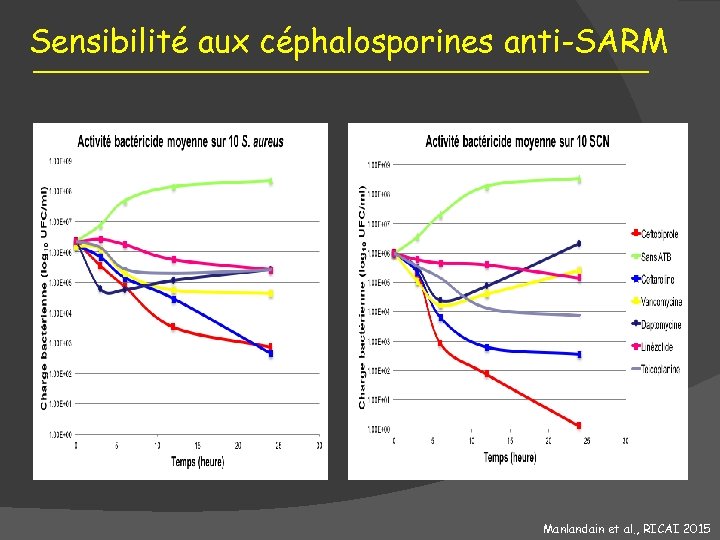 Sensibilité aux céphalosporines anti-SARM Manlandain et al. , RICAI 2015
Sensibilité aux céphalosporines anti-SARM Manlandain et al. , RICAI 2015
 Premières souches d’ERV
Premières souches d’ERV
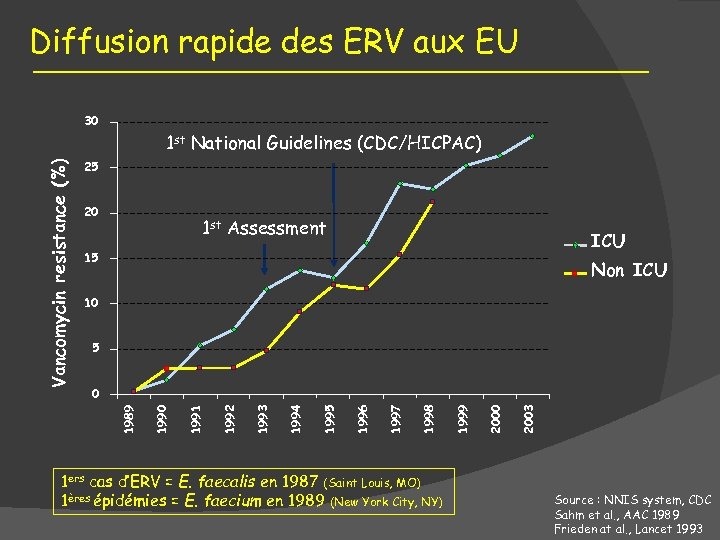 Diffusion rapide des ERV aux EU 30 25 20 1 st Assessment ICU 15 Non ICU 10 5 1 ers cas d’ERV = E. faecalis en 1987 (Saint Louis, MO) 1ères épidémies = E. faecium en 1989 (New York City, NY) 2003 2000 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 0 1989 Vancomycin resistance (%) 1 st National Guidelines (CDC/HICPAC) Source : NNIS system, CDC Sahm et al. , AAC 1989 Frieden at al. , Lancet 1993
Diffusion rapide des ERV aux EU 30 25 20 1 st Assessment ICU 15 Non ICU 10 5 1 ers cas d’ERV = E. faecalis en 1987 (Saint Louis, MO) 1ères épidémies = E. faecium en 1989 (New York City, NY) 2003 2000 1999 1998 1997 1996 1995 1994 1993 1992 1991 1990 0 1989 Vancomycin resistance (%) 1 st National Guidelines (CDC/HICPAC) Source : NNIS system, CDC Sahm et al. , AAC 1989 Frieden at al. , Lancet 1993
 Prévalence actuelle des ERV aux EU
Prévalence actuelle des ERV aux EU
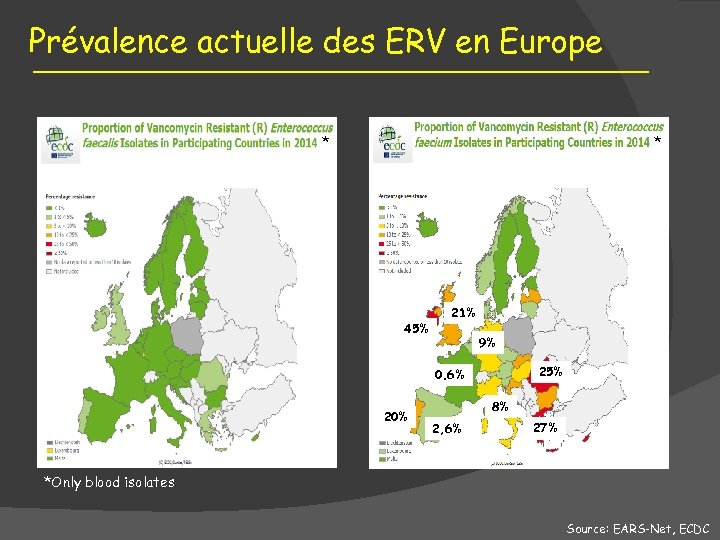 Prévalence actuelle des ERV en Europe * * 45% 21% 9% 25% 0. 6% 20% 8% 2, 6% 27% *Only blood isolates Source: EARS-Net, ECDC
Prévalence actuelle des ERV en Europe * * 45% 21% 9% 25% 0. 6% 20% 8% 2, 6% 27% *Only blood isolates Source: EARS-Net, ECDC
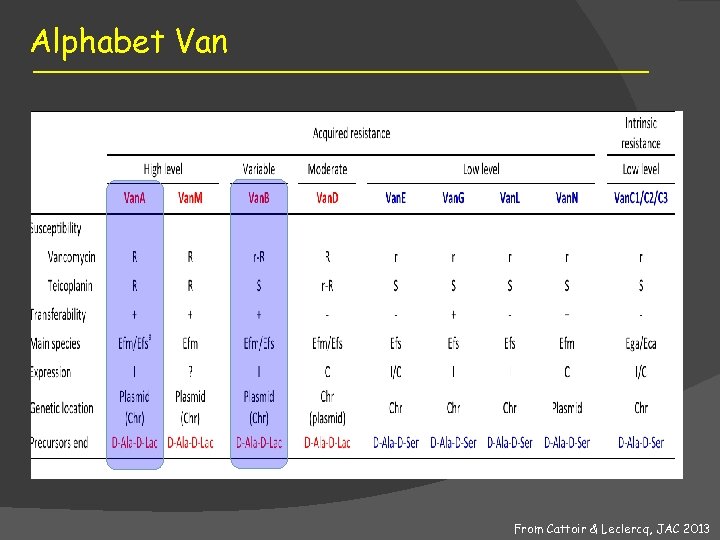 Alphabet Van From Cattoir & Leclercq, JAC 2013
Alphabet Van From Cattoir & Leclercq, JAC 2013
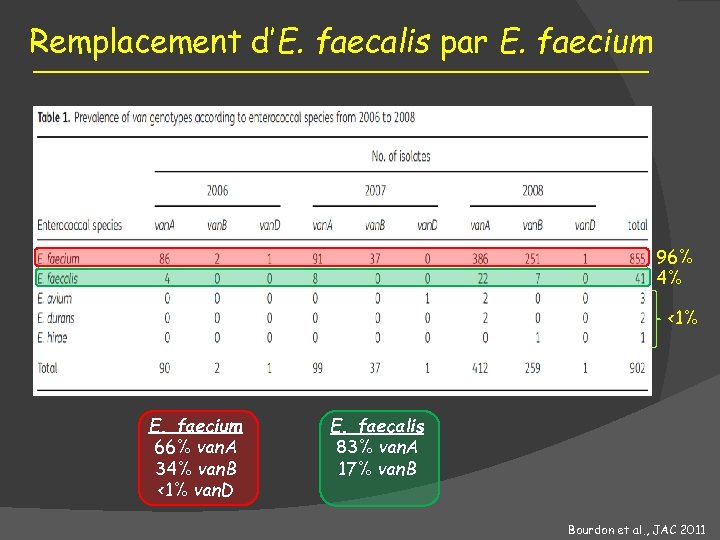 Remplacement d’E. faecalis par E. faecium 96% 4% <1% E. faecium 66% van. A 34% van. B <1% van. D E. faecalis 83% van. A 17% van. B Bourdon et al. , JAC 2011
Remplacement d’E. faecalis par E. faecium 96% 4% <1% E. faecium 66% van. A 34% van. B <1% van. D E. faecalis 83% van. A 17% van. B Bourdon et al. , JAC 2011
 Clonal complex 17 (CC 17) v. Subpopulation of hospital-adapted clones of E. faecium that have subsequently acquired resistance to vancomycin v. CC 17 isolates share common characteristics: • HLR to ampicillin and fluoroquinolones • Presence of a pathogenicity island, harbouring virulence genes (esp et hyl. Efm) • Presence of the specific IS 16 Homan et al. , JCM 2002 Willems et al. , EID 2005 Leavis et al. , PLo. S Pathog 2007
Clonal complex 17 (CC 17) v. Subpopulation of hospital-adapted clones of E. faecium that have subsequently acquired resistance to vancomycin v. CC 17 isolates share common characteristics: • HLR to ampicillin and fluoroquinolones • Presence of a pathogenicity island, harbouring virulence genes (esp et hyl. Efm) • Presence of the specific IS 16 Homan et al. , JCM 2002 Willems et al. , EID 2005 Leavis et al. , PLo. S Pathog 2007
 Résistance à l’ampicilline 95 -98 % de souches ampi-R chez E. faecium ERV 92% Pas d’E. faecalis ampi-R 92% (sauf EU, Liban, Argentine) 77% 83% 91% Sources : EARS-Net, ECDC NRC France
Résistance à l’ampicilline 95 -98 % de souches ampi-R chez E. faecium ERV 92% Pas d’E. faecalis ampi-R 92% (sauf EU, Liban, Argentine) 77% 83% 91% Sources : EARS-Net, ECDC NRC France
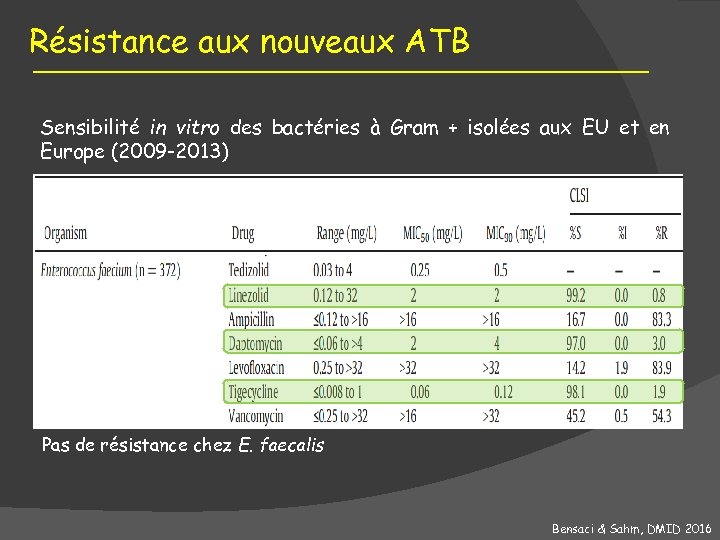 Résistance aux nouveaux ATB Sensibilité in vitro des bactéries à Gram + isolées aux EU et en Europe (2009 -2013) Pas de résistance chez E. faecalis Bensaci & Sahm, DMID 2016
Résistance aux nouveaux ATB Sensibilité in vitro des bactéries à Gram + isolées aux EU et en Europe (2009 -2013) Pas de résistance chez E. faecalis Bensaci & Sahm, DMID 2016
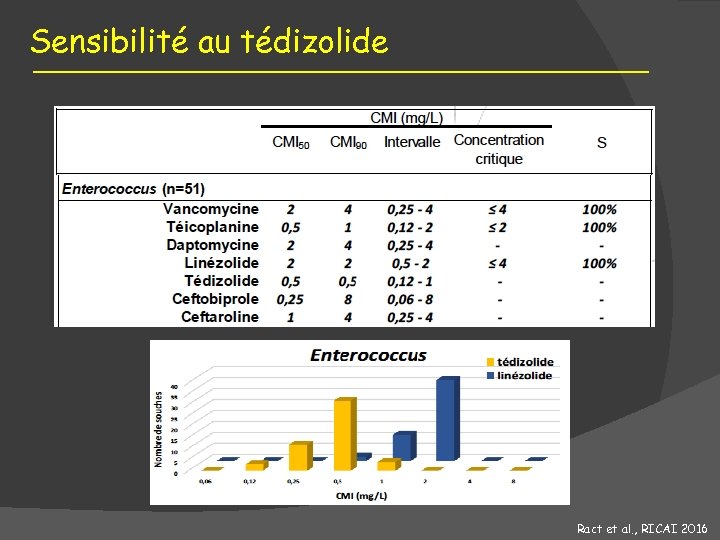 Sensibilité au tédizolide Ract et al. , RICAI 2016
Sensibilité au tédizolide Ract et al. , RICAI 2016
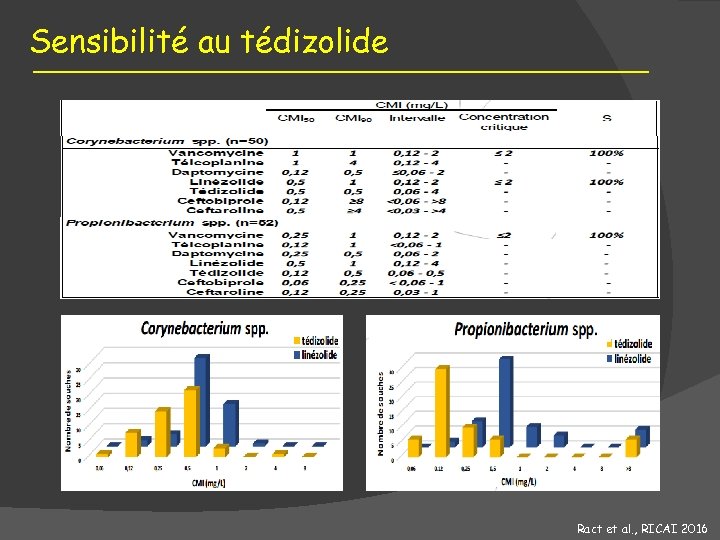 Sensibilité au tédizolide Ract et al. , RICAI 2016
Sensibilité au tédizolide Ract et al. , RICAI 2016
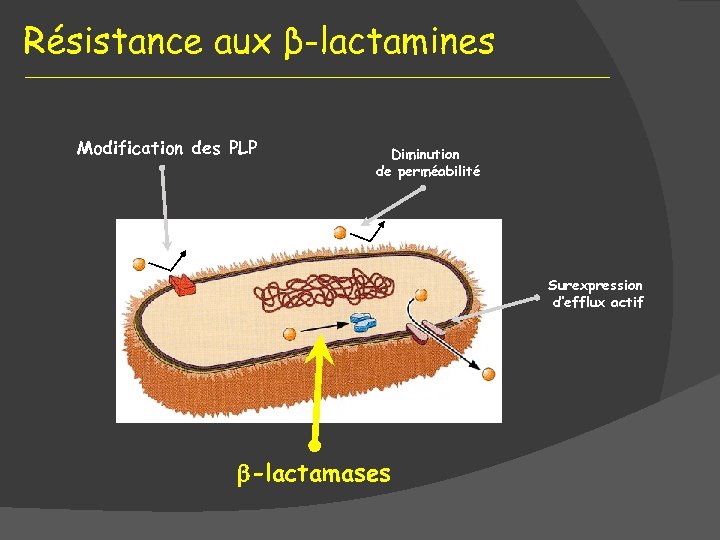 Résistance aux β-lactamines Modification des PLP Diminution de perméabilité Surexpression d’efflux actif -lactamases
Résistance aux β-lactamines Modification des PLP Diminution de perméabilité Surexpression d’efflux actif -lactamases
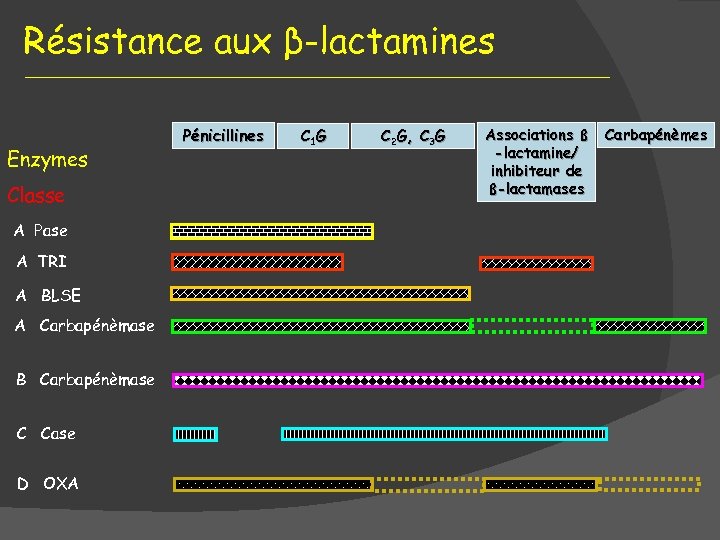 Résistance aux β-lactamines Enzymes Classe A Pase A TRI A BLSE A Carbapénèmase B Carbapénèmase C Case D OXA Pénicillines C 1 G C 2 G, C 3 G Associations ß -lactamine/ inhibiteur de ß-lactamases Carbapénèmes
Résistance aux β-lactamines Enzymes Classe A Pase A TRI A BLSE A Carbapénèmase B Carbapénèmase C Case D OXA Pénicillines C 1 G C 2 G, C 3 G Associations ß -lactamine/ inhibiteur de ß-lactamases Carbapénèmes
 Résistance aux C 3 G E. coli 2002 1, 9% K. pneumoniae 2005 Explications : - BLSE +++ -(-p. Amp. C) x 5, 7 2014 10, 9% 5, 1% x 6, 0 2014 30, 7 % ECDC EARS-Net
Résistance aux C 3 G E. coli 2002 1, 9% K. pneumoniae 2005 Explications : - BLSE +++ -(-p. Amp. C) x 5, 7 2014 10, 9% 5, 1% x 6, 0 2014 30, 7 % ECDC EARS-Net
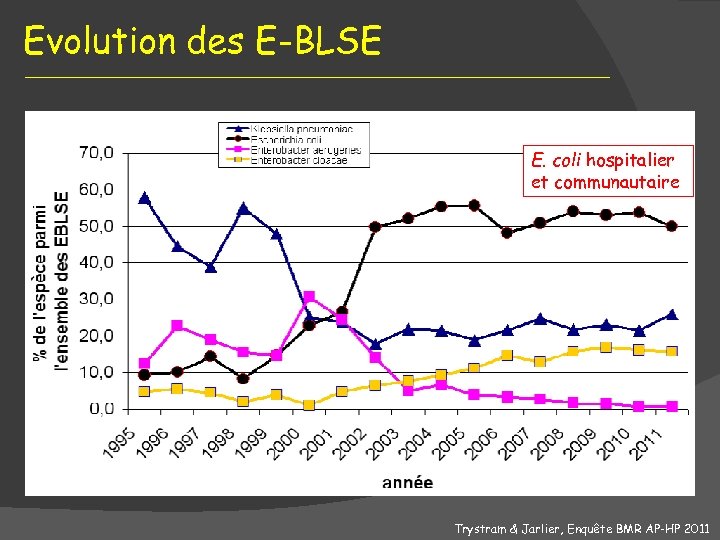 Evolution des E-BLSE E. coli hospitalier et communautaire Trystram & Jarlier, Enquête BMR AP-HP 2011
Evolution des E-BLSE E. coli hospitalier et communautaire Trystram & Jarlier, Enquête BMR AP-HP 2011
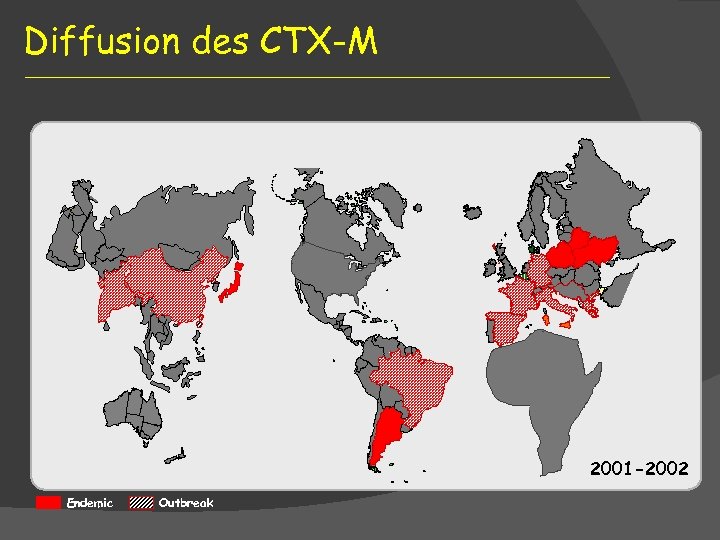 Diffusion des CTX-M 2001 -2002 Endemic Outbreak
Diffusion des CTX-M 2001 -2002 Endemic Outbreak
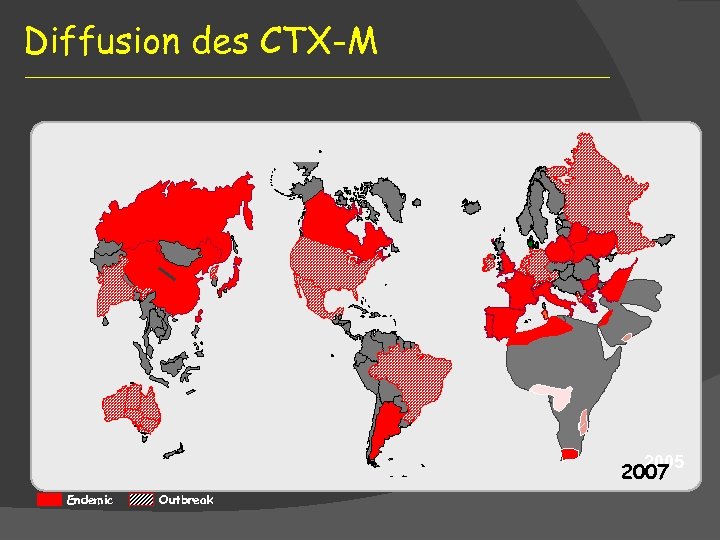 Diffusion des CTX-M 2005 2007 Endemic Outbreak
Diffusion des CTX-M 2005 2007 Endemic Outbreak
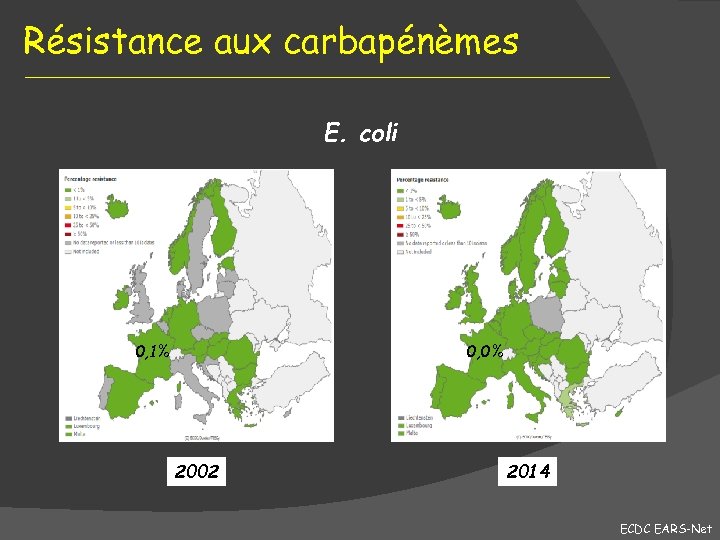 Résistance aux carbapénèmes E. coli 0, 1% 0, 0% 2002 2014 ECDC EARS-Net
Résistance aux carbapénèmes E. coli 0, 1% 0, 0% 2002 2014 ECDC EARS-Net
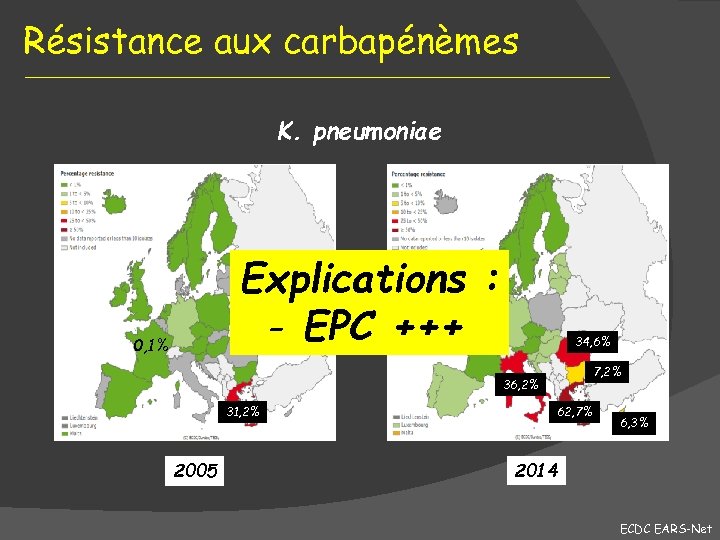 Résistance aux carbapénèmes K. pneumoniae Explications : - EPC +++ 0, 1% 34, 6% 0, 9% 7, 2% 36, 2% 31, 2% 2005 62, 7% 6, 3% 2014 ECDC EARS-Net
Résistance aux carbapénèmes K. pneumoniae Explications : - EPC +++ 0, 1% 34, 6% 0, 9% 7, 2% 36, 2% 31, 2% 2005 62, 7% 6, 3% 2014 ECDC EARS-Net
 Types de carbapénémases
Types de carbapénémases
 KPC : Klebsiella pneumoniae carbapenemase 2001
KPC : Klebsiella pneumoniae carbapenemase 2001
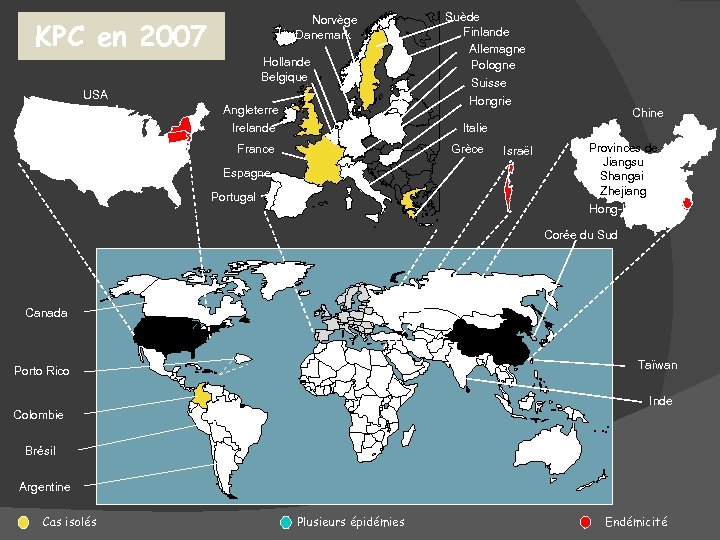 Norvège Danemark KPC en 2007 Hollande Belgique USA Angleterre Irelande Suède Finlande Allemagne Pologne Suisse Hongrie Chine Italie France Grèce Espagne Portugal Israël Provinces de Jiangsu Shangai Zhejiang Hong-Kong Corée du Sud Canada Taïwan Porto Rico Inde Colombie Brésil Argentine Cas isolés Plusieurs épidémies Endémicité
Norvège Danemark KPC en 2007 Hollande Belgique USA Angleterre Irelande Suède Finlande Allemagne Pologne Suisse Hongrie Chine Italie France Grèce Espagne Portugal Israël Provinces de Jiangsu Shangai Zhejiang Hong-Kong Corée du Sud Canada Taïwan Porto Rico Inde Colombie Brésil Argentine Cas isolés Plusieurs épidémies Endémicité
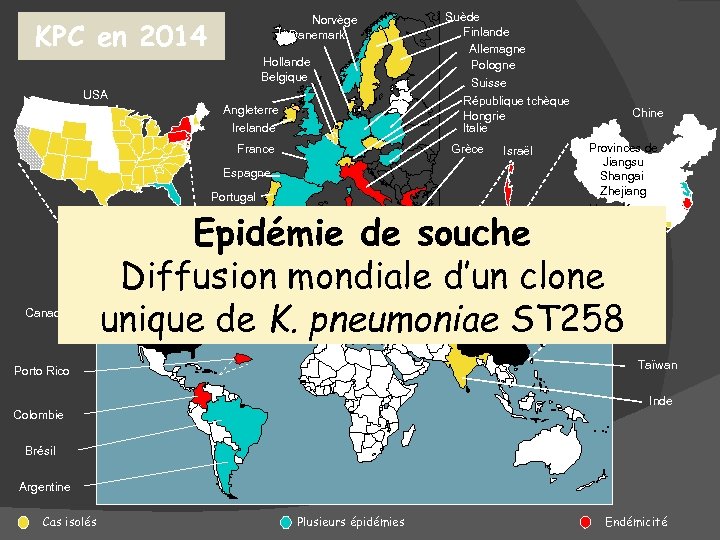 Norvège Danemark KPC en 2014 Hollande Belgique USA Angleterre Irelande France Suède Finlande Allemagne Pologne Suisse République tchèque Hongrie Italie Grèce Espagne Portugal Israël Chine Provinces de Jiangsu Shangai Zhejiang Hong-Kong Epidémie de souche Diffusion mondiale d’un clone unique de K. pneumoniae ST 258 Corée du Sud Canada Taïwan Porto Rico Inde Colombie Brésil Argentine Cas isolés Plusieurs épidémies Endémicité
Norvège Danemark KPC en 2014 Hollande Belgique USA Angleterre Irelande France Suède Finlande Allemagne Pologne Suisse République tchèque Hongrie Italie Grèce Espagne Portugal Israël Chine Provinces de Jiangsu Shangai Zhejiang Hong-Kong Epidémie de souche Diffusion mondiale d’un clone unique de K. pneumoniae ST 258 Corée du Sud Canada Taïwan Porto Rico Inde Colombie Brésil Argentine Cas isolés Plusieurs épidémies Endémicité
 NDM : New Delhi Metallo-β-lactamase 2009 Lancet Infectious Diseases 2011
NDM : New Delhi Metallo-β-lactamase 2009 Lancet Infectious Diseases 2011
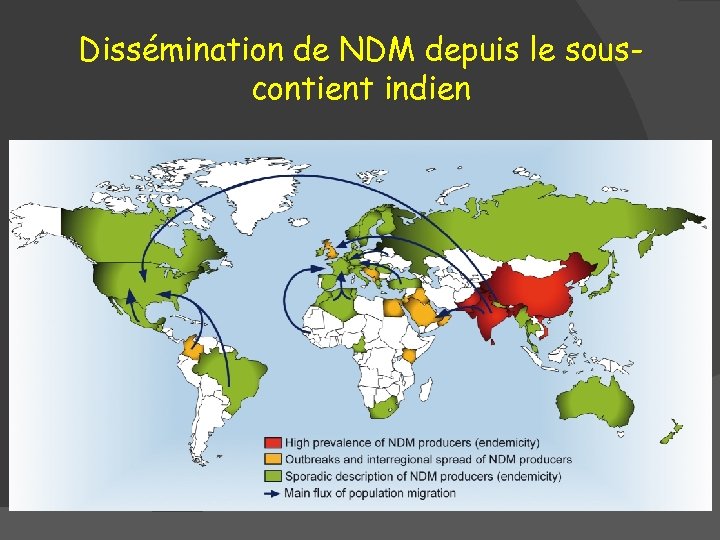 Dissémination de NDM depuis le souscontient indien
Dissémination de NDM depuis le souscontient indien
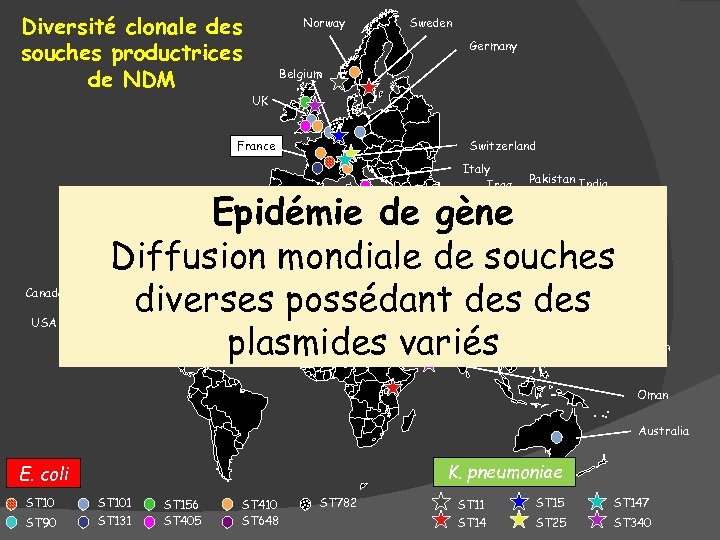 Diversité clonale des souches productrices de NDM Norway Sweden Germany Belgium UK Switzerland France Italy Iraq Canada USA Pakistan India Epidémie de gène Diffusion mondiale de souches diverses possédant des plasmides variés Japan Oman Australia K. pneumoniae E. coli ST 10 ST 90 ST 101 ST 131 ST 156 ST 405 ST 410 ST 648 ST 782 ST 11 ST 14 ST 15 ST 147 ST 25 ST 340
Diversité clonale des souches productrices de NDM Norway Sweden Germany Belgium UK Switzerland France Italy Iraq Canada USA Pakistan India Epidémie de gène Diffusion mondiale de souches diverses possédant des plasmides variés Japan Oman Australia K. pneumoniae E. coli ST 10 ST 90 ST 101 ST 131 ST 156 ST 405 ST 410 ST 648 ST 782 ST 11 ST 14 ST 15 ST 147 ST 25 ST 340
 OXA-48 et OXA-48 -like (OXA-162 / OXA-181 / OXA-204 / OXA-232 / OXA-244 / OXA-245) 1ère description en 2004 Turquie Endémique en Turquie et des les pays du Maghreb
OXA-48 et OXA-48 -like (OXA-162 / OXA-181 / OXA-204 / OXA-232 / OXA-244 / OXA-245) 1ère description en 2004 Turquie Endémique en Turquie et des les pays du Maghreb
 Dissémination européenne de OXA-48 depuis les pays du Maghreb Epidémie de plasmide Diffusion chez de souches d’entérobactéries diverses d’un même plasmide hyper-conjugatif Cas isolés OXA-181 Plusieurs épidémies Endémicité
Dissémination européenne de OXA-48 depuis les pays du Maghreb Epidémie de plasmide Diffusion chez de souches d’entérobactéries diverses d’un même plasmide hyper-conjugatif Cas isolés OXA-181 Plusieurs épidémies Endémicité
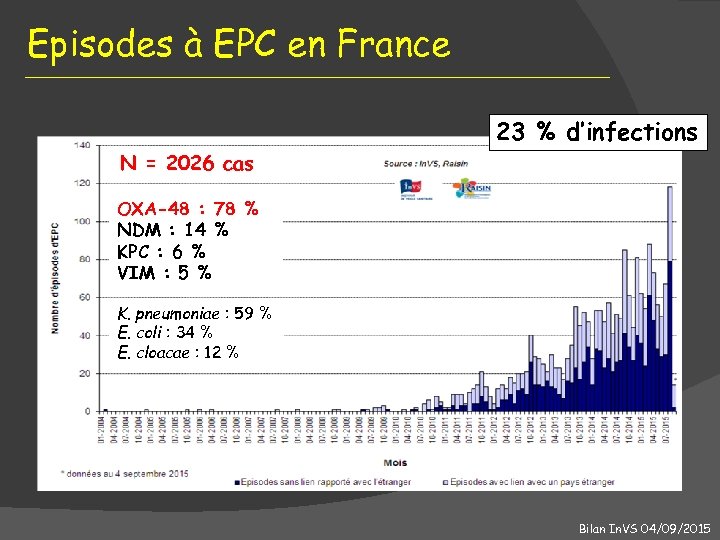 Episodes à EPC en France 23 % d’infections N = 2026 cas OXA-48 : 78 % NDM : 14 % KPC : 6 % VIM : 5 % K. pneumoniae : 59 % E. coli : 34 % E. cloacae : 12 % Bilan In. VS 04/09/2015
Episodes à EPC en France 23 % d’infections N = 2026 cas OXA-48 : 78 % NDM : 14 % KPC : 6 % VIM : 5 % K. pneumoniae : 59 % E. coli : 34 % E. cloacae : 12 % Bilan In. VS 04/09/2015
 Résistance plasmidique à la colistine o Décrite en Chine (porc) : gène mcr-1 CMI x 8 -16 o Transférable par transformation chez des souches cliniques d’E. coli, K. pneumoniae et P. aeruginosa o Protéine MCR-1 = phosphoéthanolamine transférase (modification du lipide A) Liu et al. , LID 2015
Résistance plasmidique à la colistine o Décrite en Chine (porc) : gène mcr-1 CMI x 8 -16 o Transférable par transformation chez des souches cliniques d’E. coli, K. pneumoniae et P. aeruginosa o Protéine MCR-1 = phosphoéthanolamine transférase (modification du lipide A) Liu et al. , LID 2015
 Résistance plasmidique à la colistine Modèle d’infection de cuisse chez la souris efficacité in vivo Prévalence chez l‘animal et l’homme (Chine) 1, 2% Liu et al. , LID 2015
Résistance plasmidique à la colistine Modèle d’infection de cuisse chez la souris efficacité in vivo Prévalence chez l‘animal et l’homme (Chine) 1, 2% Liu et al. , LID 2015
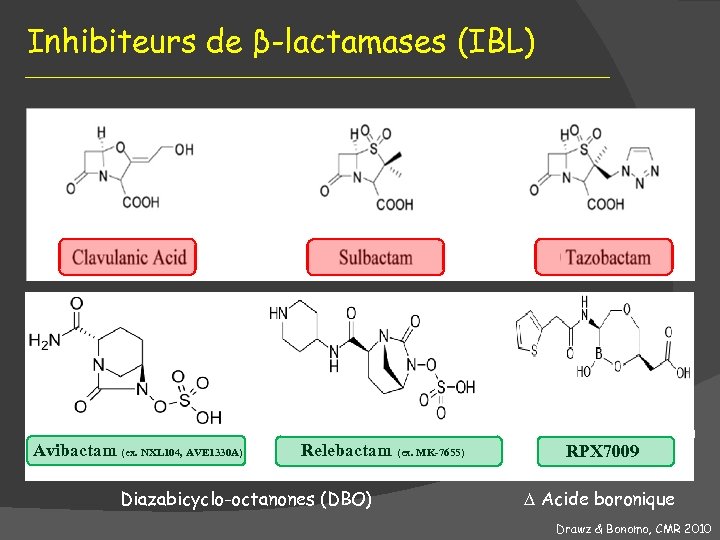 Inhibiteurs de β-lactamases (IBL) Avibactam (ex. NXL 104, AVE 1330 A) Relebactam (ex. MK-7655) Diazabicyclo-octanones (DBO) RPX 7009 Acide boronique Drawz & Bonomo, CMR 2010
Inhibiteurs de β-lactamases (IBL) Avibactam (ex. NXL 104, AVE 1330 A) Relebactam (ex. MK-7655) Diazabicyclo-octanones (DBO) RPX 7009 Acide boronique Drawz & Bonomo, CMR 2010
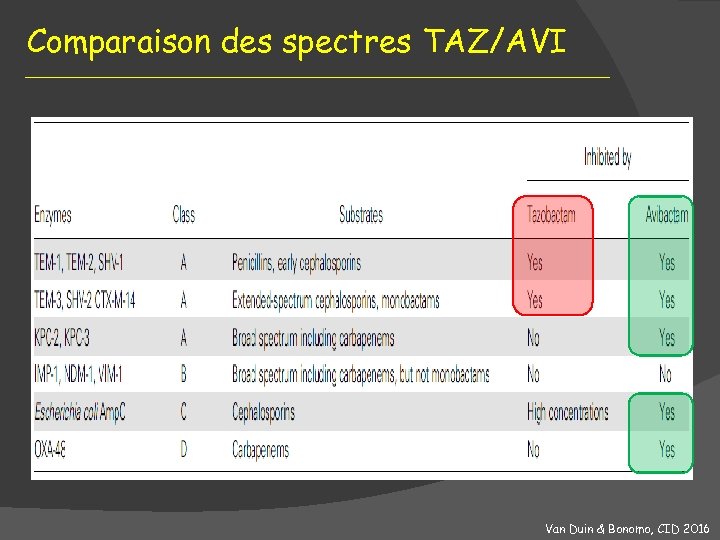 Comparaison des spectres TAZ/AVI Van Duin & Bonomo, CID 2016
Comparaison des spectres TAZ/AVI Van Duin & Bonomo, CID 2016
 Comparaison CAZ / CAZ-AVI Différence 1024 512 -2048 128 -256 1 2 -4 b CMI 50/CMI 90 Drawz et al. , AAC 2014
Comparaison CAZ / CAZ-AVI Différence 1024 512 -2048 128 -256 1 2 -4 b CMI 50/CMI 90 Drawz et al. , AAC 2014
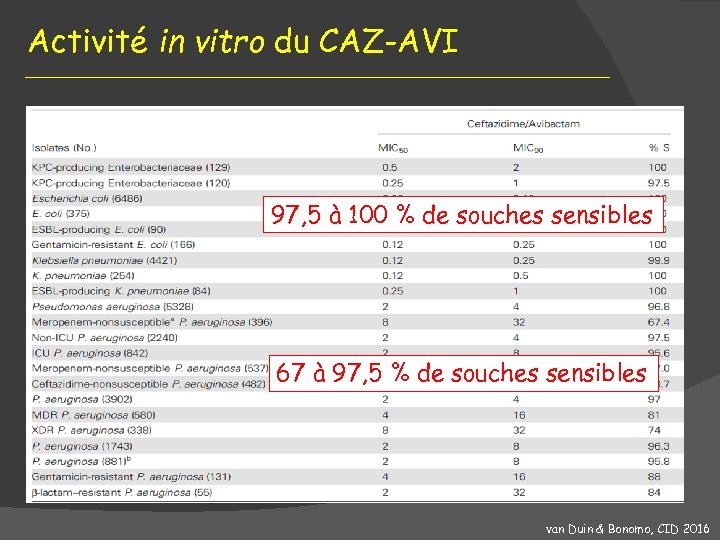 Activité in vitro du CAZ-AVI 97, 5 à 100 % de souches sensibles 67 à 97, 5 % de souches sensibles van Duin & Bonomo, CID 2016
Activité in vitro du CAZ-AVI 97, 5 à 100 % de souches sensibles 67 à 97, 5 % de souches sensibles van Duin & Bonomo, CID 2016
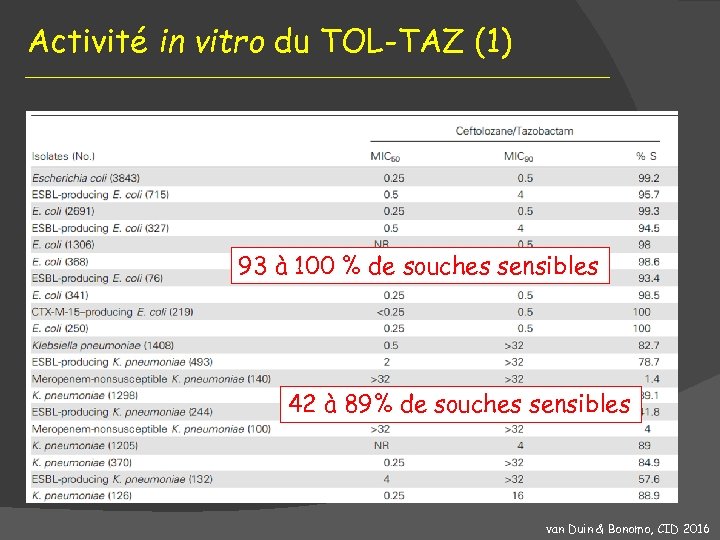 Activité in vitro du TOL-TAZ (1) 93 à 100 % de souches sensibles 42 à 89% de souches sensibles van Duin & Bonomo, CID 2016
Activité in vitro du TOL-TAZ (1) 93 à 100 % de souches sensibles 42 à 89% de souches sensibles van Duin & Bonomo, CID 2016
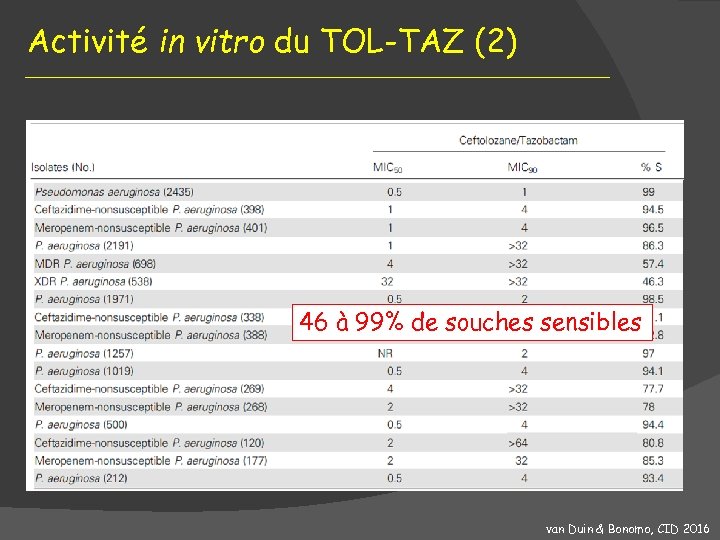 Activité in vitro du TOL-TAZ (2) 46 à 99% de souches sensibles van Duin & Bonomo, CID 2016
Activité in vitro du TOL-TAZ (2) 46 à 99% de souches sensibles van Duin & Bonomo, CID 2016


